Нейротрофический фактор мозга что это
Нейротрофический фактор мозга что это
Депрессивные расстройства представляют серьезную социально-экономическую и медицинскую проблему современного общества [13, 47]. Частота встречаемости данной патологии в общей популяции составляет 5–20 % [7]. Несмотря на интенсивные исследования, причины, индуцирующие развитие этого расстройства, а также пути его формирования остаются неясными [1, 12]. В настоящее время известен ряд нейробиологических аномалий, связанных с развитием депрессивных расстройств: нарушение баланса активности серотонин- и глутаматергических систем головного мозга, нейрогормональные нарушения, касающиеся в первую очередь функции гипоталамо-гипофизарно-адреналовой системы; иммунологические нарушения, структурно-функциональные изменения в лимбической системе мозга, снижение объема гипокампа и т.д. [2, 3, 4, 8, 9, 10, 14]. Усиление апоптоза при невротических связанных со стрессом расстройствах и при депрессии, нарушение нейрональной киназной регуляции и угнетение нейрогенеза привлекли внимание к факторам, регулирующим эти процессы [6, 11, 41, 43].
Исследование механизмов индуцированной стрессом психопатологии на животных моделях показало, что стресс, провоцирующий у грызунов развитие депрессивноподобного состояния, может сопровождаться нейропластическими изменениями, включающими угнетение нейрогенеза в гиппокампе [35]. Вероятно, эти эффекты стресса на мозг являются одной из причин наблюдаемого у некоторых депрессивных больных уменьшения объемов ряда отделов мозга (гиппокамп, кора и миндалина) [20]. Отмечаемое преимущественно в гиппокампе снижение экспрессии этого фактора после стресса и ее восстановление длительным введением антидепрессантов привели к созданию нейротрофической гипотезы депрессии [23], согласно которой изменение уровня мозгового нейротрофического фактора (brain-derived neurotrophic factor, BDNF) является ключевым механизмом формирования и терапии этой психопатологии. Проведенные исследования показали, что депрессия приводит к нарушениям нейропластичности, что, возможно, служит основой для хронизации процесса и развития когнитивного дефицита [15].
BDNF – это белок с молекулярной массой 13 кДа, который принадлежит к классу цитокинов, семейству факторов роста и подсемейству нейротрофинов; выявляется в глиальных и преимущественно в нейрональных клетках. Впервые этот фактор был описан в 1987 г. [17]. BDNF играет важную роль в развитии и функционировании ЦНС и имеет существенное значение в развитии ее различных патологических состояний. Основная функция данного белка в организме заключается в поддержке выживания нейронов, их росте и формировании новых синапсов. Повышение его активности, наблюдаемое у лиц с депрессией, проходящих психотерапию или фармакотерапию, коррелирует с улучшением памяти и обучения и с редукцией симптомов этого расстройства. Установлено, что BDNF обладает выраженными нейрозащитными свойствами, угнетает клеточный апоптоз [27, 34], препятствует гибели нейронов [26, 29, 31, 40, 45] и cтимулирует рост холинергических нервных волокон [32]. Нейротрофические факторы регулируют структурную, синаптическую и морфологическую пластичность для модулирования интенсивности или количества синаптических связей и нейротрансмиссии [39, 44]. Таким образом, патологические изменения системы нейротрофического фактора могут не только привести к дефектам нервной регенерации и, следовательно, к структурным аномалиям в головном мозге, но также могут снизить нейронную пластичность и ослабить способность человека адаптироваться к кризисным ситуациям [24].
Считается, что BDNF тесно сопряжен с депрессией и стрессом, точные механизмы стресс-индуцированного снижения регуляторной функции BDNF неизвестны [18]. Этот цитокин принимает участие в росте нервных клеток, формировании новых синапсов и их модификации через стимулирование генов, вовлеченных в регуляцию уровня серотонина [28, 33, 38]. Кроме того, существует и обратная связь – стимуляция серотониновых рецепторов приводит к активации экспрессии гена BDNF. В процессе развития мозга именно этот циклический процесс играет одну из главных ролей в выживании, синаптической пластичности и росте серотониновых нейронов. Нарушение в его регуляции может привести к структурным и функциональным изменениям в участках мозга, ответственных за эмоциональное состояние [49]. У пациентов с депрессией отмечена высокая частота встречаемости полиморфизма гена, кодирующего BDNF. По результатам функциональной МРТ изменения в этом гене замечены также у лиц без депрессии с гиперактивацией зон мозга, ответственных за сильные негативные эмоциональные переживания [48].
Группа ученых из Великобритании во главе с доктором Джорджиной Хозанг (Georgina Hosang) провели оценку влияния полиморфизма гена, кодирующего BDNF, на стрессовые события. Вариации в последовательности генов BDNF, по данным научных работ, также могут привести и к уязвимости к стрессу. В целом метаанализ продемонстрировал достоверную взаимосвязь между стрессовыми событиями и вариантом гена BDNF Val66Met у лиц с депрессией. После стандартизации по типу стресса достоверная взаимосвязь не подтвердилась лишь для стрессовых событий, пережитых в детстве [30]. Показано, что стресс снижает экспрессию BDNF в гиппокампе посредством активации 5-HT2A-рецепторов [47]. Предполагают, что стресс, пережитый в детстве, коррелирует с коротким аллелем 5-HTTLPR [8], в то время как стрессовые события во взрослой жизни – с Met-вариантом BDNF при депрессии. Полученные результаты, по мнению ученых, свидетельствуют о том, что лица с генетической «уязвимостью» к негативному опыту – носители варианта BDNF Val66Met, могут получить дополнительные преимущества в отношении снижения риска депрессии от позитивного окружения и избегания стресса.
Также авторы отмечают, что ген BDNF может содержать внушительное число полиморфизмов, которые также могут быть задействованы в формировании депрессии при неблагоприятных условиях внешней среды [30]. Ген BDNF локализован на хромосоме 11p13 и кодирует предшественник пептида pro-BDNF [42]. Все нейротрофины, в том числе BDNF, синтезируются, как предшественники, про-нейротрофины, которые претерпевают посттрансляционную модификацию перед тем как стать зрелым гомодимерным белком. Pro-BDNF производится в эндоплазматическом ретикулуме, который аккумулируется в транс-Гольджи сети через аппарат Гольджи. Было высказано предположение, что pro-BDNF связывает сортилин в аппарате Гольджи, что обеспечивает правильное формирование зрелого домена. Зрелые домены BDNF связываются с карбоксипептидазой Е, тем самым обеспечивая сортировку для контролируемого формирования BDNF [36]. Замещение валина (Val) на метионин (Met) в кодоне 66 в продомене ухудшает эту сортировку BDNF [25]. Pro-BDNF является основной формой нейротрофинов.
Вследствие того, что стресс и депрессия являются одними из факторов, приводящими к самоубийству, в последнее время ряд исследований попытались выяснить роль BDNF в суицидальном поведении. Эти исследования, хотя и в зачаточном состоянии, обеспечивают полную поддержку идеи, что нарушения в BDNF могут быть важным, существенным фактором в суицидальном поведении. Недавно было обнаружено, что полиморфизм в BDNF гене ассоциирован с повышенным суицидальным риском [50].
Кроме того, BDNF является одним из кандидатов на роль биомаркера ответа на терапию антидепрессантами [16]. Это связано с тем, что, во-первых, этот цитокин синтезируется как в мозге, так и клетками других органов, во-вторых, множественные исследования показывают снижение уровня этого вещества при формировании депрессии и повышение – при лечении, и, в-третьих, уровень BDNF прямо коррелирует со степенью улучшения состояния пациента, оцененного с помощью шкалы Гамильтона (Hamilton Depression Rating Scale) [19, 21]. Таким образом, раннее изменение концентрации BDNF в плазме в начале терапии может предсказать эффективность всего курса лечения [37]. Доказано, что деструктивные процессы, отмечающиеся на фоне аффективных расстройств, являются частично обратимыми на фоне терапии нейротрофическими и нейропротективными препаратами [5]. Длительная терапия антидепрессантами повышает экспрессию BDNF в гиппокампальных и корковых нейронах и может предотвращать стресс-индуцированное снижение экспрессии BDNF [22].
Таким образом, экспериментальные, доклинические и клинические исследования показывают, что депрессия может быть связана с невозможностью нейронных систем проявлять адаптивную пластичность. Учитывая роль BDNF и его родственных рецепторов в нервной и структурной пластичности и то что депрессия и антидепрессанты оказывают противоположные действия на BDNF, очевидно, что BDNF-сигнализация имеет решающее значение в патофизиологии депрессии и в механизме действия антидепрессантов.
Обзор написан в рамках выполнения грантов РФФИ (проекты № 14-04-01157 и № 14-04-31925) и гранта Президента РФ № 14.120.14.3854-МК.
Рецензенты:
Семке А.В., д.м.н., профессор кафедры психиатрии, наркологии и психотерапии, ГБОУ ВПО «Сибирский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации, г. Томск;
Невидимова Т.И., д.м.н., профессор кафедры нормальной физиологии, ГБОУ ВПО «Сибирский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации, г. Томск.
BDNF: что это такое и как его повысить
BDNF – это нейротрофический фактор мозга, который отвечает за рост и выживание нервных клеток по мере их развития. Он также стимулирует и контролирует нейрогенез (рост новых нервных клеток). Еще BDNF участвует в нейропластичности. Это процесс, который позволяет нервным клеткам компенсировать потери после травмы, а также адаптироваться к новым ситуациям и изменениям в окружающей среде.
Почему так важен BDNF?
Он повышает пластичность мозга. Когда клетки мозга повреждаются или находятся в стрессовой ситуации, BDNF защищает их и помогает им стать сильнее.
Облегчает депрессию. Во время депрессии нейронные пути отключатся и теряют гибкость. А вот достаточный уровень нейротрофического фактора мозга наоборот, повышает гибкость и активирует цепочки нейронов. [R]
Ускоряет потерю веса. BDNF помогает сбросить вес. Исследования показывают, что чем больше избыточный вес человека, тем ниже уровень Нейротрофического фактора мозга. [R, R]
Улучшает сон. Нейротрофический фактор мозга улучшает сон, увеличивая медленные мозговые волны на самой глубокой стадии сна. [R]
Защищает от нейродегенеративных заболеваний. Исследования показывают, что высокий BDNF снижает риск развития нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона. Одно исследование отслеживало группу взрослых в течение десяти лет и показало, что у людей с высоким уровнем BDNF слабоумие и болезнь Альцгеймера развиваются на 50% медленнее, чем у людей с низким уровнем содержания этого белка. [R]
По мере старения уровень нейротрофического фактора, генерируемого мозгом, естественным образом начинает снижаться. Имея несколько правильных повседневных привычек, вы можете настроиться на постоянное высвобождение большего количества BDNF, сохраняя свой мозг эластичным и закаливая его для роста и укрепления.
Как повысить BDNF
1. Занимайтесь спортом
Упражнение на выносливость высвобождает белок под названием FNDC5. FNDC5, в свою очередь, увеличивает нейротрофический фактор мозга на 200-300 процентов. В одном исследовании мужчины, которые ежедневно ездили на велосипеде в течение 3 месяцев, почти в четыре раза увеличили свой BDNF. [R, R, R]
Сильная тренировка также увеличивает BDNF, но только на несколько минут после тренировки. Выбирайте умеренно интенсивное кардио. Не любитель бегать? Плавайте, катайтесь на велосипеде, занимайтесь йогой в быстром темпе или спортом. Что бы ни случилось, повышение частоты пульса также приведет к повышению уровня BDNF.
2. Высыпайтесь
Вы освобождаете нейротрофический фактор мозга на более глубоких стадиях сна. Есть 5 стадий сна, и вы проходите их каждые 90 минут или около того. В среднем, вы проводите от трети до половины ночи на стадиях 3 и 4, которые дают вам глубокий, восстановительный сон. [R]
Хороший сон — это одна из самых важных вещей, которые вы можете сделать для вашего здоровья.
3. Меньше нервничайте
Стресс ядовит для BDNF. Воздействие стрессовых событий и повышенного уровня гормонов стресса приводит к нарушению пространственной памяти и повреждению нейронов гиппокампа. Считается, что эти нейроны поддерживаются нейротрофинами, такими как фактор роста нервов (NGF) и нейротрофический фактор мозга (BDNF). Поэтому снижение уровня стресса напрямую ведет к увеличению уровня Нейротрофического фактора мозга. [R, R]
4. Больше гуляйте в солнечные дни
В результате анализа 2 851 человека было установлено, что весной и летом количество BDNF в крови увеличивается, а осенью и зимой снижается. Уровни BDNF связаны с количеством часов воздействия солнечного света на человека. [R]
Простая прогулка в солнечные дни увеличивает нейротрофический фактор. Это также повышает настроение, увеличивает выработку витамина D и снижает риск заболевания раком кожи, если вы не доводите себя до ожогов.
5. Голодайте … иногда
Объем и частота приема пищи — основополагающие аспекты питания, которые оказывают серьезное влияние на здоровье и продолжительность жизни. Чрезмерное потребление пищи связано с ростом заболеваемости сердечно-сосудистыми заболеваниями, диабетом и некоторыми видами рака и является одной из основных причин инвалидности и смертности в промышленно развитых странах.
Как ограничение калорийности пищи, так и снижение частоты приема пищи или прерывистый пост могут подавлять развитие различных заболеваний и увеличивать продолжительность жизни. Связано это с уменьшением окислительных повреждений и повышением стрессоустойчивости. Многие из положительных эффектов ограничения калорийности и голодания опосредованы нервной системой. Например, прерывистый пост приводит к увеличению выработки нейротрофического фактора мозга (BDNF), который повышает устойчивость нейронов в мозгу к дисфункции и дегенерации. Такая активация BDNF может также способствовать благоприятному воздействию на регуляцию глюкозы и сердечно-сосудистую функцию. [R]
6. Постоянно изучайте что-то новое
Один из классических принципов нейронауки заключается в том, что мозг сохраняет значительное количество структурной и функциональной пластичности на протяжении всей взрослой и старости. Изучение новых вещей, которое стимулирует физическую и психическую активность, приводит к серьезным изменениям в последующем поведении, включая обучение и память, которые охватывают широкий спектр нейронных систем.
Именно поэтому так важно постоянно изучать новые вещи и приобретать различные навыки. Будь то езда на велосипеде, вышивание крючком или бег с препятствиями. Чем больше вы заставляете мозг сталкиваться с неизвестными ему вещами, тем выше ваш уровень BDNF. [R]
Ноотропы для повышения BDNF
Ашваганда
Ашваганда является одним из самых мощных адаптогенов и с древних времен используется для адаптации организма к стрессу. В мозгу Ашваганда помогает регенерировать аксоны и дендриты, восстанавливать синапсы и восстанавливать нейронные сети, пораженные нейродегенеративными заболеваниями.
Ашваганда совершает часть этой функций в мозгу, повышая уровень BDNF. Исследования показывают, что Ашваганда может также предотвратить снижение уровня BDNF в мозгу.
Бакопа Монье
Бакопа монье помогает повысить уровень BDNF в мозгу. Она используется для укрепления памяти и в качестве антидепрессанта на протяжении тысячелетий. Древние аюрведические тексты рекомендовали Бакопу, чтобы помочь запомнить длинные отрывки текста.
Исследования показывают, что Бакопа монье улучшает запоминание слов, повышает внимание, фокусирует внимание и снижает беспокойство. Исследование, проведенное в Индии, показало, что экстракт Бакопы монье способствует нейрогенезу в гиппокампе, повышая уровень BDNF в мозгу.
Докозагексаеновая кислота (ДКГ)
Докозагексаеновая кислота (ДКГ) способствует повышению уровня BDNF в мозгу. ДГК составляет большую часть серого вещества в мозгу. Она регулирует нейронную сигнализацию и экспрессию генов. ДГК воздействует на нейротрансмиттеры, которые влияют на память, обучение, фокус и внимание.
Одно исследование, проведенное в Калифорнийском университете в Лос-Анджелесе, показало, что ДГК может восстановить нормальный уровень BDNF даже после травмы головного мозга.
Готу Кола
Готу-Колу на Бали часто называют «студенческой травой», потому что она обостряет ум. Экстракт готу колы увеличивает рост дендрита и аксонов в мозгу, что способствует улучшению памяти.
Это было продемонстрировано в исследовании, проведенном в Китае. Исследователи обнаружили, что экстракт Готу Кола значительно увеличил концентрацию BDNF в мозгу. [R]
L-Теанин
Это аминокислота, которая присутствует в зеленом чае. L-Теанин используется в качестве ноотропного вещества для снижения беспокойства, улучшения обучения и настроения, а также для повышения концентрации внимания.
В ходе одного исследования выяснилось, что L-Теанин оказывает антидепрессивное и антидепрессивное действие «за счет индукции BDNF в гиппокампе и агонистического действия L-Теанина на рецептор NMDA». [R]
Магний L-Треонат
Магний имеет решающее значение для всей электрической и электрохимической активности организма. Он участвует в мышечных сокращениях, сердечном ритме, нервной функции и активности клеток мозга.
Исследования показывают, что L-Треонат магния легко пересекает барьер между кровью и мозгом (по сравнению с другими формами магния). И как только он попадает в мозг, магний усиливает NMDA-рецепторную сигнализацию, экспрессию BDNF и синаптическую пластичность в префронтальной коре головного мозга. [R]
АЦЦ (Ацетилцистеин)
Ацетилцистеин (N-Ацетил-L-Цистеин, NAC, АЦЦ) – это мощный антиоксидант, который повышает настроение, снижает тревогу, улучшает память и уменьшает компульсивное поведение. Исследования показали, что NAC помогает увеличить выделение дофамина и уменьшить количество воспалительных цитокинов.
Ученые считают, что такая совокупность механизмов в мозгу обусловлена способностью АЦЦ способствовать выживанию клеток и синтезу факторов роста, что приводит к увеличению роста нейритов. Частично за счет активации сигнального пути BDNF/TrkB. [R]
Ноопепт
Ноопепт – это ноотропный препарат, аналогичный по действию рацетамам. И известен тем, что стимулирует познание, память, обучение, восприятие, логическое мышление и настроение.
Исследование, опубликованное Российской академией медицинских наук в Москве, показывает, что Ноопепт стимулирует фактор роста нервов (NGF) и нейротрофический фактор мозга (BDNF). [R]
Родиола Розовая
Родиола Розовая – это адаптогенное и ноотропное растение, которое на протяжении сотен лет используется в традиционной медицине России и скандинавских стран. Эта трава известна тем, что улучшает бдительность, энергию, память и настроение. А также обладает антитревожными и антидепрессантными свойствами, что снижает усталость, способствует познанию и концентрации внимания.
Ученые обнаружили, что Salidroside, основное биоактивное соединение, обнаруженное в экстракте Родиолы Розы, значительно повышает уровень BDNF в гиппокампе. [R]
Птеростильбен
Птеростильбен – это природный полифеноловый антиоксидант, содержащийся в чернике, винограде и коре индийского дерева кино. Этот мощный антиоксидант стимулирует BDNF, повышает нейропластичность, снимает тревогу, повышает уровень допамина, а также способствует познанию, обучению и памяти.
Что снижает BDNF?
Заключение
BDNF является одним из самых мощных биологических факторов для обострения вашего ума. Включите одну или несколько из этих привычек в свою повседневную жизнь, чтобы думать быстрее и лучше.
Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Одно из самых распространенных и тяжелых нейродегенеративных заболеваний — болезнь Паркинсона — считается не поддающейся лечению. О том, могут ли маленькие белковые молекулы изменить сложившуюся картину, и каким тернистым путем продвигаются исследователи, чтобы терапия нейротрофическими факторами уже сегодня стала реальностью, и пойдет речь в данной статье.
Конкурс «био/мол/текст»-2018

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Введение
Причем здесь нейротрофические факторы? Для начала стоит пару слов сказать о самих нейротрофических факторах (для краткости будем обозначать их «НТФ»). Итак, НТФ — это большая и разношерстная группа полипептидов (длиной до 200 аминокислот), которые играют ключевую роль в развитии и сохранении структур как центральной, так и периферической нервных систем, принимают участие в регуляции роста, развития, дифференциации, миграции и выживания клеточных популяций, а также процессах их адаптации к внешним воздействиям. Поскольку этим критериям соответствуют многие неспецифические факторы, Ив-Алан Барде (Yves-Alain Barde) расширил понятие нейротрофических факторов и включил в него следующие критерии [4]:
Можно еще добавить, что подлинные НТФ активируют рецепторные тирозинкиназы. Таким образом, в дальнейшем мы будем разграничивать собственно НТФ и просто ростовые факторы, которые в чем-то очень схожи с НТФ, но вышеуказанным критериям не отвечают.
В 1981 году доктор Стэнли Аппел (Stanley Appel) выдвинул гипотезу, названную «Единая гипотеза возникновения бокового амиотрофического склероза, паркинсонизма и болезни Альцгеймера» [5], которая постулировала, что каждое из этих заболеваний возникает из-за недостатка особого «гормона», или ростового фактора, который должен в норме секретироваться тканью, иннервируемой пораженными нейронами, захватываться пресинаптическими окончаниями последних и ретроградно (противотоком) транспортироваться к телу нейрона. Через год после публикации гипотезы Аппела был открыт нейротрофический фактор мозга — BDNF (brain-derived neurotrophic factor; заслуга принадлежит как раз Иву-Алану Барде), — после чего начался настоящий нейротрофический бум, когда новые факторы открывали каждый год. Несмотря на то, что обнаружение нейротрофических факторов как таковых относится к началу 50-х годов (работы Риты Леви-Монтальчини, за которые она была удостоена Нобелевской премии в 1986 году [39]), многое в их биологии стало известно как раз в 80–90-е годы.
В 1993 году открыли глиальный нейротрофический фактор — GDNF (glial cell line-derived neurotrophic factor), — и сразу же стало очевидно, что этот белок способствует дифференцировке и выживанию дофаминовых нейронов [6]. Гипотеза Аппела к этому времени набрала популярность, и ее попытались приложить к GDNF, однако все оказалось не однозначно. Мыши с полным нокаутом («выключением») гена Gdnf умирали еще до рождения из-за отсутствия. почек [7], но отнюдь не дофаминовых нейронов, а в недавнем исследовании с комбинацией сразу нескольких методик нокаута гена непосредственно в черной субстанции и на разных этапах развития животных показано, что отсутствие GDNF никак не влияет на количество (и качество) дофаминовых нейронов [8].
Относительно гипотезы Аппела стоит сказать, что сегодня мало для каких нейродегенеративных заболеваний удалось показать значительный вклад НТФ в патогенез. Для клиницистов и нейробиологов, занимающихся трансляционными исследованиями, сегодня важно не столько участие НТФ в развитии болезни, сколько потенциал к ее лечению. Собственно лечение нейродегенеративных заболеваний как таковое отсутствует. Все доступные на сегодня подходы направлены на устранение симптомов, но не причины заболевания. Можно принимать L-DOPA, чтобы восполнить нехватку дофамина, можно усилить действие L-DOPA коктейлем из ингибиторов ферментов деградации дофамина, можно вдобавок принимать агонисты (активаторы) дофаминовых рецепторов, наконец, можно стимулировать электрическим током субталамические ядра [9], но ничто из этого не вернет пациенту уже утраченных нейронов и не поможет остановить гибель тех немногих, что еще остаются «в строю».
GDNF — «суперзвезда» в терапии болезни Паркинсона
Этому нейротрофическому фактору нельзя не уделить особое внимание. Из-за своей уникальной способности специфично восстанавливать дофаминовые нейроны GDNF стал одним из самых изученных НТФ и одним из немногих, прошедших клинические испытания на реальных пациентах с болезнью Паркинсона [10]. GDNF, с одной стороны, останавливает патологические процессы в дофаминовых нейронах, a с другой, восстанавливает синтез дофамина и его секрецию, возвращая нейроны в нормальное функциональное состояние.
Итак, сегодня известно, что GDNF возглавляет целое семейство белков, куда, кроме GDNF, входят еще нейртурин (NRTN), артемин и персефин. Каждый из указанных белков связывается со своим собственным рецептором. GDNF, к примеру, связывается с GFRα1. Потом этот комплекс связывается с тирозинкиназой RET и уже с ее помощью посылает сигнал внутрь клетки. Вообще чаще всего комплекс «НТФ—рецептор» погружается (интернализуется) внутрь пресинаптического окончания и с помощью белка динеина, выполняющего роль молекулярного извозчика, перемещается по актиновым микрофиламентам к телу нейрона (это называется ретроградным транспортом). Уже в теле нейрона происходит запуск сигнального каскада, который в конечном итоге изменяет экспрессию определенных генов. Так, GDNF слабо экспрессируется в черной субстанции, зато этого НТФ относительно много в стриатуме (где, вопреки названию, GDNF синтезируют не глиальные клетки, а ГАМК-ергические интернейроны), откуда ретроградным транспортом он и попадает в тела дофаминовых нейронов. Поэтому мы увидим в дальнейшем, что именно стриатум является тем местом, куда исследователи вводят GDNF и другие НТФ с целью восстановить дофаминовые нейроны черной субстанции. У GDNF (как и остальных НТФ) есть один недостаток — из-за своего размера этот белок не может проникнуть через гематоэнцефалический барьер. По этой причине в большинстве исследований GDNF вводится напрямую в мозг.
Чудодейственные эффекты GDNF были многократно продемонстрированы в доклинических исследованиях на животных моделях болезни Паркинсона [11]. Вызвать паркинсонизм у грызуна или примата довольно просто: достаточно ввести в мозг 6-ОНДА (6-гидроксидофамин) или сделать инъекцию МРТР (1-метил-4-фенил-1,2,3,6-тетрагидропиридин). Эти вещества избирательно (а самое главное быстро) разрушают дофаминовые нейроны, вызывая весь спектр классических симптомов паркинсонизма. Используя эти так называемые токсические модели, еще в 90-х годах была оценена эффективность белка GDNF при введении в боковые желудочки мозга грызунов. И эффективность оказалась достаточно высокой — удалось добиться восстановления двигательных функций и усиления обмена дофамина. GDNF, когда был введен перед 6-ОНДА, продемонстрировал еще и нейропротекторный эффект, поскольку защитил дофаминовые нейроны от токсического поражения. Применение GDNF, меченного изотопом йода 125 I, показало, что этот белок поразительно широко распространяется в мозге (благо все мозговые желудочки связаны между собой) и после инъекции его можно обнаружить и в стриатуме, и в черной субстанции, а также в коре, таламусе, гиппокампе и даже мозжечке. Чуть позже аналогичные эксперименты провели на мармозетках и макаках резусах, со сходными результатами [12].
Успехи экспериментов на животных были столь воодушевляющими, что не заставили долго ждать и клинические испытания на людях. Первое же исследование, проведенное на 50 добровольцах с болезнью Паркинсона (двойное слепое плацебо-контролируемое). провалилось [12]. Пациенты получали внутрижелудочковые инъекции белка GDNF с помощью микрокатетера восемь месяцев (для части испытуемых срок увеличили даже до двух лет). Диапазон доз варьировал от 25 микрограммов до значительных 4000 микрограммов, правда, по одной инъекции в месяц. Пациенты по результатам исследования вместо улучшения самочувствия получили потерю веса, анорексию, тошноту, болевой синдром в шейном отделе позвоночника и другие неприятные последствия (например потеря обоняния). Авторы исследования (надо сказать, изрядные оптимисты) нашли во всем этом плюсы — если есть побочные эффекты, значит введенный GDNF биологически активен, заключили они! Ранее уже было сказано, что у животных при введении в желудочек мозга, GDNF распространяется чрезвычайно обширно. Собственно, этот факт и сыграл злую шутку, так как белок проник, вероятно, в область таламуса, по непонятной причине «обойдя стороной» стриатум и черную субстанцию, и вызвал целый веер неспецифических (и вредоносных) реакций.
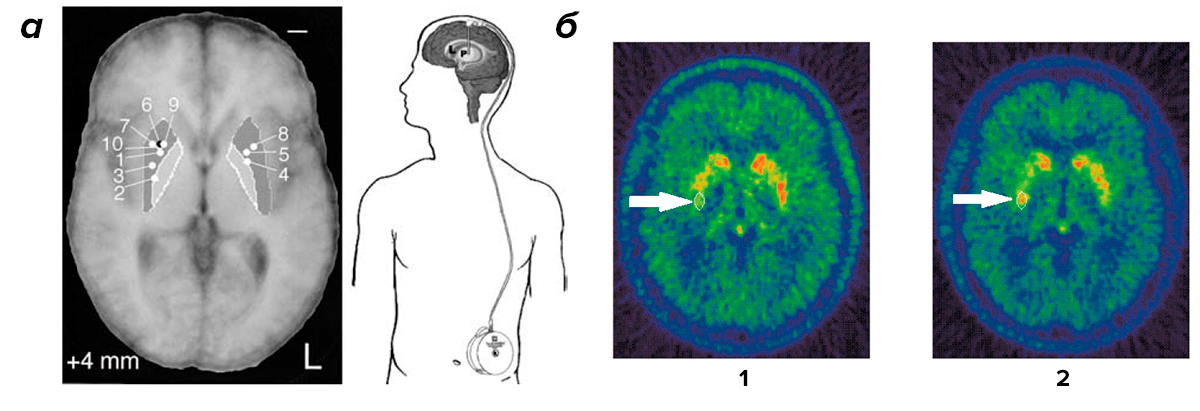
Параллельно проводили другие клинические испытания, в которых исследователи проявили бо́льшую прозорливость. Пяти пациентам в Бристоле (Великобритания) и десяти в Университете Кентукки (США) GDNF вводили с помощью катетера прямо в стриатум. Катетер был соединен с минипомпой, управляемой микрокомпьютером (рис. 1а). Каждый день в течение шести месяцев маленькие объемы растворенного белка поступали в мозг пациентов. Через каждые восемь недель дозу увеличивали (от трех микрограммов в день в начале испытаний до 30 микрограммов к их окончанию). Эффективность лечения проверяли в процессе и после окончания испытаний по специальной шкале UPDRS (unified Parkinson’s disease rating scale; унифицированной шкале оценки болезни Паркинсона). Эта шкала в своем общем виде позволяет оценить тяжесть моторных и немоторных симптомов болезни (существуют еще и более специализированные разновидности UPDRS). За четыре месяца удалось добиться более чем 30-процентного улучшения показателей по шкале UPDRS как во время, так и после лечения [13]. В Бристоле пошли дальше и вводили GDNF в течение года. Им удалось добиться почти 40-процентного улучшения моторных функций и на 61% улучшить использование двигательных навыков в повседневной жизни (шкала UPDRS III). Как говориться, аппетит приходит во время еды, так что воодушевленные британские исследователи продлили испытания еще на год. В итоге, через два года введения GDNF моторные функции улучшились на 57%, а по шкале UPDRS III улучшение составило 63% [14]. Но и это еще не все. У тех же бристольских пациентов через 18 месяцев введения GDNF наблюдалось повышение накопления ДОФА (диоксифенилаланина, предшественника дофамина), меченного изотопом 18 F, на 28% (рис. 1б). Это свидетельствует о том, что лечение повысило накопление дофамина в стриатуме [15].
Рисунок 1. Карта инъекций и схематичное изображение минипомпы (а) у пациентов из Кентукки, а также ПЭТ скан пациента из Бристольской группы (б) до введения (1) и после введения (2) GDNF. Цветом обозначена плотность 18 F ДОФА. Стрелкой показано место инъекции.
Когда испытания окончились, один из пациентов бристольской группы умер от инфаркта (это было никак не связано с лечением), что позволило заглянуть ему в мозг и увидеть результаты лечения на клеточном уровне. Оказалось, что в той половине стриатума которая получала GDNF, плотность аксонов дофаминовых нейронов в пять раз выше [16]. Таких результатов невозможно достичь никакими обычными средствами терапии болезни Паркинсона. Более того, в процессе лечения не наблюдалось побочных эффектов. Вы впечатлены? Исследователи тоже были крайне обрадованы результатами. Хотя при такой маленькой выборке пациентов вероятность ошибочного результата является высокой, что дает основания для резонной критики в адрес исследователей. И вот настала очередь фазы 2 — рандомизированного двойного слепого плацебо-контролируемого исследования.
Исследование проводили на 34 добровольцах в течение полугода, но, ко всеобщему разочарованию, оно не выявило ни убедительного повышения накопления 18 F ДОФА, ни тем более улучшения двигательных функций у получавших GDNF [17]. Этот разочаровывающий результат привел к остановке клинических испытаний GDNF на длительное время. Однако к самому исследованию появилось немало вопросов. Почему, например, доза белка была меньше, чем в предыдущих испытаниях (15 миллиграммов в день вместо 30-и)? Почему базовые моторные функции по шкале UPDRS определяли сразу после антипаркинсонической терапии (ясное дело, что после L-DOPA базовые показатели будут лучше)? Почему в выборку попали пациенты с разной тяжестью заболевания? Впрочем, последний вопрос в равной мере можно адресовать всем указанным исследованиям.
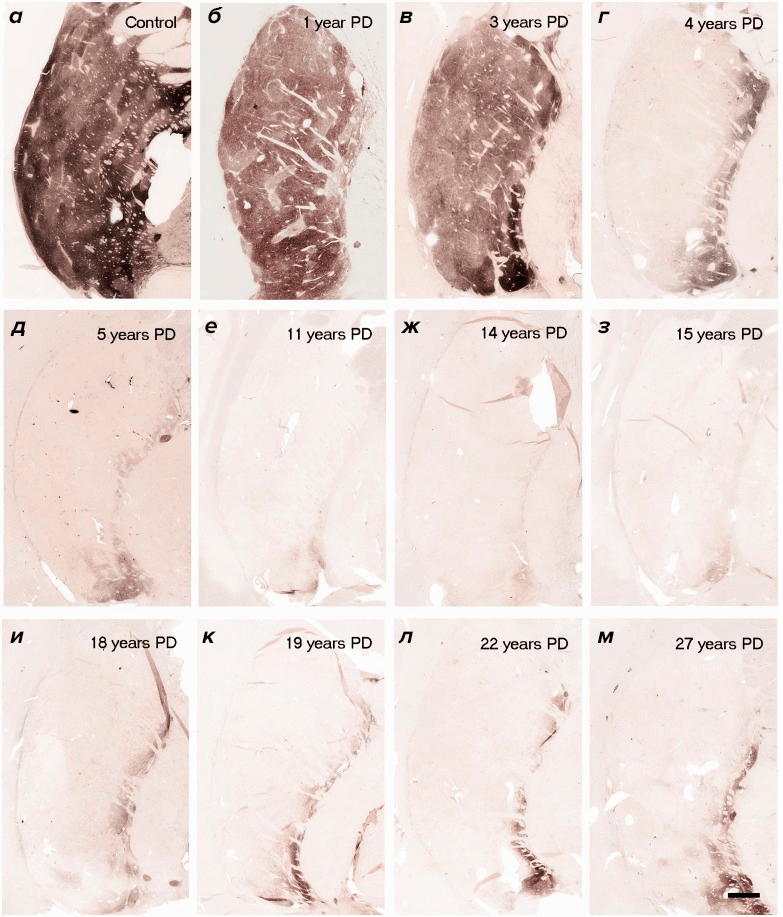
В работе Джеффри Кордуэра (Jeffrey Kordower) очень наглядно показано, как разительно отличается состояние дофаминовой системы на разных этапах заболевания [18]. Так уже через пять лет болезни плотность дофаминовых нейронов в большинстве случаев снижается настолько, что восстанавливать почти нечего (рис. 2). Вы можете вводить сколько угодно GDNF в стриатум, но если ваша «транспортная система» полностью уничтожена, до черной субстанции он никак не доберется, а значит, и лечение насмарку.
Рисунок 2. Плотность аксонов дофаминовых нейронов на срезе стриатума, иммуногистохимически окрашенных с помощью антител к тирозингидроксилазе. а — здоровый субъект; б–м — срезы стриатума пациентов с болезнью Паркинсона на разных стадиях заболевания.
Однако неудачное исследование фазы 2 побудило провести дополнительное исследование на приматах. На макаках резусах был полностью смоделирован процесс введения GDNF и дозировки, применявшиеся для лечения людей [19]. С повышением дозы GDNF росло число побочных эффектов, и во всей красе проявлялась токсичность белка. Проявились нарушения аппетита, потеря веса, потеря клеток Пуркинье в мозжечке. Даже увеличение числа аксонов (спраутинг) уже казалось каким-то зловеще бесконтрольным. Исследователи заключили, что GDNF вводить на самом деле небезопасно, и это также надолго остановило клинические испытания.
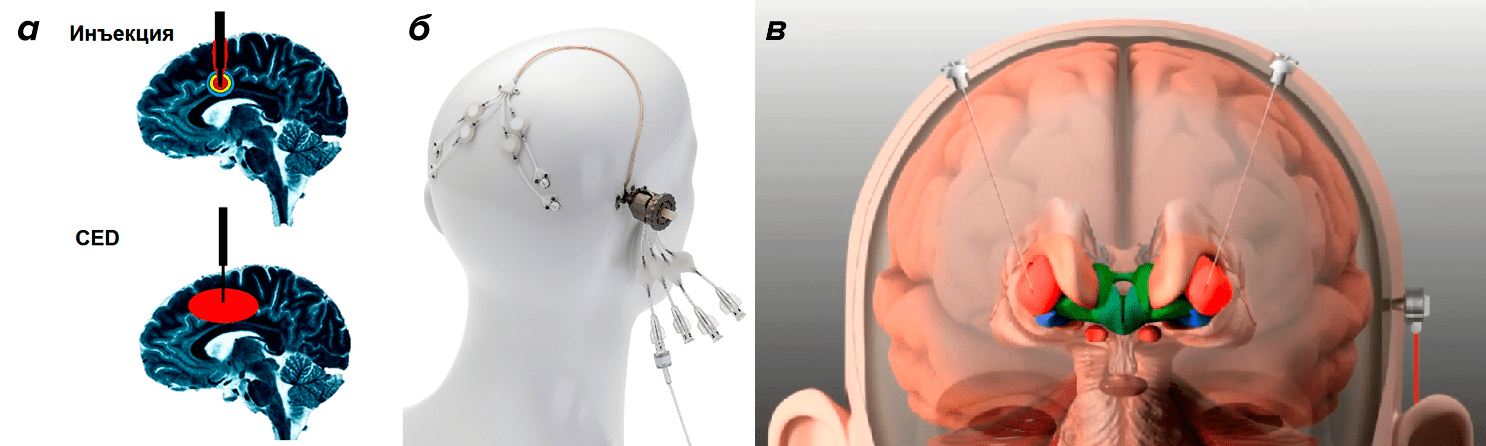
Тем не менее на сайте clinicaltrialsregister.eu можно найти информацию о двух продолжающихся клинических испытаниях GDNF (табл. 1). О результатах пока ничего не известно. Кроме того, что это испытания второй фазы, проводятся они снова в Бристоле и отличаются иным подходом к введению самого белка. Так, теперь инъекция делается билатерально (то есть в обе половины стриатума) и с помощью методики CED (convection-enhanced delivery), или доставки с улучшенной конвекцией. Этот подход заключается в том, что ультратонкий катетер, введенный в стриатум, впрыскивает GDNF под большим напором, что позволяет покрыть гораздо бо́льшую площадь стандартным объемом раствора, сделать это равномерно и не травмируя ткани (рис. 3) [20]. Метод хорошо зарекомендовал себя в экспериментах на макаках [21] и свиньях [22] и, как мы видим, добрался до клинических испытаний. Хочется верить, что все ошибки предыдущих испытаний были учтены и нас ожидают по-настоящему впечатляющие результаты.
Рисунок 3. Схематичное сравнение (а) обычной инъекции с помощью минипомпы и доставки с улучшенной конвекцией (CED). Система для введения по методу CED, произведенная компанией Renishaw (б), и схема билатеральной инъекции в стриатум, проводимой с ее помощью (в).
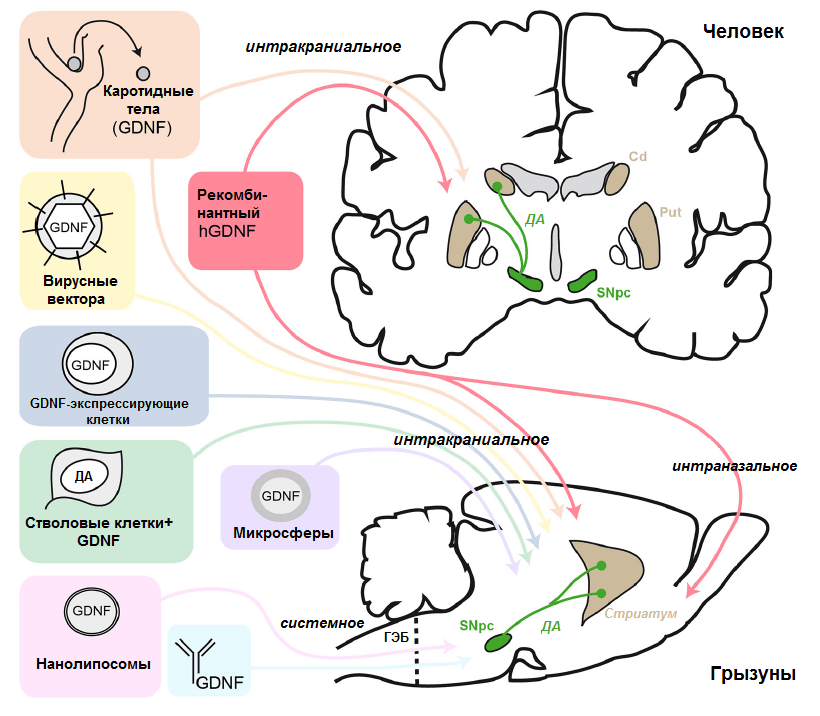
На рекомбинантном белке свет клином не сошелся (рис. 4). Другим многообещающим подходом является использование аденоассоциированных вирусных (AAV) векторов для доставки гена GDNF в мозг. По сути, речь идет о генной терапии. Аденоассоциированный вирус исполняет роль «умной упаковки», которая в силу своей природы умеет доставлять сама себя внутрь клетки. Также эти вирусы малозаметны для иммунной системы (что хорошо и для вируса, и для исследователей). В научной фантастике вирусный вектор, как правило, мутирует, неся человечеству зомби-апокалипсис (вспомните хотя бы «Я — легенда» с Уиллом Смитом). В реальности ничего подобного, конечно же, быть не может в принципе. Никакой исследователь (если он в своем уме) не создаст конструкт, обладающий хоть небольшой патогенностью. Из вируса выбрасывается вся его патогенная начинка (ответственная среди прочего за воспроизводство вируса) и замещается тем геном/генами, которые необходимо доставить по адресу. Адресность в данном случае задается специфическим промотором, который позволит геному вируса производить требуемый белковый продукт только в определенных клетках. Преимущество вирусной доставки очевидно — вам достаточно сделать всего одну инъекцию, после которой в целевой области появится множество дополнительных копий необходимого гена (в нашем случае GDNF), и экспрессия возрастет в десятки или сотни раз. Продукция белка после этого будет на высоком уровне постоянно. А что еще нужно для восстановления поврежденных нейронов? В целом, метод вирусной доставки GDNF прекрасно зарекомендовал себя в экспериментах на животных, коих было немало [13], и таки добрался до клинических испытаний на людях. На данный момент в Роквилле (США), уже идет первая фаза испытаний вирусного вектора AAV2-GDNF на пациентах со значительной продолжительностью (более пяти лет) болезни Паркинсона. В этом исследовании также учтены кое-какие подходы из испытаний белка GDNF, в частности вирусные частицы вводятся билатерально в стриатум с применением техники CED.
Рисунок 4. Схема различных подходов к доставке GDNF, применяемых в испытаниях на животных и человеке. Сокращения: ГЭБ — гематоэнцефалический барьер; SNpc — компактный слой (pars compacta) черной субстанции (substantia nigra); ДА — дофамин; Cd — хвостатое тело; Put — скорлупа (putamen). Хвостатое тело и скорлупа входят в состав стриатума.
| НТФ | Цель исследования | Группа пациентов | Идентификаторы баз clinicaltrials.gov и clinicaltrialsregister.eu | Фаза испытаний |
|---|---|---|---|---|
| AAV2-GDNF | Испытание четырех различных доз AAV2-GDNF на предмет безопасности при билатеральной внутристриатальной инъекции | 24 пациента со стажем болезни более пяти лет | NCT01621581 | Продолжается фаза 1 |
| Рекомбинантный GDNF | Исследование эффектов после введения различных доз (9–11 mg/ml) c помощью CED | EUCTR2011-003866-34-GB | Продолжается фаза 2 | |
| Рекомбинантный GDNF | Сравнение 9 и 18 месячного режима лечения (схема та же, что и в вышеприведенном триале) | EUCTR2013-001881-40-GB | Продолжается фаза 2 | |
| AAV2-Neurturin (CERE-120) | Испытание безопасности и эффективности CERE-120 при введении в стриатум (фаза 1) или комбинированно в стриатум и черную субстанцию (фаза 2) | 60 пациентов в фазе 1 и примерно 50 в фазе 2 | NCT00985517 | Фаза 1 завершена. Не выявлено осложнений, но и существенного положительного эффекта тоже. Начаты испытания фазы 2 |
| Рекомбинантный PDGF-BB | Двухнедельное испытание различных доз PDGF-BB при введении в желудочек мозга на предмет безопасности | 12 пациентов с умеренной тяжестью заболевания | NCT00866502 | Фаза 1/2 завершена. Показана безопасность и переносимость лечения. Намечены новые испытания |
| Рекомбинантный CDNF | Рандомизированное плацебо-контролируемое исследование эффективности инъекции средней и высокой доз CDNF с помощью CED | 18 пациентов | NCT03295786 | Фаза 1/2, идет набор добровольцев |
| Рекомбинантный CDNF | Рандомизированное плацебо-контролируемое исследование безопасности инъекции CDNF и проверка надежности и безопасности системы введения препаратов по методу CED, а также проверка эффективности CDNF для коррекции моторных и немоторных функций | 18 пациентов со средней тяжестью заболевания | EUCTR2015-004175-73 | Фаза 1/2, продолжается |
| Рекомбинантный CDNF | Рандомизированное плацебо-контролируемое исследование эффективности билатеральной внутристриатальной инъекции CDNF (продолжение проекта EUCTR2015-004175-73), направленное на изучение эффектов после окончания лечения | 18 пациентов со средней тяжестью заболевания | EUCTR2018-000346-19 | Продолжается фаза 2 |
Про GDNF можно сказать еще очень много (он пользуется вполне заслуженным вниманием у исследователей), но, как говорится, «надо и честь знать». Однако прежде чем мы перейдем к другим НТФ, стоит сказать еще немного об иных, альтернативных подходах к использованию GDNF в терапии паркинсонизма (краткий, но емкий разбор их многообразия приведен в еще не потерявшем свежести обзоре Хавьера д’Анлемонта де Тассиньи (Xavier d’Angelmont de Tassigny) [10]) (рис. 4).
Так вот, одним из любопытных способов обойти непроницаемый гематоэнцефалический барьер (ГЭБ), избежать инвазивной операции и не связываться с вирусами, является использование нанолипосом. Эти полые липидные шарики с GDNF внутри, на поверхность которых посажены трансферриновые рецепторы, легко «проскальзывают» через ГЭБ. Несмотря на кажущуюся неспецифичность действия, такой подход позволяет почти полностью восстановить дофаминовые нейроны у мышей. А еще липосомы можно закапать в нос, и до стриатума они доберутся по аксонам обонятельных нервов. Показано, что такие «капли в нос» хорошо защищают дофаминовые нейроны от токсического поражения.
Можно также связать GDNF c молекулой иммуноглобулина (антителом) к клеточным компонентам ГЭБ (правда, такой GDNF-IgG провалился в испытаниях на обезьянах).
Чтобы не вводить GDNF в стриатум ежедневно, был испытан подход, когда вводится биоразлагаемая микросфера, которая медленно секретирует GDNF в течение восьми недель. Позитивный эффект после такого курса сохраняется 24 месяца.
Существуют попытки (достаточно успешные) совместить клеточную терапию и НТФ. В одних случаях в стриатум вводят астроциты, экспрессирующие GDNF, в других случаях это могут быть стволовые клетки, которым GDNF в первую очередь помогает приживаться и выживать. Двум больным паркинсонизмом посчастливилось получить такое необычное лечение с весьма впечатляющими показателями на выходе [24]. Правда, до более масштабных клинических испытаний данный подход еще не добрался в виду ряда нерешенных проблем с приживлением и функционированием трансплантата (и мне сдается, что из-за трудоемкости и рискованности эта процедура все же сильно проигрывает вирусным векторам и введению рекомбинантного белка). Неожиданно, но каротидные тельца (скопления хеморецепторов в месте разветвления сонной артерии на наружнюю и внутреннюю дуги) оказались чрезвычайно богаты GDNF, поэтому эти небольшие кусочки ткани также пересаживали в стриатум, дабы восстановить поврежденные дофаминовые нейроны. Этот метод даже испытали на пациентах. Эффект, однако, оказался не столь долгосрочен, да и разброс среди пациентов был весьма велик [25].
Существует еще множество неинвазивных способов стимулировать экспрессию в мозге пациентов, не прибегая к серьезному медицинскому вмешательству. Практически все самые распространенные антидепрессанты (нередко применяемые для лечения депрессивных симптомов при паркинсонизме) усиливают синтез или секрецию GDNF [26]. Все больше публикуется сообщений о том, что соединения из растительных средств традиционной китайской медицины, такие как эхинакозид, пуерарин, нарингин, эффективно усиливают синтез GDNF и защищают дофаминовые нейроны от токсического повреждения. Усилить производство GDNF может транскраниальная магнитная стимуляция, метод, который все шире применяется в терапии болезни Паркинсона, а также физические упражнения и даже ограничение потребления пищи (или снижение калорийности). Однако какими бы заманчиво простыми не были эти решения, гимнастика, диета и антидепрессанты могут быть лишь дополнением к более серьезной терапии.
Близкий родственник GDNF — нейртурин
Как мы уже упоминали ранее, этот НТФ входит в то же семейство, что и GDNF, и имеет 42% сходства с последним. Благодаря своей способности восстанавливать и защищать дофаминовые нейроны он, так же как и GDNF, быстро привлек к себе внимание. Несмотря на многообещающие результаты экспериментов на животных [27] клинические испытания пошли не так хорошо, как хотелось бы. Исследователи решили не размениваться по мелочам и сразу же приступили к тестированию AAV-вектора для доставки нейртурина (коммерческое название этого средства — CERE-120). В первом испытании участвовали 12 пациентов с большой продолжительностью заболевания. Им сделали билатеральную инъекцию CERE-120 в стриатум и обнаружили безопасность и эффективность процедуры. По крайней мере, через год после инъекции не наблюдалось побочных эффектов, а двигательная активность по шкале UPDRS улучшилась на 36%. Настораживало только отсутствие изменений в метаболизме дофамина у больных [28]. Однако испытания фазы 2 обернулись едва ли не катастрофой. В рандомизированном мультицентровом исследовании с участием 58 пациентов [29] не только не удалось добиться существенного улучшения в течение года, но и у 13 из 38 пациентов, получивших инъекции CERE-120, обнаружились серьезные побочные эффекты. У троих из них даже появились опухоли в мозге. Впрочем, таковые возникли и у двух ложнооперированных пациентов из контрольной группы, так что AAV-вектор вряд ли виноват в этом. Посмертное вскрытие умерших пациентов показало, что аксональный транспорт нейртурина ухудшен, поскольку белок, синтезированный в стриатуме, так и не добрался до черной субстанции.
Но и это не остановило маховик клинических испытаний. Было проведено рандомизированное мультицентровое исследование с 51 пациентом, дабы узнать, сможет ли одновременная инъекция CERE-120 в стриатум и черную субстанцию как-то улучшить дело. Но и в этот раз ничего не вышло. Казалось бы, можно поставить точку, но на сайте clinicaltrials.gov обнаружилась информация, что в США снова проводятся испытания CERE-120. Вероятно, опыт прошлых испытаний будет учтен, и старания исследователей (и надежды пациентов) вознаградятся.
Другие НТФ и ростовые факторы в борьбе с паркинсонизмом
Вообще стоит сказать, что многие НТФ и ростовые факторы могут защищать дофаминовые нейроны, однако когда дело доходит до болезни Паркинсона, нейроны нужно не защищать, а восстанавливать. И тут очень немногие НТФ могут похвастаться эффективностью.
Известно, что белки семейства VEGF (факторы роста эндотелия сосудов) тоже могут восстанавливать дофаминовые нейроны после токсического поражения [32]. Но либо эти эффекты скромны (в случае с VEGF-C), либо недостаточно исследованы (в случае с VEGF-A и B). Есть сходные данные о представителях семейства фактора роста фибробластов (FGF), но опять-таки немногочисленные. На фоне вышеназванных ростовых факторов выгодно выделяется изоформа фактора роста тромбоцитов (PDGF-BB), который, вопреки своему названию, стимулирует восстановление нигростриатной системы после поражения 6-ОНДА. Причем действует он не напрямую, а стимулируя стволовые клетки в «горячих точках» нейрогенеза в мозге (преимущественно в субвентрикулярной зоне) [32]. PDGF-BB уже был испытан в первом исследовании с участием 12 пациентов, которым непродолжительное время этот белок вводили в желудочки мозга. Пока что доказана только безопасность PDGF-BB, но из-за короткого режима испытаний не оценили эффекта на двигательные функции пациентов, хотя и установили повышение в мозге плотности дофаминового траспортера [33].
CDNF и MANF — новые «игроки на поле»
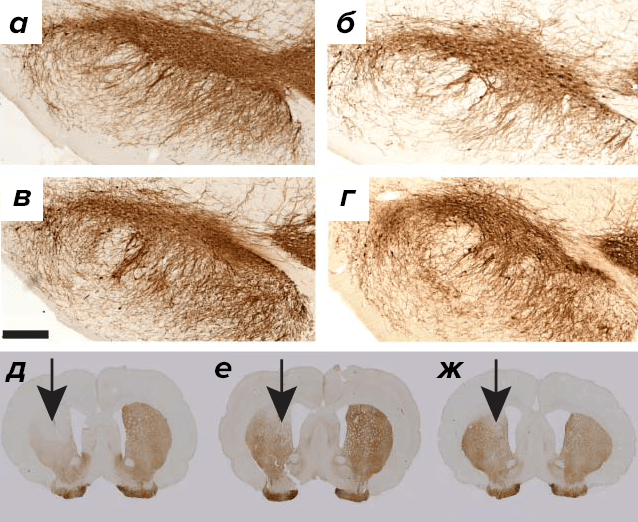
Скромные результаты, которые GDNF и нейртурин показали в ходе клинических испытаний, побудили исследователей искать новые НТФ, потенциально полезные для терапии болезни Паркинсона. В 2003 году был открыт белок, названный мезэнцефалическим астроцитарным нейротрофическим фактором, или MANF (mesencephalic astrocyte-derived neurotrophic factor). Сразу же выявилось, что MANF обеспечивает выживание эмбриональных дофаминовых нейронов in vitro. В 2007 году был обнаружен гомологичный (на 59%) белок CDNF (cerebral dopamine neurotrophic factor). Как вы уже догадались из названия, этот НТФ преуспевает в деле защиты и восстановления дофаминовых нейронов. Примечательно, что уже в первой публикации [34] было показано, что в токсической модели болезни Паркинсона (когда вводится 6-ОНДА, избирательно уничтожающий дофаминовые нейроны) CDNF восстанавливает нейроны эффективней, чем GDNF (рис. 5).
Рисунок 5. Срез черной субстанции здорового животного (а), после введения 6-ОНДА (б), 6-ОНДА+GDNF (в) и 6-ОНДА+CDNF (г). Срез стриатума после одностороннего введения 6-ОНДА (д), 6-ОНДА+GDNF (е) и 6-ОНДА+CDNF (ж).
Самое любопытное, что последовательности аминокислот и трехмерная структура MANF и CDNF разительно отличаются от всех остальных НТФ, так что даже какие-то эволюционные связи провести трудно. В отличие от прочих НТФ, оба фактора локализованы преимущественно в эндоплазматическом ретикулуме (ЭПР) — внутриклеточной системе из полостей, которая окружает ядро и является местом синтеза белка в клетке, — но могут переходить и в секретируемую форму. Вообще для них характерна двойственная активность. Строение N-конца белковой молекулы позволяет им действовать как нейротрофическим факторам, а благодаря строению С-конца они «заякорены» в ЭПР, и этой погруженной частью могут останавливать и обращать вспять так называемый стресс ЭПР. Это состояние развивается чаще всего из-за накопления неправильно свернутых или поврежденных белков (вспомните α-синуклеин) и заканчивается, как правило, апоптозом. Так вот, MANF взаимодействуя с регулятором «ремонтных» белков шаперонов, GRP78, помогает «распутывать» белки с неправильной конформацией, а CDNF, помимо этого, еще способен напрямую взаимодействовать с Bax и каспазой-3 и таким образом останавливать апоптоз. Показано, что CDNF, в отличие от остальных НТФ, может устранять скопления α-синуклеина [35], [36].
Самое интересное в отношении CDNF, то, что он почти инертен в отношении здоровых нейронов и начинает активно действовать лишь при наличии какого-либо патологического процесса. Согласитесь, очень удобное свойство для потенциального терапевтического средства. Благодаря своим малым размерам CDNF чрезвычайно хорошо распространяется от места укола и прекрасно транспортируется от стриатума до черной субстанции (рис. 6) [37]. Здесь «балл» также достается CDNF, а не GDNF, поскольку последний транспортируется достаточно медленно и сразу же «пасует» перед скоплениями α-синуклеина на своем пути. За десяток лет был проведен целый ряд исследований на различных животных от мышей до обезьян [38], в которых многократно был показан мощный защитный/восстанавливающий эффект CDNF, поэтому неудивительно, что уже начались его клинические испытания (на сайтах clinicaltrials.gov и clinicaltrialsregister.eu есть информация о трех клинических испытаниях первой и второй фаз в Финляндии и Швеции).
Рисунок 6. Срез стриатума здорового животного (а), окрашенного антителами к тирозингидроксилазе, и после введения 6-ОНДА (б). Окрашивание среза антителами к CDNF после введения последнего здоровому животному (в) и при введении CDNF после 6-ОНДА (г).
Да, в свое время и на GDNF c нейртурином возлагали большие надежды, которые они пока не оправдали, однако уже в испытаниях на животных CDNF показал себя лучше вышеназванных НТФ, стоит ли поэтому ожидать, что испытания провалятся? Думаю, нет. В этот раз на стороне исследователей и пациентов стоит сама природа, создавшая CDNF эффективным и безопасным. Огромный опыт, извлеченный из предыдущих экспериментов и испытаний GDNF, нейртурина или PDGF-BB, также поможет оптимизировать лечение, сделать его безопасным и действенным.
Заключение
Путь, по которому пошли исследователи и клиницисты, взяв на вооружение НТФ, оказался ухабистым, но никто и не обещал, что будет легко, однако награда в конце слишком велика, чтобы повернуть назад, — впервые у медицины появилась возможность вычеркнуть болезнь Паркинсона из разряда неизлечимых. Пессимизм середины–конца прошлого десятилетия сменяется оптимистичными прогнозами.
В 2017 году мне посчастливилось побывать в лаборатории профессора Марта Саарма (Mart Saarma) в Биоцентре при Университете Хельсинки. Руководимая им группа исследователей открыла CDNF и первой показала его эффективность в лечении паркинсонизма. В ожидании лабораторного семинара мы сидели в кабинете профессора, где он рассказал о некоторых исследованиях его лаборатории, в частности о тестировании CDNF на приматах и создании миметиков GDNF (малых молекул-аналогов, проникающих через ГЭБ). Результаты (к слову, очень впечатляющие) говорили сами за себя, но и та страсть, с которой Март рассказывал об исследованиях, ошибках прошлых испытаний и перспективах грядущих, заразили меня оптимизмом в отношении лечения болезни Паркинсона. Мне очень хочется верить, что после прочтения этой статьи немного оптимизма появится и у вас.