стт в стоматологии что это
Кюретаж десен в стоматологии
Кюретаж в стоматологии – это процедура очистки полости (например, пародонтального кармана) от посторонних включений, например, зубных отложений, кусочков омертвевшей ткани десны и т.п. Кюретаж является одним из важных методов лечения пародонтита, однако данный метод применяют и в других случаях. К примеру, после удаления зуба может проводиться кюретаж лунки, который позволяет удалить из ранки все остатки извлеченного зуба – обломки корней, частицы пломбировочного материала и т.п.
По сути кюретаж является хирургической процедурой, но в большинстве случаев, при развитии пародонтита, образовании десневых карманов, это единственный метод, позволяющий удалить от корней зуба все, что провоцирует размножение микробов, разрушающих прикрепление зуба к кости – и остановить развитие болезни.
Показания и противопоказания
Кюретаж пародонтальных карманов выполняется в том случае, если десневые карманы (в норме имеющие глубину не более 2 мм) углубились до 4 мм и более. В этом случае другие способы уже не дадут необходимого эффекта и не позволят остановить разрушение пародонта и обнажение корней зубов.
Признаками, показывающими развитие пародонтита и необходимость применения данной процедуры, можно считать:
При этом нередки случаи, когда десна на первый взгляд выглядит нормально, но под ней образовался глубокий карман, требующий обязательного вмешательства. Для того, чтобы это определить, делается рентгеновский снимок зуба, на котором видны образовавшиеся карманы и разрушение пародонта. После всестороннего обследования и исчерпания других возможностей лечения врач может принять решение о проведении кюретажа.
Противопоказания к кюретажу в стоматологии носят относительный характер. Это, как правило, воспалительные процессы в острой стадии, сопровождающиеся обильным выделением гноя, фиброзные образования (рубцы) внутри кармана, очень большая глубина кармана (более 6 мм), сильная расшатанность зубов. Некоторые из этих проблем удается решить – например, подавить сильное воспаление, выполнить шинирование подвижных зубов и т.п. И после этого оказывается возможным проведение кюретажа.
Методы выполнения процедуры
Не следует путать кюретаж десневых карманов и профессиональную чистку зубов, когда стоматолог удаляет зубной камень и налет, полирует поверхность зубов. При чистке отложения снимаются с поверхности зуба, а кюретаж зубов очищает карманы между десной и зубом. В зависимости от глубины карманов различают закрытый и открытый кюретаж.
Закрытый кюретаж: техника проведения
Если глубина десневого кармана не превышает 5 мм, проводится закрытый кюретаж. Процедура является менее травматичной, но предполагает анестезию. В процессе врач выскабливает поверхность десны, примыкающую к зубу, и удаляет зубные отложения, поврежденные участки. Для этого может применяться ультразвуковое оборудование. Отслоение десны здесь не производится. За счет полировки поверхности зуба уменьшается вероятность возникновения новых отложений.
Единственный существенный недостаток метода в том, что врач почти не видит полость десневого кармана во время манипуляций. Тем не менее на легкой и средней стадии пародонтита закрытый кюретаж позволяет улучшить состояние, остановить развитие патологии, в дальнейшем применяя консервативную терапию.
Открытый кюретаж: показания к проведению
При глубоких пародонтальных карманах (5-6 мм) и большом количестве отложений, а также признаках повреждения костной ткани проводится открытый кюретаж. Все процедуры также предполагают выполнение анестезии. Во время этой операции делается точный разрез десны и осуществляется ее отделение, позволяющее открыть полость глубокого десневого кармана. Далее проводится чистка твердых отложений, выскабливание поверхности полости. Рана обрабатывается антисептиком, при необходимости происходит подсадка синтетического костного материала. После этого накладываются швы и десневая повязка.
Спустя 10 дней швы можно снять. При строгом выполнении всех требований методики, а также соблюдении предписанного режима в реабилитационном периоде восстановление происходит быстро. Развитие пародонтита при этом останавливается.
Альтернативные методы проведения процедуры
Удаление твердых зубных отложений в полости кармана может производиться различными способами. Значительная их часть может быть отнесена к закрытому типу операции, т.к. их применение не предполагает разрезов десны.
Вакуумный кюретаж в стоматологии
Очистка пародонтальной полости здесь производится специальными кюретами, которые соединены с устройством вакуумного отсасывания отделенных частиц из зоны обработки. Меньшее количество повреждений и мгновенное удаление частиц тканей и налета позволяют снизить риск осложнений и сократить период реабилитации.
Химический
В этой методике применяются различные химические вещества (в частности, лимонная кислота) для размягчения и последующего удаления твердых частиц зубного налета. Раствор оказывает не только очищающее и размягчающее действие, но и антисептическое, позволяя легче, с меньшими повреждениями удалить все лишнее из десневого кармана, одновременно обеззараживая полость и снижая вероятность инфицирования.
Ультразвуковой
Метод разрушения твердых зубных отложений с помощью ультразвука требует применение специального оборудования, например, аппарата «Вектор». Воздействуя ультразвуком, а также водно-воздушной струей под давлением, он позволяет успешно удалять твердый налет, хотя для кюретажа применяется здесь применяется и обычный ручной инструмент.
Крио-метод
Использование жидкого азота для удаления различных отложений и пораженных тканей практикуется и при обработке пародонтальных карманов. Заморозка позволяет также убивать болезнетворные микроорганизмы, снижает риск осложнений и делает всю операцию совершенно бескровной.
Лазерный
Наиболее часто задаваемый вопрос от пациентов — что такое лазерный кюретаж пародонтальных карманов? Отвечаем: лазерный кюретаж – это один из самых современных методов очистки десневых карманов, его суть в том, что луч лазера прогревает зону действия до высокой температуры, мгновенно выжигая посторонние включения, бактерии, одновременно закрывая кровеносные капилляры, предотвращая кровотечение. Этот способ меньше травмирует ткани, не требует наложения швов, сокращает восстановительный период.
Реабилитация после операции
После выполнения кюретажа десен не всегда требуется специальная реабилитация. Процедуры закрытого кюретажа, особенно выполняемые ультразвуковым или лазерным методом, практически не требуют никаких особых ограничений. Лишь в первые часы необходимо отказаться от приема пищи, а в последующие 2-3 дня – ограничиться только мягкой (или полужидкой) негорячей и не холодной пищей. Вначале зубы могут реагировать на горячее и холодное, но в дальнейшем эта чувствительность исчезает. После открытого кюретажа необходимо тщательно выполнять рекомендации врача, чтобы не допустить осложнений.
Возможные осложнения
Осложнения могут быть вызваны индивидуальными особенностями организма или нарушением требований врача.
Повышенная чувствительность зубов может сохраняться до двух месяцев. Для того, чтобы ускорить ее регрессию, потребуется применять специальные пасты и гели, которые назначит врач. Отек и гематома в месте операции могут сохраняться до 14 дней. Опасности это не представляет и проходит самостоятельно. В отдельных случаях могут наблюдаться стянутость, затруднения в открывании рта, но эта проблема обыкновенно также исчезает на протяжении нескольких дней. Зубы могут сохранять подвижность до 3-х недель. Необходимо дождаться конца этого периода, прежде чем возвращаться к твердой пище.
Рекомендации после процедуры
Рекомендации после проведения кюретажа в стоматологии всегда носят индивидуальный характер. В одних случаях на первое время нужно лишь отказаться от твердой пищи и чистки зубов жесткой щеткой. В других приходится выполнять более строгие требования, наблюдаться у стоматолога и снимать швы после заживления повреждений. Важно внимательно прислушиваться к советам врача и стараться максимально точно выполнять все предписания – тогда процедура кюретажа принесет максимум пользы и пародонтит долгое время вас не побеспокоит.
Техники забора соединительнотканных трансплантатов
Автор: Francisco Teixeira Barbosa
Автор: Francisco Teixeira Barbosa
Часть 1. Почему мы используем мягкотканные трансплантаты?
Потому что это хирургия класса люкс? Потому что «трансплантация» в тренде?
Преследуются две основные цели:
1) Увеличение ширины кератинизированной ткани
2) Увеличение объема мягких тканей
После того, как несколько авторов поняли, что ширина кератинизированной ткани вокруг зубов была клинически переоценена, использование свободных десневых трансплантатов (СДТ) стало вариантом решения эстетических дефектов, таких как смещение мягких тканей (Bernimoulin et al., 1975, Miller, 1982), увеличения гребня с помощью мягких тканей (Seibert 1983) и для того, что в настоящее время довольно развито: консервация лунки в эстетической зоне (Landsberg & Bichacho 1994).
Мы все знаем, что у СДТ есть два больших ограничения: увеличение объема и эстетический результат (иногда цвет и поверхность имеют разный цвет с участком-реципиентом), и вскоре преимущества использования субэпителиального соединительнотканного трансплантата (ССТ) стали очевидными в литературе (B. Langer & Calagna 1980, B. Langer & L. Langer, 1985). Учитывая преимущества ССТ над СДТ, мы собираемся сосредоточиться в данной статье на ССТ.
Мы также должны знать роль неотъемлемых факторов, связанных с генетическим определением десневых тканей, или для чего я рекомендую вам статьи от Karring (Karring et al., 1971; Karring et al., 1975), а также лекцию от Juan Alberto Fernandez на oralsurgerytube, на который я убедительно рекомендую вам подписаться.
Жевательная слизистая оболочка: эпителий, собственная пластинка, подслизистый слой и надкостница.
Что мы должны знать о донорском участке?
Жевательная слизистая оболочка твердого неба состоит из трех гистологических слоев:
— Эпителий (толщина 300 мкм, 0,3 мм, это действительно довольно тонкий слой)
Другой анатомической особенностью, которую всегда следует учитывать, является большая небная артерия. Для простоты я буду использовать от данные из Monnet-Corti, в которых основные ветви большой небной артерии были на расстоянии +/- 12 мм от края десны в области клыков, +/- 14 мм в области второго моляра (Monnet- Corti et al., 2006). Хотя это исследование имеет некоторые неточные измерения (край десны не всегда является хорошим ориентиром), почти все авторы предположили, что большую небную артерию можно обнаружить на расстоянии 76% от высоты свода неба, измеряемой от цементно-эмалевого соединения первого моляра.
Рисунок 2. Соглашение привел к тому, что эти измер
Доступ ко всем статьям по подписке
Доступ к 1524 статьям
Новые статьи почти каждый день
Без автоматического продления
Подробнее о подписке
StraumannPLAY
About
Довольно часто на прием к пародонтологу приходят пациенты с рецессиями, которые возникли после проведенного ортодонтического лечения. Большинство рецессий относятся к I и II классу по Миллеру и не очень глубокие. Но иногда мы сталкиваемся с более сложными случаями: рецессии III класса; рецессии глубиной более 5 мм; наличие рубцовых изменений после ранее проведенных хирургических вмешательств.
На примере данного пациента мы предложим методику устранения глубокой одиночной рецессии десны III класса по Миллеру с помощью КСЛ, СТТ и Emdogain®. (КСЛ – коронально-смещенный лоскут, СТТ – соединительно – тканный трансплантат).
Исходная ситуация
План лечения
После анализа клинической ситуации и оценки всех рисков, пациенту был предложен двухэтапный протокол лечения рецессии 32 зуба:
1 этап – проведение углубления преддверия полости рта в области 41-33 по методике Шмидта.
Через 3 месяца: 2 этап- проведена пластика рецессии с помощью КСЛ, СТТ и Emdogain® 0,3.
.Лечение
Послеоперационный период протекал без особенностей.
Через 3 месяца сформировалось достаточное по глубине преддверие для того, чтобы провести пластику рецессии с применением КСЛ (Илл. 3).
2 этап (Через 3 месяца):
Для забора СТТ использовали на небе зону 24-26 и получили субэпителиальный трансплантат методом одного разреза. На СТТ был нанесен Emdogain®.
На чистую, сухую поверхность корня был нанесен Emdogain®.
С помощью монофиламентной нити – Pro-len 6,0 СТТ был зафиксирован на поверхность корня 32 зуба. Проведена мобилизация лоскута и фиксация лоскута в межзубных промежутках с помощью монофиламентной нити – Pro-len 6,0.
На поверхность ушитой раны были нанесены остатки Emdogain®.
Послеоперационный период протекал без особенностей. Не отмечалось выраженной болевой реакции, отеков и гематом. Через 14 дней сняли швы (Илл. 4).
После проведенного 1 этапа получили достаточную по ширине зону подвижной десны, которую на втором этапе мы смогли переместить в область дефекта.
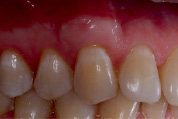
После выполнения пластики рецессии десны на момент снятия швов мы получили закрытие рецессии на 95%. Полученный результат мы можем считать хорошим, так как по данным литературы успешность закрытия рецессий III класса соответствует – 70-80% (Miller P.D., 1985;Harris R.J., 1997)
Через 3, 6 и 12 месяцев результат оставался стабильным, что подтверждает правильность выбора методики (Илл. 5, 6 и 7).
Заключение
Для закрытия рецессии у данного пациента мы использовали 2-х этапную методику с применением СТТ и Emdogain®.
Двухэтапная методика позволила нам снять риски натяжения лоскута после ушивания раны.
Использование СТТ позволило нам получить широкую зону прикрепленной десны в области корня 32 зуба.
Эмалево-матричные протеины (Emdogain®) способствуют регенерации пародонта при устранении рецессий, улучшают заживление раневой поверхности, способствуют формированию прикрепления (“Регенерация пародонта”, А.Скулеан; 2012).
По данным многочисленных исследований Emdogain® сам по себе обладает антимикробным эффектом, поэтому при использовании данного препарата при проведении пластических операций нам не нужно назначать пациенту антибиотико- терапию.
Выводы
Тщательное планирование операции, выявление всех факторов риска и использование дополнительных средств (Emdogain® и PrefGel) позволяет добиться хороших результатов при проведении хирургических вмешательств даже в сложных клинических случаях.
Стт в стоматологии что это
При лечении частичного и полного отсутствия зубов ортопедические конструкции на дентальных имплантатах прочно вошли в современную стоматологию в качестве «золотого стандарта». Четкие протоколы имплантации, работы с костной тканью позволяют достигать предсказуемой интеграции имплантатов [1]. В связи с этим эстетический аспект имплантологического лечения, как и всей стоматологии, выходит на первый план.
Критерием эстетического успеха реставрации является способность максимально имитировать натуральный зуб [2], для чего необходим симбиоз оптимального позиционирования имплантата в костной ткани и состояния мягких тканей периимплантатной зоны. Правильные параметры толщины, уровня, цвета и текстуры мягких тканей предопределяют эстетический успех реставрации [2] являются гарантом долгой службы имплантата ввиду снижения риска развития периимплантита [3] и обеспечивают удовлетворенность лечением пациента и доктора.
С момента своего внедрения (более 50 лет назад) трансплантация мягких тканей все чаще используется в клинической практике для увеличения толщины десны в области зубов и имплантатов, коррекции слизисто-деcневых деформаций, улучшения эстетики и создания адекватной ширины кератинизированной десны (КД) [4; 5].
Целью нашего исследования является обзор современных подходов и аутотрансплантатов, используемых для увеличения объема мягких тканей полости рта.
Наличие адекватной ширины и толщины КД имеет важное значение для зубов, а для имплантатов может быть критическим. Кератинизированная слизистая оболочка десны и ее достаточный объем, как показала практика, защищает поверхность зубов и имплантатов от потери клинического прикрепления вследствие воспаления, защищает от механической травмы, способствует проведению более качественной индивидуальной гигиены полости рта для пациентов [6].
Несколько последних исследований показали, что увеличение объема мягких тканей с использованием свободного десневого трансплантата эффективно для уменьшения воспаления слизистой оболочки, дискомфорта пациента и обеспечения оптимального контроля над биопленкой вокруг имплантатов [7]. Более того, сообщалось, что толщина мягких тканей критически важна и может влиять на потерю краевой кости в области имплантатов [6].
Метаанализ Thoma et al. показал, что увеличение объема мягких тканей аутогенными трансплантатами является наиболее предсказуемым методом поддержания состояния здоровья периимплантатных тканей для увеличения ширины и толщины кератинизированной десны [8]. Было установлено, что наличие как минимум 2 мм кератинизированной десны обеспечивает защитными свойствами мягкие ткани, окружающие имплантаты, а имплантаты с меньшим количеством кератинизированной десны более склонны к развитию биологических осложнений [9; 10].
Методика использования свободного десневого трансплантата (СДТ), полученного из твердого неба, была впервые предложена Nabers с целью углубления преддверия полости рта [11]. Эта техника позже была модифицирована Sullivan и Atkins и применялась для закрытия рецессий десны в области зубов. В дальнейшем показания для использования СДТ расширились и стали применяться в области имплантатов как после их установки, так и для адаптации мягких тканей до реконструкции альвеолярного гребня и последующей установки имплантатов [12].
В то время как традиционные подходы при проведении мягкотканной пластики были нацелены прежде всего на увеличение кератинизиованной десны, основная цель современной пародонтологии заключается в достижении конечных эстетических результатов [4; 13]. Внедрение в практику и замена СДТ на субэпителиальные соединительнотканные трансплантаты (ССТ) представляют собой переход от традиционной хирургии слизистой оболочки десны к пластической хирургии пародонта [4]. Существует множество доказательств того, что ССТ является методом выбора и активно используется на сегодняшний день при лечении рецессии десны зубов и имплантатов [14; 15], для увеличения толщины мягких тканей [3], маскировки измененного цвета корней зубов или видимых компонентов имплантата [4], а также реконструкции межзубной десны [16].
В то время как СДТ, сохраняя свой первоначальный вид мягких тканей неба на участке реципиента, может приводить к плохой эстетической интеграции и образованию «заплаткоподобной» текстуры [4], ССТ способен увеличивать объем и качество мягких тканей, а также обеспечивать гармоничный, эстетический контур десны [4; 13].
При лечении рецессий десны в области имплантатов настоятельно рекомендовано использование ССТ независимо от изначальной ширины и толщины окружающей имплантат кератинизированной десны [17].
Для получения ССТ с неба было предложено несколько методик, такие как метод «окна», одиночного и параллельного разреза. Данные хирургические способы забора ССТ нацелены преимущественно на достижение заживления первичным натяжением, путем сохранения покрывного лоскута, который затем плотно адаптируется швами к донорскому участку после забора трансплантата. Эти методики первоначально считались золотым стандартом, поскольку, в отличие от классического способа забора СДТ, они сопровождались меньшей послеоперационной чувствительностью и считались менее травматичными [18].
Тем не менее в дальнейшем было продемонстрировано, что ССТ может быть получен путем забора СДТ и его последующей деэпителизацией, а послеоперационная чувствительность приравнивалась как после забора ССТ методом «окна», при условии, если донорская область полученного трансплантата защищена в послеоперационном периоде [19]. Также, за последнее время было опубликовано несколько утверждений в пользу снижения болевой чувствительности при заборе СДТ и улучшение заживление раны на небе, соблюдая определенные параметры, по сравнению с классическими методами получения ССТ [20].
Производить забор субэпителиального соединительнотканного трансплантата (ССТ) можно лишь в определенных участках слизистой оболочки полости рта, которые соответствуют следующим критериям: возможность обеспечения оптимального размера трансплантата, приемлемая после- операционная болезненность и отсутствие серьезных рисков для здоровья [4]. Безусловно, зонами выбора для стоматологов являются: зона твердого нёба – от клыка до второго моляра, и область бугра верхней челюсти.
Трансплантаты из различных донорских зон, как правило, имеют различную геометрическую форму: ССТ с бугра более объемные и короткие, в то время как ССТ из латеральной области твердого нёба более протяженные и тонкие [4].
Также донорские зоны имеют различия в степени дискомфорта в послеоперационном периоде для пациента, что было показано в работе группы американских ученых [21]. При стандартизированном размере забираемого ССТ (толщиной 1,5 мм, одинаковой длины и ширины) пациенты отмечали различную степень выраженности болевых ощущений в послеоперационном периоде. Боль оценивалась по субъективной шкале от 1 до 10. В среднем показатели болевых ощущений в группе пациентов с донорской зоной в области твердого нёба были существенно выше, чем у пациентов с донорской зоной в области бугра (5,9 ± 2,74 против 2,6 ± 2,16).
Клинический опыт многих исследователей [4; 5] свидетельствует о том, что в долгосрочном периоде (1 год и более) после аугментации мягких тканей альвеолярного гребня ССТ из области бугра верхней челюсти и твердого нёба могут наблюдаться существенные отличия в клиническом результате. Ткани, аугментированные трансплантатами с твердого нёба, зачастую показывают значительное уменьшение объема в первые недели, но затем остаются стабильными в долгосрочном периоде и обеспечивают надлежащий эстетический результат. В свою очередь, при использовании ССТ из области бугра зачастую отмечается хорошая стабильность полученного объема тканей в первые месяцы, а затем наблюдается тенденция к гиперпластической реакции, увеличению объема и появлению эстетически нежелательного эффекта «белой заплатки» [22].
Ключ к пониманию механизмов, ответственных за столь отличающиеся клинические результаты и разное поведение соединительнотканных трансплантатов, лежит в их различном гистоморфологическом строении.
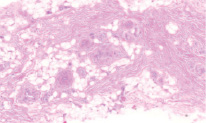
Рис. 1. Микропрепарат в окраске гематоксилин-эозином представлен участком соединительной ткани подслизистого слоя твердого нёба. Значительную площадь поверхности препарата занимают кровеносные сосуды и жировая ткань
Данные отечественной и зарубежной литературы свидетельствуют о том, что трансплантаты из области бугра имеют более плотное строение за счет большего числа коллагеновых волокон в lamina propria, чем ткань из области переднего отдела твердого нёба (72.79 % волокон для ССТ из области бугра против 51.08 % для ССТ из области твердого нёба по данным Tavelli 2019 [23], что обуславливает стабильное сохранение первоначального объема ССТ из области бугра. При рассмотрении глубжележащих слоев тканей донорских областей также наблюдаются значительные отличия: в подслизистом слое переднего отдела твердого нёба наблюдается гораздо большее количество жировой и железистой ткани, нежели в области бугра верхней челюсти (25,75 % против 4,89 % по данным Sanz-Martin, 2019 [24], что может влиять на большую усадку нёбного трансплантата, меньшее увеличение объема мягких тканей и значительно более слабую индукцию кератинизации эпителия аугментируемой области [25].
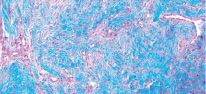
Рис. 2. Микропрепарат в окраске по Маллори представлен участком соединительной ткани lamina propria из области твердого нёба. Хорошо заметна богатая васкуляризация и рыхлая структура коллагеновых волокон
В свою очередь, соединительная ткань из области бугра менее васкуляризована, что затрудняет питание трансплантата на этапе, когда сосуды питающего ложа еще не проросли в трансплантат, и вся его трофика происходит за счет диффузии. В связи с этим ССТ из области бугра должен быть полностью перекрыт тканями реципиентного ложа, в отличие от ССТ из области переднего отдела твердого нёба, где допустимо частичное оголение трансплантата для заживления вторичным натяжением [4].
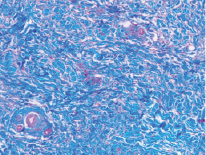
Рис. 3. Микропрепарат в окраске по Маллори представлен участком субэпителиальной соединительной ткани из области бугра верхней челюсти. Наблюдается более плотная структура соединительной ткани наряду с меньшим количеством кровеносных сосудов
По данным Dellavia C., Ricci G. 2014 [26] при использовании ССТ из области бугра для аугментации мягких тканей альвеолярного гребня в отдаленных сроках весьма часто отмечается неудовлетворительный эстетический результат в виде гиперплазии мягких тканей и изменения цвета – эффект «белой заплатки». В связи с этим для достижения удовлетворительного состояния мягких тканей приходилось прибегать к гингивопластике измененного участка, однако в течение 9 месяцев, по данным исследований, происходило возвращение 70 % объема тканей, удаленного после пластики. Гиперпластические изменения связаны с особой структурой коллагеновых волокон соединительной ткани в области бугра верхней челюсти: при созревании коллагена были обнаружены процессы, схожие с теми, что протекают в организме при фиброзных изменениях других органов и систем. Выдвигаются гипотезы о принадлежности фибробластов мягких тканей бугра и твердого нёба к различным субпопуляциям, обладающих разными показателями активности экспрессии генов, ответственных за продукцию ферментов, участвующих в метаболизме коллагена: его созревании, создании поперечных цепей и деградации. Таким образом, в мягких тканях бугра верхней челюсти деградация коллагена металло-матриксными протеиназами затруднена ввиду большего количества поперечных связей коллагеновых волокон, что клинически находит своё проявление в гиперпластической реакции.
Рис. 4. Гиперпластическая реакция слизистой оболочки в области зуба 2.3 через 1 год после коронального смещения лоскута с ССТ из области бугра верхней челюсти
Заключение
Современная стоматология развивается в направлении увеличения предсказуемости результата лечения, получения высоких функциональных и эстетических показателей и снижения послеоперационного дискомфорта для пациентов, в связи с чем научно обоснованное использование соединительнотканных трансплантатов остаётся темой активного изучения.
На сегодняшний день нашей исследовательской группой проводится клинико-гистологическое исследование с целью обоснования применения соединительнотканных трансплантатов из различных зон нёба для устранения дефицита мягких тканей в области зубов и имплантатов. Продемонстрированные в статье микропрепараты используются для изучения гистоморфологической структуры ткани донорских областей твердого нёба и бугра верхней челюсти. Основной задачей исследования является выявление зависимости клинических и эстетических результатов аугментации мягких тканей от гистологического строения использованных соединительнотканных трансплантатов, изучение их регенеративного потенциала и разработка научно обоснованного протокола забора, формирования размера и применения соединительнотканных трансплантатов из различных донорских областей в различных клинических ситуациях для достижения оптимального результата лечения.