стромально васкулярная фракция что это
Инъекция стромально-васкулярной фракции (SVF)



Можно ли остановить разрушение сустава на поздней стадии? И как лечить некроз тазобедренного сустава? Еще вчера при подобных диагнозах даже вопросов не задавали! Протезировать сустав и точка! Жизнь после менялась в корне, ведь ни один, даже самый современный протез, не сравнится с родным суставом. А через какое-время протез требует замены.
Вместо протеза в Доктор Ост научились “выращивать заново” разрушенные хрящи, связки и сухожилия, используя стволовые клетки для лечения суставов. Чтобы остановить гибель сустава и вернуть его функцию стало, достаточно всего одного укола! Подарите своему суставу шанс на вторую жизнь!
Записаться на приём
ЧТО ТАКОЕ SVF?
Стромально-васкулярная фракция (SVF) – это клеточный концентрат, изъятый и приготовленный из жировой ткани пациента. В таком концентрате присутствуют стромальные клетки и клетки крови, то есть содержимое сосудов (васкулярная ткань). Полученный с помощью передовых технологий биоматериал представляет огромную ценность. Он позволяет восстановить утраченные ткани, вернуть функцию суставов, связок, сухожилий и избежать протезирования.
Стромальные клетки являются предшественниками стволовых клеток и обладают не меньшей регенеративной способностью. А плазма, богатая факторами роста и тромбоцитами, служит питательной средой для стремительного роста новой ткани из подсаженных стромальных клеток.
По сути это универсальная ремонтная бригада для починки любой аварии в организме. Попадая в зону пораженного сустава, стромально-васкулярная фракция запускает активное восполнение собственных утраченных клеток.
Таким образом, наука лишь направляет, стимулирует и усиливает естественную способность организма к восстановлению. Стало возможным заново вырастить костную ткань при остеонекрозе или хрящевую прослойку сустава при артрозе суставов 3 степени. Даже для лечения разрыва связки или сухожилия теперь можно положиться на силы собственного организма! Все это без химии, синтетических инородных материалов, хирургического вмешательства и протезов.
На что способны стромальные клетки
Артроз III cтепени
Рост хрящевых тканей после SVF
Сустав снова здоров!
Стромальные клетки есть практически во всех тканях. Больше всего их в костном мозге, в крови и в подкожном жире. Такие клетки обладают высоким потенциалом менять свою программу и воспроизводить специализированные клетки любых тканей и органов. Таким образом реализуется механизм регенерации, то есть восполнения, обновления.
Кроме того, стромальные клетки способствуют образованию новых капилляров, что улучшает кровоснабжение тканей кислородом и питательными факторами. В конечном счете, инъекции стромальных клеток укрепляют местный иммунитет, повышая силы организма к сопротивлению хроническим воспалительным процессам и инфекциям.
Помимо этого, стромальные клетки обладают выраженным противовоспалительным и противоболевым эффектом. Такое действие достигается за счет выделения стромальными клетками особых веществ. Это неоценимое свойство стромальных клеток применяется для быстрого немедикаментозного лечения артрита 3 степени.
Уникальные свойства стромальных клеток известны давно, но только сейчас их научились выделять, концентрировать и доставлять непосредственно к пораженным органам. Благодаря технологии SVF стало возможно без операции лечение артроза 3 степени, лечение некроза суставов, лечение разрыва сустава.
Сравнительный анализ PRP и SVF-терапии
Специалисты ЦМРТ более 15 лет специализируются на диагностике и лечении заболеваний суставов. Читайте подробнее на странице Лечение суставов.
Консультация ортопеда по безоперационному лечению суставов
SVF и PRP — современные методы регенеративной терапии, применяемые в лечении заболеваний опорно-двигательного аппарата. Эти техники используют в травматологии и ортопедии, доказывая их высокие показатели эффективности.
Рассказывает специалист ЦМРТ
Дата публикации: 16 Февраля 2021 года
Дата проверки: 30 Ноября 2021 года
Содержание статьи
PRP-терапию проводят при хронических состояниях, повреждении мягких тканей и остеоартрозе. Метод применяют на практике уже более 20 лет. Он основан на использовании собственной плазмы крови пациента (обогащенной тромбоцитами), которую вводят в сустав для восстановления пораженных тканей. Тромбоциты выделяют многочисленные факторы роста, которые играют активную роль в регенеративных процессах.
SVF-терапия — инновационный метод лечения путем введения в пораженный сустав инъекций, содержащих стволовые клетки жировой ткани и плазмы пациента. Предварительно жировую ткань преобразуют в стромально-васкулярную фракцию при помощи специального оборудования. В медицинской практике она считается значимым источником клеточного материала. Стромально-васкулярная фракция обладает большим регенеративным потенциалом.
Согласно клиническим исследованиям, в лечении пациентов с умеренной степенью артроза PRP-терапия оказалась эффективней, чем инъекции гиалуроновой кислоты (по данным The Journal of Arthroscopic and Related Surgery, No 3, 2017). Значительных успехов добиваются и благодаря методу SVF-терапии. Наблюдая за пациентами спустя год после лечения, удалось выявить, что применение регенеративной терапии показало лучшие результаты в сравнении с использованием стероидных препаратов.
Регенеративная терапия позволила расширить возможности лечения болезней суставов. Ранее единственным выходом считалось оперативное вмешательство, а болевой синдром купировали с помощью внутрисуставных гормональных блокад.
Сколько длится курс
Курс PRP включает несколько сеансов, обычно от 2 до 7, их необходимо проводить 2-3 раза в неделю. При артрозе коленного или тазобедренного суставов может понадобиться 2-3 процедуры — по одной инъекции каждые 7-10 дней.
Оптимальное количество сеансов зависит от показаний и индивидуальных особенностей пациента. Эффект от PRP-терапии наступает через 1-2 неделю после лечения.
Исследования AJSM (The American Journal of Sports Medicine) показали, что уже спустя 3 месяца после проведения процедуры 75% пациентов смогли вернуться к спортивной активности. Однако курс PRP необходимо повторять каждые 6-10 месяцев.
Плазмотерапия PRP
Клеточная биотехнология, основанная на инъекционном введении активированной аутоплазмы.
SVF-терапия предполагает введение всего одной инъекции, а ее действие начинает проявляться уже через 1-4 дня. Такой быстрый результат особенно ценен для пациентов, испытывающих сильную боль.
Лечебный эффект продолжается дольше, чем при PRP-терапии, так как сохраняется от 3 до 4 лет. В ряде случаев необходимость в повторении инъекции может возникнуть раньше.
Как показывают исследования, переход от воспаления к стадии регенерации поврежденных клеток ведет к эффективному восстановлению. Среди начальных результатов — уменьшение воспаления, снижение болевого синдрома, улучшение двигательных функций.
SVF-терапия
Введение стволовых клеток, извлеченных из стромально- васкулярной фракции жировой ткани.
Показания к PRP и SVF-терапии
Важно!
Показания к проведению PRP и SVF-терапии по большей части совпадают. Но следует отметить, что инъекции стромально-васкулярной фракции рекомендуют при любой степени развития остеоартроза (в т.ч. при костных разрастаниях на суставные поверхности). SVF считают наиболее эффективным методом лечения при повреждении хрящевой ткани, менисков и внутрисуставных сухожилий в результате травм, а также в случаях, когда невозможно провести оперативное вмешательство, даже при наличии срочной необходимости (например, слишком длительное ожидание квоты на операцию).
После проведения SVF-терапии не остается рубцов и восстановление происходит относительно быстро. Однако в течение первых 3-5 дней после процедуры пациенту необходимо обеспечить максимальный покой и соблюдать ортопедический режим (ортеза, трость).
Максимального результата удается достигнуть при совмещении методов — SVF и PRP. Использование плазмы увеличивает пролиферативную активность (развитие и рост) стволовых клеток жировой ткани. Для закрепления результатов восстановительной терапии, врачи рекомендуют пройти курс ЛФК и физиотерапии.
Стромально-васкулярная фракция
Автор статьи
Для лечения заболеваний опорно-двигательной системы используется SVF-терапия. Она предполагает получение стволовых клеток из жировой ткани пациента с их последующим введением в зону патологического процесса. В Москве SVF-терапия суставов становится всё более популярной благодаря высокой эффективности и безопасности для пациента. Она в основном используется для лечения артроза, либо с целью ускорения репаративных процессов в суставе после травм и операций.
Что это?
SVF-терапия
SVF-терапия суставов предполагает введение стромально-сосудистой фракции жировой ткани в суставную полость. Что это такое и как работает, мы сейчас объясним простым языком.
В жировой ткани содержится огромное количество стволовых клеток. Их там даже больше, чем в красном костном мозге, который продуцирует кровяные тельца. Кроме того, у клеток из жировой ткани меньше коэффициент старения, выше уровень генетической стабильности и пролиферативной активности. Проще говоря, клеток здесь не только больше: они лучше подходят для восстановления суставных хрящей.
Полученные стволовые клетки вводят внутрь сустава. Там они стимулируют регенераторные процессы, усиливают восстановление хряща, обеспечивают нормализацию иммунных процессов и устранение воспаления.
ACP SVF-терапия предполагает дополнительное обогащение стромально-сосудистой фракции аутологичной (собственной) кондиционированной плазмой крови. Такая процедура усиливает эффект от стволовых клеток и обеспечивает более быстрый клинический эффект.
Как получают жировую ткань?
Чтобы выделить стволовые клетки из жировой ткани, её вначале нужно получить из организма пациента. Делают это с помощью одной из двух процедур:
В подавляющем большинстве клиник применяется липосакция. Этот метод более щадящий для пациента.
Существует огромное количество способов липосакции. Все их можно разделить на два типа:
1. С предварительным эмульгированием жира.
2. Без эмульгирования.
Для получения стромально-сосудистой фракции часто делают забор жировых клеток без предварительной обработки ультразвуком или лазером, чтобы не повредить стволовые клетки. Обычно делают «мокрую» липосакцию. Под кожу вводят физраствор. Затем жир отсасывают шприцем, под действием отрицательного давления.
Процедура безболезненна для пациента, потому что проводится под местной анестезией. Анестетик добавляют в физраствор. Чтобы он действовал дольше, а кровопотеря была меньшей, дополнительно в состав лекарственной смеси включают адреналин.
стволовые клетки
Как получают стволовые клетки из жировой ткани?
На следующем этапе проведения процедуры врач получает стромально-васкулярную фракцию. Именно она будет введена в сустав в качестве источника стволовых клеток. Стромально-сосудистая фракция выделяется в первые сутки после забора материала. Длительное хранение возможно, но нежелательно: постепенно число стволовых клеток уменьшается, так как часть из них погибает. Часть регенераторного потенциала теряется, что может повлечь за собой снижение эффективности лечебной процедуры.
По этой причине все этапы лечения обычно проходят за один день. Но если по каким-то причинам введение стромально-сосудистой фракции в больной сустав не может быть выполнено сразу, её консервируют и могут длительно хранить при температуре около 4 градусов.
Обычно стволовые клетки не культивируют. Хотя эта процедура позволяет увеличить их количество, она не является обязательной, потому что в стромально-васкулярной фракции стволовых клеток и без того достаточно много. Кроме того, «свежие» клетки имеют меньше генетических дефектов. Отсутствие необходимости в культивировании снижает стоимость SVF-терапии суставов.
Выделение клеток может проводиться «ручным» или автоматизированным методом. Если это делается вручную, то процедура проходит в основном с помощью ферментирования. Вкратце её можно описать следующим образом:
1. Расслоение жировой ткани на три слоя. Вверх поднимается свободный жир из разрушенных жировых клеток. Внизу находится физраствор, плазма и форменные элементы крови. Средний слой содержит целые адипоциты (жировые клетки).
2. Врач отбирает только средний слой. Верхний и нижний удаляются.
3. Жир промывают фосфатным буфером, добавляют противогрибковые средства и антибиотики для предотвращения инфекционных осложнений после введения в сустав.
4. К жировой ткани добавляют раствор с ферментами. Это протеазы, которые расщепляют белки. Процедура продолжается 2 часа.
5. Центрифугирование жировой ткани. В результате снова получаются три слоя. Вверх поднимается маслянистая жидкость – свободный жир из разрушенных клеток. В средней части остаются жировые клетки и ферменты. Вниз опускается стромально-васкулярная фракция. Именно её врач берет для последующего введения внутрь сустава.
В последние годы во многих клиниках всё чаще используются специальные аппараты для автоматического извлечения субстанции, содержащей стволовые клетки. Выход получается больше, так как используется не ферментация, а другие способы их получения. Современные устройства выделяют чистую стромально-васкулярную фракцию за короткое время, и она сразу же может быть введена в сустав.
Преимущества автоматизированного выделения стромально-васкулярной фракции:
Как SVF вводят в сустав?
курсы SVF-терапии
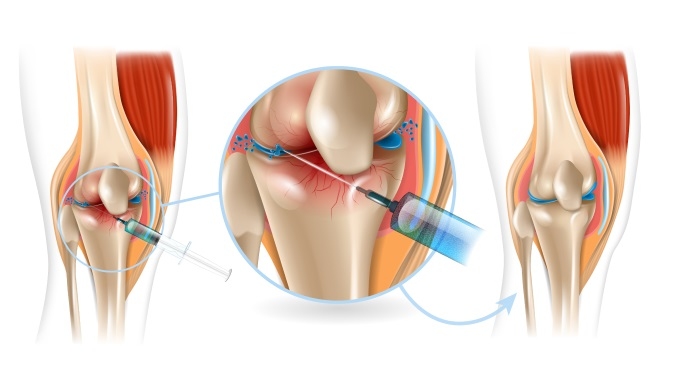
Терапия стромально васкулярной фракцией жировой ткани предполагает её введение внутрь сустава. Врач для этого делает внутрисуставную инъекцию.
Процедура проводится в условиях стерильности. Её делают в чистой перевязочной или малой операционной. Руки хирурга обрабатываются, как перед полноценной операцией.
Врач обрабатывает кожу антисептиком на расстояние 20 см от зоны укола. Он обязательно соблюдает правило сдвига кожи при выполнении инъекции. Врач вкалывает иглу в кожу, затем отодвигает её в сторону, и только после этого продвигает дальше внутрь сустава. Так достигается отсутствие сквозного отверстия, сообщающего суставную полость с внешней средой. После укола кожа восстанавливает положение и закрывает прокол на нижнем уровне.
Делают это по двум причинам:
Врач соблюдает принцип двух пальцев. Он натягивает двумя пальцами кожу перед введением стволовых клеток. Это позволяет уменьшить её толщину. В результате меньшее количество тканей кожного покрова попадает в иглу. Соответственно, меньше клеток кожи проникает внутрь сустава.
Иногда врач использует принцип клещевой фиксации. Он поднимает мягкие ткани в зоне введения лекарственного средства. Это позволяет уменьшить болезненность инъекции.
Процедура умеренно болезненная для пациента. Для её обезболивания используют местные анестетики. Они вводятся постепенно, по мере продвижения иглы внутрь сустава. Особое внимание уделяют обезболиванию кожи и фиброзного слоя суставной капсулы, так как эти участки наиболее интенсивно иннервируются. Соответственно, они самые болезненные.
После введения иглы в сустав врач удаляет шприц с анестетиком. Он меняет его на шприц со стромально-васкулярной фракцией. Её вводят в количестве нескольких миллилитров. После укола врач извлекает иглу и прикладывает к месту прокола стерильную салфетку.
На какие результаты можно рассчитывать?
Чаще всего стромально-васкулярная фракция используется в лечении остеоартроза. При этом заболевании рассчитывать можно на такие результаты:
В результате лечения замедляется прогрессирование дегенеративных процессов в хрящевой ткани, частично восстанавливаются дефекты гиалинового хряща, уменьшается трение суставных поверхностей. Пациент может снизить дозы нестероидных противовоспалительных средств или полностью отказаться от них, что благоприятно скажется на желудочно-кишечном тракте.
Важным преимуществом использования стромально-васкулярной фракции является долговременность полученного эффекта. Результаты достигаются через 1-3 месяца и сохраняются минимум 6 месяцев. При необходимости процедуру можно проводить повторно. Периодические курсы SVF-терапии позволяют держать артроз под контролем и не допускать развития тяжелой стадии, требующей выполнения операции по эндопротезированию сустава.
курсы SVF-терапии
Другие преимущества метода лечения:
Куда обратиться?
Судя по отзывам, цену ACP SVF-терапии многие считают высокой и не делают эту процедуру только по этой причине. Действительно, пожизненный приём НПВП стоит значительно дешевле. Однако обезболивающие препараты не излечивают заболевания суставов и даже не замедляют их развития, не дают долговременного эффекта и вызывают осложнения со стороны желудочно-кишечного тракта.
Цену стромально-васкулярной фракции жировой ткани, которая используется в борьбе с заболеваниями суставов, стоит сравнивать скорее со стоимостью хирургических вмешательств. Ведь зачастую клеточная терапия позволяет не только отсрочить, но даже избежать необходимости в операции, в том числе такой сложной и очень дорогой как эндопротезирование.
Чтобы пройти курс клеточной терапии, обратитесь в Клинику доктора Глазкова. Мы предпочитаем лечить заболевания опорно-двигательного аппарата консервативными методами, и только в случае крайней необходимости прибегаем к операциям. Клиника оснащена современным медицинским оборудованием. Наши специалисты стажировались в лучших клиниках Европы.
Актуальная стоимость SVF-терапии суставов в Москве указана в прайсе. После прохождения процедуры вы получите быстрые заметные результаты. Но главное – они будут долговременными. В результате клеточно-регенеративной терапии уходят хронические боли, улучшается подвижность суставов и замедляется дальнейшее прогрессирование болезни.
Стромально васкулярная фракция что это
В последние годы жировая ткань широко используется как источник мезенхимальных стволовых клеток (МСК), применяемых в регенеративной медицине для терапии таких патологических состояний, как дефекты суставной костной ткани, ожоги, артрозы, аутоиммунные заболевания, инфаркт миокарда и т. п. [1]. Множество исследований подтверждают терапевтический эффект МСК в лечении нейродегенеративных, аутоиммунных и воспалительных заболеваний.
Технология получения МСК из жировой ткани включает выделение стромально-васкулярной фракции (Stromal vascular fraction — SVF, СВФ) — смешанной клеточной популяции, состоящей из стромальных/стволовых клеток, эндотелиальных, гладкомышечных клеток, фибробластов, иммунных клеток и др., отделенных от адипоцитов и стромы различными методами. При этом, несмотря на то что большинство исследований посвящено действию МСК, которые представляют собой не более 20% клеточной популяции СВФ [24], терапевтический потенциал последней во многом остается малоисследованным.
Цель настоящей работы — освещение результатов исследований, опубликованных в современной литературе и посвященных механизмам действия СВФ, а также потенциалу ее использования при местном применении.
Клеточный компонент СВФ
Клеточный компонент СВФ гетерогенен и меняется в зависимости от места липосакции, пола и возраста донора, а также наличия хронических заболеваний (ожирения) [41, 42]. Основной клеточной фракцией, обладающей терапевтическим эффектом, являются МСК, помимо которых СВФ содержит предшественники эндотелиальных клеток, перициты, моноциты/макрофаги, регуляторные Т-лимфоциты, предшественники гемопоэтических клеток. При этом данные литературы о поверхностных маркерах довольно противоречивы. Большое количество исследований посвящено их описанию [5]. В целом считается, что для негемопоэтической (CD45–) популяции клеток СВФ характерна экспрессия маркеров МСК [4]. Однако существуют сложности в идентификации субпопуляций СВФ [5]. Также интересно, что культивирование способно влиять на процентное соотношение клеток СВФ с тенденцией к снижению содержания стромальных и прогениторных клеток (Ramakrishnan, Boyd, 2018).
Механизм действия СВФ
Основной механизм действия основан на сложной связи разнородной клеточной популяции СВФ с клетками реципиента, приводящей к стимуляции дифференцировки клеток, ангиогенезу, иммуномодулирующему, антиапоптотическому эффектам и соответственно восстановлению поврежденных клеток и тканей [6].
Иммуномодулирующее действие СВФ определяется присутствием МСК и популяции иммунных клеток. Механизм их действия в данном случае может быть основан как на хоуминге и дифференцировке в сайт-специфичные дифференцированные клетки, стимулировании тканевых стволовых клеток (СК) реципиента, так и на паракринном эффекте. Причем паракринный эффект МСК может обеспечиваться как прямым взаимодействием с СК реципиента и клетками иммунной системы (контакт клетка—клетка), так и за счет растворимых факторов [14]. МСК продуцируют огромное количество факторов роста и цитокинов, обладающих иммуносупрессивным, антиапоптотическим, антифибротическим и ангиогенным действиями. Они способны ингибировать активацию звездчатых клеток печени (основного источника внеклеточного матрикса) и вызывать их Fas/FasL-опосредованный апоптоз [22]. Однако в то же время данные литературы, посвященной спектру выделяемых цитокинов, неоднозначны. Так, G. Kilroy и соавт. [18] в своей работе показали, что различные экзогенные факторы влияют на секрецию цитокинов, в том числе и провоспалительных (хотя большинство литературных источников указывают на синтез противовоспалительных цитокинов). В частности, МСК, подвергаясь воздействию липополисахаридов, продуцируют гемопоэтические (IL-7, M-CSF, G-CSF, GM-CSF) и провоспалительные цитокины (IL-6, IL-8, IL-11, TNF-α) [22]. Имеются сведения о том, что МСК способны ингибировать В-лимфоциты и снижать продукцию иммуноглобулинов [15]. В зависимости от условий культивирования МСК экспрессируют IDO, COX-2, HGF, IL-10, HLA-G и способны индуцировать регуляторные Т-лимфоциты (Tрег) [16, 17], снижая таким образом иммунный ответ. С другой стороны, данные исследований СК свидетельствуют о том, что искусственная среда, создаваемая при культивировании, не может полноценно имитировать естественную нишу. Результатом действия среды могут быть изменение экспрессии генов и соответственно различия в секретируемых веществах.
Регенеративное действие СВФ, реализуемое мультипотентными стволовыми и прогениторными клетками, в целом сходными с МСК костного мозга по морфологии и иммунофенотипу (но с некоторыми различиями в экспрессии у МСК: CD49d+, CD34+, CD106–), связано с их способностью мигрировать в зоны повреждения [36]. Наличие их дифференцировки в местах повреждения является весьма спорным вопросом, так как результаты многих исследований показывают минимальное число МСК в тканях после трансплантации. Так, в экспериментальном лечении инфаркта миокарда лишь около 1% от изначального числа введенных клеток определялось в сердечной мышце [37]. Другие исследования [38] также показывают эффективную миграцию МСК в таргетные ткани с дальнейшим быстрым снижением их количества в течение 1—2 нед. Соответственно паракринный механизм действия в тканях реципиента может быть более вероятным.
Способность СВФ стимулировать ангиогенез доказана во многих работах, что имеет особое значение в лечении состояний, сопровождающихся ишемией и снижением васкуляризации. Механизм реваскуляризации под действием СВФ весьма интересен.
С одной стороны, интрадермальное введение СВФ при лечении ожогов у крыс линии Вистар вызывало достоверное увеличение экспрессии сосудистого эндотелиального фактора роста (Vascular endothelial growth factor — VEGF) на 3-и и 10-е сутки по сравнению с контролем [2]. Помимо VEGF, такие факторы ангиогенеза, продуцируемые клетками СВФ, как βFGF, HGF, PDGFB, TGF-β, также участвуют в данном процессе и наряду с возможным влиянием контактов клетка—клетка (МСК-клетки реципиента) стимулируют формирование CD31+ сосудистоподобных структур и их стабилизацию [9].
С другой стороны, результаты исследования Y. Koh и соавт. [8] показали, что формирование сосудистой сети под действием СВФ может не только быть следствием прямого стимулирующего действия на уже имеющиеся клетки и соответственно ангиогенеза, но и развиваться за счет так называемой разборки-сборки сосудистой сети. Известно, что жировая ткань содержит огромное количество кровеносных сосудов, разрушение которых происходит при приготовлении СВФ (разборка сосудистой сети). Затем, при введении СВФ в поврежденную область, разъединенные клетки сосудистой стенки способны совместно с уже имеющимися кровеносными сосудами создавать гибридную сосудистую сеть (сборка). Причем доказано, что взаимоотношения клеток в СВФ обеспечивают соответствующий терапевтический потенциал. Так, процесс разборки-сборки сосудистой сети требовал обязательного присутствия матрикса, эндогенных или экзогенных факторов ангиогенеза и макрофагов [8].
Эффекты СВФ также определяются выживаемостью клеток после трансплантации в условиях ишемии (особенно актуально при проведении процедур липофилинга в сочетании с аутотрансплантацией клеток СВФ). Так, Z. Dong и соавт. [7] выявили, что ASCs, полученные из СВФ, способны выживать в условиях гипоксии и мигрировать в периферические зоны неваскуляризованного жирового трансплантата на 14-е сутки после пересадки, в то время как структуры, отличные от CD34+, отсутствовали уже на 4-е сутки. При этом МСК оказывали иммуномодулирующее действие за счет увеличения числа М2-макрофагов и стимулировали ангиогенез в зоне графта.
Макрофаги, получаемые при выделении СВФ из жировой ткани, обладают противовоспалительным фенотипом (М2) и также могут играть роль в снижении воспаления [3]. M. Zeyda и соавт. [20] определили, что макрофаги, выделенные из SVF жировой ткани, экспрессируют маркеры MR, CD163, интегрин αvβ5, CD209, CD200, CD1β и CD1c и являются М2-подобными макрофагами с высоким уровнем секреции IL-10 и антагониста рецептора IL-1. Однако результаты этого исследования показали даже более высокую базальную и индуцированную секрецию провоспалительных цитокинов (TNF-α, IL-6, IL-1, MCP-1 и MIP-1α), чем у М1-макрофагов [20]. Тем не менее известно, что при развитии ожирения фенотип макрофагов переключается с «альтернативно активированных» М2-макрофагов на «классически активированные» М1-макрофаги, продуцирующие провоспалительные цитокины [30], что также может влиять на спектр секретируемых цитокинов.
Наличие фракции Tрег в жировой ткани подтверждается выявлением клеток Foxp3+CD4+ в выделенной СВФ [29]. Tрег-клетки обладают иммуносупрессивным и толерогенным действием и в большом количестве синтезируют IL-10 [31]. Однако эта субпопуляция присутствует в большом количестве у животных (и у человека) с нормальной массой тела, тогда как ожирение вызывает прогрессивное снижение их числа, возможно, за счет ингибирования пролиферации Tрег лептином и TNF-α [31, 32].
Применение СВФ
Большинство исследований посвящено местному применению СВФ. Однако спектр использования СВФ широк: имеются данные как об изолированном применении СВФ, так и о ее сочетанном применении, например с обогащенной тромбоцитами плазмой или совместно с жировыми графтами. Так, у пациентов со шрамами и дефектом мягких тканей лица был показан достоверно лучший результат комбинированного применения СВФ и жирового графта по сравнению с классическим липофилингом дефектов [10]. При инъекционном введении СВФ в подкожную область пальцев пациентов с системной склеродермией наблюдалось снижение боли, отека, ограничения функциональности и симптомов синдрома Рейно без значимых побочных эффектов [11]. Помимо этого, определялась высокая эффективность внутрисуставного введения аутологичной СВФ у пациентов с остеоартритом [12, 13]. Эндобронхиальное введение активированных МСК СВФ выявило, что у 86% пациентов не было значимых побочных эффектов, таких как аллергические реакции, нарушения функции почек и печени, сердца, сатурации кислорода. У 2 пациентов после первой процедуры наблюдались усиление кашля, жжение в области сердца и снижение сатурации до 94—92%, усиление ЧСС. Однако нежелательные явления были устранены простой подачей кислорода без дополнительного лечения, что, по мнению авторов, могло быть следствием процедуры бронхоскопии, а не клеточной терапии [24].
Собственный опыт
На практике описанные выше клинические эффекты могут быть реализованы путем инъекционной аутотрансплантации различных продуктов на основе липоаспирата: милли-, микро-, нанографта и СВФ. Результаты наших клинических исследований [43—46] показывают, что применение более трудоемкого и дорогостоящего ферментативного метода выделения клеток СВФ обосновано в тех ситуациях, при которых применение других продуктов на основе аутологичной жировой ткани было нецелесообразным: в 37 случаях — лечение поздних лучевых повреждений прямой кишки, в 21 случае — лечение пациентов с гонартрозом (интраартикулярные инъекции), в 5 случаях — лечение хронических ран нижних конечностей. Важными отличиями СВФ, полученной ферментативным способом, от других продуктов на основе липоаспирата являются отсутствие в продукте фрагментов жировой ткани и тканевого детрита, а также возможность контролировать концентрацию клеточной взвеси. В связи с этим применение СВФ оправдано при внутрисуставном, подслизистом введении, а также при наличии выраженных изменений реципиентной зоны, не позволяющих применять липографтинг.
Выделение СВФ производилось по общепринятой методике [47] путем инкубации в коллагеназе 2-го типа в течение 30 мин при температуре 37 °C. В дальнейшем осуществлялись фильтрация, инактивация коллагеназы и центрифугирование с целью получения клеточного осадка, который ресуспендировался в 1 мл физиологического раствора. Для подсчета количества клеток и их жизнеспособности забиралась аликвота объемом 0,2 мл, а оставшаяся часть разбавлялась в необходимом для инъекций объеме физиологического раствора. Инъекции СВФ проводили с помощью иглы диаметром 27—31G с общим количеством введенных клеток от 15 до 25 млн на 1 пациента.
В группе пациентов с поздними лучевыми повреждениями прямой кишки инъекции СВФ производились в подслизистый слой диффузно папульно. В верхних отделах прямой кишки введение осуществлялось эндоскопически. При наличии поверхностных эрозий (у 5 пациентов) СВФ применялась как монотерапия, а в случае язв или ректовагинальных свищей (у 32) — в сочетании с введением липографта в глубокие слои ректовагинальной перегородки. У всех 37 пациентов произошло заживление дефектов в срок от 3 до 12 мес.
В группе пациентов с гонартрозами СВФ вводилась интраартикулярно в объеме 5 мл. Однократная инъекция приводила к стойкому снижению степени артроза, что сопровождалось уменьшением болевого синдрома, увеличением объема движений в пораженном суставе и, как следствие, нагрузки на конечность.
В 4 случаях пациентам с хроническими ранами нижних конечностей инъекции СВФ назначались при выраженном дефиците мягких тканей в области дефекта с обнажением сухожилий и/или суставной капсулы, в 1 случае — пациентке с хронической раной левой голени при гранулематозе с полиангиитом. У всех больных были отмечены положительная динамика, формирование грануляционной ткани. У 3 из 5 пациентов было достигнуто полное заживление ран.
Заключение
Таким образом, на основании имеющихся данных литературы и собственного опыта можно заключить, что, несмотря на различие сведений о процентном соотношении клеточных компонентов СВФ и неизученность в полном объеме механизма действия и миграции клеток, СВФ является перспективным методом лечения локальных повреждений мягких тканей, в том числе лучевых поражений. Местное применение СВФ не вызывает существенных побочных эффектов (а имеющиеся связаны, как правило, с процедурой инъекции), относительно безопасно для пациента и может применяться в терапии многих заболеваний, сопровождающихся воспалением и фиброзом, а также дефектами ткани, в том числе глубокими.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.