строма что это в медицине
СТРОМА
Полезное
Смотреть что такое «СТРОМА» в других словарях:
СТРОМА — (от греч. stroma подстилка) в биологии основная опорная структура органов, тканей и клеток животных и растений. Напр., соединительнотканная строма желез, белковая основа эритроцитов и пластид, сплетение гиф у многих сумчатых грибов … Большой Энциклопедический словарь
СТРОМА — (от греч. stroma подстилка), в биологии основная опорная структура органов, тканей и клеток животных и растений. Напр., соединительно тканная строма желез, белковая основа эритроцитов и пластид, сплетение гиф у многих сумчатых грибов … Энциклопедический словарь
строма — структура, основа Словарь русских синонимов. строма сущ., кол во синонимов: 2 • основа (56) • структура … Словарь синонимов
СТРОМА — (от греч. stroma подстилка, ковёр), основа органов животных, состоящая из неоформленной соединит, ткани. В С. располагаются специфич. элементы органов, проходят кровеносные и лимфатич. сосуды, содержатся волокнистые структуры, обусловливающие её… … Биологический энциклопедический словарь
СТРОМА — (stroma) соединительнотканный каркас, основа органа, поддерживающий его функциональную (рабочую) ткань (паренхима (parenchyma)). Например, строма эритроцитов представляет собой пористую основу нитей белка внутри красной клетки крови, внутри… … Толковый словарь по медицине
строма — (гр. stroma подстилка) биол. 1) основа (или остов) органа животного, состоящая из неоформленной соединительной ткани, в которой находятся способные к размножению и развитию клетки, а также волокнистые структуры, обеспечивающие опорную функцию… … Словарь иностранных слов русского языка
строма — (stroma; греч. stroma подстилка) соединительнотканная опорная структура органа или опухоли … Большой медицинский словарь
Строма — (от греч. stroma подстилка) (биологическая), 1) основа (или остов) органа животного организма, состоящая из неоформленной соединительной ткани, в которой расположены специфические элементы органа, имеются способные к размножению клетки, а … Большая советская энциклопедия
Строма — Для улучшения этой статьи желательно?: Дополнить статью (статья слишком короткая либо содержит лишь словарное определение). Добавить иллюстрации. Найти и оформить в виде сносок ссылки на авто … Википедия
Строма
Стро́ма (от греч. στρῶμα — подстилка) — основа (или остов) органа животного организма, состоящая из неоформленной соединительной ткани (интерстиция), в которой расположены специфические элементы органа, имеются способные к размножению клетки, а также волокнистые структуры, обусловливающие её опорное значение. В строме проходят кровеносные и лимфатические сосуды; элементы стромы играют и защитную роль, так как способны к фагоцитозу. Из клеток стромы кроветворных органов развиваются красные и белые кровяные тельца.
Другие значения
Полезное
Смотреть что такое «Строма» в других словарях:
СТРОМА — (от греч. stroma подстилка) в биологии основная опорная структура органов, тканей и клеток животных и растений. Напр., соединительнотканная строма желез, белковая основа эритроцитов и пластид, сплетение гиф у многих сумчатых грибов … Большой Энциклопедический словарь
СТРОМА — (от греч. stroma подстилка), в биологии основная опорная структура органов, тканей и клеток животных и растений. Напр., соединительно тканная строма желез, белковая основа эритроцитов и пластид, сплетение гиф у многих сумчатых грибов … Энциклопедический словарь
строма — структура, основа Словарь русских синонимов. строма сущ., кол во синонимов: 2 • основа (56) • структура … Словарь синонимов
СТРОМА — (от греч. stroma подстилка, ковёр), основа органов животных, состоящая из неоформленной соединит, ткани. В С. располагаются специфич. элементы органов, проходят кровеносные и лимфатич. сосуды, содержатся волокнистые структуры, обусловливающие её… … Биологический энциклопедический словарь
СТРОМА — (от греч. stroma подстилка), понятие, обозначающее поддерживающие или опорные структуры органа. В этом отношении понятие С. как бы противополагается понятию паренхимы (см.). Обычно С. состоит из капсулы, одевающей орган снаружи, и трабекул,… … Большая медицинская энциклопедия
СТРОМА — (stroma) соединительнотканный каркас, основа органа, поддерживающий его функциональную (рабочую) ткань (паренхима (parenchyma)). Например, строма эритроцитов представляет собой пористую основу нитей белка внутри красной клетки крови, внутри… … Толковый словарь по медицине
строма — (гр. stroma подстилка) биол. 1) основа (или остов) органа животного, состоящая из неоформленной соединительной ткани, в которой находятся способные к размножению и развитию клетки, а также волокнистые структуры, обеспечивающие опорную функцию… … Словарь иностранных слов русского языка
строма — (stroma; греч. stroma подстилка) соединительнотканная опорная структура органа или опухоли … Большой медицинский словарь
Строма — (от греч. stroma подстилка) (биологическая), 1) основа (или остов) органа животного организма, состоящая из неоформленной соединительной ткани, в которой расположены специфические элементы органа, имеются способные к размножению клетки, а … Большая советская энциклопедия
Опухоли стромы полового тяжа (гормонально-активные)
К опухолям стромы полового тяжа относятся гранулезо-стромально-клеточные опухоли (гранулезоклеточная опухоль и группа текомфибром) и андробластомы, опухоли, которые происходят из гранулезных клеток, тека-клеток, клеток Сертоли, клеток Лейдига и фибробластов стромы яичников. В отдельных случаях женские и мужские опухолевые компоненты сочетаются (гинандробластомы). Гормонально-зависимые опухоли разделяются на феминизирующие (гранулезоклеточные и текома) и маскулинизирующие (андробластома).
Опухоли стромы полового тяжа составляют около 8% всех овариальных образований.
Феминизирующие опухоли встречаются в любом возрасте: гранулезоклеточная чаще у детей и в молодом возрасте, текома в пре- и постменопаузе и крайне редко у детей. Гранулезоклеточная опухоль (фолликулома) развивается из гранулезной ткани, сходной по строению с зернистым эпителием зреющего фолликула. Текома состоит из клеток, похожих на тека-клетки атретических фолликулов. Гра-нулезоклеточные опухоли составляют 1-2% всех новообразований яичника. Текомы встречаются в 3 раза реже.
Симптомы Опухолей стромы полового тяжа (гормонально-активных):
Диагностика Опухолей стромы полового тяжа (гормонально-активных):
Диагноз устанавливают на основании выраженной клинической картины, данных общего осмотра и гинекологического исследования, тестов функциональной диагностики, уровня гормонов, УЗИ с ЦДК, лапароскопии.
Гормонопродуцируюшая феминизирующая опухоль яичника при двуручном влагсишщно-абдоминалъном исследовании определяется как одностороннее образование диаметром от 4 до 20 см (в среднем 10-12 см), плотной или тугоэластической консистенции (в зависимости от доли фиброзной или текаматозной стромы), подвижное, гладкостейное, безболезненное.
На эхограммах феминизирующие опухоли визуализируются в виде одностороннего образования округлой формы с преимущественно эхопозитивным внутренним строением и эхонегативными включениями, нередко множественными. Диаметр опухоли 10-12 см.
Опухоль может иметь кистозные варианты и в таких случаях напоминает цистаденому яичников. Звукопроводимость опухолей обычная. Сопоставление анамнестических данных, эхографической картины с визуализируемой патологией эндометрия (особенно в постменопаузальном возрасте) помогает установить правильный диагноз.
При ЦДК визуализируются множественные зоны васкуляризации как в самой опухоли, так и по ее периферии. Внутренние структуры образования имеют вид пестрой мозаики с преобладанием венозного кровотока. В режиме спектрального допплера кровоток в опухолях яичника имеет невысокую систолическую скорость и низкую резистентность (ИР ниже 0,4).
Точность диагностики при УЗИ с ЦДК составляет 91,3%, при использовании РКТ и МРТ 84,9 и 89,9%.
Феминизирующие опухоли могут быть доброкачественными (80%) и злокачественными. Злокачественность определяется метастазами и рецидивами. Метастазы возникают преимущественно в серозном покрове органов брюшной полости, на париетальной брюшине и в сальнике. Злокачественной чаще бывает гранулезоклеточная опухоль, крайне редко текома. Отдельные описания злокачественных теком относятся к наблюдениям фибросарком или диффузным гранулезоклеточным опухолям яичника.
Лечение Опухолей стромы полового тяжа (гормонально-активных):
Во время операции делают срочное гистологическое исследование, ревизию брюшной полости, тщательно осматривают другой яичник, при его увеличении показана биопсия.
У девочек при доброкачественной гранулезоклеточной опухоли удаляют только пораженный яичник, у пациенток репродуктивного периода показано удаление придатков матки пораженной стороны. В перименопаузальном возрасте выполняют надвлагалищную ампутацию матки с придатками или экстирпацию матки с придатками (в зависимости от изменений в эндометрии). Небольшие опухоли можно удалить путем хирургической лапароскопии.
При злокачественной опухоли (по результатам срочного гистологического заключения) показана экстирпация матки с придатками с обеих сторон и удаление сальника.
Фиброма яичника нередко сочетается с миомой матки. Не исключаются и фиброма и киста в одном и том же яичнике. При сочетании с другими заболеваниями клиническая картина определяется совокупностью их симптомов.
Фиброма яичника часто обнаруживается случайно во время операции. Рост фибромы медленный, но при дистрофических изменениях опухоль может быстро увеличиваться.
Фиброма яичника не продуцирует стероидные гормоны, но в 10% наблюдений может сопровождаться синдромом Мейгса (асцит в сочетании с гидротораксом и анемией). Развитие этих процессов связывают с выделением отечной жидкости из ткани опухоли и ее попаданием из брюшной в плевральные полости через люки диафрагмы. На разрезе ткань фибром обычно плотная, белая, волокнистая, иногда с зонами отека и кистозной дегенерации, возможно обызвествление, иногда диффузное. Опухоль локализуется в одном яичнике в виде четко очерченного узла.
При увеличении митотической активности опухоль относят к пограничным с низким злокачественным потенциалом.
Фиброму яичника диагностируют на основании клинического течения заболевания и данных двуручного влагалищно-абдоминального исследования. Опухоль приходится дифференцировать с субсерозным миоматозным узлом на ножке, а также с опухолями другого строения. При гинекологическом исследовании сбоку или позади матки определяется объемное образование диаметром 5-15 см, округлой или овоидной формы, плотной, почти каменистой консистенции, с ровной поверхностью, подвижное, безболезненное. Фиброма яичника нередко сопровождается асцитом, поэтому ее иногда принимают за злокачественное новообразование.
Диагностике помогает УЗИ с ЦДК. На эхограммах видно округлое или овальное образование с четкими ровными контурами. Внутреннее строение преимущественно однородное эхопозитивное. средней или пониженной эхогенности. Иногда выявляются эхонегативные включения, указывающие на дегенеративные изменения. Непосредственно за опухолью определяется выраженное звукопоглощение. При ЦДК сосуды в фибромах не визуализируются, опухоль аваскулярна.
Чувствительность и специфичность МРТ и РКТ в диагностике фибромы яичника равноценны УЗИ.
При лапароскопии фиброма яичника округлая или овоидная, со сглаженным рельефом поверхности и скудной васкуляризациеи. Капсула обычно белесоватая, сосуды определяются только в области маточной трубы. Возможен и белесовато-розовый оттенок окраски капсулы. Консистенция опухоли плотная.
Лечение фибромы оперативное. Объем и доступ оперативного вмешательства зависят от величины опухоли, возраста пациентки и сопутствующих гинекологических и экстрагенитальных заболеваний. Как правило, удаляют придатки матки пораженной стороны при отсутствии показаний для удаления матки у пациенток репродуктивного возраста При небольшой опухоли используют лапароскопический доступ.
К каким докторам следует обращаться если у Вас Опухоли стромы полового тяжа (гормонально-активные):
Что такое гиперплазия эндометрия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Анькина А. О., врача УЗИ со стажем в 9 лет.
Определение болезни. Причины заболевания
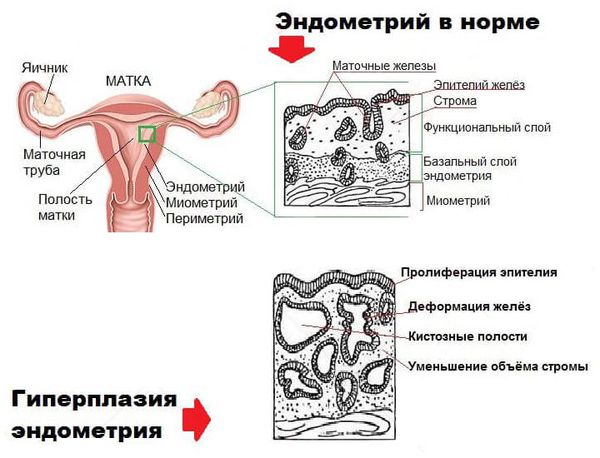
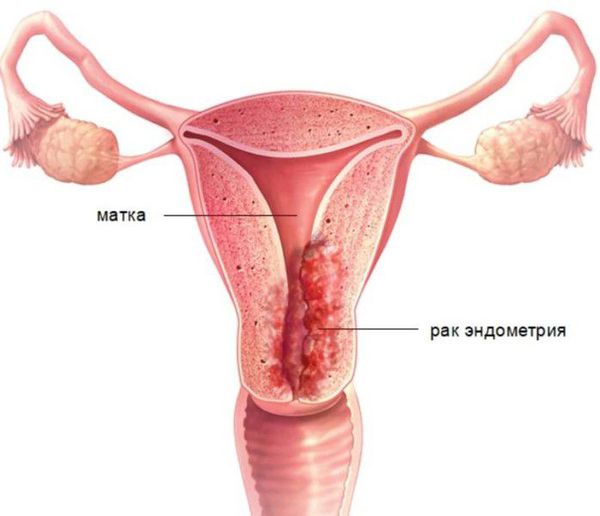
Диагноз « гиперплазия эндометрия » ставится только по заключению гистологического исследования. Без своевременной диагностики и целенаправленного лечения повышается риск развития рака эндометрия.
В составе маточного эндометрия есть специфические рецепторы, которые делают его органом-мишенью для половых гормонов. При гормональном сбое нарушается рост и дифференцировка эндометриальных клеток, что приводит к разрастанию эндометрия.
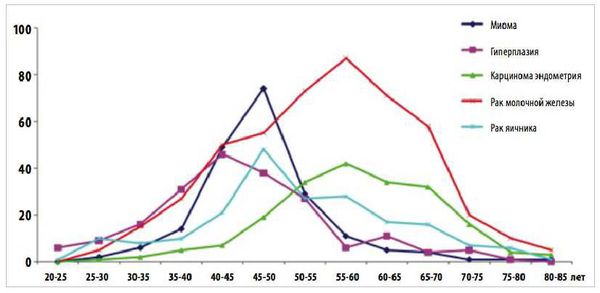
Факторы риска развития гиперплазии эндометрия [1] [8] [11] :
Симптомы гиперплазии эндометрия
В период перехода к менопаузе основным симптомом заболевания являются нерегулярные обильные менструации, сменяющиеся длительными мажущими кровянистыми выделениями.
Женщины менопаузального возраста жалуются на скудные кровянистые выделения из половых путей. Они могут проявляться эпизодически либо быть продолжительными.
Патогенез гиперплазии эндометрия
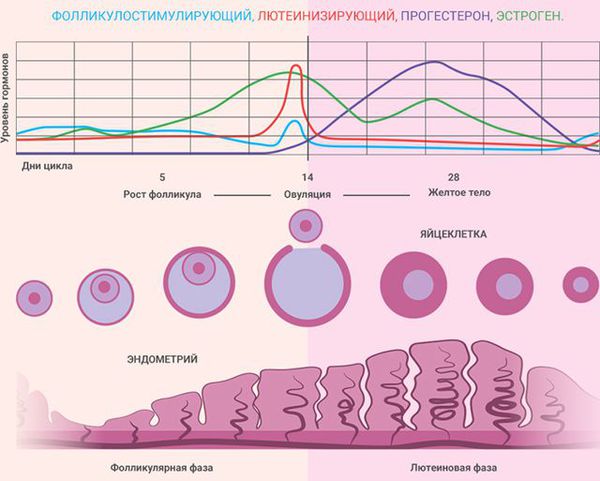
Состояние эндометрия зависит от фазы менструального цикла:
В патогенезе гиперплазии эндометрия выделяют два варианта развития событий:
В случае гиперплазии эндометрия с атипией избыток желёз эндометрия сочетается с клеточными мутациями (атипическим перерождением). Атипическая гиперплазия эндометрия является предраковым состоянием.
Классификация и стадии развития гиперплазии эндометрия
Международная классификация болезней 10-го пересмотра (МКБ-10):
Пересмотренная классификация ВОЗ 2014 года:
Осложнения гиперплазии эндометрия
Анемия. Для гиперплазии эндометрия характерны аномальные маточные кровотечения. В связи с этим женщины часто страдают от хронического малокровия разной степени выраженности.
Бесплодие. Гормональные изменения отражаются на качестве эндометрия, что создаёт риск неудачной имплантации эмбриона. Помимо этого, гиперплазия эндометрия часто выявляется на фоне хронической ановуляции, при которой зачатие невозможно.
Диагностика гиперплазии эндометрия
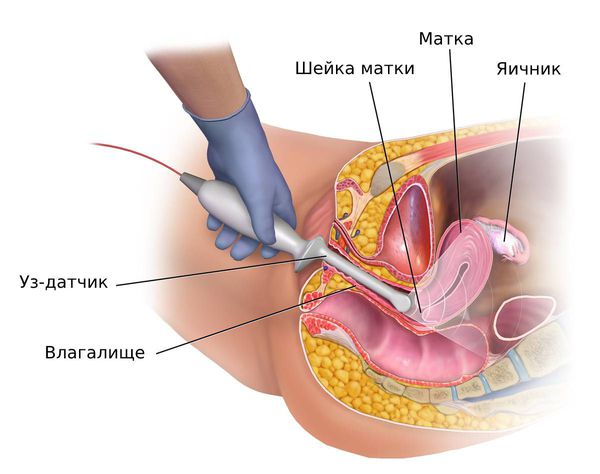
Диагностика основана на анализе данных анамнеза пациентки (истории болезни), клинической картины заболевания (жалоб и физикального осмотра), а также на результатах ультразвукового и гистероскопического исследования с обязательным патоморфологическим анализом соскоба из полости матки.
Диагноз «гиперплазия эндометрия» ставится только на основании гистологического исследования материала, полученного при диагностическом выскабливании слизистой оболочки матки или удалении матки.
Анамнез и клиническая картина
При сборе анамнеза врач-гинеколог задаёт пациентке вопросы:
Физикальный осмотр включает в себя местный осмотр наружных половых органов, исследование влагалища и шейки матки в зеркалах, а также бимануальное (двумя руками) исследование матки и придатков. Осмотр проводится на первичном приёме, чтобы исключить воспалительные заболевания и/или объёмные опухолевые образования.
Инструментальная диагностика
У женщин репродуктивного и пременопаузального возрастов при подозрении на гиперплазию эндометрия ТВУЗИ органов малого таза проводится на 5 – 7-й день менструального цикла. В норме в это время толщина эндометрия не превышает 6 мм. Патологию эндометрия подозревают, когда его толщина не соответствует определённой фазе менструального цикла:
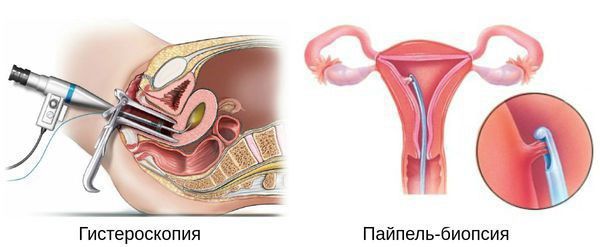
Гистероскопия с раздельным диагностическим выскабливанием (РДВ) матки и цервикального канала — информативный метод в диагностике гиперпластических процессов эндометрия. При помощи гистероскопа (эндоскопического прибора для осмотра полости матки) врач оценивает состояние слизистой оболочки матки и цервикального канала. При необходимости удаляет локальные поражения и обязательно берёт материал для последующего гистологического исследования.
Если выскабливание проводят как лечебную процедуру при обильном маточном кровотечении, врач полностью удаляет слизистую оболочку матки под контролем гистероскопии.
Дифференциальная диагностика гиперплазии эндометрия проводится с полипом эндометрия, субмукозной (подслизистой) миомой матки, эндометритом, прервавшейся беременностью и раком эндометрия.
Лечение гиперплазии эндометрия
Лечение патологии эндометрия основывается на трёх принципах:
Тактика лечения будет зависеть от результата гистологического исследования эндометрия, полученного в ходе выскабливания, от возраста женщины, сопутствующих заболеваний и репродуктивных планов.
Гиперплазия эндометрия без атипии:
Гиперплазия эндометрия с атипией:
Медикаментозное лечение гормональными препаратами проводится пациенткам репродуктивного возраста с неатипической гиперплазией эндометрия при наличии симптомов, факторов риска, отсутствии регресса за 6 месяцев наблюдения и при атипической гиперплазии эндометрия у женщин, планирующих беременность.
Гормональную терапию назначают не менее чем на 6 месяцев:
В качестве негормональной терапии возможно применение препаратов:
Лечение нужно сочетать с низкокалорийной диетой и достаточной физической нагрузкой согласно общему физическому развитию женщины. При необходимости врач назначает препараты, которые нормализуют метаболизм углеводов в организме: подавляют образование глюкозы клетками печени, повышают чувствительность тканей к инсулину, расщепляют сложные сахара.
Хирургическое лечение. Атипическая гиперплазия эндометрия на начальном этапе требует обязательной консультации онкогинеколога, который должен установить, нужна ли операция и в каком объёме.
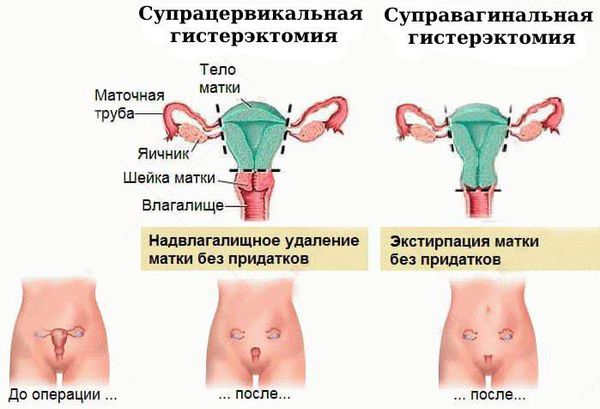
Чаще всего выполняется надвлагалищная ампутация матки — суправагинальная гистерэктомия (удаление тела и шейки матки). Вопрос о сохранении яичников решается строго индивидуально, зависит от возраста пациентки и факторов риска.
Показания к гистерэктомии:
Прогноз. Профилактика
Обследование для исключения гиперплазии или рака эндометрия показано в следующих случаях:
1. Если есть аномальные маточные кровотечения [29] [31] :
2. Если по результатам цитологического исследования соскоба шейки матки отмечается:
Профилактика:
Строма что это в медицине
В функциональном отношении клетки лимфоидной системы могут быть разделены на три типа: стволовые кроветворные клетки, клетки-предшественники первичных лимфоидных органов, клетки вторичных лимфоидных органов. По темпу клеточного обновления лимфоидная ткань занимает одно из первых мест в организме. Развитие лимфоидных клеток не прекращается всю жизнь – это необходимо для “подстройки” иммунитета к постоянно изменяющейся иммунологической ситуации.
Особенность всей лимфоидной системы состоит в том, что в течение всей жизни ее органы объединяют интенсивные клеточные миграции, в ходе которых осуществляется пролиферация и дифференцировка иммунокомпетентных клеток. Эти процессы происходят при условии упорядоченной миграции клеток-предшественников из одних органов кроветворной системы в другие, включая костный мозг, тимус и периферические лимфоидные органы. Стоит отметить, что дифференцировка общих предшественников в разных направлениях (например, в Т- и В-клетки) требует различных несовпадающих местных условий.
Основная функция лимфоузлов состоит в обеспечении взаимодействия антигена, который поступает туда по афферентным лимфатическим сосудам, с иммунокомпетентными клетками. В ходе иммунного ответа в структуре лимфоузла происходит ряд изменений, благодаря которым обеспечивается возможность для наибольшего количества лимфоцитов проконтактировать с антигеном и между собой. Структуры лимфатического узла создают условия для направленного, а не случайного взаимодействия разных субпопуляций лимфоцитов и для развития стимулированных антигеном клонов иммунокомпетентных клеток.
Группой экспертов ВОЗ (Котье и соавт., 1973) предложено выделять в лимфоузле следующие функциональные зоны и структуры:
1. Кортикальный слой с залегающими в нем фолликулами.
2. Паракортикальную зону.
3. Мозговое вещество с мозговыми тяжами.
Фолликулы и мозговые тяжи являются тимуснезависимыми областями (В-зона), паракортикальная зона – тимусзависимой областью (Т-зона). В-зависимые зоны – это зоны лимфоидных фолликулов лимфоузлов, селезенки, аппендикса, миндалин, лимфоидных агрегатов кишечника. Т-зависимые зоны – это паракортикальная зона лимфоузлов, периартериальные зоны селезенки, интерфолликулярные зоны в аппендиксе, миндалинах, пейеровых бляшках.
Структура и клеточный состав лимфоузлов человека исследовались многими авторами. Непаренхиматозный компонент лимфатических узлов представлен стромальными образованиями, выполняющими, в основном, опорную и трофическую функцию – фибробласты, фиброциты, миоциты, эндотелиоциты сосудов, нейральные элементамы. Также непаренхиматозные структуры лимфоидной ткани включают в себя группу ретикулярных клеток и экстрацеллюлярный матрикс, которые играют ключевую роль в формировании лимфоидного микроокружения, отвечающее за развитие лимфоидных клеток. Остальные элементы стромы играют вспомогательную роль.
Термин ретикулярные клетки носит собирательный характер и включает 4 основных морфофункциональных типа: гистиоцитарные, дендритные, интердигитирующие и фибробластические ретикулярные клетки. На светооптическом уровне с использованием рутинных окрасок дифференцировать указанные типы достаточно сложно. Определение принадлежности к определенному варианту требует гистохимических и иммуногистохимических методов анализа.
Гистиоцитарные ретикулярные клетки имеют вид фиксированных макрофагов, почти неотличимых от гистиоцитов и макрофагов костномозгового происхождения, особенно находящихся в лимфатических фолликулах.
Дендритные ретикулярные клетки преобладают в корковом веществе, главным образом в центрах первичных и вторичных лимфатических фолликулов, являясь антиген-представляющей субпопуляцией клеточных элементов лимфатического узла. Эти клетки способны длительное время удерживать антиген на своей поверхности, регулируя образование В-клеток памяти и предшественников антителоформирующих плазмоцитов. Кроме того, дендритные ретикулярные клетки образуют правильную сеть в первичных и вторичных лимфоидных фолликулах. Реализации этих функций способствуют длинные отростки цитоплазмы, которые соединены с такими же отростками соседних дендритных ретикулярных клеток. Они имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются на срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Их отростки также выявляются окрашиванием на CD21 и CD23. Дендритные клетки помимо длинных отростков, которыми они соединяются между собой, имеют отчетливо различимые замыкательные комплексы – десмосомы, отличающие эти клетки от интердигитирующих ретикулярных клеток.
Интердигитирующие ретикулярные клетки в наибольшем количестве присутствуют в паракортикальной зоне, определяя стимуляцию Т-клеточного ответа. Интердигитирующие ретикулярные клетки имеют бледно окрашивающиеся ядра овальной или удлиненной формы, иногда с инвагинациями довольно сложной конфигурации, и широкую цитоплазму. Эти клетки имеют большое сходство с клетками Лангерганса, но не содержат гранул Бирбека. При иммуноцитохимическом исследовании в них определяется белок S-100 и антиген HLA-DR. Интердигитирующие ретикулярные клетки, в отличие от дендритных, соединяются между собой и другими клеточными элементами при помощи пальцевидных отростков цитоплазмы, входящих между такими же структурами других клеток.
Фибробластические ретикулярные клетки характеризуются наличием в цитоплазме волокнистых структур, идущих на формирование ретикулиновых волокон.
Как и в костном мозге, система кровеносных сосудов является важным компонентом лимфатического узла, поскольку из крови в его ткань и обратно осуществляется интенсивная миграция лимфоцитов. Проникшие в узел через его ворота кровеносные сосуды ветвятся в мозговом и корковом слоях. В корковом слое располагаются мелкие венулы, в которые переходят капилляры. Эндотелий посткапиллярных венул построен из высоких клеток, в их цитоплазме часто обнаруживаются лимфоциты. В ходе миграции лимфоциты проходят как между эндотелиальными клетками, так и через их цитоплазму, затем через базальную мембрану и попадают в ткань глубокого кортекса. Эмиграция лимфоцитов из лимфоузлов осуществляется через эфферентные лимфатические сосуды, по которым лимфоциты возвращаются в кровоток. В этих взаимодействиях участвуют селектины, CD44 и интегрины, экспрессированные на лимфоцитах.
Имеется небольшое количество работ по морфологии некоторых клеточных элементов лимфоидного микроокружения при лимфопролиферативных заболеваниях. Так, при исследовании морфологических особенностей дендритных ретикулярных клеток при неходжкинских лимфомах отмечено изменение ультраструктуры ретикулярных клеток. При этом, происходило уменьшение количества лимфоцитов, контактирующих с дендритными ретикулярными клетками, увеличение межклеточных расстояний, перестройки плазматических мембран, изменения ультрацитохимических свойств клеток, в частности, снижение или полное отсутствие реакции на кислую фосфатазу. Отмечено уменьшение количества дендритных ретикулярных клеток в зависимости от гистологического варианта лимфом. Так, лимфомы фолликулярного типа сопровождаются увеличением количества ретикулярных клеток, в то время как при диффузных лимфомах отмечено уменьшение их числа и значительные деструктивные изменения. Данные о вовлечении в патологический процесс дендритных ретикулярных клеток при неходжкинских лимфомах были подтверждены при иммуногистохимических и экспериментальных исследованиях.
Известно, что строма реализует свое воздействие на гемопоэтические клетки, как путем непосредственных межклеточных контактов, так и опосредованно, с помощью гуморальных механизмов. При лимфоидных неоплазиях происходят значительные нарушения в системе межклеточных взаимодействий. Клетки микроокружения являются главным источником цитокинов – пептидов, обеспечивающих регуляцию пролиферации, дифференцировки и апоптоза гемопоэтических клеток. Отмечено, что роль цитокинов в патогенезе лимфопролиферативных заболеваний весьма значительна. К примеру, известно, что пролиферативная активность стромы лимфоузлов у больных неходжкинскими лимфомами не зависит от морфологического варианта заболевания, а связана с продукцией цитокинов, в частности ФНО-α стромальными элементами лимфатических узлов. У пациентов с хроничесским лимфолейкозом повышена секреция стромой лимфатических узлов ИЛ-6 и ИЛ-4 in vitro, что отражает участие данных веществ в патогенезе заболевания. Применение химиотерапии снижает продукцию ИЛ-4 in vivo, что может быть благоприятным фактором, учитывая особенность ИЛ-4 ингибировать апоптоз опухолевых клеток. Также были показаны различия в экспрессии внутриклеточного ИЛ-8 клетками опухолевого клона и нормальными В-лимфоцитами, что имеет клиническое значение.
Стромообразование в опухоли является результатом взаимодействия между опухолевыми клетками и клетками соединительной ткани гистиогенного и гематогенного происхождения. Существует множество установленных и предполагаемых взаимодействий между клетками стромы и паренхимы гемопоэтической и лимфатической систем. Хорошо известно, что клетки стромы костного мозга играют ключевую роль в хоуминге, пролиферации и дифференцировке клеток-предшественниц гемолимфопоэза. Таким же образом, эпителиальные клетки тимуса модулируют пролиферацию и дифференцировку Т-лимфоцитов. Что касается лимфатических узлов, значительные исследования были посвящены дендритным клеткам, которые презентируют антиген и участвуют в инициации Т- зависимых клеточных ответов.
Работы, посвященные изучению дендритных клеток (ДК) при некоторых формах опухолей, показали, что количество и иммунофенотип ДК, их распределение в опухолевой и непораженной ткани отражаются на прогнозе этих новообразований. ДК считаются наиболее важным фактором, определяющим состав лимфоидной популяции и влияющим на регулирование функциональной активности лимфоидных клеток. Они могут создавать не только противоопухолевые, но и проопухолевые стимулы.
Согласно данным Цыплакова Д.Э. и соавт. (1995), исследовавших влияние кровеносного микроциркуляторного русла на клеточный иммунный ответ в лимфатических узлах, регионарных к злокачественным опухолям, сосудистое русло лимфатических узлов играет двоякую роль. С одной стороны, на ранних этапах развития опухоли происходит активация Т-клеточных иммунных реакций с усилением рециркуляции лимфоцитов через посткапиллярные венулы и превращением их путем бласттрансформации в цитотоксические Т-киллеры, что, вероятно, сдерживает процесс метастазирования. С другой стороны, на более поздних стадиях опухолевого роста изменения сосудистой стенки и циркуляторные расстройства сопровождаются отложением внутри- и внесосудистого фибрина, затрудняя тем самым рециркуляцию лимфоцитов и, следовательно, приводят к уменьшению числа трансформированных Т-киллеров, способных уничтожать попадающие в лимфатический узел опухолевые клетки, что, по мнению авторов, предопределяет процесс метастазирования. При появлении в лимфатических узлах метастазов фибрин уже способствует их закреплению в лимфоидной ткани, а также изолирует от цитотоксического действия оставшихся в небольшом количестве Т-эффекторов.
На сегодняшний день накопилось достаточное количество данных, свидетельствующих о роли стромального микроокружения в становлении лимфопролиферативных заболеваний. При этом отсутствует целостное представление о структурных особенностях лимфоидной стромы при нарушениях пролиферации и дифференцировки В-лимфоцитов. Дальнейшее изучение лимфоидного микроокружения, его морфофункциональных особенностей, адгезивных взаимодействий с использованием современных методов структурного анализа может способствовать поискам новых методов лечения гемобластозов и лимфопролиферативных заболеваний.