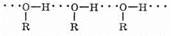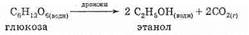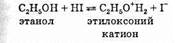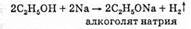спирт алифатический что это
Алифатические (простые спирты)
Спирты. Фенолы. Простые эфиры
Замещение одного или нескольких атомов водорода в молекуле углеводорода на гидроксильную группу приводит к образованию молекулы спирта. Спирты бывают алифатическими, алициклическими и ароматическими, причем в последних ОН-группа не связана непосредственно с ароматическим ядром (например: бензиловый спирт С6Н5СН2ОН).Соединения, в которых гидроксильная группа связана с атомом углерода ароматического кольца, называют фенолами.
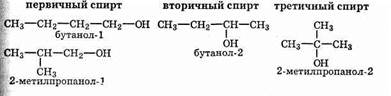
ОН-группа может быть связана с первичным, вторичным или третичным атомом углерода. Соответственно спирты разделяют на первичные (RCH2OH), вторичные (R2CHOH) и третичные (R3COH).
По числу гидроксильных групп спирты разделяются на одноатомные, двухатомные, трехатомные и т.д. Многоатомные спирты называют гликолями.
Алифатические (простые спирты)
Члены гомологического ряда алифатических спиртов имеют общую формулу СnН2n+1ОН.
Структурная изомерия предельных (алифатических) одноатомных спиртов определяется строением углеродной цепи и положением гидроксильной группы в цепи. Например, существуют четыре изомера бутанола С4Н9ОН. Нумерацию цепи начинают с того края, ближе к которому расположена ОН-группа.
Низшие спирты (до С12) при комнатной температуре — жидкости, высшие — твердые вещества. Температуры кипения спиртов намного выше температур кипения алканов с такой же молекулярной массой. Например, t°кип (С2Н5ОН — этанол)=78°С, а t°кип (С3Н8 — пропан)=42°С; t°кип(С7Н15ОН — гептанол-1)=180°С, а t°кип (C8H18 — октан)=126°С. Причиной этого является высокая полярность связи О—Н и легкость образования водородных связей молекулами спирта. Итак, спирты имеют аномально высокие температуры кипения благодаря водородным связям.
При испарении жидкости водородные связи между молекулами разрываются, что требует дополнительной затраты энергии. Следовательно, увеличение молекулярной массы приводит к росту температуры кипения, а разветвленные спирты кипят при более низкой температуре, чем неразветвленные.
Низшие спирты хорошо растворимы в воде, т.к. молекулы спирта легко образуют водородные связи с молекулами воды:
Спирты с большой молекулярной массой и большим размером углеводородного радикала (R) образуют гораздо меньше водородных связей, чем молекулы воды, занимающие тот же объем, что и молекула спирта. Поэтому растворение высших спиртов в воде энергетически невыгодно, и их растворимость невелика.
Образование азеотропных смесей
Этанол образует азеотропную смесь с водой, содержащую 95,6% этанола и кипящую при 78,1°С. Поэтому безводный этанол может быть получен только перегонкой над каким-либо осушителем (например, СаО — оксидом кальция (II)). Многие другие спирты также образуют с водой азеотропную смесь.
при кипении жидкости состава А пар имеет тот же состав, что и эта жидкость. Это означает, что и состав, и, следовательно, температура кипения (Ткип) не изменяются в течение процесса. Такую смесь называют азеотропом, или нераздельно кипящей смесью. Азеотропы — не соединения, т.к. их составы зависят от давления.
Спирты как растворители
Спирты — хорошие растворители. Они растворяют как полярные, так и неполярные вещества. Наличие в молекуле полярной ОН-группы позволяет им растворять такие полярные вещества, как гидроксиды калия и натрия. Неполярный алкильный радикал обеспечивает растворимость в спиртах таких малополярных соединений, как углеводороды.
Алифатические спирты легче воды, а ароматические — чуть тяжелее.
Этанол — подвижная жидкость с низкой вязкостью. Многоатомные спирты из-за большого числа водородных связей имеют высокую вязкость.
Промышленные источники спиртов
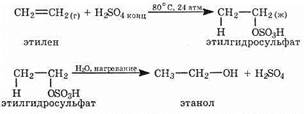
1. Гидратация алкенов. Каталитическая гидратация алкенов протекает по механизму электрофильного присоединения по правилу Марковникова (см. §2.4). Например, получение этанола:
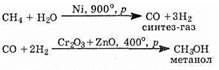
2. Природный газ как источник метанола. Метанол можно получить из природного газа. Смесь метана с водяным паром пропускают над катализатором:
3. Ферментативный синтез этанола. Этанол получают при брожении Сахаров, вызываемом ферментами:
Дрожжи — это живые одноклеточные организмы, содержащие фермент зимазу, который катализирует реакцию.
Лабораторные синтезы спиртов
. Гидролиз галогеналканов. Галогеналканы гидролизуются под действием водных растворов щелочей. Реакция протекает по механизму нуклеофильного замещения:
2. Синтез спиртов из сложных эфиров. При кипячении сложного эфира с разбавленной кислотой или щелочью образуются карбоновая кислота или ее соль и спирт:
Восстановление альдегидов, кетонов и карбоновых кислот. Спирты образуются также при восстановлении альдегидов и кетонов (см. §6), карбоновых кислот и их производных — сложных эфиров и хлорангидридов (см. §7).
Ниже указаны промышленные и лабораторные способы синтеза спиртов.
Химические свойства спиртов
Подобно воде, спирты проявляют амфотерные свойства. Большинство химических реакций спиртов протекают с разрывом связи RO—Н, например, реакции с натрием или карбоновыми
кислотами обусловлены разрывом связи R—ОН.
Первой стадией таких реакций обычно является протонирование атома кислорода. После этого связь R—О + Н2 разрывается гораздо легче. Например, реакция этанола с иодоводородной кислотой начинается с переноса протона:
Затем алкилоксоний-катион теряет молекулу воды, превращаясь в галогеналкан:
Основные свойства наиболее сильны у третичных спиртов и падают в ряду: третичные > вторичные > первичные спирты
Кислотные же свойства спиртов уменьшаются в ряду: первичные > вторичные > третичные спирты
Рассмотрим реакции спиртов на примере этанола.
Реакции с разрывом связи RO—H. Кислотные свойства спиртов
1. Спирты реагируют с щелочными и щелочноземельными металлами, при этом образуется алкоксид металла и водород. Например, реакция этанола с натрием идет значительно медленнее, чем реакция натрия с водой:
Итак, кислотные свойства спиртов выражены очень слабо. С увеличением длины углеводородного радикала скорость этой реакции замедляется.
В присутствии воды образующиеся алкоголяты разлагаются до исходных спиртов:
C2H6ONa+Н2О®С2Н6ОН+NaOH Это доказывает, что спирты — более слабые кислоты, чем вода.
2. Спирты реагируют с карбоновыми кислотами, образуя при этом сложные эфиры. Эта реакция называется реакцией зтерификации (см. §7).
Спирты и фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация спиртов
По числу гидроксильных групп:
Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
Классификация по строению углеводородного радикала
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
Строение спиртов и фенолов
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5 о С). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
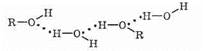
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Номенклатура спиртов
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
Например, пропандиол-1,2 (пропиленгликоль):
Изомерия спиртов
Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Ф ормуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
| Бутанол-1 | 2-Метилпропанол-1 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.