спинраза что это за препарат
Применение Нусинерсен (Спинраза) у взрослых пациентов со СМА
Главная » Лекарства и исследования » Применение Нусинерсен (Спинраза) у взрослых пациентов со СМА
В марте 2020 года в научном журнале The Lancet Neurology была опубликована статья «Применение Нусинерсена для лечения взрослых с проксимальной (5q) спинальной мышечной атрофией: наблюдательное, многоцентровое исследование» (авторский коллектив Hagenacker T, et al). В статье представлены результаты независимого исследования реальной практики применения препарата Нусинерсен (торговое наименование – Спинраза) у подростков и взрослых со СМА в 10 клинических центрах Германии.
Описанные результаты наблюдения за эффективностью и безопасностью применения Спинраза показали значительные клинически значимые улучшения моторной функции у взрослых больных СМА, получавших лечение. Эта публикация вносит значительный вклад в понимание значимости терапии у взрослых пациентов, данные о применении терапии у которых ранее были крайне ограничены. На сегодняшний момент – эта публикация содержит результаты наблюдения за самой большой на сегодня когортой взрослых больных со СМА, получавших лечение и вносит значительный вклад в свидетельства, поддерживающие применение терапии Спинраза для взрослых пациентов.
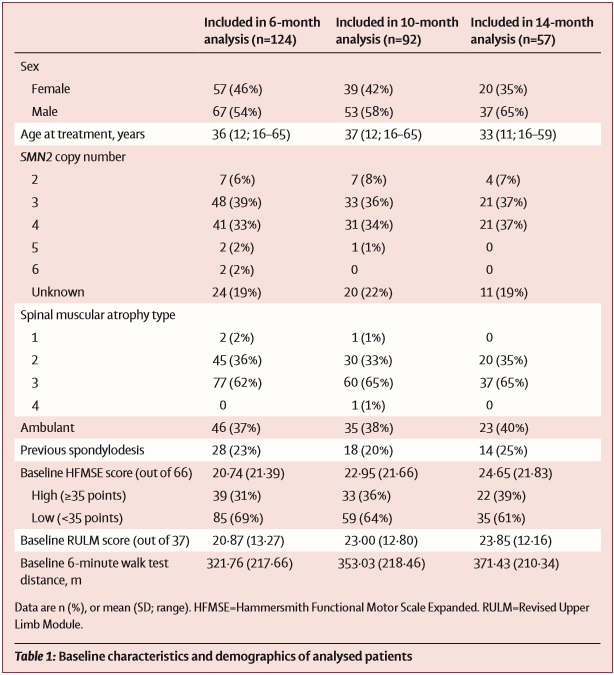
Исследование содержит данные от 124 взрослых больных СМА (в основном, 2 и 3 типов), получавших лечение в 10 нервно-мышечных центрах Германии и основано на оценке двигательных функций с помощью нескольких шкал: Хаммерсмит (HFMSE), RULM и 6-минутного теста ходьбы (6MWT).
Учитывая факт медленного функционального ухудшения состояния у взрослых пациентов со СМА при естественном течение заболевания (без лечения), полученные данные позволяют говорить о том, что лечение взрослых больных со СМА с помощью нусинерсен позволяет достичь значимых клинически улучшений двигательной функции или стабилизации состояния взрослых больных СМА. При этом, не выявлено зависимости и взаимосвязи возраста пациентов и эффективности терапии.
Описание исследования
Несмотря на одобрение применения нусинерсена (Спинраза) для всех групп пациентов, независимо от возраста и типа заболевания большинством регуляторов, однако, данные по эффективности и безопасности применения препарата у взрослых больных со СМА оставались фрагментарными. Единственное ранее опубликованное исследование описывает применение Спинраза у 19 взрослых пациентов со СМА 3 типа и описывает значительное улучшение моторной функции после 300 дней применения нусинерсен.
Исследовательский коллектив поставил целью выяснить безопасность и эффективность применения Спинраза у широкой и разнородной группы взрослых пациентов со СМА. Для этого в наблюдательное исследование были включены 10 нервно-мышечных центров Германии, в которых проходили лечение пациенты от 16 до 65 лет с генетически подтвержденным диагнозом СМА в период с 13 июля 2017 года до 1 мая 2019 года. Все взрослые пациенты, которые получали лечение в этих 10 центрах были включены в исследование. Для оценки результата лечения влючались только пациенты, получавшие лечение в течение, как минимум, 6 месяцев с продолжением наблюдения вплоть до 14 месяцев на терапии.
173 пациента были скринированы для участия в исследовании, из которых 139 (80%) подошли для анализа данных. Из них, 124 пациента (89%) были включены в срез данных 6 месячного интервала получения терапии, 92 пациента (66%) – 10-месячного, и 57 (41%) в 14-месячный анализ. Из анализа были исключены пациенты, для которых отсутствовали данные оценок по шкалам при начале терапии, а также в связи с отказом пациентов от участия (2 человека) и в связи с возникшими побочными реакциями на фоне приема препарата (отказ от продолжения лечения – 2 человека).
Основные результаты:
Основным инструментом оценки была шкала Хаммерсмит (HFMSE), которая состоит из 33 пунктов оценки моторной функции для оценки повседневной активности. По каждому пункту может быть выставлено от 0 до 2 баллов, таким образом, максимальный балл по данной шкале – 66. Уровень в 3 балла по данной шкале считается клинически значимым.
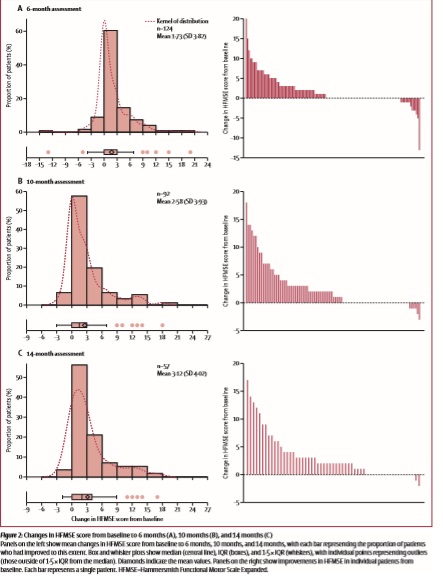
Средние оценки по шкале Хаммерсмит (HFMSE) значительно повысились по сравнению с оценками перед началом терапии, средняя разница в 6-месячный анализ данных составила 1.73 балла, в 10-месячный – 2.58 балла, в 14-месячный – 3.2 балла.
Клинически значимые улучшения моторной функции (по данной шкале служит отметка в более чем 3 балла) наблюдались у 35 (28%) из 124 пациентов через 6 мес после начала лечения, у 33 (35%) из 92 пациентов через 10 мес после начала лечения, и у 23 (40%) из 57 пациентов через 14 мес после начала лечения.
За исключением 2 пациентов, все пациенты, у который отмечались улучшения более чем в 3 балла по HFMSE к 10 мес с начала лечения – сохранили набранные баллы и к 14-месяцам и далее. У 5 пациентов было установлено улучшение в более чем 10 баллов (3 ходящих и 2 неходячих пациентов со СМА 3 типа с 3 или 4 копиями SMN2, возраст пациентов от 48 до 59 лет). 14 пациентов не смогли показать улучшений на терапии, продолжая ухудшаться. При этом, при анализе не было установлено никакой зависимости от улучшений оценки по HFMSE и возрастом пациентов.
Дополнительно оценивалась функция верхних конечностей по шкале RULM, которая включает 20 разделов, максимально возможное количество баллов по этой шкале – 37, при этом уровень в 2 балла по данной шкале считается клинически значимым.
Функция рук также значительно улучшалась по сравнению с состоянием до начала терапии. Так, у 28 (23%) из 120 пациентов через 6 мес после начала лечения отмечено улучшение функции по шкале RULM как минимум на 2 балла (т.е. клинически значимо), в то время как у 74 (61%) пациентов не отмечено улучшений, у 18 (15%) пациентов отмечалось ухудшение на 1 балл или более, а у 10 (8%) пациентов ухудшение составило 2 балла или более. 28 (23%) пациентов сохранили полную функциональность (37 из 37 возможных баллов на протяжении 6 мес после начала лечения. 21 (75%) пациент из 28 сохранили полную функциональность к 14-месячной отметке после начала терапии. При этом, при анализе не было установлено никакой зависимости от улучшений оценки по RULM и возрастом пациентов.
Также производилась оценка (у ходящих пациентов) по 6-минутному тесту ходьбы (измерение дистанции, которую пациент может преодолеть за 6 минут). Значительные улучшения были установлены у пациентов при анализе после 6-ти, 10-ти и 14-ти мес после начала терапии.
Помимо общего анализа был также проведен дополнительный анализ в разных субгруппах пациентов.
Так, при сравнении групп взрослых пациентов со СМА 2 и СМА 3 типов:
— клинически значимые улучшение по шкале HMFSE (более 3 баллов) были установлены:
у 23 (30%) пациентов из 77 после 6 мес. после начала лечения; 18 (32%) из 60 пациентов после 10 мес.; 15 (41%) из 37 пациентов после 14 мес. лечения в группе больных со СМА3 типа.
У 1 (2%) из 45 пациентов после 6 мес. после начала лечения; 2 (7%) из 30 пациентов после 10 мес.; 1 (5%) из 20 пациентов после 14 мес. лечения в группе больных со СМА2 типа.
— клинически значимые улучшения функции рук по шкале RULM были отмечены на всех трех анализируемых интервалах у пациентов со СМА2 типа, а у пациентов со СМА3 типа только после 14-мес периода наблюдения.
При сравнении групп взрослых пациентов из подгруппы неамбулаторных (неходячих) и амбулаторных (ходячих) улучшения были отмечены во всех временных интервалах у обоих групп, при этом более значительные изменения уровня моторной функции наблюдались в группе ходячих по сравнению с неходячими пациентами.
При сравнении между группами пациентов имеющих перед началом терапии высокий балл по HMFSE (более 35) и низкий балл (ниже 35) было отмечено, что улучшения у пациентов с более высокими изначально баллами были значительнее.
При сравнении групп пациентов с неоперированным позвоночником (96 пациентов) и пациентов с металлоконструкцией в позвоночнике(28 пациентов) – не было отмечено значительного различия в улучшениях баллов по HMFSE. Но при этом отмечается, что эффект от лечения нусинерсен у пациентов с металлоконструкцией был несколько ниже, что, вероятно, связано с предшествующей тяжестью состояния и выражается в более низких баллах HMFSE у таких пациентов до начала терапии.
Безопасность
За 14-месячный период наблюдения не было отмечено каких-либо новых, не выявленных ранее побочных эффектов. При этом, у 82 (47%) пациентов отмечались какие-либо побочные реакции. Наиболее частые побочные реакции на лечение: головные боли у 61 (35%) пациентов, боли в спине 38 (22%) пациентов и тошноту у 19 (11%) пациентов, другие встречались более редко.
Выводы исследования:
Данные, полученные в результате этого исследования показывают значительное улучшение двигательной функции у взрослых пациентов со СМА после начала терапии через 6,10 и 14 мес. После начала терапии. Наибольшее улучшение моторной функции коррелирует с меньшей тяжестью состояния пациента до начала терапии.
В целом, пропорция пациетов со значимым улучшением по шкале HMFSE в группе взрослых пациентов со СМА 3 типа, чем в группе СМА2, но не было установлено никакой корреляции между возрастом пациента и уровнем улучшения моторной функции (т.е. не зависит от времени, прошедшего с момента начала заболевания). А также данные указывают, что более высокий результат показывают пациенты с более чем 35 баллами по HMFSE до начала терапии.
Данные естественного течения заболевания свидетельствуют о том, что взрослые со СМА в среднем ежегодно теряют 0,5-1 балл HMFSE. Конечно, с учетом индивидуальных особенностей пациентов, фазы клинических ухудшений сменяются периодами стабилизации, поэтому эта оценка потери функции – усредненная. Тем не менее, учитывая эти факты, результаты полученные в данном исследовании, подтверждают значительный эффект от терапии нусинерсен у взрослых пациентов.
В части безопасности, не было выявлено никаких не описанных ранее осложнений. Примерно у пятой части пациентов возникали боль в спине и пост-пункционные головные боли, это количество совпадает с общим процентом осложнений при проведении люмбальной пункции (8-25%) в целом.
В исследовании не оценивалось влияние терапии на функцию глотания и дыхания, это потребует дополнительных исследований в будущем. Также дополнительных исследований потребует получение данных наблюдения за долгосрочной эффективностью применением нусинерсен, а также индивидуальых схем применения нусинерсен с учетом режима дозирования и перерывов в лечении.
Данный материал носит исключительно информационный характер и не может служить рекламой препарата. Рекомендации относительно индивидуального применения лекарственного препарата следует получать у вашего лечащего врача.
Источник: The Lancet
Что изменилось в лечении пациентов со СМА в последние годы
Время чтения: 8 мин.
В сентябре прошла очередная ежегодная конференция по СМА, организованная благотворительным фондом «Семьи СМА». В этом году повестка конференции существенно отличалась от предыдущей: специалисты рассказывали о новых лекарствах для пациентов со спинальной мышечной атрофией, о том, как они работают и как их можно получить в России. О ключевых посланиях конференции — рассказываем в нашей статье.
Сухие цифры медицинской революции
Впервые болезнь спинально-мышечной атрофии (СМА) описали в конце XIX века, но первая классификация типов заболевания появилась только в 1991 году.
Причину болезни удалось понять 4 годами позже: в 1995-м открыт ген SMN, ответственный за развитие СМА.
Сегодня первому препарату 4 года. Это Спинраза (Нусинерсен), — и это уже не единственный вариант терапии. Сегодня в мире для лечения СМА одобрено три лекарственных препарата, в дополнение к уже упомянутой Спинразе — рисдиплам (Эврисди) и генная терапия онасемноген абепарвовек (Золгенсма).
А как у нас?
В России Спинраза была зарегистрирована и применяется с 2019 года. Врачи уже видят, как она работает . Раньше специалисты как дважды два четыре знали, что дети со СМА первого типа никогда не будут сидеть и тем более ходить. Сегодня это уже не аксиома.
Ольга Германенко, директор благотворительного фонда «Семьи СМА» / f-sma.ru
« В России, как и во всем мире, изменения происходят на глазах, — говорит Ольга Германенко, директор благотворительного фонда «Семьи СМА», член Экспертного совета по редким (орфанным) заболеваниям при Комитете по охране здоровья ГД РФ, член Ассамблеи Европейской Ассоциации «СМА Европа». — Мы очень быстро уходим от позиции «ничего сделать нельзя, положите и не трогайте» к возможностям замедлить течение болезни, а в ряде случаев и получить улучшение состояние здоровья при СМА ».
Наша страна вошла в число государств, где лечат спинально-мышечную атрофию и проводят клинические исследования в этой области. Работа со СМА становится все более «модным направлением».
Чем хороши клинические рекомендации-2020
КР — это подробный ответ на вопрос, как выявить и лечить СМА в России.
В варианте-2020 детально описаны основные симптомы СМА каждого типа (кроме СМА4), виды диагностики, жалобы и симптомы, на которые врач (подстрочно: и родитель) обязан обратить внимание; расписаны виды реабилитации для лежачих, сидячих и ходячих пациентов, дан список необходимых технических средств реабилитации (ТСР) и др.
Но главное: в качестве патогенетического лечения рекомендован конкретный препарат — Нусинерсен (Спинраза). Впервые в российской практике. Это значит, что получить лекарство сегодня легче, чем год назад. Аргумент регионального Минздрава «вы назначили слишком дорогой препарат, отзовите назначение!» больше не сработает.
— Невозможно справляться со СМА только с помощью лекарств, — говорит один из крупнейших экспертов по СМА в Европе Лоран Серве, д.м.с., детский невролог и глава Отдела клинических испытаний и баз данных в Институте миологии при парижском госпитале La Pitie Salpetriere, координатор Института I-Motion, координатор нервно-мышечного центра в Льеже (Бельгия).
СМА — это не только слабость мышц. Сколиоз, периодические эпизоды пневмонии, трудности со сном и приемом пищи часто сопровождают эту болезнь. Нельзя просто принимать Спинразу и на этом успокоиться. Человеку со СМА помимо невролога, педиатра/терапевта и генетика нужен консилиум специалистов. В клинических рекомендациях-2020 он включает:
При этом врач-невролог осуществляет основное наблюдение за пациентом.
Привлечь этих и других специалистов — законное право родителей пациента. В том числе с помощью телемедицины, то есть — удаленно.
Спинраза
Показания к применению
Лечение спинальной мышечной атрофии (СМА).
Возможные аналоги (заменители)
Действующее вещество, группа
Лекарственная форма
Раствор для интратекального введения
Противопоказания
Гиперчувствительность к действующему или любому из вспомогательных веществ.
Как применять: дозировка и курс лечения
Лечение должно проводиться медицинскими работниками, обладающими опытом выполнения люмбальных пункций.
Препарат предназначен для интратекального введения посредством люмбальной пункции.
Рекомендованная доза составляет 12 мг (5 мл). Следует начинать терапию препаратом как можно раньше после постановки диагноза.
Режим введения препарата:
— в первый день лечения (день 0)
— в 14, 28, 63 день лечения
В случае задержки или пропуска введения дозы препарат следует ввести как можно ранее, при этом интервал между дозами должен быть не менее 14 дней; далее следует продолжить введения с назначенной частотой.
— Далее дозу следует вводить 1 раз в 4 месяца.
В случае задержки или пропуска введения дозы препарат следует ввести как можно ранее, и далее продолжить введения с назначенной частотой.
Препарат должен применяться постоянно и длительно. Необходимость в продолжении терапии должна оцениваться лечащим врачом на основании клинического состояния пациента.
Фармакологическое действие
Препарат для лечения заболеваний костно-мышечной системы.
Антисмысловой олигонуклеотид (АСО), структура которого специально разработана для лечения спинальной мышечной атрофии (СМА), представляющей собой прогрессирующее нервно-мышечное заболевание с аутосомно-рецессивным типом наследования, причиной развития которого являются мутации в длинном плече хромосомы 5 (5q).
Побочные действия
Нарушения со стороны нервной системы
Нарушения со стороны желудочно-кишечного тракта
Нарушения со стороны скелетно-мышечной и соединительной ткани
Особые указания
Меры предосторожности при применении
Процедура люмбальной пункции
Процедура люмбальной пункции сопровождается риском возникновения нежелательных реакций, таких как, головная боль, боль в спине, рвота. Потенциальные сложности могут возникнуть при введении препарата пациентам в ранней возрастной группе и пациентам со сколиозом. По решению врача может быть использованы ультразвуковой или иные визуализационные техники для облегчения интратекального введения препарата.
Тромбоцитопения и нарушения свертываемости крови
Тромбоцитопения и случаи нарушения свертываемости крови, включая острую тяжёлую тромбоцитопению, наблюдались после подкожного или внутривенного введения других АСО. При наличии клинических показаний, рекомендовано выполнять лабораторные тесты для определения количества тромбоцитов и показателей свертываемости крови перед введением препарата.
Нефротоксичность наблюдалась после подкожного или внутривенного введения других АСО. При наличии клинических показаний, рекомендовано выполнять количественное определение белка в моче (предпочтительно в первой утренней порции мочи). В случае стабильного повышения содержания белка в моче рекомендуется дальнейшее обследование.
Сообщалось о гидроцефалии, не связанной с менингитом и кровотечением, у пациентов, получающих нусинерсен. Некоторым пациентам был имплантирован вентрикулоперитонеальный шунт. Следует провести оценку развития гидроцефалии у пациентов со сниженным сознанием. Преимущества и риски лечения нусинерсеном пациентов с вентрикулоперитонеальным шунтом в настоящее время неизвестны, и необходимо тщательно оценить необходимость в продолжении лечения.
Применение при беременности и лактации
Беременность: возможно только после оценки соотношения пользы и риска лечения у женщин детородного возраста или женщин во время беременности.
Российские больницы закупили одно из самых дорогих лекарств в мире на 17 млрд рублей
Российские медицинские организации в рамках госзакупок заключили в 2021 году 171 контракт на поставки препарата «Спинраза» для лечения спинальной мышечной атрофии (СМА). Общая сумма контрактов составила 17 млрд рублей. Об этом сообщило РИА «Новости» со ссылкой на пресс-службу электронной торговой площадки «РТС-Тендер». Ранее в РФ зарегистрировали другой препарат для лечения СМА — «Золнгесма». Он самый дорогой в мире.
«По аналитическим данным площадки «РТС-Тендер», взятым из открытых источников, по госзакупкам «Спинразы» за 2021 год был заключён 171 контракт на сумму 17 млрд рублей. Экономия по заключённым контрактам составила порядка 1 млрд рублей, или 5% от начальной цены», — подсчитали в компании.
Самым крупным заказчиком препарата стал Федеральный центр планирования и организации лекарственного обеспечения граждан Минздрава РФ. Он заключил 53 контракта на сумму 13,3 млрд рублей. Центр — заказчик закупок на поставку препаратов для Фонда поддержки детей с редкими тяжёлыми заболеваниями «Круг добра».
Также в число крупных заказчиков вошли:
Спинальная мышечная атрофия (СМА) — генетическое заболевание, при котором поражаются двигательные нейроны спинного мозга, что приводит к атрофии мышц.
Стоимость одной инъекции «Спинразы» — почти 7,9 млн рублей. В год пациенту нужно сделать шесть инъекций. Это около 48 млн рублей на пациента. «Спинразу» зарегистрировали в России в августе 2019 года. В конце 2020 года одобрение также получил первый пероральный препарат для лечения СМА — «Эврисди».
Исследование: дети, получившие «Спинразу» до первых симптомов СМА, не нуждаются в ИВЛ
Согласно результатам исследования, благодаря лечению пациенты продолжают сохранять и набирать новые двигательные навыки. 96% детей сейчас могут самостоятельно ходить с поддержкой. Помимо этого, все пациенты, которые сами начали передвигаться, сохраняют этот навык. Также в компании отметили, что лечение хорошо переносится детьми и ни один ребенок не вышел из исследования из-за побочных реакций на препарат.
«Пресимптоматическое лечение препаратом “Спинраза” способно сделать из детей даже с тяжелыми типами СМА практически здоровых! Именно поэтому скрининг новорожденных на СМА и срочная организация лечения — то, что должно стать реальностью в будущем!» — написала на странице в фейсбуке глава фонда «Семьи СМА» Ольга Германенко о данных исследования.
Новые данные по эффективности #нусинерсен (#спинраза) у пресимптоматических пациентов со #СМАПредставленный анализ…
Исследование компании «Биоген» длится больше четырех с половиной лет. В нем приняли участие 25 детей с генетически подтвержденным диагнозом СМА, которые получили первую дозу препарата «Спинраза» в возрасте до шести недель.
Спинальная мышечная атрофия — это неизлечимое заболевание, при котором у человека поврежден или вовсе отсутствует ген, отвечающий за работу двигательных нейронов. Болезнь приводит к поражению нервной системы и постепенной атрофии мышц. В результате у человека сильно искривляется позвоночник, ему становится трудно дышать, он не может двигаться, при этом его интеллект полностью сохранен.
«Спинраза» — единственный зарегистрированный в России препарат, который помогает детям со СМА. Сейчас обеспечивать нуждающихся этим препаратом должны региональные власти, но из-за его высокой стоимости сделать это могут не все субъекты.
Руководители пациентских организаций и благотворительных фондов объяснили «Таким делам», почему необходимо перевести лекарственное обеспечение пациентов со СМА на федеральный уровень.
Новости
На Ваш почтовый ящик отправлено сообщение, содержащее ссылку для подтверждения правильности адреса. Пожалуйста, перейдите по ссылке для завершения подписки.
Если письмо не пришло в течение 15 минут, проверьте папку «Спам». Если письмо вдруг попало в эту папку, откройте письмо, нажмите кнопку «Не спам» и перейдите по ссылке подтверждения. Если же письма нет и в папке «Спам», попробуйте подписаться ещё раз. Возможно, вы ошиблись при вводе адреса.
Исключительные права на фото- и иные материалы принадлежат авторам. Любое размещение материалов на сторонних ресурсах необходимо согласовывать с правообладателями.
По всем вопросам обращайтесь на mne@nuzhnapomosh.ru
Нашли опечатку? Выделите слово и нажмите Ctrl+Enter
Нашли опечатку? Выделите слово и нажмите Ctrl+Enter
Благотворительный фонд помощи социально-незащищенным гражданам «Нужна помощь»
Адрес: 119270, г. Москва, Лужнецкая набережная, д. 2/4, стр. 16, помещение 405
ИНН: 9710001171
КПП: 770401001
ОГРН: 1157700014053
р/с 40703810701270000111
в ТОЧКА ПАО БАНКА «ФК ОТКРЫТИЕ»
к/с 30101810845250000999
БИК 044525999
Благотворительного фонда помощи социально-незащищенным гражданам «Нужна помощь» в отношении обработки персональных данных и сведения о реализуемых требованиях к защите персональных данных