спинальная амиотрофия что это
Спинальная мышечная атрофия: что это такое и как ее вылечить
О спинальной мышечной атрофии у детей говорят все чаще, обычно — в контексте появления долгожданных лекарств против нее. Можно ли спасти всех больных и что для этого требуется?
Что такое СМА?
Спинальная мышечная атрофия (СМА) — это целая группа наследственных, генетических заболеваний, при которых страдают двигательные нейроны передних рогов спинного мозга. Из-за мутации в гене SMN1 у больных СМА снижена выработка SMN-белка, без которого нейроны разрушаются и перестают передавать сигналы от мозга к мускулатуре. В результате у человека постепенно атрофируются мышцы конечностей, головы и шеи.
Какой тип СМА самый опасный?
Существует 5 основных типов спинальных мышечных атрофий. Каждый из них имеет свои особенности, в том числе – симптомы и время манифестации.
Во многом тяжесть и скорость развития болезни определяется количеством у ребенка копий гена SMN2, он почти идентичен гену SMN1 и может в некоторой степени компенсировать его поломку.
Высокая смертность в случае отсутствия раннего лечения характерна только для СМА нулевого и первого типов. Большая часть пациентов с другими типами атрофий доживает до взрослого возраста. Четвертый тип, затрагивающий взрослых, на продолжительность жизни значительного влияния не оказывает.
Почему именно я? Как часто врачи ставят страшный диагноз
Обычно тип наследования СМА у детей — аутосомно-рецессивный. Некоторые, более редкие виды СМА, имеют другой тип наследования, а могут вообще не передаваться следующим поколениям. Это значит, что ребенок может заболеть только в том случае, если у обоих родителей есть поломанный ген, ответственный за синтез соответствующего белка. И даже тогда вероятность болезни составляет лишь 25%. Еще в четверти случаев ребенок вообще не унаследует мутаций, и в половине — сам станет бессимптомным носителем.
Согласно последним данным, в среднем дефектные гены, вызывающие мышечную атрофию, можно найти у каждого пятидесятого новорожденного, что не так мало, как хотелось бы. Сегодня среди 10 тысяч младенцев СМА диагностируют хотя бы у одного. Не зря эта болезнь является одной из ведущих причин детской смертности, связанных с генетическими нарушениями.
Когда стоит заподозрить неладное? Симптомы болезни
СМА первого типа может стать заметна почти сразу после рождения. Младенцы с этой тяжелой патологией:
Дети с СМА первого типа сначала могут выглядеть совершенно здоровыми. Однако со временем родители замечают, что ребенок мало двигается, быстро набирает вес, ему все труднее держать игрушки. Так как начинать лечить мышечную атрофию нужно как можно раньше, появление любых описанных симптомов — повод немедленно обратиться к врачу-неврологу.
Дети с СМА второго типа начинают отставать в развитии после 6–7 месяцев. Симптомы могут развиться еще позже, но обычно — до достижения ребенком 18 месяцев жизни. Дети с этой формой спинальной атрофии:
СМА третьего типа возникает к 1,5–2 годам, иногда — в позднем детстве или в подростковом возрасте. Ее основные признаки:
Взрослые, столкнувшиеся с СМА четвертого типа, как правило, жалуются на:
Эта форма СМА также способна прогрессировать, но почти никогда не затрагивает мускулатуру, отвечающую за дыхание, а потому не составляет угрозы жизни.
Может ли болезнь пройти сама по себе?
СМА — это расстройство, вызванное специфической мутацией в геноме. Оно всегда имеет прогрессирующий характер и не может пройти со временем, так как наша ДНК не способна починить сама себя, избавившись от нежелательных элементов кода.
Лечение СМА. Спинраза — это единственная надежда?
До недавнего времени вылечить СМА было невозможно, и все действия сводились к поддержанию жизни и улучшению ее качества. Для этого, например, используются специальные упражнения и приборы, призванные помочь двигаться и дышать, в том числе — зонды для кормления.
Настоящим прорывом стала разработка первого эффективного лекарства против спинальной мышечной атрофии. Препарат Спинраза (нусинерсен) был одобрен в США в 2016 году, а в России — в 2019-м. Он направлен на лечение всех типов СМА и подходит для пациентов всех возрастов. В основе — небольшие последовательности нуклеотидов, позволяющих синтезировать белок SMN на базе другого, схожего гена в нашей ДНК — SMN2. Препарат вводят в спинномозговую жидкость. Одной инъекции недостаточно. Чтобы защитить нейроны, лекарство нужно использовать регулярно: несколько раз в первый год жизни, и каждые 4 месяца — после.
В прошлом году в России стал доступен Рисдиплам. Он, как и Спинраза, воздействует на прочтение гена SMN2, но его можно пить в виде таблеток, что гораздо удобнее.
Третий препарат против СМА — Золгенсма (онасемноген абепарвовек), в нашей стране пока не зарегистрирован. Его применяют у детей до 2 лет. Внутри лекарства — аденовирусный вектор (оболочка вируса), который доставляет в нейроны работающий ген SMN1, после чего клетки начинают синтезировать нужный им белок (ДНК ребенка при этом никак не изменяется). Так как это средство генной терапии, для полного выздоровления хватает всего лишь одной дозы лекарства, в чем его значительное преимущество.
Сколько стоит лечение и когда его не поздно начать?
Ситуация для больных детей усугубляется в связи с тем, что лечить СМА нужно на ранних стадиях, так как из-за болезни нейроны отмирают постоянно, день за днем. Если ребенок болен СМА первого типа, у него есть в запасе около двух лет, у маленьких пациентов с другими формами болезни времени для лечения чуть больше, но прогноз тем лучше, чем раньше начата терапия. И все же на сегодняшний день прогресс в лечении СМА очевиден. Этот диагноз – больше не приговор, а в будущем спасительные лекарства, несомненно, будут становиться все эффективнее и дешевле.
Амиотрофия Верднига-Гоффмана — это наиболее злокачественная спинальная мышечная атрофия, развивающаяся с рождения или в первые 1-1,5 года жизни ребенка. Характеризуется нарастающими диффузными мышечными атрофиями, сопровождающимися вялыми парезами, прогрессирующими до полной плегии. Как правило, амиотрофия Верднига-Гоффмана сочетается с костными деформациями и врожденными аномалиями развития. Диагностическую основу составляет анамнез, неврологический осмотр, электрофизиологические и томографические исследования, анализ ДНК и изучение морфологического строения мышечной ткани. Лечение слабо эффективно, направлено на оптимизацию трофики нервной и мышечной тканей.
МКБ-10
Общие сведения
Амиотрофия Верднига-Гоффмана является самым тяжелым вариантом из всех спинальных мышечных атрофий (СМА). Ее распространенность находится на уровне 1 случай на 6-10 тыс. новорожденных. Заболевание имеет несколько форм: врожденную, промежуточную (раннюю детскую) и позднюю. Целый ряд специалистов выделяет последнюю форму как самостоятельную нозологию — амиотрофию Кугельберга-Веландера. Отсутствие этиотропного и патогенетического лечения, ранний летальный исход ставят курирование пациентов с болезнью Верднига-Гоффмана в ряд наиболее сложных задач, стоящих перед современной неврологией и педиатрией.
Причины
Амиотрофия Верднига-Гоффмана — наследственная патология, кодируемая поломкой в генетическом аппарате на уровне локуса 5q13 5-й хромосомы. Ген, в котором происходят мутации, получил название survival motor neuron gene (SMN) — ген, ответственный за выживание мотонейронов. У 95% пациентов с болезнью Верднига-Гоффмана отмечается делеция теломерной копии этого гена. Тяжесть СМА прямо коррелирует с протяженностью участка делеции и сопутствующим наличием изменений (рекомбинации) в генах H4F5, NAIP, GTF2H2.
Носителем измененного гена, обуславливающего возникновение заболевания, является каждый 50-й человек. Но благодаря аутосомно-рецессивному типу наследования, патология у ребенка проявляется только тогда, когда соответствующая генетическая аберрация имеется и у матери, и у отца. Вероятность рождения ребенка с патологией в такой ситуации составляет 25%.
Патогенез
Результатом аберрации SMN-гена является недоразвитие мотонейронов спинного мозга, локализующихся в его передних рогах. Следствием становится недостаточная иннервация мышц, приводящая к их выраженной атрофии с потерей мышечной силы и прогрессирующим угасанием способности совершать активные двигательные акты. Основную опасность представляет слабость мышц грудной клетки, без участия которых невозможны движения, обеспечивающие дыхательную функцию. При этом сенсорная сфера на всем протяжении заболевания остается интактной.
Симптомы амиотрофии
Врожденная форма
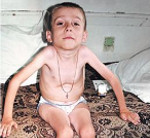
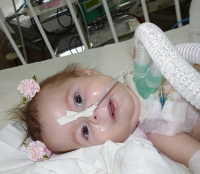
СМА I клинически манифестирует до 6-месячного возраста. Внутриутробно может проявляться вялым шевелением плода. Зачастую мышечная гипотония отмечается с первых дней жизни и сопровождается угасанием глубоких рефлексов. Дети слабо кричат, плохо сосут, не могут держать голову. В отдельных случаях (при более позднем дебюте симптомов) ребенок учится держать голову и даже сидеть, но на фоне развития заболевания эти навыки быстро исчезают. Характерны ранние бульбарные нарушения, понижение глоточного рефлекса, фасцикулярные подергивания языка.
Данная амиотрофия Верднига-Гоффмана сочетается с олигофренией и нарушениями формирования костно-суставного аппарата: деформациями грудной клетки (воронкообразной и килевидной грудной клеткой), искривлением позвоночника (сколиозом), контрактурами суставов. У многих пациентов выявляются другие врожденные аномалии: гемангиомы, гидроцефалия, косолапость, дисплазия тазобедренных суставов, крипторхизм и пр.
Течение СМА I наиболее злокачественное с быстро нарастающей обездвиженностью и парезом дыхательной мускулатуры. Последний обуславливает развитие и прогрессирование дыхательной недостаточности, выступающей основной причиной летального исхода. В связи с нарушением глотания возможен заброс пищи в дыхательные пути с развитием аспирационной пневмонии, которая может явиться смертельно опасным осложнением спинальной амиотрофии.
Ранняя детская форма
СМА II дебютирует после 6-месячного возраста. К этому периоду дети имеют удовлетворительное физическое и нервно-психическое развитие, в соответствии с возрастными нормами приобретают навыки держать голову, переворачиваться, садиться, стоять. Но в подавляющем большинстве клинических случаев дети так и не успевают научиться ходить. Обычно эта амиотрофия Верднига-Гоффмана манифестирует после перенесенной ребенком пищевой токсикоинфекции или другого острого инфекционного заболевания.
В начальном периоде периферические парезы возникают в нижних конечностях. Затем они достаточно быстро распространяются на верхние конечности и мускулатуру туловища. Развивается диффузная мышечная гипотония, происходит угасание глубоких рефлексов. Наблюдаются контрактуры сухожилий, тремор пальцев, непроизвольные мышечные сокращения (фасцикуляции) языка. На поздних стадиях присоединяются бульбарные симптомы, прогрессирующая дыхательная недостаточность. Течение более медленное, чем у врожденной формы болезни Верднига-Гоффмана. Пациенты могут доживать до 15-летнего возраста.
Амиотрофия Кугельберга-Веландера
Диагностика
Больные спинальной мышечной атрофией I типа находятся под наблюдением детских неврологов и неонатологов. Большое значение имеет возраст манифестации заболевания – для амиотрофии Верднига-Гоффмана характерно развитие с момента рождения до 6 месяцев. В анамнезе часто имеются сведения о позднем и вялом шевелении плода во время беременности.
При осмотре ребенка обращается внимание на выраженную мышечную гипотонию, неспособность самостоятельно сидеть или удерживать голову, типичную «позу лягушки» – плечи приподняты, руки вдоль туловища, ноги выпрямлены и повернуты кнаружи. Отмечаются мышечные подергивания, ослабление или отсутствие сухожильных рефлексов, грубые костные деформации (колоколообразная грудная клетка, Х-образные нижние конечности). Для подтверждения диагноза назначаются следующие дополнительные исследования:
Амиотрофию Верднига-Гоффмана следует дифференцировать с другими генетически обусловленными нервно-мышечными заболеваниями, имеющими такое же быстропрогрессирующее течение. К ним относятся врожденные структурные миопатии, ювенильный боковой амиотрофический склероз, синдром Фукуямы.
Лечение амиотрофии Верднига-Гоффмана
Немедикаментозная терапия
Для прохождения лечения все больные подлежат обязательной госпитализации в стационар. В тяжелых ситуациях (например, при выраженной гипоксемии вследствие слабости дыхательных мышц) пациентов переводят в отделение реанимации и интенсивной терапии и подключают к аппарату ИВЛ. На сегодняшний день не существует этиотропной терапии амиотрофии Верднига-Гоффмана. Все мероприятия носят симптоматический и паллиативный характер. Применяются следующие методы лечения:
Медикаментозная терапия
Для достижения максимального эффекта лечение должно быть комплексным, проводиться непрерывно и подбираться индивидуально для конкретного пациента. Лекарственные препараты, применяющие для лечения амиотрофии Верднига-Гоффмана следующие:
Хирургическое лечение
При развитии грубых деформаций грудной клетки и позвоночника или крайне выраженных контрактур суставов показаны ортопедические операции. У лежачих больных, страдающих постоянно рецидивирующими пневмониями, выполняется трахеостомия. При гастроэзофагеальном рефлюксе, резистентном к медикаментозному лечению, прибегают к лапароскопической фундопликации Ниссена.
Новейшие разработки
Ведутся постоянные исследовательские работы по поиску эффективного лекарства для терапии спинальной мышечной атрофии. Наиболее перспективным направлением считается генная терапия. В клинической практике уже используются антисмысловые олигонуклеотиды, исправляющие дефекты матричной РНК в гене SMN2 (Спинраза).
В конце 2019 года был зарегистрирован и одобрен к клиническому применению препарат Золгенсма, который содержит функционально полноценный ген SMN1. Доставка этого гена в нервные клетки производится с помощью аденоассоциированного вируса, проникающего через гематоэнцефалический барьер. Использование Золгенсмы приводит к значительному увеличению продукции белка SMN1 и улучшению состояния пациентов.
Прогноз
Врожденная амиотрофия Верднига-Гоффмана имеет крайне неблагоприятный прогноз. При ее манифестации в первые дни жизни ребенка, его гибель, как правило, происходит до 6-месячного возраста. При начале клиники после 3-х месяцев жизни, летальный исход наступает в среднем к возрасту 2 года, иногда — к 7-8 годам. Ранняя детская форма характеризуется более замедленным прогрессированием, дети погибают в возрасте 14-15 лет.
Профилактика
Первичная профилактика амиотрофии Верднига-Гоффмана заключается в пренатальной диагностике. При обнаружении в биоптатах ворсин хориона или амниотической жидкости мутации SMN1 показано прерывание беременности. Вторичная профилактика сводится к предупреждению осложнений – аспирационной пневмонии, контрактур суставов, инфекций нижних дыхательных путей.
Причины и диагностика спинальной мышечной атрофии (СМА)
Отмирание моторных нейронов приводит к прогрессивному развитию слабости мышц, их атрофии, и в итоге, обездвиживанию пациента. Спинальная мышечная атрофия делится на несколько типов, в зависимости от того, насколько серьезны симптомы и в каком возрасте они начались:
Частота и тип наследования СМА
Спинальная мышечная атрофия встречается у 1 из 6000 — 10 000, с частотой носительства 1 из 38 человек. Больной ребенок рождается, при наличии двух мутаций, со стороны матери и со стороны отца. Родители, являющиеся носителями мутации в гене SMN1, не имеют клинических симптомов. Спинальная мышечная атрофия наследуется по аутосомно-рецессивному типу:
Есть и другие гены (например ATP7A и др.), поломки в которых приводят к развитию СМА. Поэтому возможны и другие типы наследования (доминантный/X-сцепленный) и, соответственно, другие риски.
Причина заболевания и патогенез СМА
Тяжесть течения болезни модифицируется вторым геном SMN2. Он очень похож на ген SMN1, но отличается последовательностью нуклеотидов в 7 и 8 экзонах. Ген SMN2 не способен продуцировать функциональный белок SMN в достаточном количестве, однако количество копий SMN2, а также последовательность этих копий влияют на фенотип. Поэтому важно получить информацию о количестве копий генов SMN1и SMN2, не только у пациента с признаками СМА, но и у пар, планирующих беременность.
Скрининг новорожденных на СМА
Хотя скрининг новорожденных еще не является стандартной практикой, время имеет решающее значение. Более ранняя диагностика СМА может помочь улучшить исходы для детей с атрофией дыхательных и скелетных мышц.