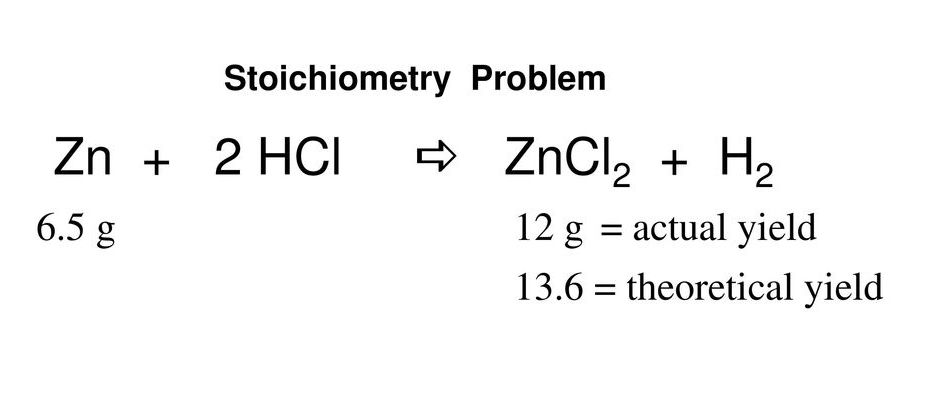
соляная кислота и цинк реакция что происходит
Как реагирует цинк с соляной кислотой?
Физические свойства металла
Цинк — это хрупкий металл серебристо-голубого цвета, он очень ковок и пластичен.
Кристаллы этого металла похожи на иголки, поэтому, вероятнее всего, название тридцатого элемента происходит от немецкого zinke, что переводится как «зубец». Цинк настолько хрупкий, что если согнуть палочку этого металла при нормальной температуре, можно услышать хруст, даже более отчетливый, чем у олова. При температурах 100–150 °С цинк становится тягучим и используется для соединения деталей между собой. Но если температура воздействия на цинк поднимется, к примеру, до 210 °С, серебристый металл вновь станет хрупким.
Химические свойства цинка
Тридцатый элемент таблицы Менделеева является мощным восстановителем. При высоких температурах металл сгорает и тем самым образует атмосферный белый оксид цинка. Реакция сопровождается голубым пламенем:
При горении цинк весьма бурно реагирует с серой. Взаимодействие сопровождается красивым зеленоватым пламенем:
С галогенами цинк реагирует в присутствии влаги:
Также цинк реагирует с парами воды при 600–800 °С с образованием водорода и оксида цинка:
Если опустить кусочек цинка в разбавленную серную кислоту, пойдет выделение пузырьков водорода:
Цинк — тяжелый металл (например, по сравнению с литием), поэтому такой металл не всплывает на поверхность под действием пузырьков.
Реакция цинка и соляной кислоты
Рассмотрим взаимодействие серебристого металла с соляной кислотой. С НСl цинк реагирует также медленно, с образованием небольших пузырьков и выделением водорода. В результате реакции получается хлорид цинка ZnCl₂:
Десятки экспериментов у вас дома
Один из самых интересных и амбициозных образовательных химических проектов
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Нахождение в природе
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Цинк находится в группе элементов из периодической таблицы, называемой переходными металлами. Эти металлы имеют переменную реакционную способность и различаются в природе в элементарной форме. Цинк встречается в природе как в элементарной форме – как блестящий серый металл, так и в виде соли. Люди и многие другие организмы зависят от определенного количества неметаллического цинка, то есть цинка в форме соли, для поддержания клеточной функции.
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Цинк и соляная кислота
Хотя не все металлы реагируют с соляной кислотой или HCl, некоторые делают. Способность металла реагировать с HCl зависит от так называемой активности металла, когда металлы с высокой активностью реагируют с HCl. Активность металлического цинка достаточно высока, чтобы позволить ему вступать в реакцию с HCl, которая производит газ H2 и хлорид соединения, или ZnCl2, объясняет д-р Мартин Зильберберг в своей книге «Химия: молекулярная природа материи и изменений».
Цинк как минерал
Цинк в теле
Пока у вас HCl в желудке – он помогает в переваривании пищи – вы не производите ни H2, ни ZnCl2, когда потребляете цинк в пище. Это потому, что цинк вы взятие через продукты питания или дополнения не в металлической форме. Вместо этого оно имеет потеряли некоторые из его электронов, образуя положительно заряженные частицы, называемые ионами цинка. Тело не использует металлический цинк, а цинк в пище не реагирует с HCl.
Цинк как типичный щелочной металл
Цинк – это типичный представитель металлов, в нормальном состоянии имеет голубовато-серый цвет, легко окисляется на воздухе, приобретая на поверхности оксидную пленку (ZnO).
Как типичный амфотерный металл цинк взаимодействует с кислородом воздуха: 2Zn+O2=2ZnO – без температуры, с образованием оксидной пленки. При нагревании образуется белый порошок.
Сам оксид реагирует с кислотами с образованием соли и воды:
С растворами кислот. Если цинк обычной чистоты, то уравнение реакции HCl Zn ниже.
Zn+2HCl= ZnCl2+H2↑ – молекулярное уравнение реакции.
Zn + 2H(+) = Zn(2+) +H2 – С.И.У. (сокращенное ионное уравнение реакции).
Реакция цинка с соляной кислотой
Данное уравнение реакции HCl Zn относится к типу окислительно-восстановительных. Это можно доказать тем, что у Zn и H2 в ходе реакции изменился заряд, наблюдалось качественное проявление реакции, а также наблюдалось присутствие окислителя и восстановителя.
В данном случае H2 является окислителем, так как с. о. водорода до начала реакции была “+”, а после стала “0”. Он участвовал в процессе восстановления, отдавая 2 электрона.
Zn является восстановителем, он участвует в окислении, принимая 2 электрона, повышая с.о. (степень окисления).
Также это реакция замещения. В ходе нее участвовало 2 вещества, простое Zn и сложное – HCl. В результате реакции образовалось 2 новых вещества, а также одно простое – H2 и одно сложное – ZnCl2. Так как Zn расположен в ряду активности металлов до H2, он вытеснил его из вещества, которое реагировала с ним.
Реакция между соляной кислотой и цинком
Свойства цинка и особенности его взаимодействия с HCl
Физические свойства металла
Цинк — это хрупкий металл серебристо-голубого цвета, он очень ковок и пластичен.
Кристаллы этого металла похожи на иголки, поэтому, вероятнее всего, название тридцатого элемента происходит от немецкого zinke, что переводится как «зубец». Цинк настолько хрупкий, что если согнуть палочку этого металла при нормальной температуре, можно услышать хруст, даже более отчетливый, чем у олова. При температурах 100–150 °С цинк становится тягучим и используется для соединения деталей между собой. Но если температура воздействия на цинк поднимется, к примеру, до 210 °С, серебристый металл вновь станет хрупким.
Химические свойства цинка
Тридцатый элемент таблицы Менделеева является мощным восстановителем. При высоких температурах металл сгорает и тем самым образует атмосферный белый оксид цинка. Реакция сопровождается голубым пламенем:
При горении цинк весьма бурно реагирует с серой. Взаимодействие сопровождается красивым зеленоватым пламенем:
С галогенами цинк реагирует в присутствии влаги:
Также цинк реагирует с парами воды при 600–800 °С с образованием водорода и оксида цинка:
Если опустить кусочек цинка в разбавленную серную кислоту, пойдет выделение пузырьков водорода:
Цинк — тяжелый металл (например, по сравнению с литием), поэтому такой металл не всплывает на поверхность под действием пузырьков.
Здесь вы найдете интересные эксперименты с цинком.
Реакция цинка и соляной кислоты
Рассмотрим взаимодействие серебристого металла с соляной кислотой. С НСl цинк реагирует также медленно, с образованием небольших пузырьков и выделением водорода. В результате реакции получается хлорид цинка ZnCl₂:
Что происходит при взаимодействии цинка с соляной кислотой?
Это реакция нейтрализации, т.к. в ней участвуют кислота и основание. В процессе они друг друга нейтрализуют и дают в результате соль и воду.
Дополню предыдущий ответ: медь не вступает в реакцию с HCl, но оксид меди вступает, образуя соль и воду.
Оксид меди является слабым основанием, и он легко реагирует с HCl с образованием растворимого хлорида меди (II) и воды.
Скорее всего у вас первоначально образовался нитрозилхлорид (активный компонент царской водки), который постепенно распался на окислы азота и хлор. Из-за образования сложной смеси продуктов реакции окраска раствора могла быть красной и даже коричневой, после улетучивания газов раствор стал желтый.
Сам оксид цинка не очень интересное вещество, но из него можно синтезировать много более интересных солей цинка растворением в кислоте (почти в любой) или в щелочи с последующим замещением аниона (если нужно). Примеры:
Опыты по химии. Кислоты
Взаимодействие кислот с металлами
Активные металлы вытесняют водород из кислот. Возьмем для испытаний цинк Zn и медь Cu.
Добавим соляную кислоту в пробирку с цинком – начинается реакция с выделением водорода.
Цинк восстанавливает водород из кислот, в ряду напряжений он расположен левее водорода.
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Медь не реагирует с кислотой: в ряду напряжений медь — правее водорода. Активный цинк реагирует с кислотой, неактивная медь – не реагирует с соляной кислотой.
Оборудование: пробирки, держатель для пробирок.
Техника безопасности: Следует соблюдать правила работы с горючими газами и правила работы с кислотами.
Постановка опыта – Елена Махиненко, текст – к.т.н. Павел Беспалов.
Взаимодействие оксидов металлов (основных оксидов) с кислотами
Как будут взаимодействовать оксиды кальция и железа
с кислотами? Основные оксиды взаимодействуют
с кислотами с образованием солей. Положим в одну пробирку оксид кальция, в другую — оксид железа. Добавим разбавленную соляную кислоту. Пробирку с оксидом железа приходится нагревать, чтобы реакция началась.
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Оксид кальция реагирует с соляной кислотой уже при комнатной температуре.
CaO + 2HCl = CaCl2 + H2O
Оксид и кислота образуют соль и воду. В пробирках образовались растворы хлорида кальция и хлорида железа. Взаимодействие с кислотами с образованием солей — характерное свойство оксидов металлов.
Оборудование: пробирки, штатив для пробирок, шпатель, держатель, спиртовка.
Техника безопасности. Следует соблюдать правила обращения с кислотами. Не допускать попадания оксида кальция на кожу.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Действие кислот на индикаторы
Для определения реакции среды используют индикаторы лакмус, метилоранж, фенолфталеин. Как индикаторы реагируют на кислую среду? Приготовим пробирки с раствором соляной кислоты. Лакмус и метилоранж в кислой среде изменяют цвет – растворы становятся соответственно красным и розовым. Фенолфталеин в кислой среде остается бесцветным.
НСI = Н + + СI —
Оборудование: пробирки, держатель для пробирок.
Техника безопасности
Следует соблюдать правила работы с кислотами.
Постановка опыта – Елена Махиненко, текст – Павел Беспалов.
Реакция обмена между оксидом меди (II) и серной кислотой
Типичный пример реакции обмена – реакция между оксидами металлов и кислотами. Продукт таких реакций – соли и вода. На кончике ложки — черный порошок оксида двухвалентной меди CuO.
Добавляем немного разбавленной серной кислоты H2SO4. Реакция начинается только тогда, когда пробирка с реагентами нагревается.
CuO + H2SO4= CuSO4 + H2O
Реакция обмена между оксидом меди и серной кислотой проходит с образованием соли – сульфата меди и воды. Сульфат меди окрашивает раствор в голубой цвет. Растворимые соединения меди ядовиты. Но в микроскопических количествах медь необходима для нормального развития растений и животных, так как она стимулирует внутриклеточные химические процессы.
Оборудование: пробирка, штатив для пробирок, спиртовка, держатель.
Техника безопасности. Следует соблюдать правила обращения с нагревательными приборами и правила обращения с кислотами, а также избегать попадания солей меди на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
По ХИМИИ помогите пожалуйста срочно!
1.Что происходит при взаимодействии цинка с соляной кислотой?Составить уравнение реакции и дать ей полную характеристику по всем признакам классификации химических реакций.
2.Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3.опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4.Опишите, как можно распознать водород.
1.что происходит при нагревании перманганата калия?составить уравнение реакции и дать ей полную характеристику по всем признакам классификации химических реакций.
2.Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3.опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
4.Опишите, как можно распознать кислород.
1.что происходит при взаимодействии мела и мрамора с соляной кислотой??составить уравнение реакции и дать ей полную характеристику по всем признакам классификации химических реакций.
Сочинения все словесные- это уж из учебника. Тут только уравнения есть смысл записывать!
Zn+2HCl=ZnCl2 + H2(газ) (р. замещения)
Zn(0)-отдает электроны и окисляется Zn-2e=Zn(+2) т. е. является восстановителем
Ионы водорода принимают электроны и восстанавливаются до свободного состояния, т. е. соляная кислота (ионы водорода) явл-ся окислителем.
2Н (+) +2е=Н2
Реакция разложения:
2КМnO4 = К2МnO4 + МnO2+O2 Это внутримолекулярная окислительно-восстановительная реакция.
В ходе реакции марганец изменяет степень окисления с (+7) до (+6) и (+4); кислород меняет степень окисления с (-2) до свободного состояния (0).
Сочинения все словесные- это уж из учебника. Тут только уравнения есть смысл записывать!
Zn+2HCl=ZnCl2 + H2(газ) (р. замещения)
Zn(0)-отдает электроны и окисляется Zn-2e=Zn(+2) т. е. является восстановителем
Ионы водорода принимают электроны и восстанавливаются до свободного состояния, т. е. соляная кислота (ионы водорода) явл-ся окислителем.
2Н (+) +2е=Н2
Реакция разложения:
2КМnO4 = К2МnO4 + МnO2+O2 Это внутримолекулярная окислительно-восстановительная реакция.
В ходе реакции марганец изменяет степень окисления с (+7) до (+6) и (+4); кислород меняет степень окисления с (-2) до свободного состояния (0).