сниженная экскреция мочевой кислоты что это значит
Диагностика и лечение подагрического артрита
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислот
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислоты (уратов) с развитием рецидивирующего острого артрита и образованием подагрических узелков (тофусов).
Подагра относится к «старым» болезням и известна со времен глубокой древности. Термин «подагра» происходит от греческих слов pus, что означает стопа, и agra — захват. Таким образом, уже в названии заболевания подчеркивается одно из кардинальных проявлений подагрического артрита. Подагра рассматривается не только как недуг, при котором патологический процесс локализуется в опорно-двигательном аппарате, но и как системное заболевание, характеризующееся поражением жизненно важных органов, и прежде всего почек. Распространенность подагры в различных регионах варьирует в широких пределах и во многом связана с особенностями питания населения, составляя в среднем 0,1%. В США этот показатель равен 0,84% (возможно, эта цифра завышена).
Подагрой болеют преимущественно мужчины (отношение мужчины/женщины составляет 9:1). У мужчин и в норме наблюдается более высокий уровень мочевой кислоты. У женщин репродуктивного возраста повышенное содержание эстрогенов способствует увеличению почечного клиренса уратов. В постменопаузальном периоде уровень мочевой кислоты у них такой же, как и у мужчин соответствующего возраста. Поэтому, если пик заболеваемости у мужчин падает на возраст 35–50 лет, то у женщин — на 55–70 лет. Однако подагра может развиваться и в более молодом возрасте и отмечается даже у детей.
Как известно, мочевая кислота является конечным продуктом расщепления пуринов и выделяется из организма почками. У здоровых лиц за 24 ч выделяется с мочой 400–600 мг мочевой кислоты. Для понимания патогенеза подагры следует остановиться на клиренсе мочевой кислоты. Он характеризует объем крови, способный очиститься в почках от мочевой кислоты за 1 мин. В норме этот показатель равен 9 мл/мин. Источником образования мочевой кислоты в организме являются пуриновые соединения, которые поступают с пищей или образуются в организме в процессе обмена нуклеотидов. В плазме крови мочевая кислота находится в виде свободного урата натрия. В норме верхняя граница этого показателя для мужчин составляет 0,42 ммоль/л (7 мг%) и для женщин — 0,36 ммоль/л (6 мг%). Содержание мочевой кислоты выше этих цифр расценивается как гиперурикемия и рассматривается в качестве фактора высокого риска развития подагры. Так, по данным Фремингемского исследования, развитие подагрического артрита наблюдается у 17% мужчин и женщин с урикемией 7,0–7,9 мг%, у 25% — с 8–8,9 мг% и у 90% — при уровне мочевой кислоты выше 9,0 мг%.
При наличии стойкого повышения мочевой кислоты в сыворотке крови выше для данного индивидуума уровня она начинает откладываться в тканях в виде свободного урата натрия, который в мочевых путях переходит в мочевую кислоту.
Выделяются следующие клинические варианты подагры:
Гиперурикемия может длительное время протекать без каких-либо субъективных и объективных симптомов и лишь случайно диагностироваться при обследовании больного. Однако она не столь безобидна, как это может показаться на первый взгляд, и нередко ассоциируется с нарушениями жирового и углеводного обмена, а также, что еще более серьезно, приводит к уратной нефропатии. Следует отметить условность дефиниции «асимтоматическая подагра». Для ее выявления необходимо повторно исследовать уровень мочевой кислоты, особенно у «подагрической личности», т. е. у мужчин молодого возраста с пристрастием к алкоголю, ожирением и артериальной гипертонией. В некоторых случаях период асимптоматической (химической) гиперурикемии длится несколько лет и только после этого происходит клиническая презентация подагры. Следует иметь в виду, что гиперурикемии обычно предшествует гиперурикозурия. Поэтому у больных с мочекислым диатезом нужно повторно исследовать уровень мочевой кислоты не только в крови, но и в моче с целью своевременного выявления подагры.
Содержание мочевой кислоты в крови может повышаться под влиянием различных факторов, как внутренних, так и внешних. Эти факторы способствуют либо увеличению образования эндогенных пуринов, либо замедлению их выделения почками. С этих позиций выделяют два типа гиперурикемии — метаболический и почечный. Метаболический тип характеризуется повышением синтеза эндогенных пуринов при наличии высокой урикозурии и нормальном клиренсе мочевой кислоты. Напротив, при почечном типе наблюдается низкий клиренс мочевой кислоты и, следовательно, нарушение выделения мочевой кислоты почками. Представленные типы гиперурикемии имеют первостепенное значение в выборе противоподагрических модифицирующих болезнь препаратов, используемых в терапии этого заболевания.
Причины повышенного биосинтеза пуринов
Нозологические формы и клинические синдромы:
Лекарства, диета и хронические интоксикации:
Причины замедления выведения мочевой кислоты почками
Нозологические формы и клинические синдромы:
Лекарства и хронические интоксикации:
Выделяют также первичную и вторичную подагру. При первичной подагре какое-либо фоновое заболевание, предшествующее ее развитию, отсутствует. В основе такой подагры лежит семейно-генетическая аномалия пуринового обмена, детерминированная несколькими генами, или так называемый «конституциональный диспуризм». Исследования уратного гомеостаза показали аутосомно-доминантный тип наследования таких аномалий. В частности, это наблюдается при врожденных нарушениях в содержании энзимов, занимающих ключевое положение в метаболизме пуринов. Так, при снижении активности гипоксантин-гуанин-фосфорибозилтрансферазы происходит увеличение ресинтеза пуринов из нуклеотидов, что способствует развитию синдрома Леша-Найхана. Этот синдром встречается только у детей и у лиц молодого возраста и обычно заканчивается уратной нефропатией с летальным исходом. При высоком содержании фосфорибозилпирофосфата также наблюдается метаболический тип гиперурикемии, так как этот фермент участвует в синтезе предшественников мочевой кислоты. Что касается вторичной подагры, то она является одним из синдромов другого заболевания, «второй болезнью», развивающейся при многих патологических процессах и чаще всего при хронической почечной недостаточности.
Большое значение в распознавании подагры, особенно ее ранней стадии, имеет клиническая картина острого подагрического артрита. Она хорошо известна, однако частота диагностических ошибок в первый год заболевания достигает 90%, а через 5–7 лет правильный диагноз ставится только в половине случаев. Поздняя диагностика связана с недооценкой классических ранних признаков заболевания, а также с многообразием дебюта и течения подагры. Ее диагностика строится на особенностях клинической картины заболевания, повышенного содержания мочевой кислоты в крови и обнаружения кристаллов урата натрия в тканях. На практике широко применяются следующие так называемые Римские диагностические критерии подагры:
Диагноз подагры считается достоверным при наличии любых двух из четырех критериев.
Менее распространены диагностические критерии подагры, предложенные Американской коллегией ревматологов (АСК) в 1977 г., которые скорее характеризуют острый воспалительный артрит или его рецидивирующие атаки, нежели подагру в целом. Согласно этим критериям, достоверный диагноз ставится при наличии 6 из 12 признаков:
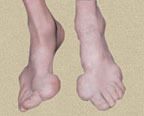
В первые 3–4 года подагра протекает по типу рецидивирующего острого воспалительного моноартрита с полным обратным развитием и восстановлением функции суставов, при этом межприступный период продолжается от нескольких месяцев до 1–2 лет. В дальнейшем этот период укорачивается, в процесс вовлекаются все новые и новые суставы и воспалительные явления локализуются не только в суставах стоп, но распространяются на суставы верхних конечностей, что обычно совпадает с образованием тофусов. Тофусы представляют собой депозиты кристаллов мочевой кислоты. Они появляются в среднем спустя 6 лет после первого приступа подагры, но иногда и через 2–3 года. Ураты чаще всего откладываются на поверхности суставного хряща, в синовиальной оболочке, синовиальных влагалищах, сухожилиях, а также в субкортикальной области эпифизов костей. Наиболее часто они располагаются на ушных раковинах и на задней поверхности локтевых суставов. Тофусы подразделяются на единичные и множественные, а также классифицируются в соответствии с их размерами, при этом к мелким относят тофусы до 1 см в диаметре, к средним — от 1 до 2,5 см и к крупным — более 2,5 см. Подагрические узлы с локализацией в опорно-двигательном аппарате являются основным элементом формирования хронического подагрического артрита. Тофусы могут располагаться в почках и других висцеральных органах.
Хроническое течение подагры не ограничивается только вовлеченностью суставов и формированием тофусов, но и характеризуется поражением внутренних органов. Подагрическая нефропатия является наиболее важным с прогностической точки зрения проявлением подагры и самой распространенной причиной летальных исходов при этом заболевании. Среди отдельных вариантов подагрической нефропатии выделяют острую мочекислую блокаду канальцев почек, мочекислый нефролитиаз, обусловленный отложением солей мочевой кислоты в чашечках и лоханках почек, хроническую уратную нефропатию и диффузный гломерулонефрит. Острая мочекислая блокада канальцев почек происходит, например, при распаде опухоли вследствие массивной медикаментозной или рентгенотерапии. Хроническая уратная нефропатия связана с отложением уратов в интерстиции почек, а развитие диффузного гломерулонефрита — с иммунными нарушениями у лиц с дисрегуляцией пуринового обмена. Такой гломерулонефрит по своей иммуноморфологии чаще всего является мезангиопролиферативным и при нем выявляют депозиты IgG и комплемента. Следует иметь в виду, что подагра часто ассоциируется с такими патологическими состояниями, как артериальная гипертония, ожирение, гиперлипидемия, жировая дистрофия печени, атеросклероз, нарушения мозгового кровообращения, алкогольная зависимость.
Течение подагры характеризуется разнообразием темпов развития болезни. Возможно относительно доброкачественное течение с редкими приступами, небольшой гиперурикемией и урикозурией и длительным сохранением функциональной недостаточности опорно-двигательного аппарата. В других случаях, напротив, с самого начала заболевания наблюдаются частые атаки острого артрита с сильными болями или непрерывные атаки с множественным поражением суставов на протяжении нескольких недель или месяцев (подагрический статус). Рефрактерное к проводимой терапии течение подагры приводит к быстрому развитию функциональной недостаточности суставов и почек.
В основе выделения вариантов течения подагры лежат: количество приступов артрита в течение года, число пораженных суставов, выраженность костно-хрящевой деструкции, наличие тофусов, патология почек и ее характер.
Варианты течения подагры
Легкое: приступы артрита 1–2 раза в год и захватывают не более 2 суставов, нет поражения почек и деструкции суставов, тофусы отсутствуют или они единичные и не превышают 1 см в диаметре.
Средней тяжести: 3–5 приступов в год, поражение 2–4 суставов, умеренно выраженная костно-суставная деструкция, множественные мелкие тофусы, поражение почек ограничено почечно-каменной болезнью.
Тяжелое: частота приступов более 5 в год, множественное поражение суставов, множественные тофусы крупных размеров, выраженная нефропатия.
Основными задачами терапии подагрического артрита являются:
Купирование острого подагрического артрита проводится противовоспалительными средствами. Для этих целей используются: колхицин — колхицин, колхикум-дисперт; нестероидные противовоспалительные препараты (НПВП) — вольтарен, дикловит, диклоран, целебрекс, мовалис); кортикостероиды — полькортолон, преднизолон, метилпреднизолон; или комбинация НПВП и кортикостероидов — амбене. Как колхицин, так и НПВП способствуют обратному развитию острого артрита в течение нескольких часов, в то время как у не прошедших лечение больных он может длиться несколько недель. До недавнего времени полагали, что лучшим препаратом для купирования приступа острого артрита при подагре является колхицин. Ярко выраженный и быстрый (в течение 48 ч) эффект колхицина рассматривался как один из диагностических признаков этого заболевания. Колхицин способен предупредить дальнейшее развитие острого приступа подагры при его назначении в первые 30–60 мин атаки. Его лечебное действие обусловлено угнетением фагоцитарной активности нейтрофилов. При остром приступе подагры мононатриевые соли уратов, фагоцитированные нейтрофилами, приводят вследствие мембранолитического их действия к гибели этих клеток и высвобождению лизосомальных ферментов, которые отвечают за развитие острого воспаления.
Из НПВП предпочтение отдают индометацину (индотард, метиндол) и диклофенаку (вольтарен, диклоран, диклофен). Эти препараты назначают в дозе 200–250 мг/сут, причем в первые часы приступа применяют большую часть суточной дозы. Проведенные контролированные исследования не выявили более высокой эффективности традиционных НПВП по сравнению с селективными ингибиторами ЦОГ-2 (нимесил, нимулид, целебрекс), например целекоксибами (коксиб, целебрекс). Однако окончательное суждение о сравнительной эффективности этих препаратов можно вынести только в ходе дальнейших исследований. Суточная доза колхицина составляет 4–6 мг/сут, причем 2/3 этой дозы больной принимает до 12 ч дня в первый день приступа. Обычно разовая доза составляет 0,6 мг и ее принимают каждый час до явного снижения подагрического воспаления. После значительного уменьшения воспаления дозу колхицина начинают снижать по 0,6 мг 2 раза в день, вплоть до полной отмены. Нередко у больных не удается наращивать суточную дозу до оптимальной из-за появления побочных реакций. Основными побочными эффектами колхицина являются тошнота, рвота, понос, возможны также геморрагический гастроэнтерит, лейкопения, нейропатия. При подагрическом статусе, характеризующемся непрерывными атаками острого артрита, рефрактерными к терапии НПВП, возможно внутривенное введение колхицина.
Противоподагрическая терапия (базисная, модифицирующая болезнь) направлена на профилактику рецидивов острого артрита, снижение содержания мочевой кислоты в крови, предупреждение дальнейшего формирования тофусов и их обратное развитие. Все противоподагрические препараты делятся на две большие группы: урикодепрессоры (урикостатики) и урикозурики. Урикодепрессоры тормозят синтез мочевой кислоты путем ингибирования фермента ксантиноксидазы, превращающего гипоксантин в ксантин, а ксантин в мочевую кислоту. Урикозурики повышают экскрецию мочевой кислоты, подавляя обратную реабсорбцию уратов почечными канальцами.
К препаратам первой группы относится аллопуринол (аллопуринол, аллопуринол-эгис, аллупол, пуринол, ремид, тиопуринол, милурит), который занимает лидирующее положение среди дру-гих противоподагрических средств. Показанием к применению аллопуринола являются метаболическая подагра, высокая гиперурикемия, частые острые атаки артрита, мочекислая болезнь, генетически обусловленный дефицит гипоксантин-гуанин-фосфорибозилтрансферазы. Применение аллопуринола возможно и у больных с подагрической нефропатией с начальными проявлениями хронической почечной недостаточности и небольшой азотемии. Начальная доза аллопуринола составляет 300 мг/сут. В случае неэффективности такой дозы ее увеличивают до 400–600 мг/сут, а при достижении клинического эффекта постепенно снижают. Поддерживающая доза определяется уровнем гиперурикемии и обычно составляет 100–300 мг/сут.
Аллопуринол способствует исчезновению атак острого артрита или их заметному ослаблению, обратному развитию тофусов и отчетливому их размягчению, снижению уровня мочевой кислоты до субнормальных цифр, нормализации показателей мочевого синдрома, урежению почечных колик и выделительной функции почек. У некоторых больных он поначалу вызывает повышение уровня мочевой кислоты и обострение подагрического артрита, поэтому на первом этапе терапии его комбинируют с противовоспалительными препаратами, в частности с низкими дозами колхицина или НПВП. По этой причине его не следует принимать при остром подагрическом артрите. При лечении аллопуринолом нередко развиваются побочные реакции, которые проявляются желудочно-кишечной токсичностью, аллергическими реакциями (кожная сыпь, эозинофилия), гепатотоксичностью с повышением сывороточных аминотрансфераз.
Урикозурические препараты, представляющие собой слабые органические кислоты, имеют меньшее значение в терапии подагры, чем урикостатики. Их не следует назначать при высоком содержании мочевой кислоты в крови, а также при нефропатии даже с начальными проявлениями почечной недостаточности. Из урикозурических препаратов сульфинпиразон и пробенецид особенно широко используются в США. Сульфинпиразон (сульфинпиразон, апо-сульфинпиразон, антуран) назначают по 200–400 мг/сут в два приема. Его, как и другие урикозурические средства, принимают с большим количеством жидкости, которую для профилактики нефролитиаза следует ощелачивать. Побочные реакции встречаются относительно часто и проявляются желудочной и кишечной диспепсией, лейкопенией, аллергическими реакциями. Противопоказанием к назначению сульфинпиразона является язвенная болезнь желудка и, конечно, подагрическая нефропатия.
Пробенецид (бенемид) является производным бензойной кислоты. Препарат назначается по 1,5–2,0 г/сут. Бензойная кислота содержится в клюкве, а также в ягодах и листьях брусники. Поэтому отвары и морсы из ягод и листьев этих растений показаны больным подагрой и в большей степени больным с подагрической нефропатией, тем более что помимо бензойной кислоты они содержат гиппуровую кислоту, обладающую урикосептическими свойствами. Урикозурическая активность присуща блокатору рецептора ангиотензина II и фенофибрату (грофибрат, нофибал). Наиболее эффективны производные бензбромарона, которые обладают не только урикозурическими свойствами, но и урикодепрессорными. Они используются в качестве монотерапии или в сочетании с аллопуринолом. Таким комбинированным препаратом является алломарон. Алломарон содержит 20 мг бензбромарона и 100 мг аллопуринола, его обычно принимают по 1 таблетке 2 раза в день.
Составной частью комплексной терапии подагры являются ощелачивающие препараты и ощелачивающие растворы, которые способны снизить риск развития нефропатии и, в частности, мочекаменной болезни. К этим препаратам относятся магурлит, блемарен и уралит. Их применение должно регулярно контролироваться показателем рН мочи. Помимо этих средств, можно принимать питьевую соду 2–4 г в день или щелочные минеральные воды.
При выраженных симптомах артрита необходимо также проводить местное лечение (долобене, финалгон, диклоран плюс, долгит крем, немулид гель, бишофит-гель).
Диете при подагре придают наибольшее значение по сравнению с другими ревматическими болезнями. Она предусматривает снижение общего калоража пищи, тем более что при подагре обычно наблюдается повышенная масса тела. Необходимо уменьшить поступление в организм экзогенных пуринов и животных жиров. Жиры снижают экскрецию мочевой кислоты почками. Крайне осторожно следует подходить к употреблению любых алкогольных напитков, включая пиво и красное вино. Исключают из пищевого рациона печенку, почки, жирные сорта мяса, мясные бульоны, копчености, горох, бобы, чечевицу, шпинат, цветную капусту, шпроты, сельдь. Следует ограничить потребление мяса до 2–3 раз в неделю, при этом лучше употреблять его в отварном виде.
Сочетание строгой диеты с длительным применением противоподагрических препаратов, а также активное воздействие на заболевания, которые повышают содержание мочевой кислоты в крови, способны существенно замедлить темпы прогрессирования костно-хрящевой деструкции, предупредить дальнейшее формирование тофусов и сохранить функциональное состояние опорно-двигательного аппарата и почек.
В. В. Бадокин, доктор медицинских наук, профессор
РМАПО, Москва
Медикаментозная терапия поражений почек, обусловленных нарушениями обмена пуринов
Рассмотрены подходы к медикаментозному лечению пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов. Описаны лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии.
Approaches to drug treatment of patients with renal diseases caused by purines metabolism disorders, are examined. Medications used for pathogenic treatment of gouty nephropathy are described.
Пуриновый обмен представляет собой сложный каскад биохимических реакций, в котором принимают участие многие ферментные системы. Содержание пуринов в организме складывается из их поступления с продуктами питания и эндогенного синтеза. Большая часть солей мочевой кислоты — уратов — образуется эндогенно в процессе метаболизма нуклеиновых кислот, однако существуют и другие пути биосинтеза этих веществ. Во всех вариантах важнейшим промежуточным звеном является инозиновая кислота, которая в дальнейшем подвергается гидролизу. Образующийся гипоксантин под влиянием фермента ксантиноксидазы преобразуется в ксантин и мочевую кислоту. С точки зрения биохимии нарушения пуринового обмена представляют собой различные варианты дисбаланса между ферментными системами, отвечающими за синтез и транспортировку мочевой кислоты и ее предшественников. Существенное значение также имеет поступление значительного количества пуринов с продуктами питания.
Считается, что в организме взрослого здорового человека содержится около 1000 мг мочевой кислоты. При нарушениях обмена пуринов этот показатель может возрастать в несколько раз. Содержание мочевой кислоты в организме не является жестким параметром и не имеет какой-либо диагностической ценности. Даже основной показатель состояния пуринового обмена — концентрация мочевой кислоты в сыворотке крови особой жесткостью не отличается. Минимальное и максимальное значения нормы отличаются примерно в 2,5 раза — 200–450 мкмоль/л у мужчин и 160–400 мкмоль/сут у женщин. У здоровых людей за сутки выводится и вновь синтезируется примерно 750 мг или 2/3 от общего объема мочевой кислоты. Из этого количества около 80% или 600 мг экскретируется почками. Оставшиеся 20% выводятся через желудочно-кишечный тракт. По оценке П. М. Клименко и соавт. (2010) клиренс мочевой кислоты в норме составляет 5,4–9,0 мл/мин [1].
Почечная экскреция уратов представляет собой сложный и многоступенчатый процесс. В клубочках происходит фильтрация уратов плазмы. Попавшие в ультрафильтрат ураты практически полностью реабсорбируются в проксимальном канальце, а затем секретируются в просвет нефрона. Некоторая часть секретированных уратов повторно реабсорбируется. Процесс активной секреции уратов очень чувствителен к различным химическим агентам. Считается, что почечную секрецию уратов повышают оротовая кислота, лозартан, эстрогены, продукты распада тетрациклина (просроченные тетрациклины обладают высокой токсичностью!); почечную экскрецию уратов понижают этамбутол, тиазиды и тиазидоподобные диуретики, в меньшей степени фуросемид и ацетазоламид [2]. Вполне очевидно, что выраженность отмеченных эффектов сильно изменяется от препарата к препарату и далеко не всегда имеет клиническое применение. В частности, урикозурические свойства эстрогенов существенного значения не имеют. Лозартан в последнее время стал фигурировать в схемах лечения подагрического тубулоинтерстициального нефрита у пациентов, не имеющих нефролитиаза [3]. Склонность тиазидов и индапамида уменьшать почечную экскрецию уратов и повышать их сывороточную концентрацию выражена достаточно ярко, что делает эти препараты как минимум нежелательными при суставной подагре и, особенно, при подагрической нефропатии.
Клинические варианты поражения почек вследствие нарушения пуринового обмена
Заболевания, связанные с нарушениями пуринового обмена, встречаются сравнительно часто, что делает актуальными вопросы, связанные с их лечением. Специалисты-урологи, а также большинство врачей общей практики хорошо знакомы с особенностями уратного нефролитиаза. В то же время эти специалисты нередко вовсе не имеют представления о существовании других, подчас более тяжелых заболеваний, обусловленных нарушениями пуринового обмена. Между тем все они встречаются с разной частотой в стационарах, а также при оказании амбулаторной медицинской помощи.
Наиболее значимым следствием нарушений пуринового обмена является повышение уровня мочевой кислоты в крови — гиперурикемия, которая и является основным этиологическим фактором различных патологических состояний. В зависимости от этиологии гиперурикемия подразделяется на первичную (не имеющую явной причины) и вторичную по отношению к какому-либо заболеванию.
Клиническим следствием первичной гиперурикемии является подагра в широком понимании этого термина. Сюда входит и классический острый микрокристаллический артрит, и различные варианты подагрической нефропатии, одним из которых является уратный нефролитиаз, и тофусы различной локализации, и осложнения всех этих состояний.
В группе заболеваний, связанных с первичной гиперурикемией, несколько особняком стоят генетически обусловленные нарушения пуринового обмена. Среди них синдром Леша–Нихена, болезнь Гирке, различные варианты наследственных дефектов транспортных систем почечных канальцев и другие. Отличительными признаками гиперурикемий, наследуемых по моногенному типу (то есть связанных с дефектом конкретного гена, определяющего развитие всего симптомокомплекса), являются манифестация в раннем детском возрасте, высокая гиперпродукция мочевой кислоты, быстрое, иногда даже «злокачественное» прогрессирование заболевания вплоть до формирования терминальной почечной недостаточности, часто весьма умеренная эффективность лечебных мероприятий, несмотря на максимально активную терапию [4].
Клиническая диагностика нарушений пуринового обмена, наследуемых по полигенному типу, в настоящее время затруднена. Проявления и характер течения заболевания в этом случае сильно варьируют в зависимости от внешних факторов, а биологический эффект значительной части генов все еще не до конца ясен [3, 4].
В нефрологической и общетерапевтической практике для определения поражения почек вследствие гиперурикемии несколько десятилетий назад было введено понятие «подагрическая почка», которое в современной медицине трансформировалось в «подагрическую нефропатию». Учитывая экспериментально доказанное повреждающее действие солей мочевой кислоты на почечные структуры, также предлагался термин «уратная нефропатия». Все эти понятия являются обобщающими и объединяют несколько достаточно сильно различающихся по своему патогенезу процессов: острую мочекислую нефропатию, уратный нефролитиаз и хронический тубулоинтерстициальный нефрит. Отдельные авторы также отмечают возможность иммунокомплексного гломерулонефрита, пусковым фактором которого служит гиперпродукция мочевой кислоты [5].
В урологической практике наиболее часто встречаются пациенты с уратным нефролитиазом. До 80% таких пациентов хотя бы один раз в жизни имели эпизод острого артрита, причем совершенно необязательно классической локализации — I плюснефалангового сустава. В последнее время все чаше встречаются атипичные варианты подагрического артрита, например, гонит. Кроме того, широкое и бесконтрольное применение нестероидных противовоспалительных средств зачастую смазывает клиническую картину, увеличивая удельный вес артритов с меньшей активностью воспалительного процесса. Можно отметить, что сочетание артрита и уратного нефролитиаза является не обязательным, а, скорее, характерным [5, 6].
Клиническая картина конкремента почки, мочеточника общеизвестна, поэтому еще раз ее подробно описывать смысла нет. Единственно, стоит отметить, что при наиболее тяжелом, «злокачественном» течении, наряду с образованием уратных камней в просвете мочевых путей, возможно и отложение кристаллов урата в почечном интерстиции, что носит название «нефрокальциноз». В отличие от нефролитиаза, нефрокальциноз при подагре всегда двухсторонний. Нефрокальциноз не имеет каких-либо специфических симптомов. Клинические проявления сводятся к прогрессированию почечной недостаточности за счет нефросклероза. Нефрокальциноз в большинстве случаев выявляется при ультразвуковом сканировании и требует специфической терапии.
Хронический тубулоинтерстициальный нефрит является характерным и частым вариантом подагрической нефропатии. Однако, ввиду меньшей яркости клинической картины, он известен главным образом специалистам-нефрологам и ревматологам.
На начальных стадиях тубулоинтерстициального нефрита патологический процесс затрагивает в основном канальцы и почечный интерстиций, поэтому ведущим симптомом является нарушение концентрационной функции почек — полиурия с низкой плотностью мочи (гипостенурией). Протеинурия не превышает 1 г/сут или вовсе отсутствует — она связана с нарушением реабсорбции белка канальцами. Для подагрического интерстициального нефрита характерна стойкая уратурия, а также стойкая или эпизодическая микрогематурия, особенно после перенесенной респираторной вирусной инфекции.
Уровень урата крови также закономерно повышен, однако необходимо помнить, что сам по себе факт наличия хронической почечной недостаточности также является причиной гиперурикемии. При явной клинической картине хронического тубулоинтерстициального нефрита его связь с нарушениями пуринового обмена не вызывает сомнений при следующих соотношениях уровней урата и креатинина крови: соответственно > 536 мкмоль/л и 595 мкмоль/л и 132–176 мкмоль/л; > 714 мкмоль/л и > 176 мкмоль/л [7].
При иммуногистохимическом исследовании почечных биоптатов у части пациентов с клинической картиной подагрического тубулоинтерстициального нефрита было отмечено свечение С3-фракции комплемента и IgG, что характерно для иммунокомплексных гломерулонефритов. Это позволило выделить хронический гломерулонефрит как отдельный вариант подагрической нефропатии [6].
При прогрессировании подагрического тубулоинтерстициального нефрита закономерно развитие артериальной гипертензии и нефросклероза.
Острая мочекислая нефропатия (острая подагрическая почка) в своей основе имеет обструкцию почечных канальцев кристаллами уратов, что приводит к острой почечной недостаточности. Заболевание начинается с олигурии. Часть пациентов одновременно предъявляет жалобы на болевой синдром по типу почечной колики, макрогематурию, что может объясняться миграцией крупных кристаллов уратов по мочеточнику. Патогномоничной является высокая уратурия, не характерная для острой почечной недостаточности другой этиологии, а также значительное повышение уровня мочевой кислоты в крови (выше 850–900 мкмоль/л). В современной нефрологической практике считается, что диагноз острой мочекислой нефропатии не вызывает сомнений при соотношении уровней урата и креатинина крови (в мг) > 1 [8].
Предположение об острой мочекислой нефропатии основывается на сочетании трех клинических признаков — высокоактивного артрита с характерной локализацией, резкого уменьшения диуреза и кирпично-бурого цвета мочи. Диагноз тем более вероятен, если пациент указывает на имевшую место гипогидратацию любого генеза — от посещения бани и физической работы при высокой температуре воздуха до неадекватной инфузионной терапии и передозировки мочегонных, а также на употребление значительного количества мясных продуктов и/или алкоголя. При естественном течении заболевания олигурия практически всегда прогрессирует до анурии с развернутой клинической картиной острой почечной недостаточности.
Проблема острой мочекислой нефропатии тесно прилежит к вторичным гиперурикемиям. Причины повышения уровня мочевой кислоты в сыворотке крови довольно многочисленны и разнообразны. Среди них: хроническая почечная недостаточность, независимо от этиологии, ожирение, особенно высоких степеней, плохо компенсированный сахарный диабет, акромегалия, гипотиреоз, гипопаратиреоз, токсикоз беременности, миелопролиферативные заболевания, саркоидоз, хроническая интоксикация свинцом, хронический алкоголизм. Прослеживается четкая связь между повышенным риском уратного нефролитиаза и наличием у пациента тяжелого псориаза, особенно суставного. В большинстве случаев выраженность гиперурикемии при этих заболевания небольшая, реже умеренная. Таким образом, нарушения пуринового обмена довольно редко значимо отражаются на клинической картине заболевания.
Самым ярким и клинически значимым вариантом вторичной гиперурикемии является «синдром лизиса опухоли» («синдром распада опухоли»), развивающийся при химиотерапии и радиотерапии лимфопролиферативных заболеваний, реже опухолей другой локализации. Ключевым компонентом этого синдрома, наряду с гиперфосфатемией и гиперкалиемией, является гиперпродукция мочевой кислоты, приводящая к развитию острой мочекислой нефропатии, причем нередко на неизмененных почках [11]. Однако тяжелая гиперурикемия, обусловленная генетическими нарушениями, крайне редко приводит к острой мочекислой нефропатии [3, 4].
Медикаментозная терапия заболеваний почек, обусловленных нарушениями пуринового обмена
Консервативная терапия любого варианта подагрической нефропатии в основе своей имеет снижение уровня гиперурикемии, а следовательно, и гиперурикурии, а также повышение растворимости урата в моче.
Всем пациентам в обязательном порядке назначается диета, цель которой уменьшить поступление пуринов в организм с пищей. Это достигается полным исключением из рациона мяса молодых животных, субпродуктов, мясные бульоны, колбас и т. д., ограниченно разрешается мясо полновозрастных животных, рыба. Пациентам рекомендуется преимущественно растительный стол, обильное щелочное питье, цитрусовые и напитки на их основе, а также полное воздержание от алкоголя.
При наличии почечной недостаточности, артериальной гипертензии, недостаточности кровообращения, ожирения вводятся дополнительные ограничения. Прежде всего, рекомендуют снизить потребление поваренной соли, так как эффективность ингибиторов АПФ, особо показанных при нефропатиях, осложненных артериальной гипертензией, да и вообще всей гипотензивной терапии напрямую зависит от объема поступающего в организм натрия. При выраженном дефиците фильтрации появляется необходимость в ограничении потреблении белка. При ожирении уменьшают общую калорийность рациона.
У ряда пациентов, например, при редко рецидивирующем уратном нефролитиазе без почечной недостаточности, при достаточной мотивации со стороны больного, вообще удается ограничиться коррекцией диеты и питьевого режима, не прибегая к назначению лекарственных препаратов.
Лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии, подразделяются на:
Базовым препаратом, влияющим на метаболизм пуринов, является аллопуринол, являющийся ингибитором фермента ксантиноксидазы. Под действием этого фермента происходит последний этап синтеза мочевой кислоты. Предшественники урата ксантин и гипоксантин имеют практически в 10 раз более высокую растворимость в воде по сравнению с мочевой кислотой. Остановка метаболизма пуринов на этом этапе сводит практически до нуля риск кристаллообразования, а значит, и микрокристаллического артрита, и нефропатии.
Аллопуринол показан при подагрическом тубулоинтерстициальном нефрите, острой мочекислой нефропатии, уратном нефролитиазе в сочетании с гиперурикемией, а также при химиотерапии злокачественных новообразований для профилактики развития вторичной гиперурикемии и острой почечной недостаточности. Минимально эффективная дозировка — 200 мг/сут, среднетерапевтическая — 300–400 мг/сут. При химиотерапии злокачественных новообразований требуются высокие, близкие к максимальным, дозировки аллопуринола — 600–900 мг/сут [2].
Аллопуринол склонен вызывать диспептические расстройства и кожную сыпь, которые отмечаются практически у каждого пятого больного. Побочные действия этого препарата чаще носят характер неприятных, но не опасных, и ввиду практически полной (вплоть по последнего времени) безальтернативности этого препарата большая часть пациентов все-таки продолжает лечение.
В последнее время на отечественном рынке появился новый ингибитор ксантиноксидазы фебуксостат, который отличается от аллопуринола более высокой селективностью [3]. Отечественный опыт применения фебуксостата пока крайне ограничен, однако зарубежные исследователи отмечают его более высокую эффективность в отношении гиперурикемии [9]. Однако уже сейчас можно отметить, что этот препарат является полноценной заменой аллопуринола в условиях его непереносимости, аллергии и т. д.
В заключение необходимо отметить, что ингибиторы ксантиноксидазы противопоказаны пациентам, получающим азатиоприн и 6-меркаптопурин, так как этот фермент принимает участие в их метаболизме. При совместном назначении резко возрастает риск токсичности, прежде всего костномозговой.
За рубежом также применяется рекомбинантная уратоксидаза — расбуриказа. Препарат существенно эффективнее аллопуринола снижает гиперурикемию и применяется, главным образом, в гематологической практике для профилактики острой уратной нефропатии [3].
Лекарственные средства, увеличивающие почечное выведение пуринов, — урикозурические препараты — угнетают процесс реабсорбции урата из просвета почечных канальцев. В современной клинической практике эта группа лекарственных средств применяется очень ограниченно. Далеко не у всех пациентов они демонстрируют достаточную эффективность. Кроме того, результатом прямого фармакологического эффекта — увеличения почечной экскреции урата — является рост риска нефролитиаза. Самый известный урикозурический препарат — пробенецид в настоящее время практически отсутствует на отечественном рынке. Бензбромарон зарегистрирован в России, но имеется лишь в очень небольшом количестве. Все урикозурические средства в организме подвергаются печеночному метаболизму и обладают некоторой гепатотоксичностью. Еще одной особенностью этих препаратов является огромное число лекарственных взаимодействий, что затрудняет их применение в составе многокомпонентных схем.
Цитратная терапия является неотъемлемой составляющей медикаментозного лечения подагрической нефропатии. Действие солей лимонной кислоты на процесс кристаллобразования в моче многогранно. Растворимость мочевой кислоты значительно меняется в зависимости от реакции среды. В кислой среде ураты имеют очень плохую растворимость и легко переходят в твердую фазу — кристаллизуются. При нейтральной или щелочной реакции растворимость этих солей увеличивается. Основным эффектом цитратов является способность защелачивать мочу, что предотвращает кристаллизацию уратов и создает условия для растворения уже сформированных кристаллов. На этом основана литолитическая терапия. Однако при щелочной реакции среды уменьшается растворимость фосфатов. Наслоение пленки фосфата на уратный камень делает практически бесперспективным процесс дальнейшего литолиза. Это диктует необходимость тщательного контроля за реакцией мочи на протяжении всего курса лечения. В современных условиях на смену эмпирическому применению растительного сырья, богатого лимонной кислотой и ее солями, пришли лекарственные средства, включающие в себя химически чистый цитрат и набор тест-полосок для мониторирования реакции мочи.
Исследования 1980–90-х гг. продемонстрировали эффективность литолиза уратных камней с применением цитратных смесей в режиме монотерапии порядка 75–80% [10, 11]. В настоящее время в результате совершенствования методики эффективность литолиза удалось повысить до 85–90% в зависимости от особенностей химического состава конкрементов [1, 12, 13].
В последние годы появились работы, свидетельствующие о целесообразности включения препаратов цитрата в многокомпонентные схемы терапии. В частности, при уратных камнях мочеточника, особенно его дистальной трети, комбинированная терапия, включающая цитрат и тамсулозин, привела к самостоятельному отхождению 84,8% конкрементов, что достоверно отличается от групп пациентов, получавших монотерапию этими препаратами (68,8% и 58,8% соответственно), а также от пациентов, получавших плацебо (26,1%) [14].
Имеются убедительные доказательства эффективности комбинации аллопуринола и цитрата при подагрическом интерстициальном нефрите. Двенадцатинедельный курс комбинированной терапии, включающей цитрат 3 г/сут и аллопуринол 100–200 мг/сут, привел к росту скорости клубочковой фильтрации в среднем на 15 мл/мин по сравнению с контрольной группой. Также существенно повысился и клиренс мочевой кислоты. Отметим низкую дозировку аллопуринола. Минимально эффективной считается 200 мг/сут, а 100 мг/сут — вообще субклиническая дозировка, тем не менее, она оказалась эффективной. Можно сделать предположение о возможном потенцировании эффектов аллопуринола и цитрата. Дополнительным позитивным следствием должно быть снижение частоты побочных действий аллопуринола, что является существенным лимитирующим фактором при медикаментозном лечении подагрической нефропатии. К сожалению, авторы не акцентировали на этом внимание [15].
Более яркий эффект цитрата в отношении функции почек отмечен при лечении хронического интерстициального нефрита, обусловленного гиперурикемией, у пациентов, страдающих ожирением [16].
Механизм действия цитрата не ограничивается защелачиванием мочи. Цитрат является одним из физиологических ингибиторов кристаллообразования. Так как моча в норме представляет собой пересыщенный солевой раствор, присутствие в ней ингибиторов кристаллообразования служит необходимым условием адекватного функционирования всей системы мочевыделения. Гипоцитратурия является одним из факторов, способствующих камнеобразованию. Этим может объясняться эффективность цитратных смесей не только при уратном, но и при кальций-оксалатном нефролитиазе [17–19].
Наряду с вышеописанными механизмами действия, соли лимонной кислоты дополнительно обладают антисептическим, цитопротективным и метаболическим эффектами, которые также могут находить применение в клинической практике. В частности, C. Strassner и A. Friesen сообщают об исчезновении кандидурии у 16 пациентов из 18 на фоне терапии цитратными смесями, что, вероятно, связано с изменением реакции мочи [20]. Заключение о цитопротективном эффекте цитрата сделано на основании успешных попыток P. Bruhl и соавт. предотвращать с его помощью химическую травму слизистой мочевого пузыря при терапии препаратами из группы оксазафосфоринов — циклофосфамидом и ифосфамидом [21] (в современной онкологической и нефрологической практике с этой целью применяется препарат из группы муколитиков — месна, практически не влияющий на кислотно-щелочное состояние). Кроме того, сообщается об использовании цитрата для коррекции ацидоза вследствие уретеросигмостомии [22].
Основная сложность при цитратной терапии уратного нефролитиаза заключается в подборе адекватной дозировки препарата. Н. К. Дзеранов, на протяжении многих лет изучавший и разрабатывавший этот аспект, рекомендует начинать с назначения диеты и оценки реакции мочи в течение 5 дней в строго определенное время суток. На основании полученных средних значений уровня рН мочи определяется начальная доза препарата и, главное, ее распределение в течение суток. Через 5 дней лечения снова определяются средние показатели реакции мочи в строго аналогичное время суток и, при необходимости, проводится коррекция дозировки препарата [23]. «Интерактивное», то есть в реальном времени, изменение дозировки цитрата неэффективно и даже небезопасно, так как приводит к скачкам уровня рН, что может вызвать кристаллизацию фосфата.
Ввиду того, что цитрат в норме присутствует в организме, лекарственные средства на его основе практически лишены токсичности. Тем не менее, существуют клинические ситуации, когда применение этих препаратов требует осмотрительности. Применение цитратных смесей нежелательно при острой мочекислой нефропатии и вообще при острой почечной недостаточности любой этиологии. Лимитирующим фактором здесь выступает не цитрат-ион, а калий, выведение которого в этой клинической ситуации затруднено. При острой мочекислой нефропатии целесообразно введение 4% раствора гидрокарбоната натрия, физиологического раствора и т. д. в сочетании с петлевыми диуретиками. Необходимо поддерживать диурез на уровне не менее 100–150 мл/час, рН мочи не ниже 6,5. При возможности назначаются ингибиторы ксантиоксидазы. Цитратные смеси целесообразны при восстановлении диуреза и достижении скорости клубочковой фильтрации 25–30 мл/мин, когда риск гиперкалиемии практически отсутствует [5, 6].
При тяжелой недостаточности кровообращения лимитирующим фактором является повышенное поступление в организм натрия, также содержащегося в цитратных смесях. Иногда в этой ситуации предпочтительнее оказывается ацетазоламид. Данный препарат из группы диуретиков — ингибиторов карбоангидразы сильно, а главное, неконтролируемо защелачивает мочу, что делает его неконкурентоспособным по сравнению с цитратом при медикаментозной терапии уратного нефролитиаза. Однако ацетазоламид — практически единственная возможность повысить уровень рН мочи, не прибегая к введению солей, что в условиях тяжелой сердечной недостаточности крайне нежелательно.
Таким образом, медикаментозное лечение пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов, несмотря на весьма ограниченный выбор лекарственных препаратов и кажущуюся простоту их выбора, представляет собой сложную и многогранную проблему, требующую междисциплинарного подхода.
Литература
ФГБУ НИИ урологии МЗ РФ, Москва