Оксид олова что это
Оксид олова(IV)
| Оксид олова(IV) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид олова |
| Традиционные названия | Окись олова |
| Химическая формула | SnO2 |
| Физические свойства | |
| Состояние (ст. усл.) | белые кристаллы |
| Молярная масса | 150,71 г/моль |
| Плотность | 6,95; 7,0096; 7,036 г/см³ |
| Термические свойства | |
| Температура плавления | 1127; 1625; 1630 °C |
| Температура кипения | 2500 °C |
| Молярная теплоёмкость (ст. усл.) | 53,2 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -577,63 кДж/моль |
| Классификация | |
| Рег. номер CAS | 18282-10-5 |
| Регистрационный номер EC | 242-159-0 |
| RTECS | XQ4000000 |
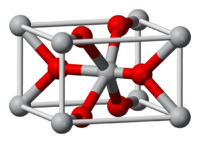
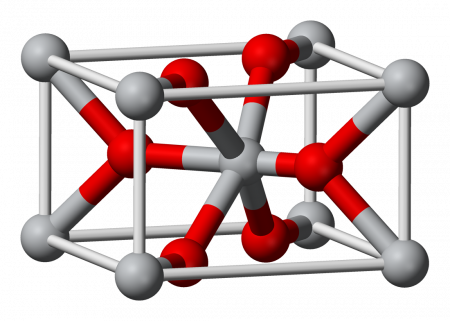
Оксид олова(IV) — бинарное неорганическое соединение, оксид металла олова с формулой SnO2, белые кристаллы, нерастворимые в воде.
Содержание
Получение
Физические свойства
Оксид олова(IV) из раствора выделяется в виде гидрата SnO2•n H2O (1 Химические свойства
Применение
Литература
Полезное
Смотреть что такое «Оксид олова(IV)» в других словарях:
Оксид олова(II) — Оксид олова(II) … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
Оксид церия(III) — У этого термина существуют и другие значения, см. Оксид церия. Оксид церия(III) … Википедия
олова(IV) оксид — alavo(IV) oksidas statusas T sritis chemija formulė SnO₂ atitikmenys: angl. stannic anhydride; tin dioxide; tin(IV) oxide rus. олова двуокись; олова диоксид; олова(IV) оксид ryšiai: sinonimas – alavo dioksidas … Chemijos terminų aiškinamasis žodynas
олова(II) оксид — alavo(II) oksidas statusas T sritis chemija formulė SnO atitikmenys: angl. stannous oxide; tin monoxide; tin protoxide; tin(II) oxide rus. олова закись; олова(II) оксид … Chemijos terminų aiškinamasis žodynas
олова двуокись — alavo(IV) oksidas statusas T sritis chemija formulė SnO₂ atitikmenys: angl. stannic anhydride; tin dioxide; tin(IV) oxide rus. олова двуокись; олова диоксид; олова(IV) оксид ryšiai: sinonimas – alavo dioksidas … Chemijos terminų aiškinamasis žodynas
олова диоксид — alavo(IV) oksidas statusas T sritis chemija formulė SnO₂ atitikmenys: angl. stannic anhydride; tin dioxide; tin(IV) oxide rus. олова двуокись; олова диоксид; олова(IV) оксид ryšiai: sinonimas – alavo dioksidas … Chemijos terminų aiškinamasis žodynas
олова закись — alavo(II) oksidas statusas T sritis chemija formulė SnO atitikmenys: angl. stannous oxide; tin monoxide; tin protoxide; tin(II) oxide rus. олова закись; олова(II) оксид … Chemijos terminų aiškinamasis žodynas
Фторид олова(II) — У этого термина существуют и другие значения, см. Фторид олова. Фторид олова(II) … Википедия
Хлорид олова(II) — У этого термина существуют и другие значения, см. Хлорид олова. Хлорид олова(II) (SnCl2) белый порошок. Плавится и кипит без разложения. При стоянии на воздухе постепенно гидролизуется влагой и окисляется O2. Хорошо растворяется в малом… … Википедия
Оксид олова(II)
| Оксид олова(II) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | оксид олова(II) |
| Традиционные названия | монооксид олова; олово окись(II); олово закись; олово одноокись |
| Химическая формула | SnO |
| Физические свойства | |
| Состояние (ст. усл.) | чёрный порошок |
| Молярная масса | 134.71 г/моль |
| Плотность | 6.45 г/см³ |
| Термические свойства | |
| Температура плавления | (при 80 кПа) 1080 °C °C |
| Температура кипения | 1425 °C |
| Температура вспышки | негорюч °C |
| Молярная теплоёмкость (ст. усл.) | 47,8 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -285,98 кДж/моль |
| Химические свойства | |
| Растворимость в воде | нерастворим |
| Структура | |
| Кристаллическая структура | тетрагональная |
| Классификация | |
| Рег. номер CAS | 21651-19-4 |
| RTECS | XQ3700000 |
| Безопасность | |
| Токсичность | при вдыхании вызывает кашель [1] |
Содержание
Физические свойства
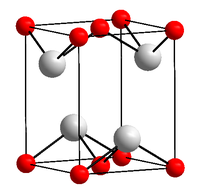
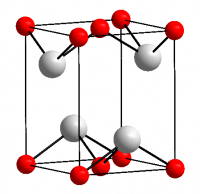
Темно-синее (почти чёрное) кристаллы, тетрагональная сингония, структура типа РbО (а = 0,3802 нм, с = 0,4837 нм, Z = 2, пространственная группа P42/nmm). При давлении выше 90 ГПа (900 тыс. атм) переходит в ромбическую модификацию (а = 0,382 нм, b = 0,361 нм, с = 0,430 нм, Z = 2, пространственная группа Рm2n).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Получение
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:
В лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
С помощью твёрдотельной реакции из хлорида олова(II):
Химические свойства
Оксид олова(II) устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
и концентрированных кислотах:
Растворяется в концентрированных щелочах:

Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.
Диспропорционирует при нагревании:
Окисляется кислородом воздуха:

Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта. [2] :

Sn и O могут образовывать соединения нестехиометрического состава.
Применение
Оксид олова(II) в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.
Оксид церия(III) с оксидом олова(II) используется в осветительных приборах как люминофор.
Примечания
Полезное
Смотреть что такое «Оксид олова(II)» в других словарях:
Оксид олова(IV) — Оксид олова(IV) … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
Оксид церия(III) — У этого термина существуют и другие значения, см. Оксид церия. Оксид церия(III) … Википедия
олова(IV) оксид — alavo(IV) oksidas statusas T sritis chemija formulė SnO₂ atitikmenys: angl. stannic anhydride; tin dioxide; tin(IV) oxide rus. олова двуокись; олова диоксид; олова(IV) оксид ryšiai: sinonimas – alavo dioksidas … Chemijos terminų aiškinamasis žodynas
олова(II) оксид — alavo(II) oksidas statusas T sritis chemija formulė SnO atitikmenys: angl. stannous oxide; tin monoxide; tin protoxide; tin(II) oxide rus. олова закись; олова(II) оксид … Chemijos terminų aiškinamasis žodynas
олова двуокись — alavo(IV) oksidas statusas T sritis chemija formulė SnO₂ atitikmenys: angl. stannic anhydride; tin dioxide; tin(IV) oxide rus. олова двуокись; олова диоксид; олова(IV) оксид ryšiai: sinonimas – alavo dioksidas … Chemijos terminų aiškinamasis žodynas
олова диоксид — alavo(IV) oksidas statusas T sritis chemija formulė SnO₂ atitikmenys: angl. stannic anhydride; tin dioxide; tin(IV) oxide rus. олова двуокись; олова диоксид; олова(IV) оксид ryšiai: sinonimas – alavo dioksidas … Chemijos terminų aiškinamasis žodynas
олова закись — alavo(II) oksidas statusas T sritis chemija formulė SnO atitikmenys: angl. stannous oxide; tin monoxide; tin protoxide; tin(II) oxide rus. олова закись; олова(II) оксид … Chemijos terminų aiškinamasis žodynas
Фторид олова(II) — У этого термина существуют и другие значения, см. Фторид олова. Фторид олова(II) … Википедия
Хлорид олова(II) — У этого термина существуют и другие значения, см. Хлорид олова. Хлорид олова(II) (SnCl2) белый порошок. Плавится и кипит без разложения. При стоянии на воздухе постепенно гидролизуется влагой и окисляется O2. Хорошо растворяется в малом… … Википедия
Оксид олова IV
| Оксид олова IV | |
|---|---|
 | |
| Систематическое наименование | Оксид олова IV |
| Традиционные названия | Окись олова, двуокись олова, диоксид олова, касситерит |
| Хим. формула | SnO2 |
| Рац. формула | SnO2 |
| Состояние | белые кристаллы |
| Молярная масса | 150,71 г/моль |
| Плотность | 7,0096 г/см 3 |
| Температура | |
| • плавления | 1630 °C |
| • кипения | 2500 (разл.) °C |
| • разложения | − |
| Мол. теплоёмк. | 53,2 Дж/(моль·К) |
| Энтальпия | |
| • образования | −577,63 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | нерастворим |
| Показатель преломления | 2,006 (D-линия натрия 589,29 нм ) |
| Кристаллическая структура | гексагональная типа рутила |
| Рег. номер CAS | 18282-10-5 |
| PubChem | 29011 |
| Рег. номер EINECS | 242-159-0 |
| SMILES | |
| RTECS | XQ4000000 |
| ChEBI | 52991 |
| ChemSpider | 26988 |
| ЛД50 | крысы, перорально 20 г/кг |
| Токсичность | низкая |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид олова IV (диоксид олова, двуокись олова) — бинарное неорганическое соединение, оксид металла олова с формулой SnO2. Белые кристаллы, нерастворимые в воде.
Содержание
Нахождение в природе
В природе встречается минерал касситерит — SnO2, основная руда олова, который в чистом виде бесцветен, однако примеси придают ему самые различные цвета.
Получение
Сжигание олова в воздухе или в кислороде при высокой температуре:
Окисление кислородом воздуха монооксида олова:
Диспропорционирование при нагревании монооксида олова:
2 SnO → 400oC SnO2 + Sn
Окисление олова горячей концентрированной азотной кислотой:
Разложение сульфата олова при нагревании:
или взаимодействием сульфата олова с разбавленной щёлочью:
Прокаливание на воздухе моносульфида олова:
Физические свойства
В воде практически нерастворим, р ПР = 57,32. Нерастворим также в этаноле и других не взаимодействующих с веществом растворителях.
Диоксид олова прозрачен в видимом свете, отражает инфракрасное излучение с длиной волны более 2000 нм.
Температура плавления 1630 °C. При высокой температуре испаряется с разложением на монооксид олова (и его ди-, три- и тетрамеры) и кислород.
Химические свойства
Гидратированная форма переходит в кристаллическую при нагревании:
Растворяется в концентрированных кислотах:
При нагревании растворяется в разбавленных кислотах:
Растворяется в растворах концентрированных щелочей:
При сплавлении с щелочами и карбонатами образует метастаннаты:
а с оксидами щелочных металлов образует ортостаннаты:
Применение
В сочетании с оксидами ванадия его используют в качестве катализатора для окисления ароматических соединений в синтезе карбоновых кислот и ангидридов кислот, катализатора реакций замещения и гидролиза.
В датчиках газообразных горючих газов.
Плёнки из диоксида олова, нанесённые на стекло или керамику применяются в датчиках горючих газов в воздухе — метана, пропана, оксида углерода и других горючих газов. Нагретый до температуры в несколько сотен градусов Цельсия материал в присутствии горючих газов обратимо частично восстанавливается с изменением стехиометрического соотношения в сторону обеднения кислородом, что приводит к снижению электрического сопротивления плёнки. Для применения в датчиках газа изучалось легирование диоксида олова различными соединениями, например, оксидом меди II.
В электронной промышленности
Основное применение соединения для создания прозрачных токопроводящих плёнок в различных приборах — жидкокристаллических дисплеях, фотогальванических элементах и в других приборах. Нанесение плёнки вещества производится из газовой фазы разложением летучих соединений олова, для повышения электропроводности соединение обычно легируют сурьмой и соединениями фтора.
Также применяется для создания прозрачных проводящих обогревательных противообледенительных плёнок на стеклянной поверхности окон транспортных средств.
Применяется в материалах контактов электрических коммутационных аппаратов, например, серебряных контактов электромагнитных реле — в материал вводят 2—14 % диоксида олова. Ранее для этой цели использовали весьма токсичный оксид кадмия.
Легирование кобальтом и марганцем дает материал, который можно использовать, например, в высоковольтных варисторах.
Легирование диоксида олова оксидами железа или марганца образует высокотемпературный ферромагнитный материал.
В стекольной и керамической промышленности в качестве белого пигмента
Диоксид олова плохо растворяется в расплавленной силикатной или боросиликатной стекломассе и имеет высокий показатель преломления относительно силикатного связующего, поэтому его микрочастицы в составе стёкол рассеивают свет, придавая стеклянной массе молочно-белый цвет и используется в производстве матовых стёкол, глазурованной керамической настенной плитке, сантехнических фаянсовых изделиях и др.
Покрытия на стекле
Тончайшие плёнки диоксида олова (
0,1 мкм) применяются в качестве адгезионного подслоя для нанесения на поверхность стеклянной посуды (в основном на бутылках, банках, сортовой посуде) полимерного покрытия, например, полиэтиленового. Нанесение таких тонких плёнок производится разложением на поверхности горячего стеклянного изделия летучих соединений олова, например, тетрахлорида олова или оловоорганических соединений, например, трихлорида бутилолова.
В качестве абразивного материала
Микрокристаллы соединения имеют высокую твёрдость и применяется в составе полировальных паст и суспензий для полировки изделий их металлов, стекла, керамики, природных камней.
Безопасность
Оксид олова II
| Оксид олова II | |
|---|---|
 | |
| Систематическое наименование | оксид оловаII |
| Традиционные названия | монооксид олова; олово окись II, олово закись, олово одноокись |
| Хим. формула | SnO |
| Состояние | чёрный порошок |
| Молярная масса | 134.71 г/моль |
| Плотность | 6.45 г/см³ |
| Температура | |
| • плавления | (при 80 кПа) 1080 °C |
| • кипения | 1425 °C |
| • разложения | 1976 ± 1 °F [1] |
| • вспышки | негорюч °C |
| Мол. теплоёмк. | 47,8 Дж/(моль·К) |
| Теплопроводность | 47,8 Вт/(м·K) |
| Энтальпия | |
| • образования | -285,98 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. [1] |
| Растворимость | |
| • в воде | нерастворим |
| Кристаллическая структура | тетрагональная |
| Рег. номер CAS | 21651-19-4 |
| PubChem | 88989 |
| Рег. номер EINECS | 244-499-5 |
| SMILES | |
| RTECS | XQ3700000 |
| ChemSpider | 80298 |
| Токсичность | при вдыхании вызывает кашель |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид олова II — неорганическое бинарное химическое соединение олова и кислорода, химическая формула SnO, черно-синие кристаллы (по другим данным коричневато-чёрные).
Содержание
Физические свойства
Темно-синие (почти чёрные) кристаллы, тетрагональная сингония, структура типа РbО (а = 0,3802 нм, с = 0,4837 нм, Z = 2, пространственная группа P42/nmm). При давлении выше 90 ГПа (900 тыс. атм) переходит в ромбическую модификацию (а = 0,382 нм, b = 0,361 нм, с = 0,430 нм, Z = 2, пространственная группа Рm2n).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Получение
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:
SnO2 + Sn → 1000oC 2 SnO
В лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
С помощью твёрдотельной реакции из хлорида олова II:
Химические свойства
Оксид олова II устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
и концентрированных кислотах:
Растворяется в концентрированных растворах щелочей и их расплавах:
SnO + NaOH + H2O ⇄ 20oC Na[Sn(OH)3] SnO + 2 NaOH → 400oC Na2SnO2 + H2O
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.
Диспропорционирует при нагревании:
2 SnO → 400oC SnO2 + Sn
Окисляется кислородом воздуха:
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта:
Sn и O могут образовывать соединения нестехиометрического состава.
Применение
Оксид олова II в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.
Оксид церия III с оксидом олова II используется в осветительных приборах как люминофор.









