Оксид кремния в чем растворяется
Оксид кремния (IV)
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) SiO2 – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Оксид кремния в чем растворяется
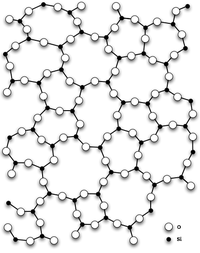
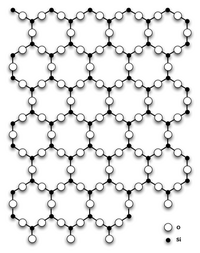
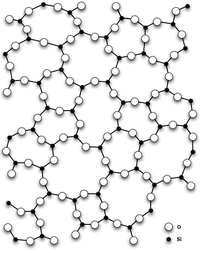
Диокси́д кре́мния (оксид кремния (IV), кремнезём, SiO2) — бесцветные кристаллы, tпл 1713—1728 °C, обладают высокой твёрдостью и прочностью.
Содержание
Свойства
Полиморфизм
Диоксид кремния имеет несколько полиморфных модификаций.
Самая распространенная из них на поверхности земли — α-кварц — кристаллизуется в тригональной сингонии
При нормальных условиях диоксид кремния чаще всего находится в полиморфной модификации α-кварца, которая при температуре выше 573 °C обратимо переходит в β-кварц. При дальнейшем повышении температуры кварц переходит в тридимит и кристобалит. Эти полиморфные модификации устойчивы при высоких температурах и низких давлениях. При высоких температуре и давлении диоксид кремния сначала превращается в коэсит, а затем в стишовит (который впервые был обнаружен на месте эпицентра ядерного взрыва). Согласно некоторым исследованиям стишовит слагает значительную часть мантии, так что вопрос о том какая разновидность SiO2 наиболее распространена на Земле, пока не имеет однозначного ответа.
Также имеет аморфную модификацию — кварцевое стекло.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с плавиковой кислотой:
Эти две реакции широко используют для травления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идет об одном и том же).
Например, может быть получен ортосиликат натрия:
или смешанный силикат кальция и натрия:
Из силиката Na2O·CaO·6SiO2 изготовляют оконное стекло.
Следует отметить, что большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют растворимым стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
Главным структурным элементом как твердого диоксида кремния, так и всех силикатов выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырех атомов кислорода О. При этом каждый атом кислорода соединен с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Получение
Синтетический диоксид кремния получают нагреванием кремния до температуры 400—500°C в атмосфере кислорода, при этом кремний окисляется до диоксида SiO2.
В лабораторный условиях синтетический диоксид кремния может быть получен действием кислот на силикатные соли. Например:
кремниевая кислота сразу разлагается на воду и SiO2, выпадающий в осадок.
Натуральный диоксид кремния в виде песка используется там, где не требуется высокая чистота материала.
Применение
Диоксид кремния применяют в производстве стекла, керамики, абразивов, бетонных изделий, для получения кремния, как наполнитель в производстве резин, при производстве кремнезёмистых огнеупоров, в хроматографии и др. Кристаллы кварца обладают пьезоэлектрическими свойствами и поэтому используются в радиотехнике, ультразвуковых установках, в зажигалках.
Диоксид кремния — главный компонент почти всех земных горных пород, в частности, кизельгура. Из кремнезёма и силикатов состоит 87% массы литосферы.
Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E551, препятствующего слёживанию и комкованию, парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство Фармакопей), а также пищевой добавки или лекарственного препарата в качестве энтеросорбента.
Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей. Используется чистый плавленый диоксид кремния с добавкой в него некоторых специальных ингредиентов.
Пористые кремнезёмы
Пористые кремнезёмы получают различными методами.
Силохром получают путём агрегирования аэросила, который, в свою очередь, получают сжиганием силана (SiH4). Силохром характеризуется высокой чистотой, низкой механической прочностью. Характерный размер удельной поверхности 60—120 м²/г. Применяется в качестве сорбента в хроматографии, наполнителя резин, катализе.
Силикагель получают путём высушивания геля кремневой кислоты. В сравнении с силохромом обладает меньшей чистотой, однако может обладать чрезвычайно развитой поверхностью: до 320 м²/г.
Кремниевый аэрогель приблизительно на 99,8 % состоит из воздуха может иметь плотность до 1,9 кг/м³ (всего в 1,5 раза больше плотности воздуха).
Кремний. Химия кремния и его соединений
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :
+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Качественные реакции
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Оксид кремния(IV)
Содержание
Свойства
Полиморфизм
Диоксид кремния имеет несколько полиморфных модификаций.
Самая распространенная из них на поверхности земли — α-кварц — кристаллизуется в тригональной сингонии
Также имеет аморфную модификацию — кварцевое стекло.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с газобразным фтороводородом:
Эти две реакции широко используют для травления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идет об одном и том же веществе).
Например, может быть получен ортосиликат натрия:
или смешанный силикат кальция и натрия:
Следует отметить, что большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют жидким стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
Главным структурным элементом как твердого диоксида кремния, так и всех силикатов, выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырёх атомов кислорода О. При этом каждый атом кислорода соединен с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Получение
Синтетический диоксид кремния получают нагреванием кремния до температуры 400—500 °C в атмосфере кислорода, при этом кремний окисляется до диоксида SiO2. А также термическим оксидированием при больших температурах.
В лабораторных условиях синтетический диоксид кремния может быть получен действием кислот, даже слабой уксусной, на растворимые силикаты. Например:
кремниевая кислота сразу распадается на воду и SiO2, выпадающий в осадок.
Натуральный диоксид кремния в виде песка используется там, где не требуется высокая чистота материала.
Применение
Диоксид кремния применяют в производстве стекла, керамики, абразивов, бетонных изделий, для получения кремния, как наполнитель в производстве резин, при производстве кремнезёмистых огнеупоров, в хроматографии и др. Кристаллы кварца обладают пьезоэлектрическими свойствами и поэтому используются в радиотехнике, ультразвуковых установках, в зажигалках.
Диоксид кремния — главный компонент почти всех земных горных пород, в частности, кизельгура. Из кремнезёма и силикатов состоит 87 % массы литосферы.
Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E551, препятствующего слёживанию и комкованию, парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство Фармакопей), а также пищевой добавки или лекарственного препарата в качестве энтеросорбента.
Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей. Используется чистый плавленый диоксид кремния с добавкой в него некоторых специальных ингредиентов.
Кремнезёмная нить также используется в нагревательных элементах электронных сигарет, так как хорошо впитывает жидкость и не разрушается под нагревом спирали.
Пористые кремнезёмы
Пористые кремнезёмы получают различными методами.
Силохром получают путём агрегирования аэросила, который, в свою очередь, получают сжиганием силана (SiH4). Силохром характеризуется высокой чистотой, низкой механической прочностью. Характерный размер удельной поверхности 60—120 м²/г. Применяется в качестве сорбента в хроматографии, наполнителя резин, катализе.
Силикагель получают путём высушивания геля кремневой кислоты. В сравнении с силохромом обладает меньшей чистотой, однако может обладать чрезвычайно развитой поверхностью: до 320 м²/г.
Кремниевый аэрогель приблизительно на 99,8 % состоит из воздуха может иметь плотность до 1,9 кг/м³ (всего в 1,5 раза больше плотности воздуха).