Объясните в чем заключается различие формулировки периодического закона
Разница между классической и современной формулировкой периодического закона Менделеева
Знаменитый русский ученый Дмитрий Иванович Менделеев еще в 19 веке сформулировал периодический закон, оказавший исключительно большое влияние на развитие физики, химии и науки в целом. Но с тех пор соответствующая концепция претерпела ряд изменений. В чем они заключаются?
Периодический закон Менделеева: первоначальная формулировка
В 1871 году Д. И. Менделеев предложил научному сообществу фундаментальную формулировку, по которой свойства простых тел, соединений элементов (равно как и их формы), как результат — и свойства тел, образуемых ими (простых и сложных), следует рассматривать как находящиеся в периодической зависимости от показателей их атомного веса.
Данная формулировка была опубликована в авторской статье Д. И. Менделеева «Периодическая законность химических элементов». Соответствующей публикации предшествовала большая работа ученого в области исследования физических и химических процессов. В 1869 году в российском научном сообществе появилась новость об открытии Д. И. Менделеевым Периодического закона химических элементов. Вскоре был издан учебник, в котором была обнародована одна из первых версий знаменитой Таблицы Менделеева.
С термином «периодический закон» Д. И. Менделеев первые ознакомил широкую публику в 1870 году, в одной из своих научных статей. В данном материале ученый указал на тот факт, что существуют еще не открытые химические элементы. Менделеев обосновывал это тем, что свойства каждого отдельного химического элемента промежуточны между характеристиками тех, что соседствуют с ним по периодической таблице. Причем как в группе, так и в периоде. То есть свойства элемента промежуточны между характеристиками элементов, располагающихся выше и ниже по таблице относительно него, а также находящихся правее и левее.
Таблица Менделеева стала уникальным результатом научных трудов. Кроме того, принципиальная новизна концепции Менделеева заключалась в том, что он, во-первых, разъяснил закономерности в соотношениях величин атомных масс химических элементов, а во-вторых, предложил сообществу исследователей рассматривать данные закономерности в качестве закона природы.
В течение нескольких лет после обнародования периодического закона Менделеева химические элементы, не известные на момент публикации соответствующей концепции, но предсказанные ученым, были открыты. В 1875 году был открыт галлий. В 1879-м — скандий, в 1886-м — германий. Периодический закон Менделеева стал неоспоримой теоретической основой химии.
Современная формулировка периодического закона
По мере развития химии и физики концепция Д. И. Менделеева развивалась. Так, в конце 19 — начале 20 века ученые смогли объяснить физический смысл того или иного атомного номера химического элемента. Позже исследователи разработали модель изменений электронной структуры атомов в корреляции с ростом зарядов ядер соответствующих атомов.
Сейчас формулировка периодического закона — с учетом вышеобозначенных и других открытий ученых — несколько отличается от предложенной Д. И. Менделеевым. В соответствии с ней свойства элементов, а также образуемых ими веществ (равно как и их формы) характеризуются периодической зависимостью от зарядов ядер атомов соответствующих элементов.
Сравнение
Главное отличие классической формулировки периодического закона Менделеева от современной заключается в том, что первоначальная трактовка соответствующего научного закона предполагает зависимость свойств элементов и образуемых ими соединений от показателей их атомного веса. Современная трактовка также предполагает наличие подобной зависимости — но предопределяемой зарядом ядер атомов химических элементов. Так или иначе, ко второй формулировке ученые пришли, в течение долгого времени развивая первую путем кропотливого труда.
Определив, в чем разница между классической и современной формулировкой периодического закона Менделеева, отразим выводы в таблице.
Современная формулировка периодического закона Д. И. Менделеева
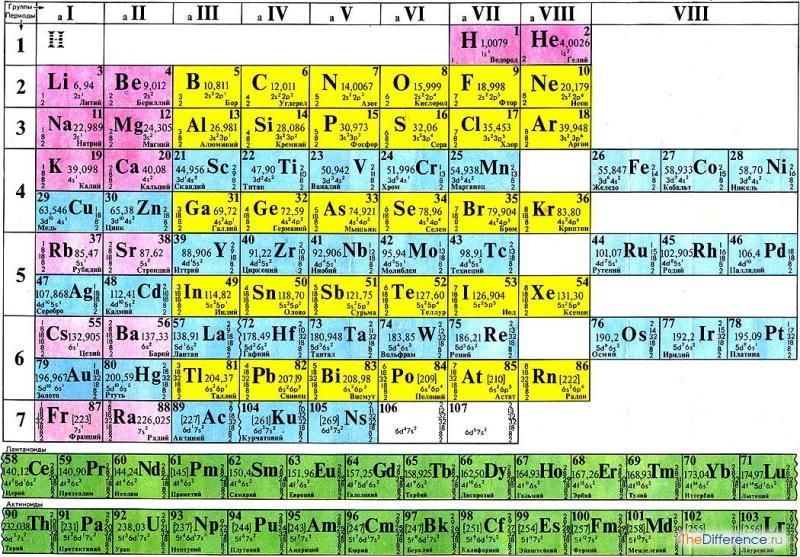
Химические элементы, которых на данный момент насчитывается 118, подчиняются периодическому закону, сформулированному Дмитрием Ивановичем Менделеевым во второй половине XIX века.
Периодический закон Менделеева — в чём суть
Химические элементы, существующие в нашем мире, созданные самой природой или человеком, подчиняются правилу — Периодическому закону, который является основой химической науки.
Периодический закон — закон, который заключается в сопоставлении свойств химических элементов и их атомных масс (в современной формулировке — зарядов ядер).
После открытия в 1869 году Д. И. Менделеевым Периодического закона химических элементов данная наука перестала быть исключительно описательной. Стало возможным научное предвидение.
Суть закона Менделеева заключается в том, что свойства химических элементов, расположенных в таблице, а также свойства образуемых ими соединений находятся в периодической зависимости от зарядов ядер их атомов.
Периодический закон Менделеева был выражен в форме периодической системы элементов.
Периодическая система химических элементов — упорядоченное расположение в таблице химических элементов и их естественная классификация.
Периодическая система химических элементов Д. И. Менделеева состоит из 7 периодов — они представляют собой элементы, расположенные по горизонтали в порядке возрастания атомного номера (заряда ядра), и восьми групп (столбцов).
Периоды делятся на:
Каждый, кроме первого, период начинается со щелочного металла, а заканчивается благородным газом. Слева направо в каждом периоде ослабевают металлические и усиливаются неметаллические свойства, что связано с возрастанием числа электронов на внешнем уровне каждого химического элемента и увеличением прочности их связи с атомом.
Группы делятся на подгруппы:
Сверху вниз в главных подгруппах усиливаются металлические и слабевают неметаллические свойства.
В главных подгруппах вместе с усилением металлических свойств увеличивается устойчивость соединений элементов в низких степенях окисления. В побочных подгруппах с ослабеванием металлических свойств увеличивается устойчивость соединений с высокими степенями окисления.
История открытия, какое имело значение
Первооткрывателем периодического закона является Д. И. Менделеев. Днем, когда был открыт периодический закон, считается 1 марта (17 февраля) 1869 г., когда ученый закончил работу над основным трудом, описавшим данный закон — «Опыт системы элементов, основанной на их атомном весе и химическом свойстве». Тогда с ним за звание первооткрывателя боролся Юлиус Лотар Мейер, который также создал свою систему химических элементов.
Существует легенда о том, что Дмитрий Иванович Менделеев увидел Периодическую систему химических элементов во сне. Однако сам ученый ответил так:
«Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
За основу своей классификации Д. И. Менделеев взял два свойства — химическое сходство элементов и их атомную массу. Ученый расписал на карточках основные свойства каждого элемента, после чего начал многократно переставлять их, чтобы найти закономерность.
Менделеев утверждал, что с ростом атомной массы элементов их свойства меняются, но не монотонно, как считали исследователи до него, а периодически. Свойства начинают повторяться после определенного количества элементов, однако они делают это не точь-в-точь, а с определенными изменениями.
Вторая версия Периодической системы появилась в 1870 году в статье «Естественная система элементов» в «Основах химии». Эта система больше похожа на современную: горизонтальных столбцов стало восемь, периоды остались в изначальном количестве, а каждый период был разбит на 2 ряда — для элементов основной и побочной подгрупп.
Для соблюдения периодичности химических элементов Д. И. Менделеев переписал атомные массы некоторых элементов, расставив их вопреки общим представлениям, а также оставил пустые клетки для неоткрытых элементов.
Первое определение химического закона звучало следующим образом:
Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, состоят в периодической зависимости от их атомного веса.
С помощью составленной периодической системы Д. И. Менделеев смог предсказать открытие новых элементов, а также целый ряд их химических и физических свойств. Подтверждение правильности систематизации появилось уже в 70-80-х годах XIX века, когда были открыт галлий, скандий и германий, которые точно встали в установленные Менделеевым места в Периодической таблице.
Формулирование Периодического закона имело большое значение для развития химии. С открытием Периодической системы химических элементов Д. И. Менделеева мир химической науки перестал быть исключительно описательным, но получил возможность прогнозирования будущих результатов.
Попытки систематизации до него
В середине XIX века научный мир знал о существовании 63 химических элементов. Исследователи предпринимали постоянные попытки систематизирования этих элементов для возможности дальнейшего прогнозирования в химической науке. Это было необходимо для преодоления определенного кризиса — невозможности открывать новые элементы и неимения твердой научной почвы для проведения опытов.
Первым установленную попытку систематизирования химических элементов предпринял Александр Эмиль Шанкуртуа — французский химик, который в 1862 году создал свою систему химических элементов, основанную на закономерности их атомных масс.
Он разместил элементы вдоль винтовой линии — «земной спирали» — которая обращала внимание на циклическую повторяемость свойств элементов.
Данная модель не привлекла внимания общественности, но стала существенным шагом к открытию Периодической системы. Александр Эмиль Шанкуртуа первым обратил внимание на закономерности между атомными массами химических элементов, но не учитывал многих других свойств. Поэтому претензии Шанкуртуа на приоритет в открытии Периодической системы, которые появились у химика после открытия Менделеева, нельзя считать обоснованными.
Джон Александр Ньюлендс в 1866 году предложил свой вариант Периодического закона, который назвал «законом октав». Модель закона напоминала менделеевскую, но при этом в формулировке существовали настойчивые попытки Ньюлендса найти взаимосвязь между химическими элементами и музыкальной гармонией.
По мнению Джона Александра Ньюлендса следовало размещать элементы по порядку возрастания атомных масс, при этом каждый восьмой элемент, как и каждая восьмая нота, должен был стать началом новой строчки. Элементы с одинаковым атомным весом, которые были установлены в то время, располагались под одним номером.
Главной ошибкой ученого был факт того, что некоторые элементы еще не были открыты. Из-за этого система рушилась.
Наиболее близкой к менделеевской системе был вариант Юлиуса Лотара Мейера, который был опубликован в 1864 году. За основу классификации химических элементов ученый взял валентность элементов. В то время еще не было установлено, что валентность не является постоянной для отдельно взятого элемента, из-за чего система не могла быть достоверно точной.
В 1869 году Мейер изменил свою таблицу на сходную с системой Менделеева, из-за чего в западной литературе считается одним из первооткрывателей Периодического закона, либо же ученым, открывшим его независимо от Менделеева.
Современная формулировка
В начале XX века в связи с проводимыми опытами по изучению строения атома было выявлено, что заряд ядра, а не атомная масса, влияет на периодичность изменений свойств элементов. Заряд ядра также влияет на атомный номер и число электронов, распределённых по электронным оболочкам химического элемента.
Современная формулировка в связи с этим отличается от первоначальной:
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений, находятся в периодической зависимости от величин зарядов ядер их атомов.
В современной химии главным вопросом остается проблема верхней границы Периодической системы химических элементов Д. И. Менделеева. Последним элементом в таблице на данный момент является элемент номер 118, синтезированный в Дубне в 2002 и 2005 годах, и получивший название Оганесон в 2016 году.
Развитие периодического закона Д. И. Менделеева
В 1869 году, когда был сформулирован Периодический закон, научный мир знал только о 63 элементах. На 2021 год известно 118 элементов, продолжаются попытки получения новых.
Формулировка Периодического закона означала лишь начало развития химии и знаний о периодичности свойств химических элементов. Несмотря на то, что изначально предсказания Менделеева были встречены со скепсисом, в итоге они стали основой для целого ряда химических открытий.
В развитии периодического закона принято выделять 2 периода:
Химический этап связан с открытием элементов Периодической системы, которые предсказал Менделеев:
Данное преобразование завершило химический этап развития Периодической системы.
Физический этап развития Периодического закона был начат в связи с тем, что химия не могла в полной мере объяснить причину периодичности свойств химических элементов. Физический этап развития Периодического закона привел к изменениям в естествознании, которые оказали на науку революционное влияние.
Дальнейшее изменение Периодической системы было связано с открытиями физики.
Физический этап можно условно разделить на периоды:
В связи с открытиями физики таблица начала менять свой изначальный облик.
Как изменяются свойства элементов в Периодической таблице
Свойства химических элементов в Периодической таблице зависят от положения каждого элемента в ряду (периоде) и столбце (группе).
Главной характеристикой химического элемента является заряд ядра его атомов.
Главными свойствами химических элементов, являются:
Слева направо в периоде происходит:
Сверху вниз в группе в главной подгруппе происходит:
Почему периодический закон Менделеева получил такое название? (3 фото)
Иногда привычные научные явления неожиданно вызывают вопросы. Особенно если взглянуть на них под иным углом. К примеру, всем хорошо известный периодический закон Менделеева – почему периодический, и какое отношение к нему имеют периоды?
Дмитрий Иванович Менделеев сформулировал закон, ставший фундаментальным, в 1869 году. В формулировке автора он выглядит следующим образом: «Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы». Изменение характеристик элементов ученый объяснил их атомной массой. Осознание периодичности изменения различных свойств создало условия для выявления и описания характеристик веществ, которые образовывали еще не открытые до этого химические элементы. Немаловажной возможностью стало и предсказание расположения природных залежей руды и даже глубины ее залегания.
Более поздние научные разработки показали, что свойства атомов и формируемых ими соединений определяются их электронным строением. А оно, в свою очередь, свойствами атомного ядра и, в частности, его заряда.
В связи с этим современная интерпретация закона выглядит следующим образом: «Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов». Из закона следует изменение характеристик элементов в конкретных совокупностях и их повторение по периодам, то есть через некое определенное количество элементов. Таким совокупностям ученый и дал название периодов.
Периодический закон Д.И. Менделеева и периодичность свойств атомов. Конспект
Оглавление
1. Современная формулировка периодического закона и структура периодической системы Д.И.Менделеева
В 1869 г. Д.И. Менделееву удалось сформулировать периодический закон – важнейший закон природы:
свойства химических элементов, а, следовательно, и свойства образуемых ими простых и сложных веществ состоят в периодической зависимости от их атомного веса.
Согласно этой формулировке наблюдалось несоответствие положения некоторых элементов в периодической системе Менделеева:
В начале 20 века закон Менделеева и его система были обоснованы на квантово-механическом уровне. Существо этого закона было полностью сохранено, а в качестве фундаментальной константы атома стал использоваться
заряд ядра атома
(соответствующий порядковому номеру элемента),
что позволило устранить наблюдавшиеся несоответствия.
Исходя из структуры электронной оболочки атомов число элементов
в III периоде – должно было бы быть 18;
в IV периоде – должно было бы быть 32;
в V периоде – должно было бы быть 50.
Это обусловлено тем, что заполнение d-состояний электронами запаздывает на один период, а заполнение f-состояний – на два периода.
Отличие реальной системы от теоретически возможной заключается в том, что в первой не учитывалось электрон-электронное взаимодействие. Теоретический учет этого взаимодействия – чрезвычайно сложная задача. На качественном уровне приходится учитывать три эффекта –
эффект экранирования электронами ядра атома,
эффект проникновения электронов к ядру,
взаимное отталкивание электронов, принадлежащих одному и тому же энергетическому слою
Эффект экранирования ядра связан с тем, что внутренние электроны атома частично заслоняют ядро, в результате чего уменьшается его воздействие на внешний электрон. Эффект экранирования учитывается некоторой постоянной Sэкр, называемой константой экранирования. Заряд ядра с учетом экранирования называется эффективным зарядом и определяется соотношением Zэфф. = Z – Sэкр. Экранирование внешнего электрона возрастает с увеличением общего числа электронов в атоме.
Эффект проникновения электронов к ядру обусловлен тем, что электрон, согласно положениям квантовой механики, может находиться в любой точке атома. Это означает, что внешний электрон часть времени находится вблизи ядра, проникая через слои внутренних электронов, и не испытывает при этом их экранирующего действия.
Распределение электронной плотности относительно ядра изображают кривой распределения вероятности нахождения электрона в шаровом слое радиуса r толщиной dr, объем которого dV = 4pr 2 dr.
Для одного и того же энергетического слоя наибольшую проникающую способность проявляют s-электроны, меньшую – p-электроны, еще меньшую – d-электроны (рис.1). Число максимумов на кривой определяется числом n. Для 3s-электрона Nmax = n, для р-электрона Nmax = (n – 1), для d-электрона Nmax = (n – 2). Эффект проникновения увеличивает прочность связи электрона с ядром.
Взаимное отталкивание электронов, принадлежащих одному и тому же энергетическому слою, оказывает большое влияние на прочность связи электрона с ядром. Это отталкивание особенно сильно проявляется между двумя электронами с противоположными спинами, находящимися на одной орбитали.
Эти эффекты приводят к изменению эффективного заряда ядра атома, что позволяет объяснить реальную структуру электронной оболочки атома.
В настоящее время система Д.И. Менделеева представляет собой предельно краткую и четкую физико-химическую энциклопедию. В современной формулировке периодический закон Д.И.Менделеева звучит следующим образом: свойства элементов, а также свойства и формы образуемых ими соединений находятся в периодической зависимости от заряда ядра атомов элементов.
На основе периодического закона разработаны графические системы Д.И. Менделеева. В настоящее время их насчитывается более 3 тысяч.
Наиболее распространены два варианта таблицы – короткопериодный и длиннопериодный.
Периоды – горизонтальные ряды, объединяющие элементы с одинаковым значением главного квантового числа n. Номер периода соответствует числу заполненных электронами энергетических уровней атома каждого конкретного элемента.
Группы – вертикальные ряды, объединяющие элементы с одинаковым числом валентных электронов.
Современная периодическая таблица состоит из 7 периодов: первый содержит всего два элемента, второй и третий – по 8 элементов (малые периоды), четвертый и пятый – по 18 элементов, шестой – 32 элемента, седьмой период не завершен, но должен содержать также 32 элемента (большие периоды).
Каждый период начинается с двух s-элементов, в атомах которых впервые появляется электрон со значением n, соответствующим номеру заполняемого периода, и заканчивается шестью p-элементами. В больших периодах между s- и р-элементами размещается по десять d- элементов. Все f-элементы условно помещаются в ячейки лантана (лантаноиды) и актиния (актиноиды), а их символы обычно выносятся за пределы периодической таблицы в виде рядов.
2. Радиус атома и энергия ионизации
Периодичностью называется повторяемость химических и физических свойств атомов химических элементов, их простых веществ и сложных соединений при изменении порядкового номера элемента в периодической таблице Д.И.Менделеева. Основная причина периодичности свойств элементов связана с электронным строением их атомов.
Рассмотрим 2 вида периодичности (горизонтальную и вертикальную) на примере таких свойств атомов как орбитальный радиус и его энергия ионизации.
Горизонтальная периодичность проявляется в появлении максимальных и минимальных значений для различных свойств элементов и их соединений в пределах каждого периода. Связана горизонтальная периодичность с изменением числа электронов на внешних энергетических уровнях атома с ростом заряда атомного ядра при движении от начала периода к его концу.
Вертикальная периодичность – вид периодичности, по которому элементы объединяют в группы: элементы одной группы имеют одинаковые конфигурации валентных электронов. Вертикальная периодичность заключается в повторяемости свойств атомов и их соединений и закономерном их изменении при увеличении заряда ядра в пределах каждой группы элементов.
Размеры атомов обычно оценивают по величине их радиуса. Однако вследствие волнового характера движения электрона радиус атома невозможно точно определить. Поэтому за радиус принимают различные условно выбранные величины. Различают орбитальный, атомный (ковалентный, металлический), ван-дер-ваальсов, ионный радиусы.
За орбитальный радиус (rорб) свободного атома принимают расстояние от центра атома до максимума, соответствующего внешнему электронному облаку, на теоретически рассчитанной кривой распределения вероятности нахождения электрона в атоме от расстояния r (см. рис. 1, табл. 1).
Рис.1. График зависимости величины 4πr 2 R 2 (r) от расстояния r для 1s-орбитали
На практике химиков больше интересуют радиусы атомов, связанных между собой. При рассмотрении простых веществ и органических соединений обычно пользуются понятием об атомном радиусе. Атомные радиусы (табл. 1) подразделяют на радиусы атомов металлов (металлический радиус), радиусы атомов неметаллов (ковалентные радиусы) и радиусы атомов благородных газов.
Под металлическим радиусом (rме) понимают половину расстояния между ближайшими соседними атомами металла в кристаллической решетке.
Радиусы атомов благородных газов (rблаг.г) рассчитаны из межатомных расстояний в кристаллах этих веществ, которые существуют при низких температурах.
Рис. 2. Ковалентные и ван-дер-ваальсовы радиусы молекулы Cl2 в кристалле
Часто для оценки размеров групп атомов или выяснения того, как могут взаимодействовать отдельные части молекулы, бывает интересно знать размер атома в том направлении, в котором он не образует химической связи. Половина расстояния между несвязанными атомами называется ван-дер-ваальсовым радиусом (rВ). Другими словами, ковалентный радиус – это радиус атома в направлении химической связи, а ван-дер-ваальсов радиус – радиус атома в любом другом направлении. Из рис. 2 видно, что ван-дер-ваальсов радиус находят по расстоянию между двумя ядрами хлора в соседних молекулах, и величина его всегда больше, чем ковалентный радиус атома (табл. 1).
В неорганической химии чаще всего оперируют понятием ионного радиуса. Ионный радиус (rион) характеризует размер иона. Ионные радиусы оценивают различными способами из экспериментальных данных. Для положительно заряженного иона (катиона) ионный радиус всегда меньше, чем ковалентный, для отрицательно заряженного иона (аниона) – больше, чем ковалентный радиус (табл. 1). Ионные радиусы одного и того же элемента изменяются в зависимости от координационного числа (к.ч.) иона и степени его окисления.
Таблица 1. Значения радиусов (в пм) для атомов и ионов I – III периодов
(1пм = 10 -9 см =10 3 нм).
Способность атомов отдавать электроны характеризует величина, называемая энергией ионизации. Энергия ионизации Eи (energy of ionization) – это количество энергии, необходимое для отрыва электрона от невозбужденного атома в газообразном состоянии.
Элемент
Для d-элементов радиус увеличивается при переходе от IV к V периоду и уменьшается при переходе от V к VI периоду. Аналогичные тенденции наблюдаются и в изменении ван-дер-ваальсовых, атомных и ионных (при одинаковом заряде) радиусов. Уменьшение радиусов d-элементов при переходе от V к VI периоду обусловлено тем, что увеличение числа электронных слоев в них компенсируется f-сжатием, связанным с заполнением электронами 4f-подслоя у f-элементов VI периода. Отмеченным закономерностям не подчиняются d-элементы 3-й и 11-й групп. Для них типичны закономерности, наблюдаемые для s- и р-элементов.
Для d-элементов значения Eи1 в группе в общем увеличиваются. Это можно объяснить эффектом проникновения электронов к ядру.
3. Сродство атома к электрону
Сродство атомов к электрону определено для многих элементов. Положительное значение Есрод1 означает поглощение энергии при присоединении электрона (эндотермический процесс) – невыгодно, отрицательное значение Есрод1 – экзотермический процесс – выделение энергии при присоединении электрона (выгодно).
4. Электроотрицательность
Электроотрицательность (ЭО) характеризует способность атома притягивать к себе электроны при образовании химической связи. Электроотрицательность не является физическим свойством, которое можно измерить. Величину электроотрицательности вычисляют, используя различные свойства веществ (энергию ионизации, сродство атома к электрону, межъядерные расстояния, энергии связи электрона с ядром и др.).
Шкала электроотрицательности по Малликену. Р.Малликеном (США) был предложен способ вычисления ЭО как среднего арифметического первой энергии ионизации атома Eи и его сродства к электрону Eсрод.:

Из уравнения следует, что атомы с большими значениями Eи и Eсрод. сильнее притягивают к себе электроны, обобществляемые при образовании связи. Так, атомы металлов имеют низкие значения электроотрицательности, так как для них характерны небольшие значения энергии ионизации и сродства к электрону. Атомы неметаллов, наоборот, характеризуются высокой электроотрицательностью вследствие того, что имеют существенно большие значения Eи и Eсрод.. Недостаток этого подхода связан с тем, что сродство к электрону установлено не для всех элементов, поэтому электроотрицательность по Малликену определена также не для всех элементов.
Шкала электроотрицательности по Полингу. Допустим, что связь в молекуле АВ – ковалентная, тогда энергию связи ЕАВ в молекуле АВ можно представить как среднее между энергиями связи в молекулах А2 и В2, обозначенных соответственно ЕА-А и ЕВ-В. Однако найденная из опыта энергия связи ЕАВ обычно оказывается больше, то есть:

Причина этого заключается в некоторой поляризации связи А-В, т.е. по значению величины Δ можно судить о степени полярности ковалентной связи и, следовательно, о способности атомов притягивать к себе электроны. Л. Полинг предположил, что величина Δ зависит от разности электроотрицательностей 

В группах р-элементов устойчивость высшей степени окисления уменьшается, но уменьшается немонотонно. Это связано с тем, что энергетическое различие между валентными s- и р-орбиталями в группах также изменяется немонотонно, то есть наблюдается четко выраженная вторичная периодичность. ΔЕsp для элементов 3-го и 5-го периодов ниже, чем для элементов 4-го периода (Ge, As, Se, Br). Поэтому устойчивость соединений в высшей степени окисления у элементов 3-го и 5-го периодов обычно выше, чем для аналогичных соединений 4р-элементов. Например, устойчивость галогенидов элементов 4-го периода мышьяка (AsСl5) и cелена (SeF6) в их высшей степени окисления меньше, чем устойчивость подобных галогенидов элементов 3-го (PCl5, SF6) и 5-го (SbCl5, TeF6) периодов. Для атомов р-элементов 6-го периода, имеющих большие различия между валентными s- и р-орбиталями, высшая степень окисления неустойчива.