О чем свидетельствует присутствие в клетке большого количества адф
О чем свидетельствует присутствие в клетке большого количества адф
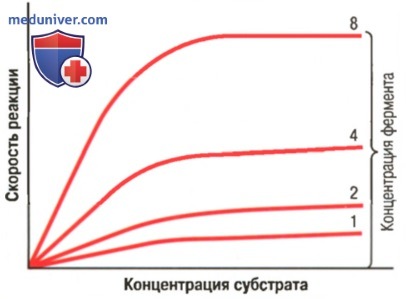
а) Концентрация АДФ в качестве фактора, контролирующего скорость высвобождения энергии. В условиях покоя концентрация АДФ в клетках чрезвычайно низка, поэтому химические реакции, которые зависят от АДФ как одного из субстратов, осуществляются чрезвычайно медленно. Они включают все окислительные метаболические пути, высвобождающие энергию из питательных веществ, наряду с прочими основными путями высвобождения энергии в организме. Таким образом, АДФ является главным лимитирующим скорость фактором практически всех путей обмена энергии в организме.
Когда клетки активируются независимо от вида их активности, АТФ превращается в АДФ, увеличивая его концентрацию пропорционально степени активности клетки. Повышение концентрации АДФ автоматически увеличивает скорость всех метаболических реакций, направленных на высвобождение энергии из питательных веществ. Таким простым способом контролируется высвобождение энергии в соответствии с активностью клетки. Снижение активности клетки приостанавливает высвобождение энергии вследствие очень быстрого превращения АДФ в АТФ.
б) Интенсивность метаболизма. Под метаболизмом понимают совокупность всех химических реакций, которые осуществляются во всех клетках организма. Оценка интенсивности метаболизма возможна по скорости высвобождения тепла в ходе химических реакций.
в) Почти все виды энергии, высвобождающейся в организме, преобразуются в тепло. При обсуждении многих метаболических реакций в предшествующих главах мы обращали внимание, что не вся энергия, заключенная в питательных веществах, запасается в АТФ. Большое количество энергии преобразуется в тепло. В среднем около 35% энергии, содержащейся в питательных веществах, преобразуется в тепло в процессе образования АТФ.
Еще большее количество энергии преобразуется в тепло при передаче энергии от АТФ функциональным системам клеток, поэтому даже при оптимальных условиях не более 27% энергии, содержащейся в питательных веществах, используются функциональными системами.
Даже если 27% энергии питательных веществ передаются функциональным системам клетки, большая часть этой энергии в результате рассеивается в виде тепла. Например, во время синтеза белка большое количество АТФ используется для формирования пептидных связей, в энергию которых преобразуется энергия АТФ. Существует постоянный кругооборот белков в организме. Часть белков распадается, в то время как другие пребывают на стадии синтеза. Если белки расщепляются, энергия, запасенная в пептидных связях, рассеивается в организме в виде тепла.
Еще одним примером использования энергии может быть мышечная работа. Много энергии расходуется на преодоление вязкого сопротивления мышц и других тканей во время движения конечностей. Вязкое сопротивление тканей порождает трение, которое порождает тепло.
Значительное количество энергии расходует сердце при перекачивании крови. Кровь растягивает стенки артерий, и растяжение артерий представляет запас потенциальной энергии. Кровоток по периферическим сосудам сопровождается трением частиц крови друг о друга и трением их о стенки сосудов, преобразующим запасенную потенциальную энергию в тепловую.
В итоге вся расходуемая организмом энергия преобразуется в тепло. Единственным существенным исключением является энергия, используемая мышцами для выполнения внешней работы.
Примерами могут быть подъем мышцами груза на некую высоту или перемещение тела во время ходьбы, когда создается потенциальная энергия для перемещения массы против сил гравитации. При отсутствии такой внешней работы вся энергия, выделяемая во время метаболических реакций, преобразуется в тепло.
г) Калория. Говоря о способах оценки метаболизма, необходимо использовать какие-либо единицы измерения для выражения количества энергии, высвобождающейся из питательных веществ или расходуемой для осуществления обменных процессов. Чаще всего с этой целью используют такую единицу измерения, как калория. Необходимо напомнить, что калория, обозначаемая строчной буквой «к» и часто называемая 1 грамм-калорией, представляет собой количество тепла, необходимое для нагревания 1 г воды на 1°С.
Количественно калория — слишком мелкая единица измерения энергетических процессов в организме, поэтому была введена единица измерения 1 Ккал, изображаемая с прописной буквы «К» и называемая килокалорией (1 Ккал = 1000 калорий). Именно эту единицу обычно используют для количественной оценки обмена энергии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Общая биология
Сущность и причины возникновения наследственной изменчивости. Роль концентрации соединения аденина, рибоза и двух фосфатных групп в суточной дозе кислорода. Риск возникновения болезней сердечнососудистой системы под влиянием токсических веществ.
| Рубрика | Биология и естествознание |
| Вид | контрольная работа |
| Язык | русский |
| Дата добавления | 16.10.2010 |
| Размер файла | 19,2 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Содержание
1. Что такое наследственная изменчивость и каковы причины ее возникновения
Все многообразие живого и его постоянное совершенство было бы невозможно без изменчивости. По механизмам возникновения и характеру изменений признаков различают два типа изменчивости: наследственную и ненаследственную. При наследственной изменчивости наследуются сами признаки.
Наследственную изменчивость принято делить на комбинативную и мутационную.
В основе комбинативной изменчивости лежит половое размножение организмов, вследствие которого возникает огромное разнообразие генотипов. Практически неограниченными источниками комбинативной изменчивости служат три процесса:
1. реципрокный обмен генами между хроматидами гомологичных хромосом, или кроссинговер. Он создает новые: группы сцепления, т. е. служит важным источником генетической рекомбинации аллелей;
2. независимое расхождение гомологичных хромосом в первом мейотическом делении. Именно независимое комбинирование хромосом при мейозе является основой третьего закона Менделя;
3. случайное сочетание гамет при оплодотворении.
Комбинативная изменчивость является важнейшим источником всего колоссального наследственного разнообразия, характерного для живых организмов. Однако перечисленные выше источники изменчивости не порождают крупных изменений в генотипе, которые необходимы, согласно эволюционной теории, для возникновения новых видов. Такие изменения возникают в результате мутаций.
Основные положения мутационной теории сводятся к следующему:
— мутации возникают внезапно как дискретные изменения признаков;
— новые формы устойчивы;
— в отличие от ненаследственных изменений мутации не образуют непрерывных рядов. Они представляют собой качественные изменения;
— мутации проявляются по-разному и могут быть как полезными, так и вредными;
— вероятность обнаружения мутаций зависит от числа исследованных особей;
— сходные мутации могут возникать повторно;
— мутации ненаправленны (спонтанны), т. е. мутировать может любой участок хромосомы, вызывая изменения как незначительных, так и жизненно важных признаков.
2. О чем свидетельствует присутствие в клетке большого количества АДФ
Образующийся АТФ расщепляется затем каким-либо ферментом, производящим тот или иной вид полезной работы (например, сократительным белком мышц актомиозином):
(2) АТФ > АДФ + H3PO4 + работа.
В состоянии покоя реакция (2) замедляется, концентрации АДФ и фосфата падают и, как следствие, тормозится потребление О2 в реакции (1). Чтобы предотвратить повышение уровня О2 в клетках, сужаются капилляры и замедляется доставка О2. Однако такого рода макроскопические механизмы имеют весьма существенное ограничение. Так, сужение капилляра должно привести к появлению в ткани кислородного градиента: концентрация О2 будет понижаться по мере удаления от капилляра. В результате клетки, расположенные вблизи капилляра, будут по-прежнему насыщены кислородом, а удаленные от него попадут в анаэробные условия. Чтобы избежать такой неблагоприятной ситуации, было бы желательно дополнить упомянутые выше надклеточные физиологические механизмы какими-то внутриклеточными, биохимическими. Повышение концентрации АДФ ведет к противоположному процессу: повышается и убыстряется потребление О2 в реакции (1).
3. Раскройте сущность закона гомологических рядов наследственной изменчивости и покажите его практическое значение
Закон гомологических рядов был сформулирован выдающимся русским ученым Н. И. Вавиловым в 1920 г. Сущность закона состоит в том, что виды и роды, генетически близкие, связанные друг с другом единством происхождения, характеризуются сходными рядами наследственной изменчивости. Зная, какие формы изменчивости встречаются у одного вида, можно предвидеть нахождение аналогичных форм у родственного ему вида.
Закон гомологических рядов, отражая общую закономерность мутационного процесса и формирования организмов, представляет широкие возможности для его практического применения в сельскохозяйственном производстве, селекции, медицине. Знание характера изменчивости нескольких родственных видов дает возможность поиска признака, который отсутствует у одного из них, но характерен для других. Таким путем были собраны и изучены голозерные формы злаков, односемянные сорта сахарной свеклы, не нуждающейся в прорывке, что особенно важно при механизированной обработке почв. Медицинская наука в качестве моделей для изучения болезней человека получила возможность использовать животных с гомологичными заболеваниями: сахарный диабет крыс; врожденная глухота мышей, собак, морских свинок; катаракта глаз мышей, крыс, собак и ряд других дефектов.
Закон гомологических рядов позволяет также предвидеть возможность появления мутаций, еще неизвестных науке, которые могут использоваться в селекции для создания новых ценных для хозяйства форм.
4. Раскройте вред курения и других токсических веществ на развитие организма человека
Группировка факторов риска и их значение для здоровья
Агрегация тромбоцитов с АДФ
Описание
Агрегация тромбоцитов с АДФ — диагностика оценки активации реакции слипания (агрегации) тромбоцитов с использованием специального индуктора агрегации — аденозиндифосфата (АДФ). АДФ способствуют склеиванию тромбоцитов (агрегации). Тест агрегация тромбоцитов с АДФ позволяет провести оценку функции тромбоцитов посредством изучения их агрегации под воздействием индуктора агрегации. Анализ помогает диагностировать заболевания свертывающей системы крови.
Тромбоциты — это клетки крови, которые ответственны за свертывание. Состояния, связанные со снижением агрегации (слипания) тромбоцитов, включают наследственные и приобретенные нарушения функции клеток. Анализ на агрегацию тромбоцитов проводят для выявления и диагностики дисфункции тромбоцитов у пациентов с чрезмерными кровотечениями.
Когда повреждаются сосуды тромбоциты скапливаются в месте повреждения, активируются и прилипают друг к другу, образуя тромбоцитарный тромб, происходит образование первичной гемостатической пробки, которая способствует остановке кровотечения и заживлению раны. При активации тромбоцитов возникает реакция, завершающаяся активацией фосфолипазы. В результате мембрана клетки изменяет свойства и может вступать в контакт с соседними клетками. Вследствие этого тромбоциты могут агрегировать друг с другом и образовывать тромбоцитарный тромб.
Активация тромбоцитов — необходимый элемент для нормального гемостаза. В нормальных условиях циркулирующие тромбоциты не взаимодействуют с внутренней поверхностью и эндотелиальными клетками сосудов. Но при повреждении стенки сосудов в просвет сосуда выходит коллаген и тромбоциты при участии фактора Виллебранда прилипают (адгезия) к поврежденному участку сосуда.
Повышенная агрегация тромбоцитов сопровождается ишемической болезнью сердца и развитием инфаркта миокарда.
Подготовка
Специальная подготовка не требуется. Взятие крови рекомендуется проводить не ранее, чем через 6–8 часов после последнего приема пищи. Накануне исследования следует исключить приём алкоголя и курение, физические и эмоциональные нагрузки.
Если пациент принимает лекарственные препараты, следует проконсультироваться с врачом по поводу целесообразности проведения исследования на фоне приёма препаратов или возможности его отмены перед исследованием, длительность отмены определяется периодом выведения препарата из крови.
Интерпретация результатов
Интерпретация теста основывается на анализе характера агрегации (одно- или двухволновая, полная или неполная, обратимая или необратимая), а также некоторых других показателей.
Единицы измерения: %
В процентах норма соответствует 25–75%.
О чем свидетельствует присутствие в клетке большого количества адф
Источники энергетического обеспечения эритроцитов
Эритроцит является метаболически активной клеткой и содержит более 40 различных ферментов. Энергетическое обеспечение эритроцита осуществляется за счет утилизации глюкозы в реакциях анаэробного гликолиза. Эффективность гликолиза характеризуется образованием двух молекул АТФ на одну молекулу глюкозы, однако это небольшое количество энергии обеспечивает эритроциту выполнение всех его функций.
Основная доля энергии АТФ расходуется в эритроцитах на транспорт ионов, функционирование АТФ-азных систем и поддержание электролитного баланса клетки. Макроэргические фосфатные связи АТФ необходимы также и для инициации реакций гликолиза и пентозофосфатного цикла.
Наиболее важные реакции гликолиза протекают с участием следующих ферментов: гексокиназы, фосфофруктокиназы и пируваткиназы. Отличительной особенностью гликолиза в эритроцитах по сравнению с другими клетками является выработка значительного количества 2,3-дифосфоглицериновой кислоты, регулирующей кислородосвязывающую функцию гемоглобина.
Кроме гликолиза в эритроцитах происходит прямое окисление глюкозы в пентозофосфатном цикле, на долю которого приходится 10 – 11 % всего энергетического метаболизма клетки. Ключевыми ферментами пентозофосфатного цикла являются глюкозо-6-фосфат-дегидротеназа, 6-фосфоглюконатдегидрогеназа. В процессе пентозофосфатного окисления глюкозы образуется восстановленная форма кофермента НАДФ, использующаяся для восстановления глутатиона – основного компонента антиоксидантной системы эритроцита.
Главной функциональной группой глутатиона является сульфгидрильная группа, водород которой обеспечивает нейтрализацию органических и неорганических окислителей, действующих на мембрану эритроцита, и защищает липиды мембраны от свободнорадикального окисления.
Вышеизложенное делает очевидным большую значимость для поддержания стабильности эритроцитарной мембраны, интенсивности гликолитических реакций, обеспечивающих образование АТФ и соответственно полноценное функционирование АТФ-азных систем и трансмембранный перенос ионов, а также состояние пентозного цикла окисления глюкозы и образование достаточного количества НАДФН2.
В условиях врожденной или приобретенной недостаточности энергообеспечения эритроцитов при нарушении активности гликолитических ферментов, а также ферментов пентозофосфатного окисления глюкозы возникает дестабилизация эритроцитарной мембраны, изменение формы эритроцита и гемолиз.
Как известно, отличительными особенностями структуры и, соответственно, метаболизма эритроцитов являются отсутствие ядра, рибосомального аппарата, в связи с чем эритроциты не обладают белок-синтетической функцией. В эритроцитах отсутствуют митохондрии, система цитохром и соответственно отсутствует цикл трикарбоновых кислот. Эритроцит не воспроизводит De novo нуклеиноыве кислотиы и липиды. Основным источником энергии для эритроцитов является глюкоза, метаболизирующаяся по двум основным путям: путь Эмбдена-Мейергофа и в гексозомонофосфатный путь.
Лишенный глюкозы эритроцит деградирует, переходит в эхиноцит, сфероцит и затем подвергается осмотическому лизису, поскольку теряет способность поддерживать градиент натрия и калия, в то же время накапливает окисленный глутатион и метгемоглобин в условиях окислительного стресса.
Метаболизм глюкозы в пути Эмбдена-Мейергофа заканчивается образованием пирувата или лактата. Проникновение глюзозы в эритроцит происходит довольно быстро с помощью неиндентифицированного переносчика мембраны клеток. Концентрация глюкозы в эритроцитах такая же, как и в плазме крови. Основные стадии пути Эмбдена-Мейергофа включают: фосфорилирование глюкозы при участии АТФ и гексокиназы.
Дефицит гексокиназы может быть одной из причин наследственной гемолитической анемии. Продукт гексокиназной реакции (глюкозо-6-фосфат) трасформирется в глюкозо-1-фосфат при участии фосфоглюкомутазы, а также находится в рановесии с фруктозо-6-фосфат вследствие глюкозофосфатизомеразной реакции (ГФИ), имеющей большое метаболическое значение. Дефицит ГФИ является причиной достаточно часто возникающей наследственной несфероцитарной гемолитической анемии. Третья стадия в пути Эмбдена-Мейергофа включает фосфорилирование фруктозо-6-фосфата до фруктозо-1,6-дифосфата при участии фосфофруктокиназы.
Дефицит фермента ФФК является одной из причин нарушения накопления гликогена и развития наследственной гемолитической анемии.
Далее в эритроците Ф-1,6-ДФ распадается на две триозы – глицеральдегидтрифосфат (ГАФ) и диоксиацетонфосфат (ДАФ).
Глицеральдегидтрифосфат непрерывно превращается в 1,3ДФГ, который затем трансформируется в 2,3ДФГ и 3ФГ. Последний дефосфорилируется в 2ФГ, который находится в равновесии с фосфоенолпируватом (ФЕП). В свою очередь ФЕП служит донором фосфата для АДФ на второй стадии синтеза АТФ в реакциях гликолиза в эритроцитах.
Гексозомонофосфатный путь. Образующийся в гексокиназной реакции глюкозо-6-фосфат далее участвует в 3-х направлениях метаболизма в эритроцитах с участием ферментов фосфоглюкокиназы, глюкозофосфоизомеразы(ГФИ) и глюкозо-6-фосфатдегидрогеназы(Г-6-ФДГ). В глюкозо-6-фосфатдегидрогеназных реакциях НАДФ+ восстанавливается до НАДФ*Н. В 6-фосфоглюконатдегидрогеназной реакции в эритроцитах образуется рибулозо-5-фосфат, который находится в равновесии с рибозо-5-фосфатом и ксилулозо-5-фосфатом.
В физиологических условиях энергетические потребности эритроцитов покрываются в результате утилизации глюкозы в пути Эмбдена-Мейергофа и гексозомонофостном пути. Однако эритроциты обладают способностью метаболизировать фруктозу, лактозу, галактозу, нуклеотиды, в частности инозин.
В эритроцитах происходят реакции восстановления метгемоглобина. Как известно, в процессе диссоциации оксигемоглобина железо гемоглобина приобретает 2-х валентное ферросостояние. В ряде случаев О2 отрывается в виде супероксиданионрадикала, забирает один электрон у железа и превращает гемоглобин в метгемоглобин. В присутствии восстановленного глютатиона и аскорбиновой кислоты метгемоглобин восстанавливается до гемоглобина.
Гемоглобин эритроцитов. Основным белком эритроцитов, на долю которого приходится около 98 % всей массы белков цитоплазмы, является гемоглобин. Последний является гетеродимерным тетрамером, состоящим из четырех полипептидных цепей, соединенных с четырьмя молекулами гема. В свою очередь гем – это молекула протопорфина IX, связанная с анионом железа. Каждый тетрамер гемоглобина может обратимо связывать и транспортировать не более 4-х молекул кислорода. К числу основных гемоглобинов (Hb) взрослого человека относится гемоглобин А (от слова adultus – взрослый), на долю которого приходится 96–98 % и в составе которого имеются две α- и две β-цепи (α2β2).
Главным регулятором сродства Hb к О2 является промежуточный продукт гликолиза – 2-3дифосфоглицериновая кислота (2-3ДФГ). Увеличение образования 2-3ДФГ снижает сродство Hb к О2, что приводит к сдвигу кривой диссоциации оксигемоглобина вправо и к усиленному поступлению О2 в ткани. Сдвиг кривой вправо возникает также при увеличении температуры тела, возрастании уровня СО2 или на фоне развития метаболического ацидоза.
Фетальный гемоглобин слабо связывается с 2-3ДФГ и поэтому характеризуется более высокой кислородсвязывающей способностью по сравнению с HbA.
Гены гемоглобина: 2 гена α–цепей глобина расположены в 16-й паре хромосом, а 11 пара хромосом содержит пару генов γ-цепей и по одной копии δ- и β-цепей. Глобин синтезируется только в эритрокариоцитах и лишь в период созревания ретикулоцита из нормоцитов. На каждой стадии развития гены α-глобина и других глобинов координировано экспрессируются.
Избыточное образование одной цепи гемоглобина, происходящее при талассемии, приводит к преципитации белка в эритроците, повреждению клетки и её преждевременной элиминации клетками моноцитарно-макрофагальной системы.
О чем свидетельствует присутствие в клетке большого количества адф
13.1. Механизмы энергообеспечения клеток различной морфофункциональной организации в условиях нормы и гипоксических состояний
Гипоксия – типовой патологический процесс, осложняющий течение различных заболеваний.
Как известно, гипоксия определяет тяжесть течения ишемического поражения сердца, головного мозга, формирование полиорганной недостаточности при ДВС – синдроме, шоковых и коллаптоидных состояний, является неизменным спутником заболеваний инфекционной и неинфекционной природы, а также стрессовых ситуаций.
Тяжесть течения многих заболеваний и их исход в конечном итоге определяется особенностями вторичных неспецифических метаболических расстройств, степенью дестабилизации клеточных мембран, а также возможностями реактивации структурных и ферментных белков в условиях гипоксии.
Вышеизложенное указывает на необходимость дальнейшей детализации механизмов развития гипоксии на молекулярно-клеточном, органном, системном уровнях, а также патогенетического обоснования новых принципов медикаментозной коррекции метаболических и функциональных сдвигов при указанном типовом патологическом процессе.
Как указывалось выше, в соответствии с общепринятыми классическими описаниями происхождения и классификации гипоксических состояний различают гипоксии экзогенного и эндогенного происхождния. Последняя включает дыхательную, циркуляторную, гемическую и тканевую гипоксии системного или локального характера.
Общепринятым является представление о том, что в основе развития гипоксий различного генеза лежат нарушения окислительно-восстановительных реакций в связи с дефицитом кислорода. В то же время высказывается точка зрения о возможности развития субстратного типа гипоксии, обусловленной недостаточностью субстратов окисления, например, глюкозы для нервных клеток, жирных кислот для миокарда.
Как известно, динамика формирования структурных и функциональных сдвигов в различных органах и тканях при гипоксии определяются в значительной мере темпами ее развития, локализацией патологии, характером этиологических факторов, инициирующих гипоксию, и особенностями компенсаторно-приспособительных реакций в том или ином органе.
В соответствии с данными литературы устойчивость тканей различных органов и систем к гипоксии широко варьируют. Наиболее чувствительной к гипоксии является нервная система: при полном прекращении кровотока признаки повреждения коры головного мозга обнаруживается через несколько секунд. Снижение потребления кислорода на 20% структурами головного мозга вызывает потерю сознания. Через 5-6 мин аноксии головного мозга возникают глубокие структурные изменения нейронов, а в продолговатом мозге – через 10-15 мин.
В сердечной мышце мелкие очаги некроза появляются через 3-5 мин с момента, развития ишемии, а крупноочаговый инфаркт миокарда формируется уже спустя 20-30 мин.
Недостаток кислорода в тканях приводит, прежде всего, к дефициту макроэргических соединений, образуемых в сопряженных с окислительно-восстановительными процессами реакциях фосфорилирования на внутренней мембране митохондрий.
Основным энергетическим субстратом для нервной системы, а также для клеток других органов и тканей, является глюкоза. Между тем, при нормальной оксигенации миокарда основным источником его энергетического обеспечения являются высшие жирные кислоты. Так, при окислении 1 молекулы пальмитиновой кислоты образуется 130 М АТФ. В условиях ишемии миокарда усиливается конкурентное ингибирование использования жирных кислот лактатом, что приводит к значительному снижению энергообеспечения миокарда. Так, в процессе анаэробных гликолитических реакций энергетический выход на 1 молекулу глюкозы составляет 2 М АТФ.
Вышеизложенное свидетельствует о том, что независимо от характера этиологических факторов и механизмов развития гипоксии, наиболее ранними проявлениями нарушения оксигенации тканей являются сдвиги их энергетического обеспечения и связанные с ними нарушения углеводного, жирового и белкового метаболизма.
Как известно, процессы ресинтеза АТФ а митохондриях тесно связаны не только с окислительно-восстановительными реакциями, но и с реакциями гликолиза, липолиза, протеолиза, являющимися поставщиками Ац-СоА для цикла Кребса. Установлено, что регулирующими ферментами гликолиза являются фосфорилаза, гексокиназа, фосфофруктокиназа, пируваткиназа, поэтому их подавление в условиях гипоксии приводит к уменьшению образования свободной энергии и в ряде случаев носит необратимый характер. В то же время роль главного регуляторного фермента в последовательных реакциях гликолиза играет фосфофруктокиназа, которую ингибируют АТФ и цитрат, а стимулируют АМФ и АДФ.
Таким образом, в условиях гипоксии, в случаях увеличения потенциала фосфорилирования, возникает активация ключевого фермента гликолиза – фосфофруктокиназы (ФФК) и соответственно возрастание пропускной способности реакции анаэробного гликолиза. При этом резко снижается запас гликогена в сердце, мозге, печени, почках, мышцах и других тканях и соответственно накапливаются продукты гликолитических реакций – молочная и пировиноградная кислоты.
Так активация ФФК на начальных этапах ишемического или гипоксического повреждения клеток приводит к усилению мобилизации гликогена, несколько улучшает энергообеспечение тканей. При этом истощаются запасы гликогена, усиливается ацидоз, приводящий на пике своего развития к подавлению ФФК, и соответственно полной блокаде энергообеспечения клетки.
Развитие метаболического ацидоза при гипоксических состояниях усугубляется также недостаточностью реакций окисления жирных кислот, аминокислот, чрезмерным накоплением кислых продуктов метаболизма указанных соединений.
На обеих стадиях окисления жирных кислот атомы водорода или соответствующие им электроны передаются по митохондриальной цепи переноса электронов на кислород. С этим потоком электронов сопряжен процесс окислительного фосфорилирования АДФ до АТФ. Следовательно, в условиях гипоксии различного генеза блокируются процессы окисления жирных кислот в тканях, в избытке накапливаются кислые продукты, формируется метаболический ацидоз, и соответственно развиваются дефицит АТФ, подавление всех энергозависимых реакции.
Касаясь функциональной значимости метаболического ацидоза, закономерно развивающегося при гипоксии различного генеза, следует отметить ряд последующих неспецифических метаболических и функциональных расстройств, представляющих собой динамическую трансформацию реакций адаптации в реакции дезадаптации.
Как известно, типовой реакцией тучных клеток и тромбоцитов на развитие гипоксии и ацидоза является их дегрануляция с избыточным освобождением в окружающую среду высокоактивных соединений – гистамина, серотонина, ФАТ, ФХЭ, ФХН, лейкотриенов, интерлейкинов. В свою очередь, избыточное накопление ионов водорода, биологически активных соединений приводит к резкому увеличению проницаемости биологических мембран за счет структурных переходов в белках и липидах, и активации процессов свободно-радикального окисления.
Таким образом, среди механизмов, приводящих к повреждению биологических мембран при гипоксии различного генеза, необходимо выделить следующие:
1) развитие метаболического ацидоза,
2) выброс вазоактивных соединений тучными клетками,
3) активацию процессов липопероксидации,
4) высвобождение лизосомальных гидролаз при дезорганизации лизосомальных мембран с последующим усугублением метаболических сдвигов.
13.2. Механизмы развития гипоксического некробиоза.
В настоящее время очевидно, что развитие гипоксического некробиоза связано в значительной мере с дезорганизацией цитоплазматических, лизосомальных, митохондриальных, и других биологических внутриклеточных мембран, формирующих отдельные функциональные и структурные компартменты.
Причем наиболее ранние расстройства возникают у градиентсоздающих и сократительных систем клеток.
Важнейшим фактором повреждения клеток при гипоксии являются ионы кальция.
Как известно, внутриклеточная концентрация кальция в состоянии покоя поддерживается в среднем на уровне 10-7М, что в 100.000 раз меньше, чем в межклеточной жидкости. В период возбуждения кальций проникает из внеклеточной среды в клетку через потенциалзависимые кальциевые каналы. При этом возникают активация фосфолипазы С и образование липидных внутриклеточных посредников – диацилглицерина и инозинфосфамина. Цитоплазматический кальций взаимодействует с кальмодулином – внутриклеточным рецептором с последующей активацией кальмодулинзависимых протеинкиназ и включением тех или иных внутриклеточных реакций.
В условиях гипоксии, дефицита энергетического обеспечения клеток возникают недостаточность механизмов инактивации цитоплазматического кальция и удаления его из клеток в связи с подавлением активности АТФ-зависимого Са-насоса, натрий- кальциевого обменного механизма, дестабилизацией митохондриальных мембран и мембран эндоплазматического ретикулума, играющих в условиях нормы важную роль в поддержании баланса внутриклеточного кальция. При избытке внутриклеточного кальция усугубляются процессы набухания митохондрий, усиливаются дефицит АТФ и подавление всех энергозависимых реакций в клетке. Избыток кальция активизирует ядерные эндонуклеазы, фрагментирующие ДНК, индуцирует апоптоз. При высоком уровне внутриклеточного кальция активизируются нейтральные протеазы – кальципаины, разрушающие цитоскелет клетки, в частности, белки фоурин и В-актин, лизирующие рецепторы и протеинкиназу С.
При гипоксическом некробиозе вокруг гибнущих клеток формируется кальцийзависимая активация системы комплемента, активация коагуляционного и тромбоцитарного звеньев гемостаза, а также фибринолиза и калликреин-кининовой системы.
Активация под влиянием кальция мембранных фосфолипаз приводит к дальнейшей дезинтеграции мембран клеток, активации циклооксигеназы и липооксигеназы с последующим образованием простагландинов, лейкотриенов, свободных радикалов с выраженным цитотоксическим действием.
Чрезвычайно важна роль дезинтеграции митохондриальных мембран в механизмах гипоксического некробиоза клеток.
Как известно, в клетках эукариот все специфические дегидрогеназы принимают участие в окислении пирувата и других субстратов, локализованных в митохондриальном матриксе. Во внутренней мембране митохондрий локализуются переносчики электронов, составляющие дыхательную цепь и ферменты, катализирующие синтез АТФ из АДФ и фосфата.
В связи с этим очевидно, что продукты гликолиза, липолиза, протеолиза, вовлекаемые через ацетил-СоА в цикл Кребса, а также АДФ должны пройти через обе мнтохондриальные мембраны, в то время как новообразованные АТФ проникают из внутренней мембраны митохондрий в цитоплазму клетки и далее к местам энергетических трат. Установлено, что наружная мембрана легко проницаема для всех молекул и ионов небольшого размера, в то время как во внутренней мембране имеются специальные ферментативные транспортные системы, обеспечивающие трансмембранный перенос ионов и различных соединений.
Таким образом, при избыточном накоплении ионов кальция в клетке, активации процессов липопероксидации при гипоксии различного генеза резко повышается проницаемость митохондриальных мембран, возникает набухание митохондрий, пространственная дезориентация ферментативных систем транспорта электронов, синтеза АТФ. В результате происходят разобщение окислительного фосфорилирования и дыхания и соответственно подавление всех энергозависимых систем клетки: синтеза белка, трансмембранного переноса ионов, сопряжения процессов возбуждения и сокращения в мышечных структурах и т.д.
В процессе набухания митохондрии энергия потока электронов трансформируется в тепловую энергию.
Наряду с локальными и системными метаболическими сдвигами в тканях, обусловленными гипоксией, ацидозом, активизацией процессов липопероксидации, возникает комплекс метаболических и функциональных сдвигов, обусловленных выбросом гормонов адаптации – катехоламинов, глюкокортикоидов.
Как известно, при чрезмерной активации симпатоадреналовой системы (САС) реакции адаптации довольно быстро трансформируется в дезадаптационные процессы. Во-первых, при активации освобождения норадреналина происходит спазм сосудов переферических органов и тканей и соответственно усугубление циркуляторной гипоксии. На фоне активации САС при участии постсинаптических β-адренорецпторов возможна активация процессов гликолиза, гликогенолиза, липолиза, что, безусловно, усугубляет развитие ацидотических сдвигов, свойственных гипоксии.
Усиление адренергетических влияний закономерно сопровождается активацией процессов липопероксидации, что вносит весомый вклад в механизмы развития гипоксического некробиоза клеток органов и тканей, чувствительных к ишемии.
Синхронно с освобождением катехоламинов в условиях гипоксического стресса выбрасываются глюкокортикоиды, индуцирующие процессы лизиса и апоптоза в лимфоидной ткани, блокирующие процессы пролиферации и репаративной регенерации в ряде внутренних органов.
