Нитро приставка в химии что значит
НИТРОСОЕДИНEНИЯ
НИТРОСОЕДИНEНИЯ (С-нитросоединения), содержат в молекуле одну или неск. нитрогрупп, непосредственно связанных с атомом углерода. Известны также N- и О-нитро-соединения (см. Нитрамины и Нитраты органические).
Нитрогруппа имеет строение, промежуточное между двумя предельными резонансными структурами:
Н итросоединения, имеющие хотя бы один а-Н-атом, могут существовать в двух таутомерных формах с общим мезомерным анионом. О-форма наз. аци-нитросоединением или нитроновой к-той:
Назв. нитросоединений производят прибавлением префикса «нитро» к назв. соединения-основы, по необходимости добавляя цифровой указатель, напр. 2-нитропропан. Назв. солей нитросоединений производят из назв. либо С-формы, либо аци-формы, или нитроновой к-ты.
Физические свойства. Простейшие нитроалканы-бесцв. жидкости. Физ. св-ва нек-рых алифатических нитросоединений приведены в таблице. Ароматические нитросоединения-бесцв. или светло-желтые высококипящие жидкости или низкоплавкие твердые в-ва, обладающие характерным запахом, плохо раств. в воде, как правило, перегоняются с паром.
ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ АЛИФАТИЧЕСКИХ НИТРОСОЕДИНЕНИЙ
* При 25°С. ** При 24°С. *** При 14°С.
В УФ спектрах алифатических нитросоединений l макс 200-210 нм (интенсивная полоса) и 270-280 нм (слабая полоса); для солей и эфиров нитроновых к-т соотв. 220-230 и 310-320 нм; для гем-динитросоед. 320-380 нм; для ароматических нитросоединений 250-300 нм (интенсивность полосы резко снижается при нарушении копланарности).
3-5), чем соответствующие нитросоединения (рК а
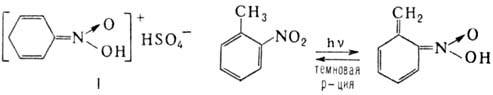
Образование нитроновых к-т в ряду ароматических нитросоединений связано с изомеризацией бензольного кольца в хиноидную форму; напр., нитробензол образует с конц. H 2 SO 4 окрашенный солеобразный продукт ф-лы I, о-нитротолуол проявляет фотохромизм в результате внутримол. переноса протона с образованием ярко-синего О-производного:
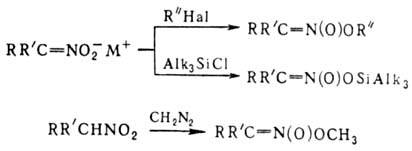
Ациклич. алкиловые эфиры нитроновых к-т термически нестабильны и распадаются по внутримол. механизму:
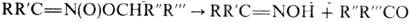
р-цию можно использовать для получения карбонильных соединений. Более стабильны силиловые эфиры. Об образовании продуктов С-алкилирования см. ниже.
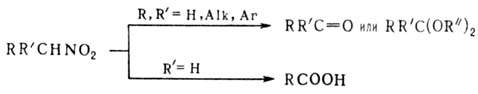
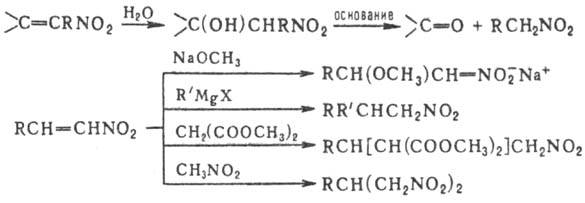
Р-ц и и с р а з р ы в о м с в я з и С—N. Первичные и вторичные нитросоединения при нагр. с минер. к-тами в присут. спиртового или водного р-ра щелочи образуют карбонильные соед. (см. Нефа реакция). Р-ция проходит через промежут. образование нитроновых к-т:
В качестве исходных соед. можно использовать силиловые нитроновые эфиры. Действие сильных к-т на алифатические нитросоединения может приводить к гидроксамовым к-там, напр.:
Метод используют в пром-сти для синтеза СН 3 СООН и гидроксиламина из нитроэтана. Ароматические нитросоединения инертны к действию сильных к-т.
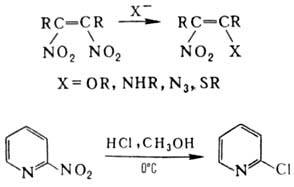
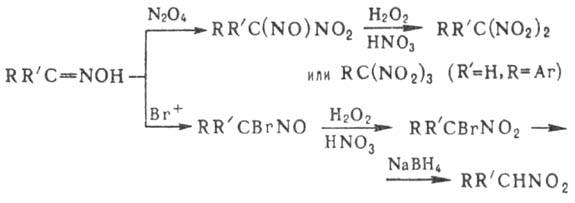
Нуклеоф. замещение группы NO 2 не характерно для нитроалканов, однако при действии тиолат-ионов на третичные нитроалканы в апротонных р-рителях группа NO 2 замещается на атом водорода. Р-ция протекает по анион-радикальному механизму. В алифатич. и гетероциклич. соед. группа NO 2 при кратной связи относительно легко замещается на нуклеофил, напр.:
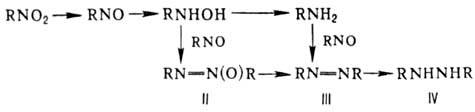
Р-ц и и п о с в я з и N = O. Одна из важнейших р-ций-вос-становление, приводящее в общем случае к набору продуктов:
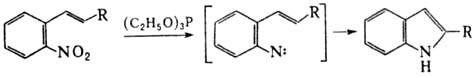
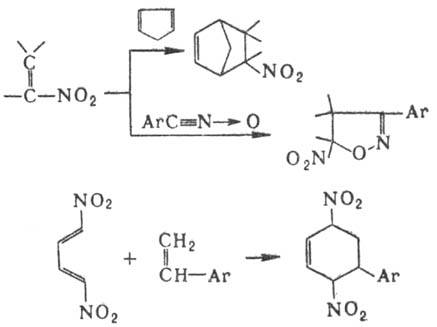
При действии Р(III) на ароматические нитросоединения происходит последоват. дезоксигенирование группы NO 2 с образованием высокореакционноспособных нитренов. Р-цию используют для синтеза конденсир. гетероциклов, напр.:
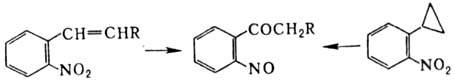
В этих же условиях силиловые эфиры нитроновых к-т трансформируются в силильные производные оксимов. Обработка первичных нитроалканов РСl 3 в пиридине или NaBH 2 S приводит к нитрилам. Ароматические нитросоединения, содержащие в орто-положении заместитель с двойной связью или циклопропильный заместитель, в кислой среде перегруппировываются в о-нитрозокетоны, напр.:
Н итросоединения и нитроновые эфиры реагируют с избытком реактива Гриньяра, давая производные гидроксиламина:
Р-ции по связям O = N 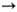

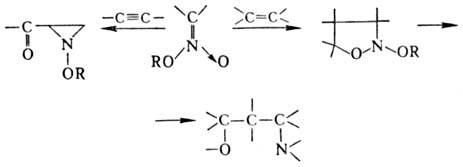
Наиб. легко эта р-ция протекает между нитроновыми эфира-ми и олефинами или ацетиленами. В продуктах циклоприсоединения (моно- и бициклич. диалкоксиаминах) под действием нуклеоф. и электроф. реагентов связи N — О легко расщепляются, что приводит к разл. алифатич. и гетеро-циклич. соед.:
В препаративных целях в р-ции используют стабильные силиловые нитроновые эфиры.
Известны примеры внутримол. С-алкилирования, напр.:
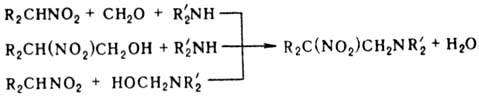
Первичные и вторичные нитросоединения реагируют с алифатич. аминами и СН 2 О с образованием р-аминопроизводных (р-ция Манниха); в р-ции можно использовать предварительно полученные метилольные производные нитросоединений или аминосоед.:
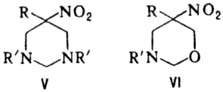
Нитрометан и нитроэтан могут конденсироваться с двумя молекулами метилоламина, а высшие нитроалканы- только с одной. При определенных соотношениях реагентов р-ция может приводить к гетероциклич. соед., напр.: при взаимод. первичного нитроалкана с двумя эквивалентами первичного амина и избытком формальдегида образуются соед. ф-лы V, если реагенты берут в соотношении 1:1:3-соед. ф-лы VI.
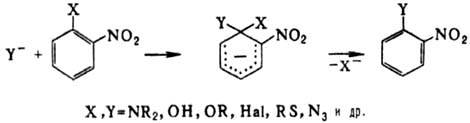
Активирующее влияние группы NO 2 на нуклеоф. замещение (особенно по орто-положению) широко используют в орг. синтезе и пром-сти. Р-ция протекает по схеме присоединение-отщепление с промежут. образованием s-комплек-са (комплекс Майзенхаймера). По этой схеме атомы галогенов легко замещаются на нуклеофилы:
Нитрогруппа облегчает перегруппировки ароматич. соед. по механизму внутримол. нуклеоф. замещения или через стадию образования карбанионов (см. Смайлса перегруп-пировка).
Введение второй группы NO 2 ускоряет нуклеоф. замещение. Н итросоединения в присут. оснований присоединяются к альдегидам и кетонам, давая нитроспирты (см. Анри реакции), первичные и вторичные нитросоединения-к соед., содержащим активир. двойную связь (р-ция Михаэля), напр.:
Первичные нитросоединения могут вступать в р-цию Михаэля со второй молекулой непредельного соед.; эту р-цию с послед. транс формацией группы NO 2 используют для синтеза поли-функцион. алифатич. соединений. Комбинация р-ций Анри и Михаэля приводит к 1,3-динитросоединениям, напр.:
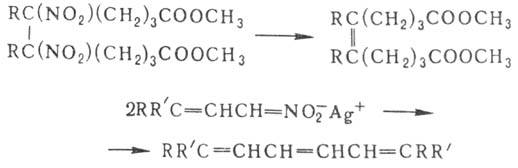
Нитроолефины могут выступать в роли диенофилов или диполярофилов в р-циях диенового синтеза и циклоприсое-динения, а 1,4-динитродиены-в роли диеновых компонентов, напр.:
Нитроалканы легко галогенируются в присут. оснований с последоваг. замещением атомов Н при a-С-атоме:
При фотдхйм. хлорировании замещаются более удаленные атомы Н:
При карбоксилировании первичных нитроалканов действием CH 3 OMgOCOOCH 3 образуются a-нитрокарбоновые к-ты или их эфиры.
Нитрогруппа не оказывает существ. влияния на свободно-радикальное алкилирование или арилирование ароматич. соед.; р-ция приводит в осн. к орто- и пара-замещенным продуктам.
Нитроалканы м.б. получены нагреванием ацилнитратов до 200 °С.
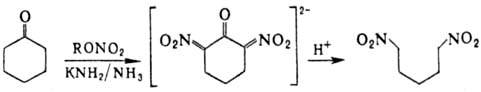
a,w-Динитроалканы получают действием алкилнитратов на циклич. кетоны с послед. гидролизом солей a,a’-динитро-кетонов:
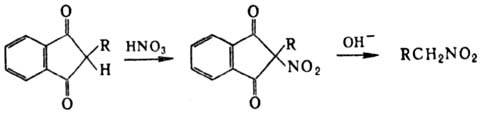
Поли-нитросоединения синтезируют деструктивным нитрованием разл. орг. соед.; напр., три- и тетранитрометан получают при действии HNO 3 на ацетилен в присут. ионов Hg(II).
Применение. Поли-нитросоединения, особенно ароматические, применяют в качестве взрывчатых веществ и в меньшей степени как компоненты ракетных топлив. Алифатические нитросоединения используют как р-рители в лакокрасочной пром-сти и в произ-ве полимеров, в частности эфиров целлюлозы; для очистки минер. масел; депарафинизации нефти и др.
Н итросоединения- полупродукты в произ-ве синтетич. красителей, полимеров, моющих препаратов и ингибиторов коррозии; смачивающих, эмульгирующих, диспергирующих и флотац. агентов; пластификаторов и модификаторов полимеров, пигментов и пр. Они находят широкое применение в орг. синтезе и в качестве модельных соед. в теоретич. орг. химии.
Лит.: Химия нитро- и нитрозогрупп, под ред. Г. Фойера, пер. с англ., т. 1-2, М., 1972-73; Химия алифатических и алициклических нитросоединений, М., 1974; Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 399-439; Тартаковский В. А., «Изв. АН СССР. Сер. хим.», 1984, № 1, с. 165-73.
Что значит приставка нитро в химии. Нитросоединения
В зависимости от радикала R, различают алифатические (предельные и непредельные), ациклические, ароматические и гетероциклические нитросоединения. По характеру углеродного атома, с которым связана нитрогруппа, нитросоединения подразделяются на первичные, вторичные и третичные.
Нитросоединения изомерны эфирам азотистой кислоты HNO2 (R-ONO)
При наличии α-атомов водорода (в случае первичных и вторичных алифатических нитросоединений) возможна таутомерия между нитросоединениями и нитроновыми кислотами (аци-формами нитросоединений):
Электрофильное нитрование[править | править исходный текст]
При электрофильном нитровании основным нитрующим агентом является азотная кислота. Безводная азотная кислота подвергается автопротолизу по реакции:
Вода сдвигает равновесие влево, поэтому в 93-95 % азотной кислоте катион нитрония уже не обнаруживается. В связи с этим азотная кислота используется в смеси со связывающей воду концентрированной серной кислотой илиолеумом: в 10%-ном растворе азотной кислоты в безводной серной кислоте равновесие практически полностью сдвинуто вправо.
Кроме смеси серной и азотной кислот используются различные комбинации оксидов азота и органических нитратов с кислотами Льюиса (AlCl3, ZnCl2, BF3). Сильными нитрующими свойствами обладает смесь азотной кислоты с уксусным ангидридом, в которой образуется смесь ацетилнитрата и оксида азота(V), а также смесь азотной кислоты с оксидом серы(VI) или оксидом азота(V).
Процесс проводят либо при непосредственном взаимодействии нитрующей смеси с чистым веществом, либо в растворе последнего в полярном растворителе (нитрометан, сульфолан, уксусная кислота). Полярный растворитель кроме того, что растворяет реагирующие вещества, сольватирует ион + и способствует его диссоциации.
В лабораторных условиях чаще всего используются нитраты и соли нитрония, нитрующая активность которых возрастает в следующем ряду:
Механизм нитрования бензола:
Кроме замещения атома водорода нитрогруппой применяется также заместительное нитрование, когда нитрогруппа вводится вместо сульфо-, диазо- и других групп.
Нитрование алкенов при действии апротонных нитрующих агентов идёт по нескольким направлениям, которое зависит от условий реакции и строения исходных реагентов. В частности, могут протекать реакции отщепления протона и присоединения функциональных групп молекул растворителя и противоионов:
Нитрование аминов приводит к N-нитроаминам. Этот процесс является обратимым:
Заместительное нитрование ацетамидов, сульфамидов, уретанов, имидов и их солей протекает по схеме
Реакцию ведут в апротонных растворителях с использованием апротонных нитрующих агентов.
Спирты нитруются любыми нитрующими агентами; реакция является обратимой:
Нуклеофильное нитрование[править | править исходный текст]
Радикальное нитрование[править | править исходный текст]
Радикальное нитрование применяется для получения нитроалканов и нитроалкенов. Нитрующими агентами являются азотная кислота или оксиды азота:
Параллельно протекает реакция окисления алканов ввиду взаимодействия радикала NO2 с алкильным радикалом по атому не азота, а кислорода. Реакционноспособность алканов возрастает при переходе от первичных к третичным. Реакцию проводят как в жидкой фазе (азотной кислотой при нормальном давлении или оксидами азота, при 2-4,5 МПа и 150-220°C), так и в газовой (пары азотной кислоты, 0,7-1,0 МПа, 400-500°C)
Анион-радикальный механизм нитрования наблюдается при взаимодействии тетранитрометана солей моно-нитросоединений.
Реакция Коновалова(для алифатических углеводородов)
Обычно образуется смесь первичных, вторичных и третичных нитросоединений. Жирноароматические соединения легко нитруются в α-положение боковой цепи. Побочными реакциями являются образование нитратов, нитритов, нитрозо- и полинитросоединений.
R-H + ·ONO2 → R· + HONO2
Нитрование ароматических углеводородов.
Химические свойства[править | править исходный текст]
По химическому поведению нитросоединения обнаруживают определенное сходство с азотной кислотой. Это сходство проявляется при окислительно-восстановительных реакциях.
Восстановление нитросоединений (Реакция Зинина):
Чаще всего при таутомеризации происходит перемещение атомовводорода от одного атома в молекуле к другому и обратно в одном и том же соединении. Классическим примером является ацетоуксусный эфир, представлющий собой равновесную смесь этилового эфира ацетоуксусной (I) и оксикротоновой кислот (II).
Таутомерия сильно проявляется для целого круга веществ, производных циановодорода. Так уже сама синильная кислота существует в двух таутомерных формах:
При комнатной температуре равновесие превращения циановодорода в изоциановодород смещено влево. Показано, что менее стабильный изоциановодород более токсичен.
Таутомерные формы фосфористой кислоты
Аналогичное превращение известно для циановой кислоты, которая известна в трёх изомерных формах, однако таутомерное равновесие связывает только две из них: циановую и изоциановуюкислоты:
Амид-иминольную таутомерию лактамов называют лактам-лактимной таутомерией. Она играет большую роль в химии гетероциклических соединений. Равновесие в большинстве случаев смещено в сторону лактамной формы.
Особенно велик перечень органических загрязняющих веществ. Их разнообразие и большая численность делают практически невозможным контроль за содержанием каждого из них. Поэтому выделяют приоритетные загрязнители (около 180 соединений, объединенные в 13 групп): ароматические углеводороды, полиядерные ароматические углеводороды (ПАУ), пестициды (4 группы), летучие и малолетучие хлорорганические соединения, хлорфенолы, хлоранилины и хлорнитроароматические соединения, полихлорированные и полибромированные бифенилы, металлорганические соединения и другие. Источниками этих веществ являются атмосферные осадки, поверхностные стоки и производственные и коммунально-бытовые СВ.
Восстановление нитросоединений . Все нитросоединения восстанавливаются в первичные амины. Если образующийся амин летуч, его можно обнаружить по изменению окраски индикаторной бумажки:
Для третичных алифатических нитросоединений специфических реакций обнаружения не имеется.
Обнаружение ароматических нитросоединений. Ароматические нитросоединения обычно окрашены в бледно-желтый цвет. При наличии других заместителей интенсивность и глубина окраски часта усиливается. Для обнаружения ароматических нитросоединений их восстанавливают в первичные амины, последние диазотируют и сочетают с β-нафтолом:
| ArNO 2 →ArNH 2 → ArN 2 Cl → ArN=N |
| OH |
Эта реакция, однако, не является специфической, так как амины образуются при восстановлении не только нитросоединений, но и нитрозо-, азоокси-и гидразосоединений. Для того чтобы сделать окончательный вывод о наличии в соединении нитрогруппы, нужно провести количественное определение.
Качественные реакции N-нитрозосоединений
Реакция с HI. С-Нитрозосоединения можно отличить от N- нитрозосоединений по их отношению к подкисленному раствору йодистого калия: С-нитрозосоединения окисляют иодистоводородную кислоту, N-нитрозосоединения с иодистоводородной кислотой не реагируют.
| ArN = O + H 2 N – Ar → Ar – N = N – Ar + H 2 O |
Реакционная смесь окрашивается в розовый цвет; постепенно окраска становится пурпурной.
Качественные реакции нитрилов
В анализе нитрилов RC≡N, ArC≡N используется их способность гидролизоваться и восстанавливаться. Для обнаружения C≡N группы проводят гидролиз:
| RC ≡ N + H 2 O → R – CONH 2 |
Иногда удобно гидролиз нитрила прервать на стадии амида, если амид плохо растворим в воде и в спирте. В этом случае реакцию ведут с 2 н. NaOH в присутствии перекиси водорода:
Качественные реакции тиолов (тиоспиртов, тиоэфиров)
| 2RSH + PbO → (RS) 2 Pb + H 2 O |
Меркаптиды свинца и меди окрашены.
Алкилнитриты имеют более низкие температуры кипения
Нитросоелинения сильно полярны и имеют большой дипольный момент
Алкилнитриты легко омыляются щелочами и минеральными кислотами с образованием соответствующих спиртов и азотистой кислоты или ее соли.
Получение
Химические свойства
При восстановлении нитросоединений образуются первичные амины:
Первичные и вторичные нитросоединения растворимы в щелочах с образованием солей. Водородные атомы при углероде, связанном с нитрогруппой активируются, в результате в щелочной среде ниросоединения перегруппировываются в аци-нитро-форму:
При обработке минеральной кислотой щелочного раствора нитросоединения образуется сильно кислая аци-форма, которая быстро изомеризуется в обычную нейтральную форму:
Первичные и вторичние нитросоединения реагируют с азотистой кислотой, третичные не реагируют:
Щелочные соли нитроловых кислот в растворе имеют красный цвет, псевдонитролы – синий или зеленовато-синий.
Первичные и вторичные ниросоединения конденсируются в присутствии щелочей с альдегидами, образуя нитроспирты (нуклеофильное присоединение):
Аци-формы первичных и вторичных нитросоединений в водных растворах при действии минеральных кислот образуют альдегиды или кетоны:
Первичные нитросоединения при нагревании с 85%-ной серной кислотой переходят в карбоновые кислоты с отщеплением гидроксиламина. Это происходит в результате гидролиза образующейся аци-формы.
(реакция Коновалова- протекает избирательно:
третичный атом С > вторичный >первичный
В реакциях восстановления нитросоединения превращаются в амины.
2. Восстановление в растворе:
а) в щелочной и нейтральной среде получаются амины:
R-NO 2 + 3(NH 4) 2 S RNH 2 + 3S + 6NH 3 +2H 2 O (реакция Зинина )
R-NO 2 + 2Al + 2KOH + 4H 2 O RNH 2 + 2K
б) в кислой среде (железо, олово или цинк в соляной кислоте) получаются соли аминов: R-NO 2 + 3Fe + 7HCl Cl — + 2H 2 O + 3FeCl 2
Строение
Также атом азота имеет два неспаренных электрона, что обуславливает свойства аминов как органических оснований.
КЛАССИФИКАЦИЯ АМИНОВ.
По количеству и типу радикалов, связанных с атомом азота:
| АМИНЫ | Первичные амины | Вторичные | Третичные амины |
| Алифатические | CH 3 — NH 2 Метиламин | (CH 3 ) 2 NH | (CH 3 ) 3 N Триметиламин |
| Ароматические |  | (C 6 H 5 ) 2 NH Дифениламин |  |
1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин . Различные радикалы перечисляются в алфавитном порядке. При наличии одинаковых радикалов используют приставки ди и три .
2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH 2 .
В этом случае аминогруппа указывается в названии приставкой амино- :
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
ИЗОМЕРИЯ АМИНОВ
1) углеродного скелета, начиная с С 4 H 9 NH 2:
3) изомерия между типами аминов – первичный, вторичный, третичный:
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой. Например:
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов:
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения, т.к. в спиртах водородная связь более прочная :
Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой :
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Анилин : С 6 H 5 -NH 2 – важнейший из ароматических аминов:
Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).

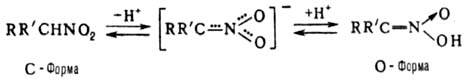
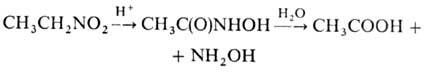
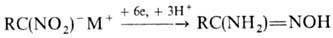
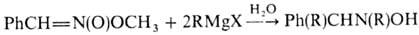
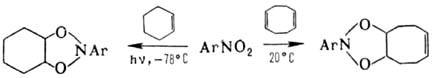
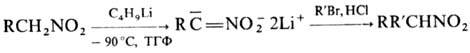
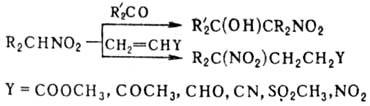
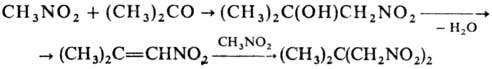
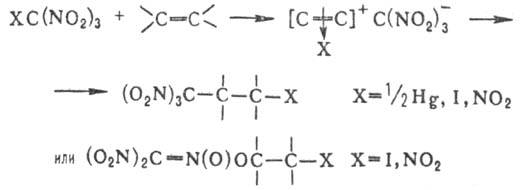
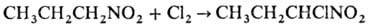
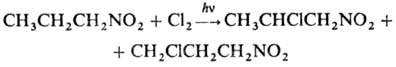
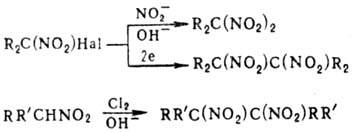
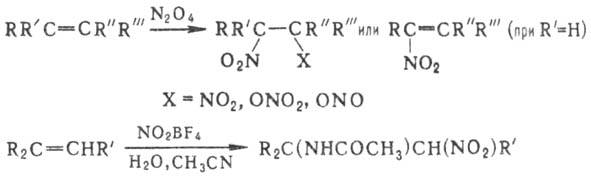


























 (1)
(1) (7)
(7) (10)
(10) (11) (11 32)
(11) (11 32) (12)
(12) (13) (11 33)
(13) (11 33) (14)
(14) (15)
(15) (16)
(16) (17)
(17) (18)
(18) (19)
(19)
 (20)
(20) (11 34)
(11 34) (21)
(21) (б)
(б) 




