Нейрональный цероидный липофусциноз 2 типа что это
Нейрональный цероидный липофусциноз 2 типа что это
Нейрональные цероидные липофусцинозы (CLN, болезнь Баттена) представляют собой гетерогенную группу заболеваний, характеризующихся накоплением определенных липопигментов, обеспечивающих сходные морфологические свойства и окрашивание липофусцином, аутофлуоресцентным пигментом, обнаруживаемым во многих тканях животных. Несмотря на то, что термин «липофусцин», обозначающий пигмент, накапливающийся в нейронах с возрастом, используется часто, липопигменты, являющиеся компонентами накапливаемой субстанции, называемой восковидной, варьируют (Seehafer и Pearce, 2006).
Ультраструктурное строение восковидной субстанции неоднородно. Химическая природа данных пигментов описана не полностью. Липофусцин в норме накапливается в нервных клетках с возрастом, количество его варьирует и рассматривается как вещество, свойственное старению.
Основной компонент пигментных накоплений младенческого и ювенильного восковидного липофусциноза включает субъединица С АТФ-синтазы дыхательной цепи. Восковидная субстанция накапливается в основном в структурах, подобных лизосомах, характеризующихся положительной реакцией на кислую фосфатазу.
Нейрональные цероидные липофусцинозы (CLN, болезнь Баттена) являются наиболее частными дегенеративными заболеваниями детского возраста. Описано восемь основных типов и ряд недостаточно изученных форм. В настоящее время выделено и описано не менее шести различных генов, расположенных на различных хромосомах (Mole et al., 2004, 2005).
Восковидный липофусциноз является генетически детерминированным прогрессирующим дегенеративным заболеванием, поражающим ЦНС и сетчатку. Заболевания детского возраста являются аутосомно-рецессивными. Основные неврологические проявления, эпилепсия, миоклонус и когнитивная деградация отражают преимущественное поражение серого вещества (Santavuori et al., 2001).
Нейрональные цероидные липофусцинозы (CLN, болезнь Баттена) встречаются в разных этнических группах; тем не менее, отмечаются этнические вариации.
Младенческая форма, редко встречающаяся в большинстве стран, часто отмечается в Финляндии, где ее частота составляет 7,7 на 100000 живых новорожденных, в то время как ювенильная форма типична для Великобритании и Германии, другие типы заболевания также выявляются преимущественно в отдельных популяциях (Goebel и Wisniewski 2004; Mole, 2004).
Цероидный липофусциноз может рассматриваться как лизосомальное заболевание. Фактически, дефицит лизосомальных ферментов выявлен при некоторых формах (см. далее) заболевания, но аномалии и дисфункция структурных белков также участвует в патогенезе (Goebel и Winiewski, 2004).
Термин нейрональный восковидный липофусциноз не полностью отражает природу заболевания, так как липопигмент также обнаруживается во многих тканях вне нервной системы, нахождение пигмента в нервной ткани до сих пор является основой диагностики CLN. Тем не менее, выявление нескольких генетических мутаций в настоящее время позволяет осуществлять молекулярную диагностику нескольких форм заболевания.
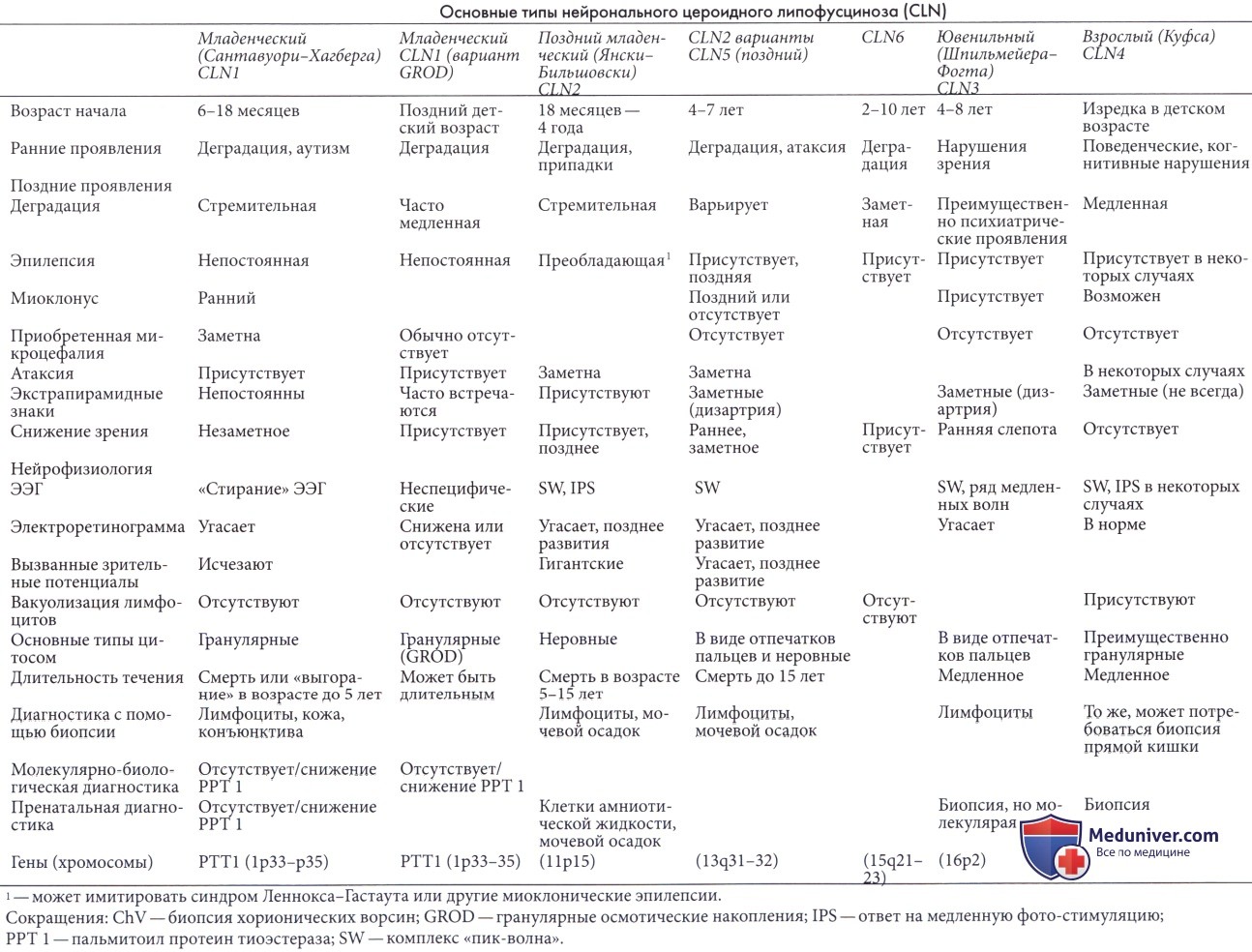
Классификация нейрональных цероидных липофусцинозов (CLN, болезни Баттена) включает четыре основных формы: CLN1 типа или классический младенческий тип, CLN2 или поздний младенческий тип, CLN3 или ювенильный тип и CLN4 или взрослый тип (Goebel et al., 1995). В одном из исследований из 520 случаев не было классифицировано 20% (Goebel и Wisniewski, 2004).
Редактор: Искандер Милевски. Дата публикации: 17.12.2018
Нейрональный цероидный липофусциноз
Нейрональный цероидный липофусциноз (НЦЛ) – это группа генетических заболеваний, в основе которых лежит накопление в клеточных структурах нейронов и других тканей токсического пигмента – липофусцина. Патология наследуется по аутосомно-рецессивному типу.
Патогенез нейронального цероидного липофусциноза
В основе патогенеза лежит нарушение утилизации пигмента липофусцина. Он накапливается в тканях организма человека и в норме, но гораздо медленнее. В случае нейронального цероидного липофусциноза это накопление происходит стремительно и приводит к атрофии тканей. Липопигменты локализуются в клеточных органеллах – лизосомах, выполняющих функцию утилизации отработанных клеточных элементов.
Ранее в основе классификации нейронального цероидного липофусциноза лежал возраст пациента, в котором начинало манифестировать заболевание. В зависимости от этого выделяли 4 типа патологии:
По мере изучения наследственных болезней были выявлены мутации в генах NCL, которые и легли в основу современной классификации. В настоящее время выделяют 10 типов заболевания в зависимости от имеющихся генетических нарушений.
Клинические проявления нейронального цероидного липофусциноза
Нейрональный цероидный липофусциноз является прогрессирующим заболеванием детей и подростков, однако некоторые формы патологии могут развиваться и у взрослых людей младше 40 лет. До появления клинических проявлений дети ничем не отличаются от своих сверстников.
Манифестация заболевания проявляется одним из трех признаков:
По мере прогрессирования присоединяются следующие признаки:
Со времени возникновения первых симптомов состояние ребенка быстро ухудшается. Гибель происходит в течение нескольких лет. При благоприятных формах нейронального цероидного липофусциноза пациенты редко переживают сорокалетний рубеж.
Методы лечения нейронального цероидного липофусциноза
На сегодняшний день эффективного патогенетического лечения нет, однако состояние пациентов можно облегчить с помощью симптоматической терапии. Это назначение противоэпилептических препаратов, миорелаксантов, седативных, антипсихотических, обезболивающих средств, витаминов. Иногда временное улучшение приносит физиотерапия.
В некоторых странах ведется активный поиск методов лечения, который сосредоточен на трех направлениях:
В целом есть обнадеживающие результаты, позволяющие надеяться на победу страшной болезни в будущем. В США и Европе зарегистрирована фермент-заместительная терапия рекомбинантной альфа-церлипеназой (Бринейра). Препарат позволяет прекратить прогрессирование заболевания.
В рамках диагностического поиска используется нейровизуализация (МРТ, ПЭТ), ЭЭГ, электроретинограмма. Активно применяется гистологическое исследование, но наиболее ценной информацией обладает молекулярно-генетическая диагностика для определения мутаций в генах. Исследуется материал от обоих родителей и ребенка. На основании полученных данных делается заключение о наличии или отсутствии у пациента нейронального цероидного липофусциноза.
Государство есть не везде
Дети с болезнью Баттена выживут только в Москве и Чечне?
32 человека – столько сейчас живет в России детей с диагностированным орфанным заболеванием «нейрональный цероидный липофусциноз 2-го типа» (НЦЛ-2), известным также как болезнь Баттена. Болезнь тяжелая: без необходимого лечения пациенты не доживают до взрослого возраста. Москва и Чеченская Республика сегодня единственные регионы, где родителям не нужно добиваться жизненно важного лекарства в судах. В других субъектах РФ на суды уходит время, во многих случаях состояние детей непоправимо ухудшается.
Болезнь Баттена входит в перечень орфанных заболеваний Минздрава РФ как «болезнь эндокринной системы, расстройства питания и нарушения обмена веществ». Особенности течения: проявляется не раньше 23 лет, поражает клетки головного мозга. Из-за этого у пациентов начинаются эпилептические приступы, ухудшаются интеллект, двигательные функции, речь, зрение. К 78 годам дети с болезнью Баттена не встают с постели, умирают в 1012 лет.
Единственный препарат, способный остановить развитие заболевания, – церлипоназа альфа, появившийся на медицинском рынке в 2017 году под торговым названием бринейра. В России лекарство не зарегистрировано (в данный момент проходит процедуру регистрации) и стоит дорого: годовой курс лечения обходится около 5060 млн руб. Причем принимать препарат нужно пожизненно, один раз в две недели. Лекарство вводится прямо в головной мозг пациента с помощью специального порта, установка которого требует хирургического вмешательства.
Церлипоназа альфа не возвращает утраченные функции организма – препарат стабилизирует текущее состояние, продлевает жизнь и повышает ее качество. Чем раньше начинается терапия, тем лучше.
То лучше, то хуже
У Варвары Муфахаровой из города Гулькевичи Краснодарского края болезнь проявилась в январе 2019-го, когда ей было три года. Эпилептические приступы случались так часто, что у девочки, прежде не отстававшей в развитии от сверстников, отказали ноги, она почти перестала говорить.
Точный диагноз – НЦЛ-2 – семья узнала только спустя полгода, после сдачи генетического анализа. Почти сразу врачи назначили препарат церлипоназа альфа. Однако Минздрав Краснодарского края не обеспечивает лекарством маленькую пациентку, несмотря на решение суда «к немедленному исполнению».
Суд состоялся в январе 2020 года. В конце марта Министерство здравоохранения Краснодарского края получило разрешение на ввоз необходимого Варваре лекарства, но вместо объявления государственных торгов на закупку обратилось к производителю церлипоназы альфа с просьбой предоставить препарат бесплатно.
Фармацевтическая компания BioMarin, которая производит церлипоназу альфа, выделила несколько флаконов лекарства, но при одном условии: лечение Варвары Муфахаровой безо всякого перерыва обязательно подхватит краевой минздрав.
В начале июля девочка получила первую инфузию препарата. После второго приема, по словам мамы Татьяны Митейко, Варя начала ползать. После третьего и четвертого вливания стала снова учиться ходить. Заново вспоминала слова, которые перестала произносить. Когда лекарства оставалось еще на два вливания, в минздраве родителям сообщили: средства на закупку препарата ищут. Последняя инфузия прошла в конце сентября. Следующая была запланирована через две недели, но лекарство минздрав не предоставил.
В конце октября Минздрав Краснодарского края в очередной раз ответил родителям Варвары Муфахаровой: «Учитывая. что лечение необходимо проводить дорогостоящим препаратом. изыскиваются финансовые средства для проведения процедуры закупки».
Состояние девочки с момента последней инфузии ухудшилось. Варвара Муфахарова почти перестала есть и спать. Ее опять не держат ноги. Вернулись частые эпилептические приступы.
– Церлипоназа альфа – препарат серьезный, его нельзя сначала назначить, сделать несколько инфузий, а потом без медицинского заключения прекратить лечение, – говорит Анастасия Татарникова, руководитель автономной некоммерческой организации «Дом редких», которая помогает российским пациентам с орфанными заболевания, в том числе детям с НЦЛ-2, защищать свои права. – Кроме того, врачи сразу заметили улучшение состояния Вари. Это не рядовая ситуация, потому что эффект церлипоназы альфа обычно оценивают не ранее чем через полгода после начала лечения.
Лечащие врачи девочки еще в сентябре сообщили в Минздрав Краснодарского края о том, что их маленькой пациентке значительно лучше.
– Даже в этом смысле у ведомства не может быть сомнений в необходимости препарата, – подчеркивает Анастасия Татарникова.
В неизвестности
Насколько долго Варе Муфахаровой придется ждать лекарства и насколько необратимы будут ухудшения в ее случае – неизвестно. Ее маме в Министерстве здравоохранения Краснодарского края обещают, что деньги вот-вот выделят или уже выделили, но подтверждения этому пока нет. Семья надеется на лучшее: в соседнем же регионе, в Ростовской области, лекарство для пятилетнего мальчика с НЦЛ-2 закупили на средства госбюджета. И гораздо быстрее, чем Варе Муфахаровой: суд прошел в марте 2020 года, позже, чем в Краснодарском крае, а пациент лечится с октября.
Правда, есть и другой пример, когда с препаратом региональный минздрав откровенно опоздал.
В Екатеринбурге семья Файдаровых два с половиной года – с середины 2017-го по конец 2019-го – добивалась покупки церлипоназы альфа для своих двоих детей-погодок – Дианы и Демида. У Дианы болезнь была выявлена раньше из-за начавшихся ухудшений. У Демида тяжелых проявлений заболевания еще не было. Чтобы его спасти, зафиксировать состояние, нужно было вводить назначенный врачами дорогой препарат. Сейчас дети Файдаровых получают лекарство, но Диана питается через зонд, а Демид уже не поднимается с постели.
В настоящий момент 12 детей из разных регионов России получают церлипоназу альфа. Пенза, Екатеринбург, Новосибирская, Владимирская, Воронежская, Ростовская и Московская области, Башкортостан, Хакасия – во всех этих регионах родителям пришлось судиться за лекарство и долго обивать пороги местных минздравов, чтобы их дети начали получать препарат бесплатно.
– Часто местные минздравы отказываются закупать лекарство из-за того, что оно не зарегистрировано в России, – объясняет юрист АНО «Дом редких» Кирилл Куляев. – Однако это не может становится причиной отказа, заявил Верховный суд в сентябре 2019 года во время процесса, где решалось, обеспечивать ли препаратом девочку с НЦЛ-2. Родители дошли до высшей инстанции, чтобы доказать свою правоту.
Решение Верховного суда сейчас помогает выигрывать в судах первой инстанции, однако региональные минздравы чаще всего подают апелляции, ждут решения суда второй инстанции, чтобы начать закупать препарат. Единственное исключение – Новосибирск: здесь церлипоназу альфа для ребенка купили после первого же судебного решения.
От чего зависит, насколько быстро будет исполняться решение суда? Юрист полагает, от политической воли в конкретных области или городе, человеческого фактора. Степень обеспеченности региона или его дотационность не всегда влияют на скорость финансовых поисков в бюджете, объявления закупок для обеспечения детей препаратом.
– Например, в Башкортостане были серьезные трудности с обеспечением ребенка непрерывной терапией, – рассказывает Кирилл Куляев. – Семье пытались помочь в прокуратуре, вмешался Следственный комитет, главу местного минздрава три раза привлекали к административной ответственности. Препарат в конце концов начали закупать, но по одному флакону, в лечении мальчика были перебои. Сейчас обеспечение наладилось, но что будет в следующем году, сказать трудно.
В Воронежской области, в городе Семилуки, тоже живет ребенок с НЦЛ-2. Его мать долго добивалась церлипоназы альфа для сына: местные СМИ описывали почти детективную историю, как врачи сначала согласились с тем, что препарат показан мальчику, а затем отказались от своего экспертного решения.
Почти в таком же положении, как Варя Муфахарова, сейчас находится пятилетняя Василиса Седова из Оренбурга. Единственное отличие: девочке еще не начинали вливать лекарство. В апреле мама Василисы, Анна Седова, выиграла суд, который встал на сторону маленькой пациентки с редким заболеванием. В сентябре апелляция оставила решение в силе. Пока региональный минздрав не торопится исполнять его, Василисе становится хуже.
Ни один родитель не откажется от борьбы за жизнь собственного ребенка. Но когда региональное здравоохранение сдастся, может быть уже поздно.
Куда переезжать?
Первая инфузия препарата церлипоназа альфа в России состоялась 26 августа 2019 года. Лекарство получила трехлетняя Лера Змейкова. Вливание прошло в одной из московских больниц, препарат девочке выдали по назначению врачей.
Лера, получившая лекарство в Москве, родом из Екатеринбурга – чтобы добиться помощи для дочери, пока заболевание не успело разрушительно отразиться на ее организме, родители практически сразу после постановки диагноза переехали в столицу. Они видели, к чему может привести долгое выбивание препарата из свердловского минздрава на примере брата и сестры Файдаровых и не хотели подобного повторения истории для Леры.
Лера Змейкова получает препарат регулярно, без перерывов и не отличается от остальных детей. В ее жизни существует только одно небольшое неудобство: приходится раз в две недели на три дня ложиться в больницу для проведения инфузии.
В чеченском селе Бено-Юрт девочка с НЦЛ-2 получила препарат после переписки родителей с республиканским минздравом, тоже без вмешательства суда.
В Москве кроме Леры Змейковой есть еще один ребенок с НЦЛ-2, его семья тоже переехала сюда из другого региона. Но переезжать в столицу всем семьям, где есть «редкие» дети, не выход, считает Кирилл Куляев:
– Если все нуждающиеся будут ехать за спасением в другой регион, пузырь орфанного обеспечения там очень быстро лопнет. Переезжать всем – это абсурд.
Известны случаи, когда российские семьи еще более кардинально меняли регион проживания ради лечения ребенка.
Анастасия Татарникова рассказывает о маме двоих сыновей с НЦЛ-2, которая переехала с детьми в Германию:
– Ее младшего сына позвали на клинические испытания церлипоназы альфа для детей до двух лет – старший не подходил по возрасту, но женщина все равно решила уезжать. Ей пришлось выбирать жизнь хотя бы для одного ребенка. Мы на связи с семьей, мама говорит, что очень скучает по родине, но высоко отзывается об организации медицинской помощи в Германии, в том числе паллиативной, которая уже необходима ее старшему сыну.
Дети из еще двух российских семей были приглашены на клинические исследования. После их завершения прием препарата церлипоназа альфа должен продолжаться, поэтому семьи решили обосноваться в Европе. Родители рассудили, что за границей шансов у их детей выжить гораздо больше.
Для того чтобы изменить ситуацию к лучшему и не заставлять семьи с тяжелобольными детьми ждать или переезжать в другую страну или в другой регион, необходимо переводить лекарственное обеспечение орфанных заболеваний, в том числе НЦЛ-2, на федеральный уровень, считают сотрудники АНО «Дом редких».
Сейчас в России создается фонд помощи детям с редкими болезнями, в октябре Анастасия Татарникова принимала участие в общественном обсуждении его возможной работы. Она надеется, что НЦЛ-2 войдет в приоритетный для финансирования список заболеваний, который будет сформирован Минздравом РФ.
Нейрональный цероидный липофусциноз 2 типа что это
НЕЙРОНАЛЬНЫЙ ЦЕРОИДНЫЙ ЛИПОФУСЦИНОЗ 2 ТИП.
(НЦЛ 2, НЕДОСТАТОЧНОСТЬ ТРИПЕПТИДИЛ ПЕПТИДАЗЫ 1, КЛАССИЧЕСКИЙ ВАРИАНТ ПОЗДНЕЙ МЛАДЕНЧЕСКОЙ ФОРМЫ НЦЛ 2 ТИПА, БОЛЕЗНЬ ЯНСКОГО-БИЛЬШОВСКОГО, сLINCL).
CLN 2; CEROID LIPOFUSCINOSIS, NEURONAL, 2; CLN2; CEROID LIPOFUSCINOSIS, NEURONAL, 2, VARIABLE AGE AT ONSETJAN SKY-BIELSCHOWSKY DISEASE; NEURONAL CEROID LIPOFUSCINOSIS, LATE INFANTILE, INCLUDED; LINCL, INCLUDED
Генетика : мутации гена трипептидил пептидазы 1 (TPP1 MIM *607998). Ген картирован на коротком плече 11 хромосомы (локус 11p15).
Эпидемиология :суммарная частота встречаемости всех форм НЦЛ в мире составляет 1: 25000.
Тип наследования :аутосомно-рецессивный
Патогенез :при всех формах НЦЛ происходит накопление в лизосомах клеток аутофлюоресцентного липопигмента, который состоит из белков сапозинов А и D и/или субединицы с митохондриальной АТФ синтазы. Накапливаемый материал характеризуется аутофлюоресценцией в зелено-желтом спектре при возбуждении светом длиной от 340 до 360 нм. При гистохимическом окрашивании материал дает положительную реакцию на кислую фосфатазу и окрашивается суданом черным В, что свидетельствует о присутствии фосфолипидов. Он также является ШИК- положительным, что может указывать на высокое содержание углеводов. Большинство из этих свойств идентично свойствам так называемых пигментов «изнашивания», или «старения», обычно называемых липофусцинами или цероидами. При электронной микроскопии нейрональных и экстранейрональных тканей обнаруживают цитосомы, заполненные агрегатами характерной морфологии, описываемые как «криволинейные» профили, по типу «отпечатков пальцев», «прямолинейные» профили, гранулярные осмиофильные отложения.
Клинические проявления :в зависимости от возраста манифестации НЦЛ 2 типа подразделяют на три формы: врожденную, позднюю младенческую, юношескую формы. Классическая форма поздней младенческой формы НЦЛ широко распространена во всем мире, но с наибольшей частотой в западной Финляндии. Обычно первые симптомы появляются в возрасте от двух до четырех лет. Манифестными симптомами являются генерализованные тонико-клонические приступы, задержка речевого развития, атаксия. По мере развития заболевания присоединяются другие типы эпилептических приступов (миоклонические, парциальные, диалептические). Вслед за развитием эпилептических приступов развиваются интеллектуальные нарушения, и происходит утрата ранее приобретенных двигательных навыков. Часто у пациентов наблюдаются атаксия, мышечная гипотония, дизартрия. Зрительные нарушения, как правило, присоединяются позднее и прогрессируют очень медленно. Мышечная гипотония сменяется спастичностью, формируются сгибательные контрактуры конечностей, формируется псевдобульбарный синдром. В терминальную стадию болезни те же симптомы, что и при младенческой
Диагностика :основными методами подтверждения диагноза НЦЛ 2 типа являются определение активности ферментов в лейкоцитах крови или культуре клеток кожных фибробластов, молекулярно-генетические наследования, исследования биоптатов при электронной микроскопии
Нейрональный цероидный липофусциноз 2 типа что это
а) Нейрональный цероидный липофусциноз взрослых (болезнь Куфса, CLN4). Несмотря на название, CLN взрослых может начинаться в детстве или подростковом возрасте, первые симптомы могут появляться в возрасте трех лет (Berkovic et al., 1988). Заболевание начинается незаметно и проявляется преимущественно когнитивными и поведенческими нарушениями. В конечном счете формируется слабо выраженная деменция. При длительном течении заболевания могут появиться экстрапирамидные признаки, в частности, дискинезия лица.
Аномалии зрения или ухудшение зрения не отмечаются. У некоторых пациентов могут развиваться миоклонические припадки. Выделяют два типа заболевания (Berkovic et al., 1988): с прогрессирующей миоклонической эпилепсией и нейропсихиатрическими изменениями (Sadzot et al., 2000), с деменцией и двигательными, мозжечковыми и экстрапирамидными нарушениями. На ЭЭГ может выявляться заметная реакция на фотостимуляцию с высокоамплитудными пиками, синхронными со вспышками при низкой частоте повторения. Большая часть зарегистрированных случаев являлись спорадическими, вероятно, аутосомно-рецессивными. В редких семьях вероятно доминантное наследование.
Могут обнаруживаться цитосомы, содержащие гранулярные осмиофильные включения, но обнаружение их вне нервной ткани может быть затруднено.
б) Другие атипичные формы. Такие формы могут составлять до 10-20% случаев по результатам некоторых наблюдений (Dyken и Wisniewski 1995; Goebel и Wisniewski 2004). Предложено несколько классификаций, некоторые содержат более 15 различных групп, но ни одна из классификаций полностью не признана (Dyken и Wisniewski, 1995). Предстоит еще установить, являются ли редко встречающиеся формы отдельными нозологическими единицами или только вариантами течения классических форм заболевания.
Несколько случаев врожденного CLN (тип Нормана-Вуда) были зарегистрированы Dyken and Wisniewski (1995). Данная форма характеризуется стремительным развитием смертельной дыхательной недостаточности и эпилептического статуса; недавно было высказано предположение, что причиной заболевания является дефицит лизосомального катепсина D (Siintola et al., 2006). В начале заболевания появляются выраженные симптомы со стороны зрения и медленно прогрессирующие припадки и деменция. Преобладание нелинейных включений и нарушение зрения отличает данное заболевание от взрослой формы.
Пигментный вариант (Goebel et al., 1995) начинается в детстве и также характеризуется длительным течением, но отличается внешним видом накапливающихся включений. Описан хронический младенческий тип (Dyken и Wisniewski, 1995) и случаи заболевания в детстве, изолированные случаи с хореей, спиноцеребеллярными симптомами, нейропатией и медленным прогрессированием. Зарегистрировано несколько случаев, сочетающихся с остеопорозом (Takahashi et al., 1990), которые могут начинаться в пренатальном периоде.
в) Диагностика. Диагностика CLN может быть затруднена при менее типичных формах заболевания. Нейрофизиологические проявления, особенно аномалии электроретинограммы и характерный ответ на ЭЭГ при низкочастотной световой стимуляции (1-3 Гц), типичны при поздней младенческой форме и некоторых «взрослых» формах. Атрофия головного мозга, выявляемая при нейровизуализации, обычно проявляется рано, но может и не обнаружиться в первый год болезни. Снижение сигнала таламуса в Т2-режиме, выявляемое при CLN1,2, 3,4, 5, 6 и турецком типе позднего младенческого CLN, подозрительно, но не специфично (Autti et al., 2007).
Молекулярное генетическое тестирование при классических типах CLN (1, 2 и 3) путем оценки содержания пальмитоил-протеин тиоэстеразы при CLN1 и активности трипептил-пептидазы 1 при CLN2 (Young et al., 2001) является наиболее эффективным методом диагностики. Анализ мутаций возможен при формах заболевания, для которых имеется клонированный ген (Zhong, 2001). Методы диагностики редких форм заболевания до сих пор разрабатываются. При некоторых формах заболевания единственным доступным методом диагностики является выявление характерных включений в лимфоцитах, коже, конъюнктиве или других экстраневральных тканях.
Ни один из типов включений не является специфичным для конкретной формы заболевания, тем не менее, обычно имеется преобладающий тип. Результаты биопсии экстраневральных тканей изредка отказываются отрицательными. В таких случаях при биопсии прямой кишки можно выявить нейроны, содержание патологические включения.
Пренатальная диагностика форм заболевания, для которых выявлен конкретный ген, может проводиться на основании тех же молекулярных технологий. Также возможна диагностика на основании морфологической оценки включений в клетках амниотической жидкости или биоптатов ворсин хориона (Chow et al., 1993) или на основании выявления субъединицы С митохондриальной АТФ-азы при CLN2 и 3 в сочетании со сцеплением ДНК при CLN 1 и 3 (Goebel et al., 1995). В отдельных случаях CLN 1 возможно выявление носителей.
г) Лечение. Предложено лечение антиоксидантами (витамином Е и С, селеном) (Santavuori et al., 1985), но результаты, к сожалению, ограничены. При большинстве типов заболевания необходимо противосудорожное лечение. Часто эффективны вальпроат натрия и/или клоназепам, но противосудорожное лечение должно подбираться индивидуально, а припадки могут быть полностью рефрактерными.
Пациентам и их семьям необходим поддерживающий уход, чтобы помочь в борьбе с тяжким заболеванием.
Редактор: Искандер Милевски. Дата публикации: 18.12.2018