Нейроэндокринная дифференцировка что это
Нейроэндокринная дифференцировка что это
Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина, Москва, Россия
Введение
Нейроэндокринные опухоли (НЭО) – группа редких опухолей, которые могут развиваться в любых органах, имеют свои уникальные особенности происхождения, течения и диагностики. НЭО объединяют разнородную группу опухолей, способных вырабатывать и запасать биологически активные вещества (гормоны, пептиды, нейропередатчики), экспрессировать нейроэндокринные маркеры, что является их основной характеристикой и нередко сопровождается яркими симптомами болезни.
Представления о НЭО развивались в течение длительного времени, которое потребовалось для накопления достаточного материала и формирования определенной концепции о природе данных опухолей.
Развитие визуальных, иммуногистохимических методов диагностики, идентификация основных биохимических маркеров, эффективный анализ большой выборки эпидемиологических данных, генетические исследования свидетельствуют о неуклонном росте заболеваемости и необходимости поиска новых подходов к диагностике и лечению НЭО.
В настоящее время наиболее перспективным решением служит корпоративное, или полидисциплинарное, взаимодействие между различными научными направлениями и медицинскими специальностями.
Для решения современных проблем эпидемиологии, диагностики и лечения НЭО в 2009 г. создано междисциплинарное сообщество МОЛНЭО (Медицинское общество по лечению нейроэндокринных опухолей), основным направлением деятельности которого и являются концентрация, анализ и пропаганда знаний о НЭО различных локализаций.
Эпидемиология НЭО
В России в настоящее время начал функционировать Регистр базы данных по заболеваемости НЭО, который также демонстрирует рост заболеваемости, аналогичный международным статистическим данным. Анализ базы данных SEER (Surveillance, Epidemiology and End Results) показал, что заболеваемость НЭО в 2010 г. достигла 5,25/100 тыс. в год. Несмотря на то что частота встречаемости НЭО составляет всего 1–2 случая на 100 тыс., при аутопсии данный показатель выше и равен 8,4 на 100 тыс. населения. Частота обнаружения НЭО при аутопсии свидетельствует о том, что их распространенность существенно выше регистрируемой [2, 3].
НЭО – это чаще всего медленнорастущие новообразования, диагностируемые на поздних стадиях [1].
Бронхопульмональные НЭО составляют до 3% всех злокачественных новообразований этой локализации и порядка 25% всех НЭО. Большая часть НЭО представлена опухолями органов желудочно-кишечного тракта (ЖКТ), включая поджелудочную железу (ПЖ). Эти новообразования составляют до 2% всех злокачественных новообразований пищеварительной системы и более 60% всех НЭО. Наиболее частыми локализациями в этой группе являются подвздошная кишка (17,1%), прямая кишка (16,3%), желудок (5,4%) и аппендикс (4,7%). Встречаются также НЭО редких локализаций (производных эмбрионального нервного гребешка, нейроэктодермы и эндодермы), частота которых составляет порядка 15% всех НЭО. Потому НЭО могут выявляться в эндокринных (феохромоцитома и параганглиома, медуллярный рак щитовидной железы, опухоли паращитовидных желез и передней доли гипофиза) и других органах (вилочковая, молочная, предстательная железы, почки, яичники, кожа).
I. НЭО пищеварительного тракта
Согласно классификации Всемирной организации здравоохранения (ВОЗ, 2010), НЭО высокой степени дифференцировки подразделяются на высокодифференцированные (ВД) НЭО (NET) G1 и G2.
Для НЭО пищеварительного тракта митотический индекс NET G1 20% или с числом митозов >20 в 10 полях зрения при большом увеличении (при этом для НЭК легкого и тимуса принимается во внимание только число митозов и значение >10 в 10 полях зрения). НЭК представляют собой опухоли с агрессивным течением, выраженной ядерной атипией и мультифокальными некрозами [5]. От других низкодифференцированных карцином НЭК отличается экспрессией нейроэндокринных маркеров – диффузной для синаптофизина, фокальной для хромогранина А. Все больше данных свидетельствуют о разнородности данной группы опухолей. Различие может определяться не только локализацией первичной опухоли (ЖКТ, ПЖ, легкие и т.п.), но и степенью дифференцировки. Например, известно, что НЭК с Ki-67>55% лучше отвечают на платиносодержащую химиотерапию, но в то же время продолжительность жизни на 4 месяца меньше, чем при НЭО с Ki-67 от 20 до 55% [5]. Среди НЭК отдельно выделяют мелко- и крупноклеточный нейроэндокринный рак. Для мелкоклеточного рака индекс пролиферации может составлять от 55 до 100%, а для крупноклеточного рака – от 40 до 70%. Дальнейшие морфологические и молекулярно-генетические исследования, возможно, позволят более четко разделить данную группу НЭО на ВД опухоли G3 и низкодифференцированную карциному G3.
Эпидемиология
НЭК гастроэнтеропанкреатической локализации составляет лишь 1% от всех злокачественных опухолей этой зоны. В 85% случаев выявляются метастазы, причем в 65% случаев – отдаленные [6, 22]. Наиболее часто выявляются метастазы в печени (70%), затем в легких (15%), костях (15%) и головном мозге (4%) [22]. У мужчин и женщин заболевание выявляется с одинаковой частотой. Средний возраст выявления заболевания составляет 60 лет [22]. Что касается НЭК грудной локализации, то мелкоклеточный рак составляет 20%, крупноклеточный нейроэндокринный рак – 3% всех случаев злокачественных опухолей легких. Мелкоклеточный рак легкого (МРЛ) выявляется, как правило, у мужчин с длительным периодом курения и в возрасте более 65 лет. Наиболее часто МРЛ метастазирует в печень, головной мозг, надпочечники, кости и костный мозг, причем в 2/3 случаев МРЛ выявляется уже с отдаленными метастазами.
Особенности клинических проявлений
В большинстве случаев НЭК не сопровождаются гормональными синдромами, а т.к. две трети опухолей диагностируются с наличием отдаленных метастазов, клинические проявления, как правило, характеризуются общими симптомами распространенного онкологического заболевания – анорексией, потерей массы тела и слабостью. Однако следует отметить следующие характерные гормональные синдромы, которыми иногда проявляется МРЛ, а именно синдром Кушинга (гиперсекреция адренокортикотропного гормона – АКТГ; в 4% случаев) и синдром неадекватной секреции антидиуретического гормона (АДГ; в 4% случаев). Клиническая картина синдрома Кушинга проявляется прежде всего ожирением, стриями на коже, избыточным ростом волос на теле, нарушением менструального цикла и бесплодием у женщин, снижением сексуального влечения и потенции у мужчин, мышечной слабостью, повышением артериального давления, развитием сахарного диабета и снижением иммунитета. При синдроме неадекватной секреции АДГ в результате задержки жидкости развиваются гиперволемия и симптомы водной интоксикации: олигурия, головные боли, головокружение, анорексия, тошнота, рвота, нарушение сна. Первые симптомы водной интоксикации появляются после снижения уровня натрия в плазме крови ниже 120 ммоль/л. При более выраженной гипонатриемии на первый план выходят симптомы со стороны центральной нервной системы: дезориентация, судороги, аритмия и коматозное состояние вследствие отека головного мозга.
Прогноз и выживаемость
Выживаемость при НЭК низкая и может составлять от 5 месяцев при диссеминированном процессе до 38 при локализованном [7]. При диссеминированном процессе лишь 5% больных имеют длительную продолжительность жизни [8]. Выживаемость без прогрессирования после платиносодержащей химиотерапии и общая выживаемость различаются в зависимости от локализации первичной опухоли – наихудшие показатели при НЭК пищевода, ободочной и прямой кишки в отличие от НЭК желудка и ПЖ [5]. К факторам неблагоприятного прогноза относятся плохое общее состояние, повышенный уровень лактатдегидрогеназы (ЛДГ) и тромбоцитоз.
Диагностика
Биохимические маркеры. При распространенных НЭК уровень хромогранина А в плазме может быть повышен у 2/3 пациентов [5], хотя значения в целом ниже таковых при высокодифференцированных НЭО [9, 10]. Напротив, уровень такого маркера, как нейронспецифическая енолаза, выше при низкодифференцированных опухолях и достоверно коррелирует с выживаемостью.
Эндоскопические и рентгенологические исследования. Эндоскопические исследования (бронхоскопия, гастроскопия, колоноскопия, энтероскопия) позволяют не только диагностировать первичную опухоль, но и брать биопсию. После подтверждения НЭК при гистологическом исследовании необходимо выполнить КТ или МРТ всех зон для оценки распространенности процесса и выработки тактики лечения. Позитронно-эмиссионная томография (ПЭТ) может быть полезной, если планируется радикальное оперативное вмешательство или если необходима оценка неоднозначных данных КТ или МРТ. Исследования с мечеными изотопами аналогами соматостатина не рекомендованы к использованию в рутинной практике, т.к. низкодифференцированные опухоли в основном не экспрессируют рецепторы к соматостатину. Хотя при НЭК некоторых локализаций возможно выполнение данного исследования. В частности, до 45% НЭК ПЖ позитивны при изотопных исследованиях с аналогами соматостатина [5] и особенно при более низких значениях Ki-67 (
1. Modlin I.M., Champaneria M.C., Chan A.K.C., Kidd M. A three-decade analysis of 3,911 small intestinal neuroen-docrine tumors: the rapid pace of no progress. Am. J. Gastroenterol. 2007;102(7):1464–73.
2. Strosberg J.R., Nasir A., Hodul P., Kvols L. Biology and treatment of metastatic gastrointestinal neuroendocrine tumors. Gastrointest Cancer Res. 2008;2(3):113–25.
3. Berge T., Linell F. Carcinoid tumours. Fre-quency in a defined population during a 12-year period. Acta Pathol Microbiol Scand. 1976;84(4):322–30.
4. Kaltsas G.A., Besser G.M., Grossman A.B. The Diagnosis and Medical Management of Advanced Neuroendocrine Tumors. Endocrin. Rev. 2004;25(3):458511.
5. Sorbye H., Welin S., Langer S.W., et al. Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study. Ann. Oncol, 2013;24(1):152–60.
6. Garcia‐Carbonero R., Capdevila J., Crespo-Herrero G., et al. Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP‐NETs): results from the National Cancer Registry of Spain (RGETNE). Ann. Oncol, 2010;21(9):1794–803.
7. Sorbye H., Strosberg J., Baudin E., et al. Gastroenteropancreatic high‐grade neuroendocrine carcinoma. Cancer. 2014;120(18):2814–23. Doi:10.1002/cncr.28721.
8. Rindi G., Falconi M., Klersy C., et al. TNM staging of neoplasms of the endocrine pancreas: results from a large international cohort study. J. Natl. Cancer Inst. 2012;104(10):764–77.
9. Korse C.M., Taal B.G., Vincent A., et al. Choice of tumour markers in patients with neuroendocrine tumours is dependent on the histological grade. A marker study of Chromogranin A, Neuron specific enolase, Progastrin‐releasing peptide and cytokeratin fragments. Eur. J. Cancer. 2012;48(5):662–71. Doi: 10.1016/j.ejca.2011.08.012.
10. Baudin E., Gigliotti A., Ducreux M., et al. Neuron‐specific enolase and chromogranin A as markers of neuroendocrine tumours. Br. J. Cancer., 1998;78(8):1102.
11. Brenner B., et al. Small cell carcinomas of the gastrointestinal tract: clinicopathological features and treatment approach. Semin Oncol. 2007;34(1):43–50. Doi: 10.1053/j.seminoncol.2006.10.022
12. Sørbye H., Westre B., Horn A. Curative surgery after neoadjuvant chemotherapy in metastatic poorly differentiated neuroendocrine carcinoma. Eur. J. Surg. Oncol. (EJSO). 2007;33(10):1209–10.
13. Yamaguchi T., Machida N., Morizane C., et al. Multicenter retrospective analysis of systemic chemotherapy for advanced neuroendocrine carcinoma of the digestive system. Cancer Sci. 2014;105(9):1176–81. Doi: 10.1111/cas.12473.
14. Moertel C.G., Kvols L.K., O’Connell M.J., Rubin J.Treatment of neuroendocrine carcinomas with combined etoposide and cisplatin. Evidence of major therapeutic activity in the anaplastic variants of these neoplasms. Cancer. 1991;68(2):227–32.
15. Mitry E., Baudin E., Ducreux M., et al. Treatment of poorly differentiated neuroendocrine tumours with etoposide and cisplatin. Br. J. Cancer. 1999;81(8):1351. Doi: 10.1038/sj.bjc.6690325
16. Iwasa S., Morizane C., Okusaka T., et al. Cisplatin and etoposide as first‐line chemotherapy for poorly differentiated neuroendocrine carcinoma of the hepatobiliary tract and pancreas. Jap. J. Clin. Oncol. 2010;40(4):313–18. Doi: 10.1093/jjco/hyp173.
17. Deutschbein T., Unger N., Yuece A., et al. Chemotherapy in patients with progressive, undifferentiated neuroendocrine tumors: a single‐center experience. Hormone and metabolic research Hormon‐und Stoffwechselforschung. Hormon. Metabol. 2011;43(12):838–43. Doi: 10.1055/s-0031-1284354.
18. Patta A. Fakih M. First‐line cisplatin plus etoposide in high‐grade metastatic neuroendocrine tumors of colon and rectum (MCRC NET): review of 8 cases. Anticancer Res. 2011;31(3):975–78.
19. Munhoz R.R., et al. Combination of irinotecan and a platinum agent for poorly differentiated neuroendocrine carcinomas. Rare tumors. 2013;5(3):e39–e39. DOI: 10.4081/rt.2013.e39.
20. Okita N.T., Kato K., Takahari D., et al. Neuroendocrine tumors of the stomach: chemotherapy with cisplatin plus irinotecan is effective for gastric poorly‐differentiated neuroendocrine carcinoma. Gastric. Cancer. 2011;14(2):161–65.
21. Nakano K., Takahashi S., Yuasa T., et al. Feasibility and efficacy of combined cisplatin and irinotecan chemotherapy for poorly differentiated neuroendocrine carcinomas. Jap. J. Clin. Oncol. 2012;42(8):697–703.
22. Okuma H.S., et al. Irinotecan plus Cisplatin in Patients with Extensive‐Disease Poorly Differentiated Neuroendocrine Carcinoma of the Esophagus. Anticancer Res. 2014;34(9):5037–41.
23. Lu Z., Li J., Lu M., et al. Feasibility and efficacy of combined cisplatin plus irinotecan chemotherapy for gastroenteropancreatic neuroendocrine carcinomas. Med. Oncol. 2013;30(3):1–5.
24. Kulke M.H., Stuart K., Enzinger P.C., et al. A phase II trial of irinotecan and cisplatin in patients with metastatic neuroendocrine tumors. Digest. Dis. Sci. 2006;51(6):1033–38.
25. Welin S., Sorbye H., Sebjornsen S., et al. Clinical effect of temozolomide‐based chemotherapy in poorly differentiated endocrine carcinoma after progression on first‐line chemotherapy. Cancer. 2011;117(20):4617–22. Doi: 10.1002/cncr.26124.
26. Ezziddin S., Opitz M., Attassi M., et al. Impact of the Ki‐67 proliferation index on response to peptide receptor radionuclide therapy. Eur. J. Nucl. Med. Mol. Imag. 2011;38(3):459–66.
Особенности диагностики нейроэндокринных опухолей
Нейроэндокринные опухоли (НЭО) — это гетерогенная группа новообразований, развивающихся из нейроэндокринных клеток. Такие клетки расположены в различных органах и секретируют биологически активные вещества, эффекты которых обуславливают многообразие клинической картины и трудности диагностики. Прежде чем попасть на прием к онкологу, пациентам зачастую бывают проведены консультации различных специалистов, обращение к которым вызвано симптоматикой новообразования. Ранняя диагностика НЭО в значительной мере зависит от онконастороженности непрофильных клиницистов и, конечно же, от морфологической верификации диагноза — «золотого правила» в онкологии, своеобразной точки отсчета онкологической истории.
Локализация НЭО крайне разнообразна, но чаще всего они обнаруживаются в органах пищеварительной системы (более 50 %): прямая (17,2 %) и тонкая кишка (13,4 %), желудок (6,0 %), поджелудочная железа (6–7 %). НЭО занимают второе место в общей структуре онкологической патологии ЖКТ, уступая лидерские позиции лишь колоректальному раку. Около 27 % случаев НЭО возникают в легких (согласно базе данных Surveillance, Epidemiology, and End Results (SEER) 1975-2016) [1].
Еще недавно обсуждались вопросы включения НЭО в список орфанных заболеваний. Но в настоящее время отмечается увеличение частоты встречаемости этой патологии, в том числе из-за улучшения диагностических возможностей (в частности, распространение гастроскопии, колоноскопии, капсульной эндоскопии).
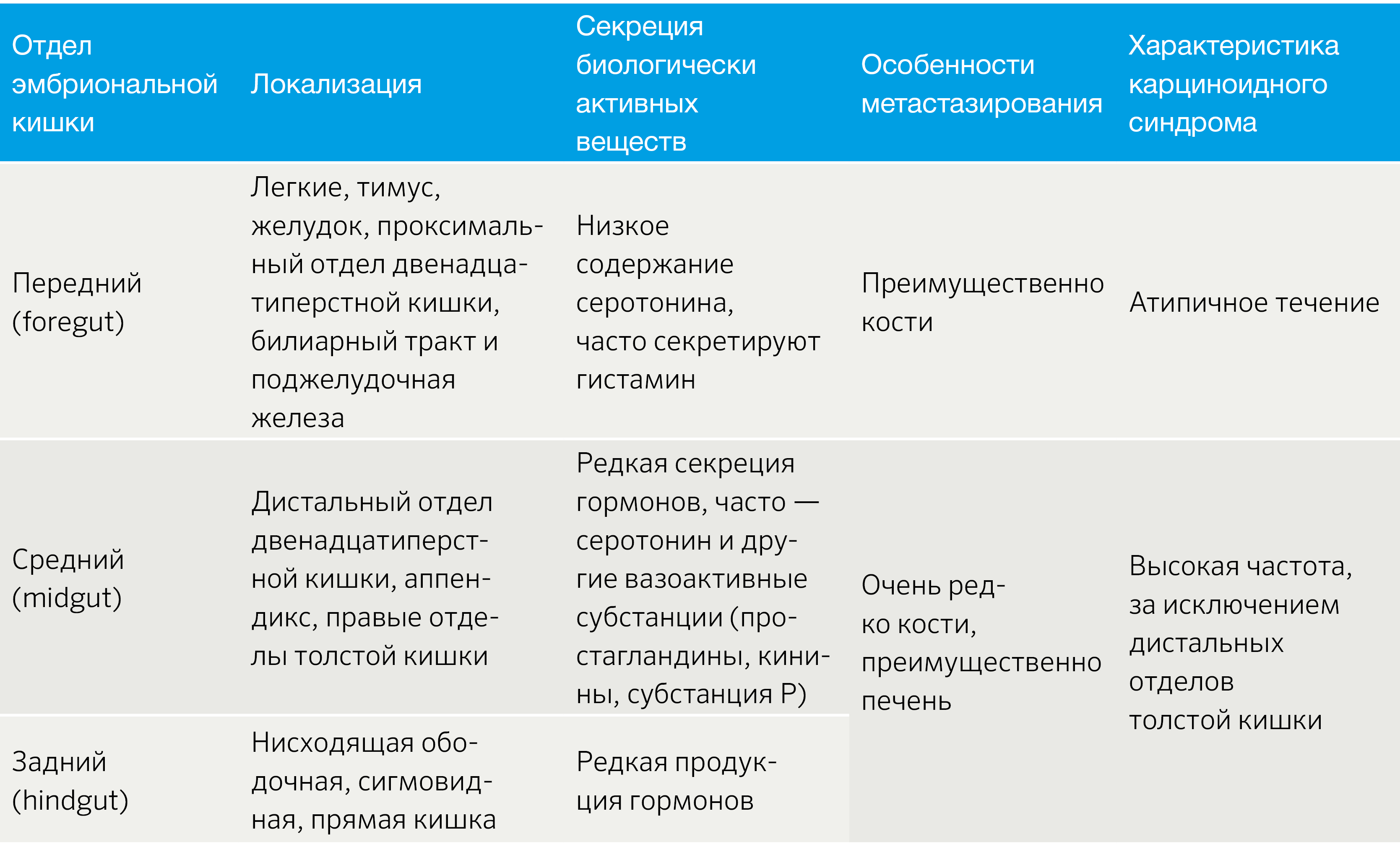
НЭО классифицируют в зависимости от отдела эмбриональной кишечной трубки: из передней, средней и задней кишки (табл. 1) [2].
Табл.1 | Классификация НЭО по эмбриогенезу [2].
Карциноидный синдром — важный клинический признак. В основном, он обусловлен эффектами серотонина, а также брадикинина, гистамина, дофамина и в меньшей степени других биологически активных веществ (БАВ).
Клинические проявления карциноидного синдрома разнообразны. Наиболее часто у пациентов отмечается гиперемия кожи лица, приливы, диарея, боль в животе. У 60 % пациентов отмечают формирование карциноидной болезни сердца, с нарушением работы преимущественно клапанного аппарата правых отделов (стеноз и/или недостаточность легочного и трехстворчатого клапанов). Серьезным осложнением является декомпенсация нарастающей сердечной недостаточности. Морфологическим субстратом служит выраженный диффузный фиброэластоз эндокарда. Возможны появления телеангиоэктазий, одышки, пеллагры, бронхоспазма. Усиливается продукция соединительнотканных компонентов, в частности, коллагена. Это ведет к фиброзированию и стенозу брыжеечных артерий, фиброзирующему стенозу уретры. Ввиду склонности к развитию спаечного процесса в брюшной полости нарастает риск формирования кишечной непроходимости.
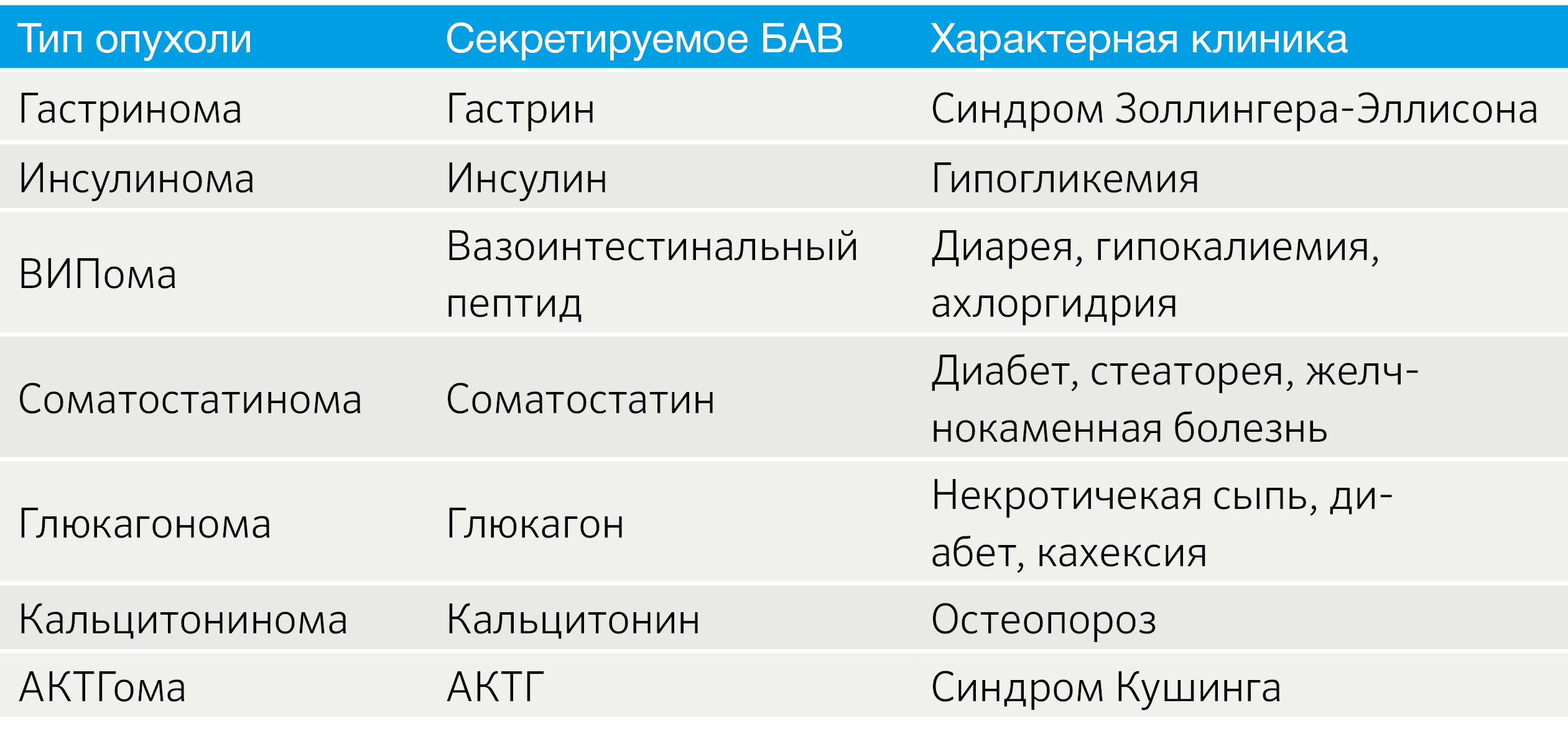
Важным аспектом является функциональный статус опухоли. В зависимости от наличия продукции БАВ выделяют функционирующие (табл. 2) и нефункционирующие новообразования [3].
Табл.2 | Функционирующие НЭО [3].
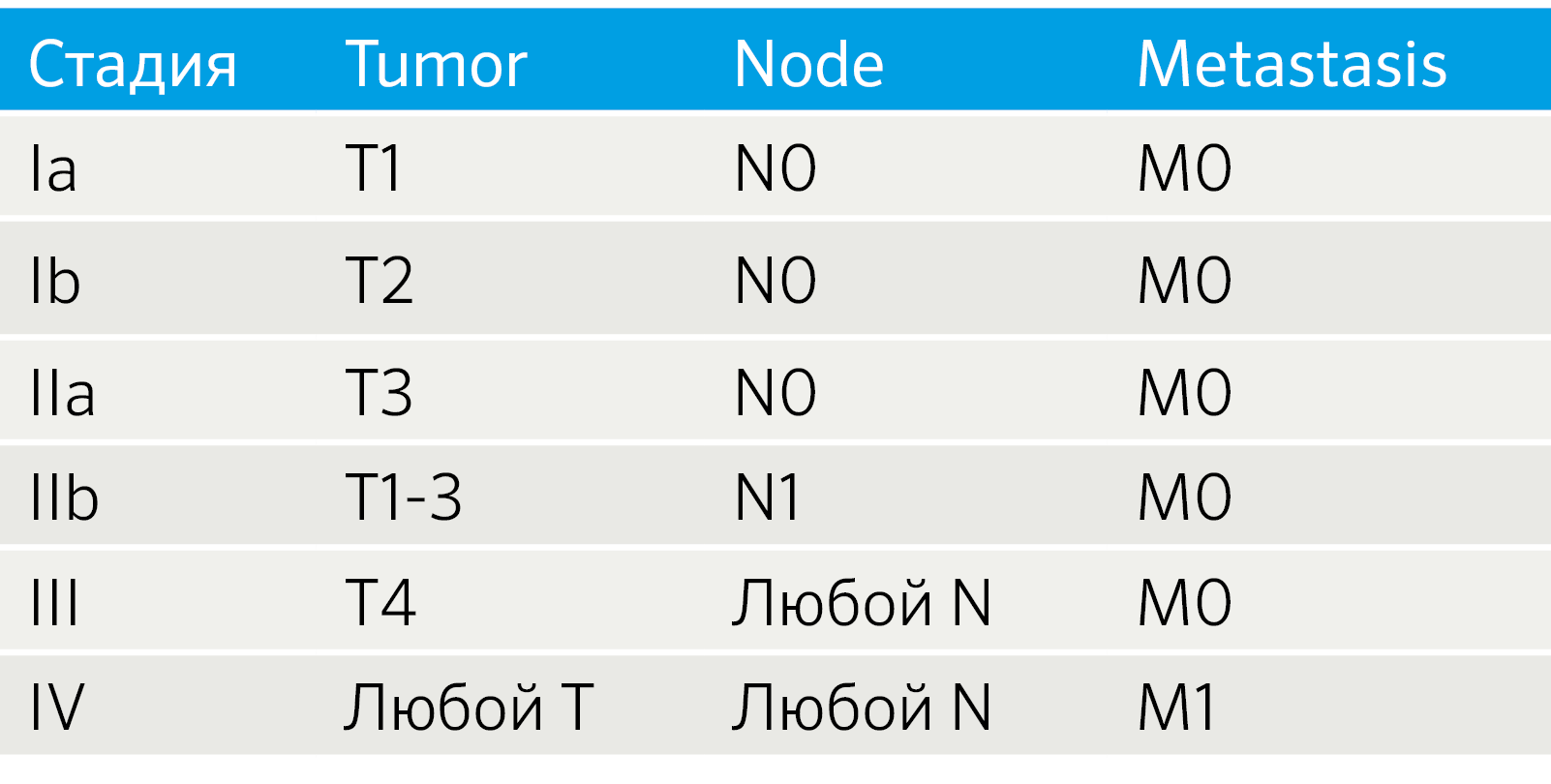
Особенности TNM-классификации определяются локализацией НЭО. НЭО легких стадируются как немелкоклеточный рак легких, для НЭО ЖКТ и поджелудочной железы разработаны рекомендации Европейского общества по изучению НЭО (ENETS) [4]. Также установление стадии TNM для всех анатомических локализаций регламентируется руководством, созданным Американским объединенным комитетом по раковым заболеваниям (the American Joint Committee on Cancer, AJCC) [5, 6]. Так как эти системы не идентичны, возникают вопросы унификации подходов к стадированию. Например, была создана модифицированная система ENETS (mENETS), для диагностики НЭО поджелудочной железы (pNET) (табл. 3) [7].
Табл.3 | Стадирование НЭО поджелудочной железы согласно модифицированной системе ENETS (mENETS) [7].
И вот мы подходим к той черепахе, на которой стоят киты онкологической диагностики. Это, несомненно, гистологическая верификация диагноза. Как и многие опухолевые заболевания, морфологические градации НЭО подвергались различным модификациям, уточнениям, дополнениям. Дискуссии в этой области в итоге привели к созданию 4-ой редакции классификации ВОЗ (2017 год) [8]. Именно она является актуальной на настоящий момент и заключение при проведении патологоанатомическом исследовании должно отвечать введенным в ней понятиям и требованиям.
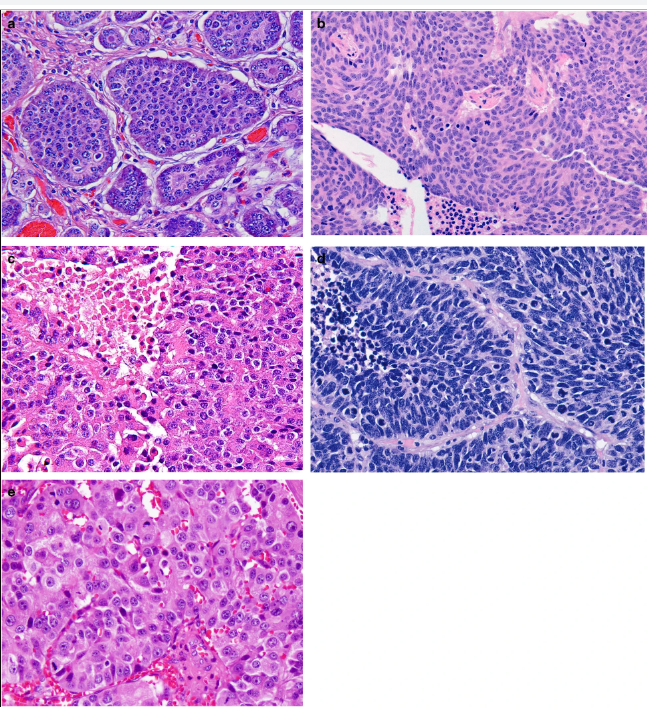
Параметрами морфологической оценки нейроэндокринных новообразований являются: гистологическое строение опухоли, определение сосудистой и периневральной инвазии, митотический индекс. Несмотря на многообразия источников НЭО, морфологическая картина является сходной (рис. 1) [9].
Нейроэндокринное происхождение атипичных клеток доказывает положительная экспрессия так называемых общих нейроэндокринных маркеров. Основные из них это хромогранин А, окрашивающий компоненты нейросекреторных гранул, и пептид синаптофизин, накапливающийся в мелких синаптических везикулах. Также применяется дополнительно установление экспрессии рецепторов соматостатина 2 и 5 типов (SSTR2 и SSTR5). В этом случае возможно определить чувствительность опухолевых клеток к аналогам соматостатина.
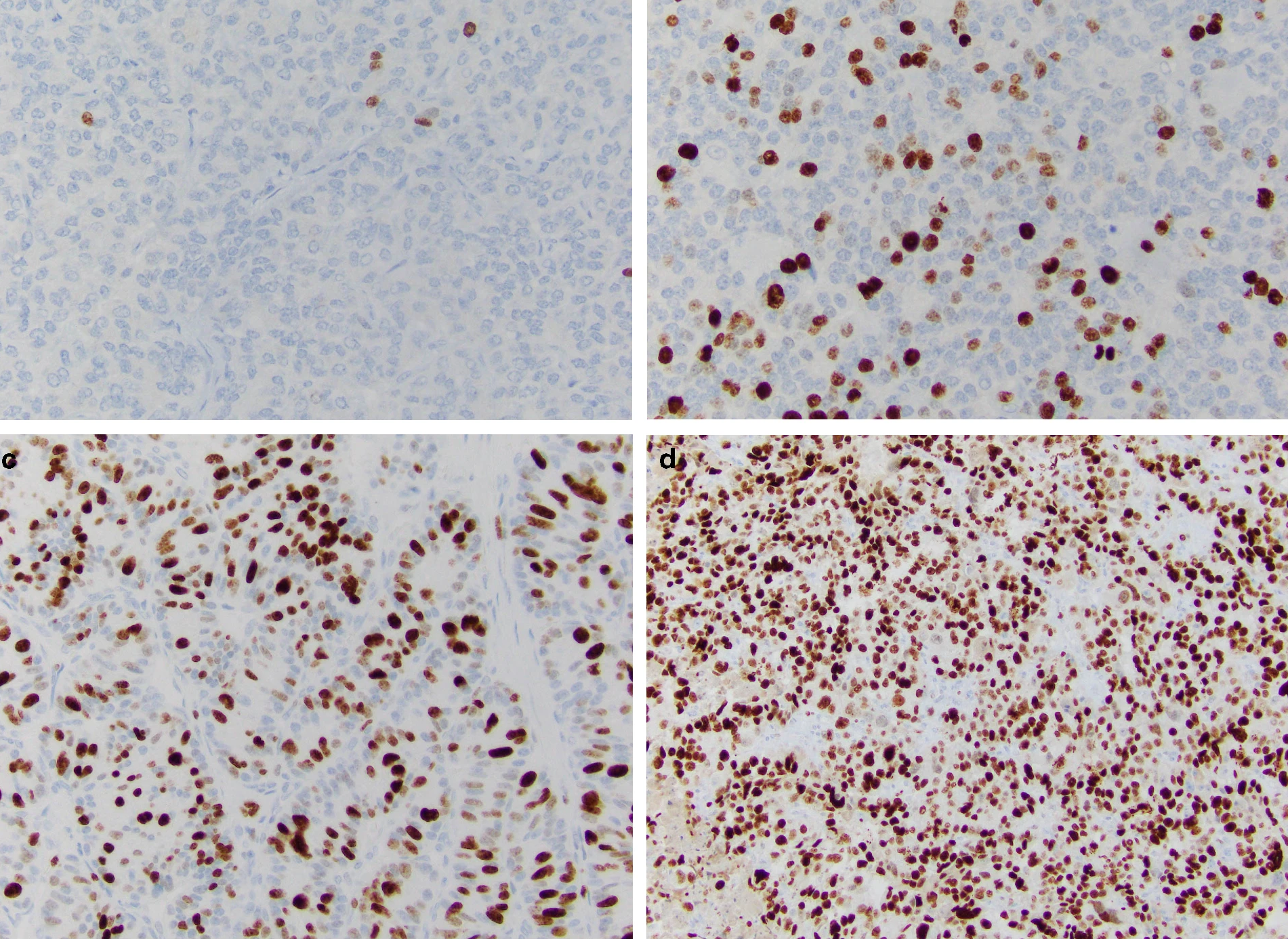
Степень злокачественности НЭО определяют на основании двух основных критериев: уровня дифференцированности опухолевых клеток и их пролиферативной активности. Традиционно выделяют три степени злокачественности (grade): G1, G2, G3. Для НЭО ЖКТ и поджелудочной железы введены понятия высокодифференцированных и низкодифференцированных новообразований (или нейроэндокринного рака (карциномы), НЭР). Высокодифференцированные НЭО объединяют G1 (менее 2 митозов на 10 репрезентативных полей зрения (РПЗ) при большом увеличении микроскопа (х400) и индекс Ki-67 ≤ 2%), G2 (2–20 митозов на 10 РПЗ и индекс Ki-67 3–20 %), G3 (> 20 митозов на 10 РПЗ и индекс Ki-67 > 20 %). Grade 3 опухоли разделяют на мелко- и крупноклеточный рак. Опухоли мелкоклеточного типа построены из однотипных клеток округлой, овальной или вытянутой формы, мелкого размера, со скудной цитоплазмой и нечеткими границами. Ядра имеют характерный вид за счет нежного хроматина и невизуализирующихся ядрышек. Определяются массивные некрозы. Крупноклеточные НЭР образованы, соответственно, клетками крупного или среднего размера, с низким ядерно-цитоплазматическим соотношением, выраженной атипией ядер, содержащих гранулярный хроматин и четкие ядрышки. В опухолевой ткани выявляются мультифокальные некрозы, значительное число митозов [8, 9].
Индекс Ki-67 определяют как средний процент окрашенных ядер при учете 500–2000 злокачественно трансформированных клеток (рис. 2) [9].
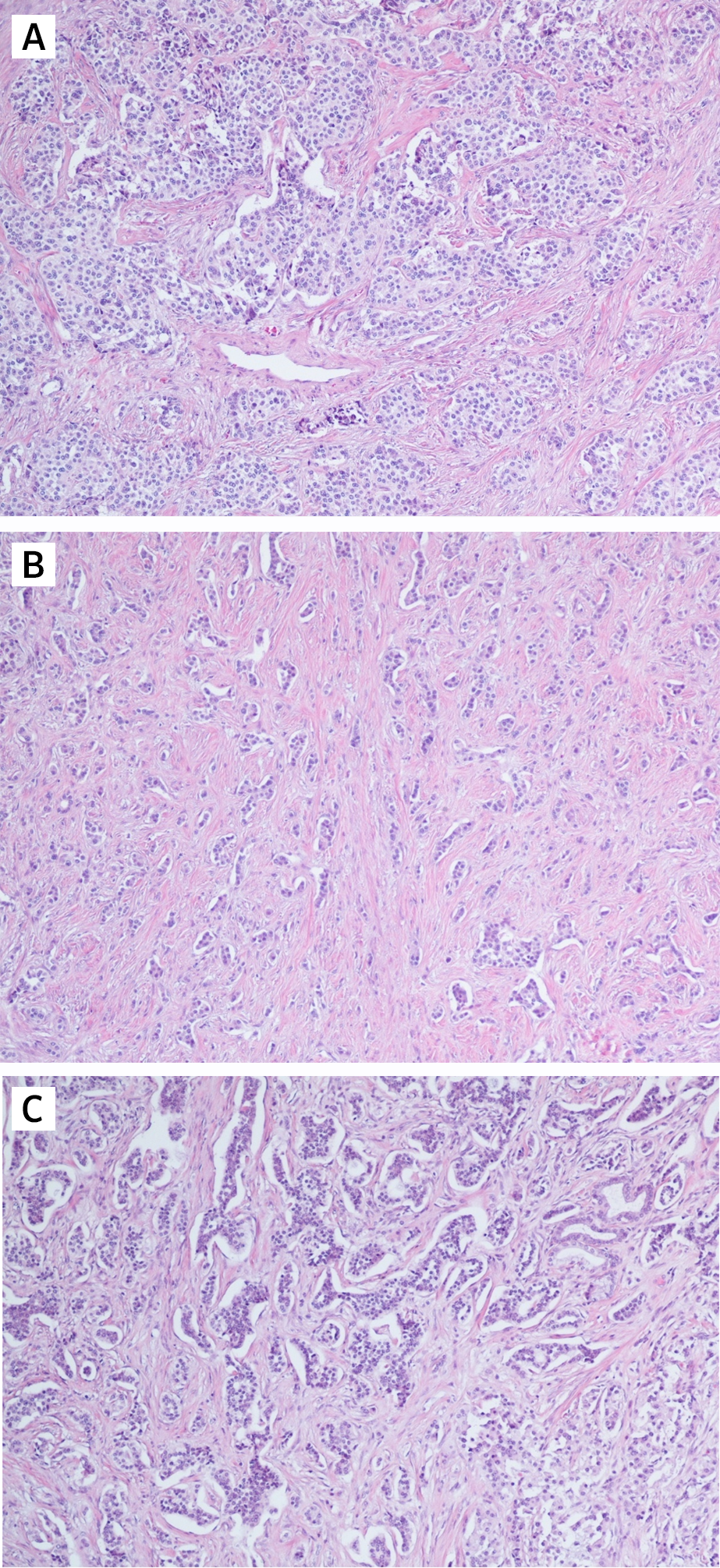
Рассмотрим различия понятий НЭО G3 и НЭР при локализации в поджелудочной железе. Несмотря на высокую степень злокачественности НЭО G3 гистологически имеют органоидную модель строения (рис. 3), отсутствие некрозов [10]. При иммуногистохимическом исследовании опухолевая ткань сохраняет экспрессию общих маркеров нейроэндокринной дифференцировки (диффузно и интенсивно определяется экспрессия синаптофизина, зачастую хромогранина А), а также панкреатические экзокринные или эктопические гормоны. Кроме того, в них отсутствует выраженная экспрессия p53 и утрата экспрессии RB (также определяются иммуногистохимически).
НЭР поджелудочной железы — это опухоли низкой степени дифференцировки и соответственно высокой степени злокачественности. Экспрессия общих маркеров нейроэндокринной дифференцировки атипичными клетками снижается: синаптофизин определяется слабо или диффузно, хромогранин А также слабо или фокально. Экзокринные гормоны отрицательны в таких опухолях [9]. Часто определяется экспрессия р53, белков ремоделирования хроматина DAXX (death-associated protein 6) и ATRX (АТФ-зависимая хеликаза), потеря экспрессии RB (белок ретинобластомы) и ISL1 (энхансер гена инсулина 1) [11].
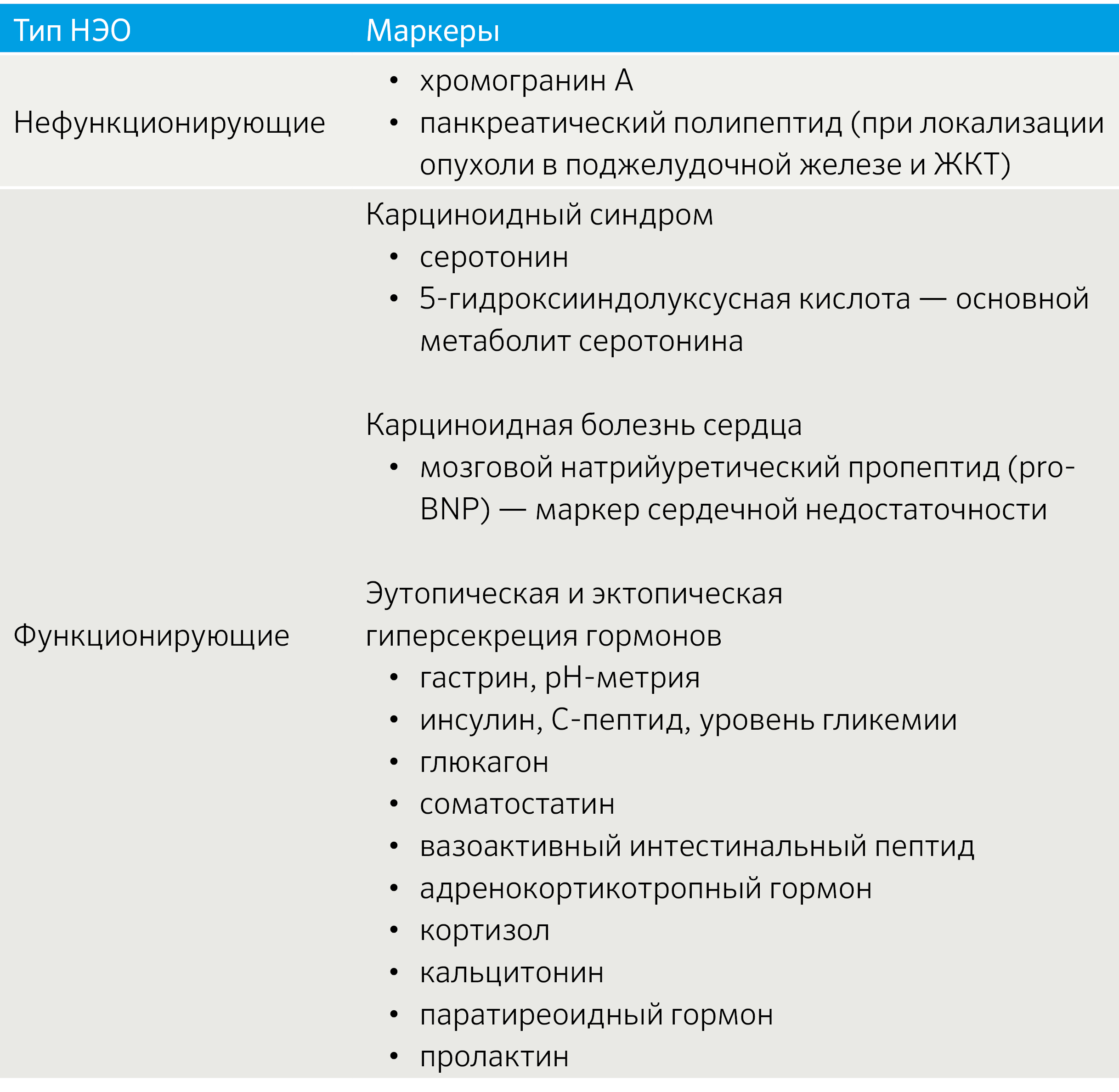
Ввиду многообразия секретирующего профиля НЭО биохимическая диагностика включает различные маркеры, комбинируемые с учетом клинической картины (табл. 4).
Табл. 4 | Спектр биохимических маркеров НЭО [2].
Методы лучевой диагностики включают «классические» КТ и МРТ с контрастированием. Для оценки метастатического поражения печени возможно проведение УЗИ органов брюшной полости.
Радионуклидная диагностика играет важную роль в топической характеристике НЭО. Она включает методы специфической метаболической визуализации ( 123 I-MIBG), рецепторной визуализации ( 111 In-октреотид, 68 Ga-DOTA-TOС/DOTA-NOC/DOTA-TATE) и неспецифической метаболической визуализации ( 18 F-FDG, 18 F-DOPA).
123 I-метайодбензилгуанидин (MIBG) является аналогом норадреналина (норэпинефрина). Он накапливается в адренергических тканях и опухолях, происходящих из них. Сцинтиграфия с 123 I-MIBG используется для диагностики нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки [12].
Для рецепторной визуализации применяют 111 In (индий)-октеотид. Он выявляет высокодифференцированные нейроэндокринные опухоли, опухоли из клеток островкового аппарата поджелудочной железы (гастринома, глюкагонома, инсулинома). Также для верификации НЭО ЖКТ применяется соматостатин-рецепторная сцинтиграфия, так как большинство из них имеют рецепторы к соматостатину (SSTR) на поверхности опухолевых клеток (чаще 2 и 5 типа).
Выбор радионуклидного метода связан со степенью дифференцировки опухолевых клеток. Первичная диагностика НЭО Grade 1 и 2 проводится путем ПЭТ/КТ с радиофармпрепаратами (РФП), мечеными галлием 68 (является ПЭТ-радионуклидом). Сродство (аффинитет) РФП к конкретному подтипу трансмембранных рецепторов соматостатина определяет выбор диагностического индикатора (ПЭТ-лиганда, представленного различными модификациями DOTA). Например, для визуализации НЭО, экспрессирующих рецепторы подтипов SSTR2a и SSTR2b, применяют 68 Ga-DOTA-TATE (DOTA-Tyr3-октреотад). 68 Ga-DOTA-NOC (DOTA-1-Nal3-октреотид) выявляет подтипы SSTR3 и SSTR5, 68 Ga-DOTA-ТOC (DOTA-Tyr3-октреотид) — рецепторы SSTR5 [13].
При отсутствии возможности проведения данного исследования следует выполнить однофотонную эмиссионную компьютерную томографию (ОФЭКТ)/КТ (гибридный метод визуализации) с соматостатин-рецепторным радиофармпрепаратом.
Для недифференцированных НЭО Grade 3 и НЭР при отрицательных результатах соматостатин-рецепторной сцинтиграфии рекомендуется ПЭТ неспецифическая метаболическая визуализация с использованием других РФП. В частности, ПЭТ/КТ c 18F-фтордезоксиглюкозой (18F-ФДГ), которая неэффективна при высокодифференцированных НЭО [14]. Также рассматривают применение 18F-L–DOPA (дигидроксифенил-аланин) — меченого предшественника допамина, который эффективен для обнаружения медуллярного рака щитовидной железы, НЭО, параганглиомы и феохромоцитомы [15].
Современные классификации НЭО в значительной мере основаны на общей морфологии, которую эти новообразования демонстрируют в различных анатомических участках. Закономерно предположить, что такая структурная схожесть является результатом общей «нейроэндокринной» мультигенной программы, стимулирующей дифференцировку нейроэндокринных клеток. Но схожесть не означает идентичность, и несомненно существующая тканеспецифичность нейроэндокринных клеток диктует характерною индивидуальную гормональную продукцию. Профиль экспрессии БАВ атипичными клетками определяет клиническую картину и прогноз заболевания. Поэтому важно иметь возможность точно определяет источник опухоли. С использованием все расширяющихся диагностических возможностей такой подход становится реальным, формируя персонализацию терапевтических стратегий в нейроэндокринной онкологии.