Неорганические соединения свинца что это
Соединения свинца
СОДЕРЖАНИЕ
Химия [ править ]
Различные окисленные формы свинца легко восстанавливаются до металла. Примером является нагревание PbO с мягкими органическими восстановителями, такими как глюкоза. Смесь оксида и сульфида, нагретая вместе, также образует металл. [2]
2 PbO + PbS → 3 Pb + SO 2
Хлорирование растворов плюмбита приводит к образованию свинца со степенью окисления +4.
Оксиды и сульфиды [ править ]
Реакция свинца с серой или сероводородом дает сульфид свинца. Твердое вещество имеет структуру, подобную NaCl (простая кубическая), которую оно сохраняет до температуры плавления 1114 ° C (2037 ° F). Если нагревание происходит в присутствии воздуха, соединения разлагаются с образованием монооксида и сульфата. [7] Соединения практически нерастворимы в воде, слабых кислотах, и раствор (NH 4 ) 2 S / (NH 4 ) 2 S 2 является ключевым для отделения свинца от аналитических элементов I-III групп, олова, мышьяка и сурьма. Соединения растворяются в азотной и соляной кислотах с образованием элементарной серы и сероводорода соответственно. [7] При нагревании смеси монооксида и сульфида образуется металл. [2]
2 PbO + PbS → 3 Pb + SO 2 ↑
Галогениды и другие соли [ править ]
Нагревание карбоната свинца с фтористым водородом дает гидрофторид, который при плавлении разлагается до дифторида. Этот белый кристаллический порошок более растворим, чем дииодид, но меньше, чем дибромид и дихлорид. Координированных фторидов свинца не существует (кроме нестабильного катиона PbF + ). [8] Тетрафторид, желтый кристаллический порошок, нестабилен.
Хлоридные комплексы [ править ]
Organolead [ править ]
Наиболее известные соединения являются двумя простейших плюмбано deratives: tetramethyllead (ТМС) и тетраэтилсвинец (TEL); однако их гомологи, а также гексаэтилдисвинец (HEDL) обладают меньшей стабильностью. Тетралкильные деративы содержат свинец (IV); связи Pb – C ковалентны. Таким образом, они напоминают типичные органические соединения. [14]
Фазовые диаграммы растворимостей [ править ]
| График, показывающий концентрацию растворенного Pb 2+ в воде в зависимости от SO 4 2– [12] | Диаграмма для свинца в сульфатных средах [12] |
Добавление хлорида может снизить растворимость свинца, хотя в богатой хлоридом среде (такой как царская водка ) свинец может снова стать растворимым в виде анионных хлорокомплексов.
| Диаграмма, показывающая растворимость свинца в хлоридных средах. Концентрации свинца представлены в виде функции от общего содержания хлоридов. [12] | Диаграмма Пурбе для свинца в хлоридной (0,1 М) среде [12] |
Ссылки [ править ]
Библиография [ править ]
СОДЕРЖАНИЕ
Химия
Различные окисленные формы свинца легко восстанавливаются до металла. Примером является нагревание PbO с мягкими органическими восстановителями, такими как глюкоза. Смесь оксида и сульфида, нагретая вместе, также образует металл.
2 PbO + PbS → 3 Pb + SO 2
Хлорирование растворов плюмбита приводит к образованию свинца со степенью окисления +4.
Оксиды и сульфиды
Реакция свинца с серой или сероводородом дает сульфид свинца. Твердое вещество имеет структуру, подобную NaCl (простая кубическая), которую оно сохраняет до температуры плавления 1114 ° C (2037 ° F). Если нагревание происходит в присутствии воздуха, соединения разлагаются с образованием монооксида и сульфата. Эти соединения практически нерастворимы в воде, слабых кислотах, и раствор (NH 4 ) 2 S / (NH 4 ) 2 S 2 является ключевым для отделения свинца от элементов аналитических групп I-III, олова, мышьяка и сурьмы. Соединения растворяются в азотной и соляной кислотах с образованием элементарной серы и сероводорода соответственно. При нагревании смеси монооксида и сульфида образуется металл.
2 PbO + PbS → 3 Pb + SO 2 ↑
Галогениды и другие соли
Нагревание карбоната свинца с фтористым водородом дает гидрофторид, который при плавлении разлагается до дифторида. Этот белый кристаллический порошок более растворим, чем дииодид, но меньше, чем дибромид и дихлорид. Координированных фторидов свинца не существует (кроме нестабильного катиона PbF + ). Тетрафторид, желтый кристаллический порошок, нестабилен.
Хлоридные комплексы
Органолид
Наиболее известными соединениями являются два простейших производных свинца : тетраметилсвинец (TML) и тетраэтилсвинец (TEL); однако их гомологи, а также гексаэтилдисвинец (HEDL) обладают меньшей стабильностью. Тетралкильные деративы содержат свинец (IV); связи Pb – C ковалентны. Таким образом, они напоминают типичные органические соединения.
Фазовые диаграммы растворимости
 | 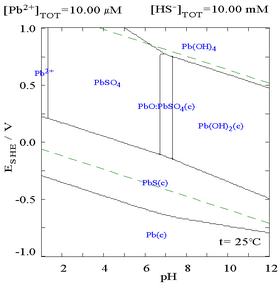 |
| График, показывающий водную концентрацию растворенного Pb 2+ в зависимости от SO 4 2− | Диаграмма для свинца в сульфатных средах |
Добавление хлорида может снизить растворимость свинца, хотя в богатой хлоридом среде (такой как царская водка ) свинец может снова стать растворимым в виде анионных хлорокомплексов.
 | 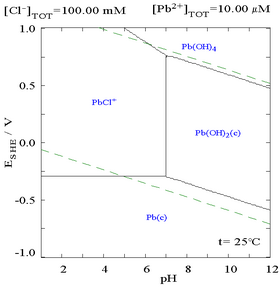 |
| Диаграмма, показывающая растворимость свинца в хлоридной среде. Концентрации свинца представлены в виде функции от общего содержания хлоридов. | Диаграмма Пурбе для свинца в хлоридной (0,1 М) среде |
Рекомендации
Библиография
Большая Энциклопедия Нефти и Газа
Неорганические соединения свинца редко применяют для стабилизации других полимеров. Свинцовые соли слабых кислот стабилизируют цвет полиолефинов низкого давления. [1]
Неорганические соединения свинца являются важнейшими стабилизаторами для ПВХ. Наибольшее практическое значение имеют соединения РЬ2, реагирующие с НС1, в частности основные соли различных кислот или средние соли слабых органических кислот. [2]
Неорганические соединения свинца способны заменять соединения кальция в костях, превращаясь тем самым в постоянный источник отравления организма. [3]
Неорганические соединения свинца не мешают определению. [4]
При взаимодействии неорганических соединений свинца с дитизоном образуется дитизонат, окрашенный в красный цвет, растворимый в хлороформе и четыреххлористом углероде. [6]
При взаимодействии неорганических соединений свинца с дитизоном образуется окрашенный в красный цвет дитизонат, растворимый в хлороформе и четыреххлористом углероде. [7]
При взаимодействии неорганических соединений свинца с дитизоном образуется дитизонат, окрашенный в красный цвет, растворимый в хлороформе и четыреххлористом углероде. [8]
Определение основано на взаимодействии неорганических соединений свинца с сульфарсазеном с образованием соединения, окрашенного в красный цвет. [9]
Метод основан на взаимодействии неорганических соединений свинца с сульфарсазеном и фотометрическом определении окрашенных в желто-оранжевый цвет растворов. [11]
Определение основано на взаимодействии неорганических соединений свинца с сульфарсазеном с образованием соединения, окрашенного в красный цвет. [12]
Так как предельно допустимая концентрация в рабочей зоне для неорганических соединений свинца равна 0 01 мг / м3, обнаруженная концентрация ее не превышает. [14]
В аэрозолях могут находиться как металлический свинец, так и некоторые неорганические соединения свинца : окись ( глет), перекись, хлорид. [15]
Неорганические соединения свинца что это
ГОСТ 20580.0-80*
(CT СЭВ 905-78)
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Общие требования к методам химического анализа
Lead. General requirements for methods of chemical analysis
ОКСТУ 1709**
________________
** Измененная редакция, Изм. N 2.
Дата введения 1980-12-01
Постановлением Государственного комитета СССР по стандартам от 29 апреля 1980 г. N 1976 срок действия установлен с 01.12.80
Проверен в 1983 г. Постановлением Госстандарта от 20.12.83 N 6396 срок действия продлен до 01.12.91**
* ПЕРЕИЗДАНИЕ декабрь 1984 г. с Изменением N 1, утвержденным в декабре 1983 г. (ИУС 4-84)
ВНЕСЕНО Изменение N 2, утвержденное и введенное в действие Постановлением Госстандарта СССР от 17.07.90 N 2203 с 01.01.91
Изменение N 2 внесено изготовителем базы данных по тексту ИУС N 11, 1990 год
Настоящий стандарт устанавливает общие требования к методам химического анализа свинца (99,992-99,5%).
Стандарт полностью соответствует CT СЭВ 905-78.
1. ОБЩИЕ ТРЕБОВАНИЯ
(Введен дополнительно, Изм. N 1, Измененная редакция, Изм. N 2).
1.1. Отбор и подготовку проб проводят по ГОСТ 24231-80 и ГОСТ 3778-77*.
(Измененная редакция, Изм. N 2).
1.2. За результат анализа принимают среднее арифметическое результатов трех определений.
Абсолютные допускаемые расхождения между наибольшим и наименьшим результатами трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) с доверительной вероятностью 0,95 не должны превышать значений, указанных в соответствующих таблицах стандартов.
1.3. Одновременно с проведением анализа в тех же условиях проводят три контрольных опыта для внесения в результат анализа соответствующей поправки на загрязнение реактивов.
1.2, 1.3. (Измененная редакция, Изм. N 1, 2).
1.4-1.12. (Исключены, Изм. N 2).
1.13. Контроль правильности результатов анализа проб проводят по ГОСТ 25086-87 путем их сопоставления с результатами анализа тех же проб, полученных по другой методике, включенной в стандарт на метод анализа, по стандартным образцам состава свинца или методом добавок.
Контроль правильности результатов анализа осуществляют не реже одного раза в месяц, а также при замене реактивов, растворов и аппаратуры, после длительных перерывов в работе и других изменениях, влияющих на результаты анализа.
(Измененная редакция, Изм. N 1, 2).
2. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
2.1. Химические анализы должны выполняться в соответствии с правилами безопасной работы в химических лабораториях.
2.2. При проведении анализа свинца используются реактивы, оказывающие вредное воздействие на организм человека: кислоты (азотная, борная, серная, соляная, уксусная), аммиак, диэтиловый эфир, калий цианистый, медь, натрия гидроксид, оксид мышьяка (III), ртуть, свинец, свинец уксуснокислый, спирт вторичный бутиловый, спирт этиловый, стронций азотнокислый, сурьма, толуол, углерод четыреххлористый, хлороформ. При работе с названными веществами необходимо соблюдать требования безопасности по нормативно-технической документации на конкретную продукцию.
2.3. Подготовка проб к анализу должна проводиться в вытяжных шкафах или боксах. Скорость воздуха, поступающего при включенной вытяжке из шкафа и открытых рабочих створках, должна быть в расчетном проеме не менее 1,2 м/с.
Химические реактивы, применяемые для анализа, должны храниться в шкафах или боксах, оборудованных вентиляцией.
2.1-2.3. (Измененная редакция, Изм. 2).
2.4. Пробы свинца, поступившие на анализ, следует хранить в стеклянных бюксах или полиэтиленовых пакетах. Остатки проб от анализа возвращаются заказчику.
Концентрации вредных веществ в воздухе рабочей зоны определяют по методикам в соответствии с ГОСТ 12.1.016-79 и утвержденным Минздравом СССР.
(Измененная редакция, Изм. 2).
2.7. Химическая лаборатория должна иметь общую приточно-вытяжную вентиляцию в соответствии с требованиями ГОСТ 12.4.021-75.
2.8. Электроустановки и электроаппаратура, используемые при анализах, должны соответствовать требованиям ГОСТ 12.1.019-79, ГОСТ 12.2.007.0-75, а также требованиям правил технической эксплуатации электроустановок потребителей* и правил техники безопасности при эксплуатации электроустановок потребителей**, утвержденных Главгосэнергонадзором.
(Измененная редакция, Изм. 2).
2.9. Для предотвращения загрязнения сточных вод и воздушного бассейна токсичными веществами утилизацию, обезвреживание и уничтожение отходов производства анализов следует проводить в установленном порядке по согласованию с санитарно-эпидемиологической службой Министерства здравоохранения СССР.
2.10. Все работы при проведении анализов следует выполнять в спецодежде и средствах индивидуальной защиты по ГОСТ 24760-81, ГОСТ 3-88, ГОСТ 12.4.041-89*, ГОСТ 12.4.013-85**, ГОСТ 12.4.011-89.
* На территории Российской Федерации действует ГОСТ 12.4.041-2001;
(Измененная редакция, Изм. 2).
2.11. При использовании сжатых, сжиженных и растворенных газов в процессе анализа требуется соблюдать правила устройства и безопасной эксплуатации сосудов, работающих под давлением, утвержденные Госгортехнадзором СССР.
2.12. (Исключен, Изм. 2).
2.13. При работе с легковоспламеняющимися жидкостями и горючими веществами следует руководствоваться требованиями ГОСТ 12.1.004-85*.
(Измененная редакция, Изм. 2).
2.14. Пожарная безопасность лабораторных помещений должна соответствовать требованиям ГОСТ 12.1.004-85 и ГОСТ 12.4.009-83.
(Измененная редакция, Изм. 2).
2.15. В помещениях, где проводятся работы со свинцом, не допускается хранить пищевые продукты, принимать пищу, курить.
Разд.2. (Введен дополнительно, Изм. N 1).
Свинец
Свинец — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: švinas (литовский), svins (латышский).
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Нахождение свинца в природе
Получение свинца
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG), в тыс. тонн:
| ЕС | 2200 |
| США | 1498 |
| Китай | 1256 |
| Корея | 219 |
Физические свойства свинца
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К) при температуре 0°C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C
Температура кипения — 1740 °C
Химические свойства свинца
С кислородом образует ряд соединений Рb2О, РbО, РbО2, Рb2О3, Рb3О4. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре получают оксида свинца и водород при взаимодействии свинца и горячего водяного пара.
Оксидам РbО и РbО2 соответствуют амфотерные гидрооксиды Рb(ОН)2 и Рb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество РbН4. PbH4 — газозообразное вещество без запаха, которое очень легко разлагается на свинец и и водород. При большой температуре галогены образовывают со свинцом соединения вида РbХ2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа РbХ4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Рb (II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb (II). В ряду напряжений Pb стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и H2SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки трудно-растворимых хлорида РbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа H2SO4 и НCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). По растворимости в воде соли свинца делятся на нерастворимые (напрммер, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (вроде, хлорид и фторид) и растворимые (к примеру,ацетат, нитрат и хлорат свинца). Соли Pb (IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Рb (II). Соли Pb (IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (РbО3)2- и (РbО4)4-, хлороплюмбатов (РbCl6)2-, гидроксоплюмбатов [Рb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4]. Еион (Ме=>Ме++e)=7,42 эВ.
Основные соединения свинца
Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Галогениды свинца
Халькогениды свинца
Халькогениды свинца — сульфид свинца, селенид свинца и теллурид свинца — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Соли свинца
Сульфат свинца
Нитрат свинца
Ацетат свинца — свинцовый сахар, относится к очень ядовитым веществам. Ацетат свинца, или свинцовый сахар, Pb(CH3COO)2·3H2O существует в виде бесцветных кристаллов или белого порошка, медленно выветривающегося с потерей гидратной воды. Соединение хорошо растворимо в воде. Оно обладает вяжущим действием, но так как содержит ионы ядовитого свинца, то применяется как наружное в ветеринарии. Ацетат применяют также в аналитической химии, крашении, ситценабивном деле, как наполнитель шёлка и для получения других соединений свинца. Основной ацетат свинца Pb(CH3COO)2·Pb(OH)2 — менее растворимый в воде белый порошок — используется для обесцвечивания органических растворов и очистки растворов сахара перед анализом.
Применение свинца
Свинец в народном хозяйстве
Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока. Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлевки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика). Борат свинца Pb(BO2)2·H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов. Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке. Сульфат свинца Pb(SO4)2, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей.
Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт.ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Свинец в медицине
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тыс. тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Физиологическое действие
Свинец и его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м³, в воде 0,03 мг/л, почве 20,0 мг/кг. Выброс свинца в Мировой океан 430—650 тысяч т/год.
