Нефросклероз почек что это
Нефросклероз: причины развития, симптомы, диагностика и лечение
Дата обновления: 06 октября 2021
Дата создания: 12 апреля 2021
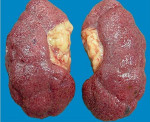
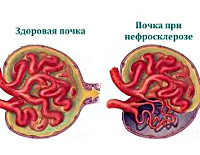
Одним из заболеваний почек является нефросклероз, при котором происходит гибель функциональных клеток (нефронов), вместо которых разрастается соединительная ткань. Такая патология приводит к уплотнению почки, происходит ее уменьшение в размерах, вследствие чего нарушаются функции органа, вплоть до полного их прекращения.
Нефросклероз протекает хронически и подразделяется на первичную и вторичную форму. При первичной патологии изначально поражаются почечные сосуды. Провокационными факторами может выступать атеросклероз, гипертония и инфаркт почки.
Вторичный нефросклероз характеризуется быстрым поражением почечной ткани. В данном случае болезнь провоцируют такие заболевания, как: сахарный диабет, пиелонефрит, туберкулез почки, мочекаменная болезнь и др.
Механизм развития нефросклероза почек
 |
| GreenFlames09 Flickr |
Нефросклероз не является самостоятельным заболеванием и, как правило, его провоцируют другие патологии. Но, несмотря на причину развития, нефросклероз имеет общий патогенез.
Под воздействием провоцирующих факторов происходит разрушение почечного эпителия с поражением части нефронов. Так как клетки органа не способы к регенерации, поврежденные участки заменяются соединительными волокнами, происходит постепенное уплотнение органа.
На непораженных участках усиливается фильтрация и кровообращение, вследствие чего увеличивается объем выделяемой мочи, но при этом уменьшается ее плотность. Из-за нарушения кровотока, регулирующего клубочковую фильтрацию, развивается или усугубляется артериальная гипертензия.
Осложнения нефросклероза
Осложнения нефросклероза возникают при гибели исходного числа нефронов на 70-75%. У больного развивается почечная недостаточность хронической формы.
Пораженная почка перестает производить гормон эритропоэтин, который участвует в процессе созревания эритроцитов в костном мозге, вследствие чего у пациента развивается железодефицитная анемия.
Также у людей с диагнозом нефросклероз повышаются риски развития нефрогенной артериальной гипертензии, нарушается обмен витамина Д, что грозит развитием остеопороза, характеризуемого склонностью к переломам.
Клинические признаки нефросклероза
 |
| aturkus Flickr |
Почечная ткань обладает высокими компенсаторными возможностями, поэтому клинические признаки почечной недостаточности проявляются только при выраженном нефросклерозе, когда общая потеря нефронов достигает 70%. А функциональная несостоятельность органа устанавливается, когда неповрежденных клеток остается всего 5%.
На начальных стадиях нефросклероза могут наблюдаться такие симптомы:
Какие симптомы возникают на 3 и 4 стадии:
Как диагностируют нефросклероз?
При подозрении на развитие нефросклероза пациенту назначается комплексное обследование с применением лабораторных и инструментальных методик.
Как лечат заболевание почек – нефросклероз?
Лечением нефросклероза занимается врач-нефролог. На начальных стадиях развития заболевания почек применяется консервативная терапия, направленная на коррекцию основных заболеваний, запускающих патологический процесс в почечных клетках. Также используются препараты для купирования последствий, вызванных функциональной почечной недостаточностью.
Консервативная терапия на ранних стадиях нефросклероза проводится амбулаторно под контролем врача-нефролога.
Помимо лекарственной терапии пациенту необходимо соблюдать строгую диету и питьевой режим.
Принципы диетического питания при нефросклерозе:
Подробную диету пациенту с диагнозом нефросклероз составит лечащий врач-нефролог, учитывая личный анамнез.
На 3 и 4 стадии нефросклероза показана госпитализация. Требуется проведение гемодиализа или хирургического вмешательства, предполагающего пересадку донорского органа. Такие операции проводятся лапароскопическим и полостным методом.
Прогноз заболевания
Нефросклероз – хроническое заболевание, которое нельзя вылечить полностью. Но, при своевременной диагностике и адекватном лечении, прогнозы для пациента могут быть вполне благоприятными. Консервативная терапия позволяет добиться длительной ремиссии нефросклероза.
А на поздних стадиях заболевания прогнозы для пациентов не утешительны. Не обойтись без операции по трансплантации донорского органа.
Профилактика нефросклероза
В целях предупреждения развития нефросклероза почек рекомендуется соблюдать некоторые профилактические меры.
Что включает профилактика:
Важную роль в предупреждении развития нефросклероза почек также играет регулярное посещение семейного врача в целях профилактического осмотра.
В 2013 году окончила Гомельский Государственный Медицинский Университет по специальности «Лечебное дело». В 2013-2014 гг. прошла интернатуру по специальности «терапия».
Работаю с 2014 года в поликлинической организации здравоохранения.
Прошла курсы повышения квалификации в 2020 году по специальности «Общая врачебная практика».
Круг профессиональных интересов: терапия, эндокринология, кардиология.
Хроническая почечная недостаточность
Хроническая почечная недостаточность – это состояние, при котором выделительная система человека перестаёт выполнять физиологические функции. Из-за гибели нефронов почки утрачивают способность поддерживать гомеостаз – постоянство внутренней среды. При хронической почечной недостаточности у мужчин и у женщин продукты распада нутриентов полностью не выводятся из организма, что влечет за собой тяжелые осложнения. В НИИ урологии и интервенционной радиологии имени Н.А. Лопаткина — филиале ФГБУ «НМИЦ радиологии» Минздрава России применяются все современные методы лечения данного заболевания.
Хроническая почечная недостаточность (ХПН) является обычно исходом заболеваний, приводящих к прогрессирующей потере нефронов:
Причины ХПН
Дисфункции мочевыделительной системы могут провоцировать другие острые и хронические патологии:
Хроническая почечная недостаточность также развивается по таким причинам:
Стадии хронической почечной недостаточности
В своем развитии почечная недостаточность проходит 4 стадии:
Хроническая почечная недостаточность по разным причинам может развиваться в течение нескольких месяцев и даже лет. Поэтому рекомендуется обращать внимание на первые тревожные «звоночки», чтобы не допустить развитие осложнений.
Симптомы и признаки ХПН
Клинические проявления хронической почечной недостаточности многообразны:
Прогрессирование хронической почечной недостаточности влечет за собой развитие следующих симптомов:
Хроническая почечная недостаточность на последней стадии сопровождается такими симптомами, как одышка, частое сердцебиение, отеки, глубокое шумное дыхание, судороги в конечностях. Ярким признаком прогрессирования заболевания считается уменьшение суточного объема мочи до 200 мл. Стул становится зловонным, изо рта появляется неприятный запах.
Вероятные осложнения при ХПН
При отсутствии своевременной диагностики и грамотной терапии хроническая почечная недостаточность провоцирует полиорганные нарушения со стороны:
Без соответствующего лечения хроническая почечная недостаточность может закончиться летальным исходом из-за уремической комы или сердечно-сосудистых нарушений у женщин и у мужчин.
Диагностика хронической почечной недостаточности
Ключевую роль в диагностике хронической почечной недостаточности играют лабораторные исследования. Уже при первых признаках заболевания могут наблюдаться изменения в составе крови – повышение уровня креатинина, мочевой кислоты и щелочной фосфатазы. При этом снижается уровень гемоглобина, тромбоцитов, альбумина и калия, уменьшаются показатели вязкости крови (гематокрита). Важный симптом хронической почечной недостаточности – существенное снижение плотности мочи, повышение уровня эритроцитов, лейкоцитов, белка и цилиндров.
Комплексная диагностика включает также липидограмму – исследование всего спектра жировых соединений в составе крови. Особое внимание уделяется показателям триглицеридов и холестерола.
Поставить точный диагноз «хроническая почечная недостаточность» помогают такие методы:
Лечение хронической почечной недостаточности
Лечение хронической почечной недостаточности направлено на достижение стойкой ремиссии, поскольку добиться абсолютного выздоровления современная медицина не способна. Но благодаря своевременной терапии удается сгладить симптоматику, отсрочить появление осложнений и существенно улучшить качество жизни пациента.
Лечение хронической почечной недостаточности должно начинаться с устранения основной причины патологии. Усилия врачей направлены на компенсацию признаков сахарного диабета, гломерулонефрита, поликистоза и других аутоиммунных нарушений. В приоритете – комплексный подход к лечению, который включает:
Большая роль отводится симптоматическому лечению, которое позволяет облегчить протекание болезни и улучшить самочувствие пациента. Больным назначают препараты, которые восполняют дефицит витамина D, контролируют артериальное давление, корректируют кислотно-щелочной баланс, борются с олигурией.
В некоторых случаях для лечения хронической почечной недостаточности показаны дробные переливания эритроцитной массы. Методика позволяет повысить уровень гемоглобина в крови, уменьшить проявления анемии, устранить последствия внутренних кровотечений. По достижении ремиссии пациентам с хронической почечной недостаточностью показано санаторно-курортное лечение.
Если консервативные методы терапии не дают ожидаемых результатов, пациенту может быть назначена трансплантация почки. Это физиологический метод заместительного лечения с использованием донорского органа. После пересадки почки проводится комбинированная иммуносупрессивная терапия, препятствующая отторжению донорской почки.
Основными способами лечения ТХПН повсеместно признаны диализ и трансплантация почки.
Наиболее полное замещение почечной функции происходит в результате успешной трансплантации почки, а диализ замещает ее лишь частично.
Гемодиализ (ГД)
— метод внепочечного очищения крови при острой и хронической болезни почек. Во время гемодиализа происходит удаление из организма токсических продуктов обмена веществ, для уменьшения биохимических аномалий, нормализация нарушений водного, электролитного балансов и кислотно-щелочного равновесий. Очищение крови производится путем снижения концентрации в ней вредных веществ. В зависимости от метода гемодиализа, это достигается различными путями. Под гемодиализом понимают процедуру фильтрации плазмы крови с помощью полупроницаемой мембраны, через поры которой проходят молекулы с небольшой молекулярной массой, а крупные молекулы белков остаются в плазме, которая затем возвращается в кровоток пациента.
Назначение:
1.Обеспечение компенсаторной функции почек, фильтрация крови от токсических соединений и конечных продуктов метаболизма. Гемодиализ при хронической недостаточности проводят трижды за неделю, но нарастание интоксикации – основание для более частого проведения процедуры. При крайне тяжести, диализ выполняют до конца жизни, или пока не трансплантируют здоровую почку. 2. Почечная недостаточность, как осложнение острого гломерулонефрита, пиелонефрита. Цель назначения процедуры – вывести излишек жидкости из организма, устранить отеки, эвакуировать продукты токсического свойства. 3. Дисбаланс электролитов в крови. Указанное состояние происходит вследствие массивных ожогов, перитонита, обезвоживания, лихорадочных явлений. Гемодиализ позволяет вывести чрезмерную концентрацию ионов одного вида, заместив их другими. Также показанием для рассматриваемой процедуры выступает избыток жидкости в организме, что приводит к отеку оболочек головного мозга, сердца, легких. Диализ помогает сократить отечность и снизить уровень артериального давления. Процедура гемодиализа проводится на АИП с помощью одноразовых расходных материалов, к которым относятся диализаторы, кровопроводящие магистрали, фистульные иглы, катетеры, диализные концентраты.
Аппарат для гемодиализа представляет автоматизированное высокопоточное устройство, с помощью которого достигается максимально качественная очистка жидкостей. Многочисленные датчики следят за процессом и контролируют все его показатели. Организм, подключенный к диализатору, получает необходимую качественную очищенную кровь. Диализ позволяет лишь частично заменить работу почек, так как не способен обеспечить ее эндокринные функции. Но и этого бывает достаточно, чтобы улучшить состояние больного.
Показания к началу Заместительной почечной терапии – гемодиализу:
В дневном стационаре – отделении гемодиализа вам помогут:
Процедура проводится 3 раза в неделю. Длительность ее составляет от 240 мин до 270 мин.
В дневном стационаре проводятся:
Отделение развернуто на 15 диализных мест. Парк аппаратов «Искусственная почка» насчитывает 15 диализных мест, работающих в 4 смены круглосуточно. Для диализа используются диализаторы с мембраной нового поколения (из полисульфона, благодаря высокой проницаемости такой мембраны кровь проходит глубокую очистку, и выводится больший объем токсинов, чем с обычной мембраной из целлюлозы), глюкозосодержащие концентраты диализирующей жидкости, установлена высокопроизводительная система водоочистки, качество воды которой полностью соответствует мировым стандартам. Наше отделение оборудовано пандусами, поручнями, что очень важно для пациентов с ограниченными возможностями здоровья.
В отделении гемодиализа пациенты могут получить консультативную помощь всех специалистов НИИ урологии и интервенционной радиологии имени Н.А. Лопаткина –филиала ФГБУ «НМИЦ радиологии» Минздрава России. Подключение к аппарату искусственной почки и регулярное прохождение процедуры позволяют продлить жизнь от 15 до 25 лет. Пациенты, отказавшиеся от данной процедуры, имеют риск летального исхода намного раньше – за считанные месяцы.
Все услуги и медицинская помощь оказывается пациентам абсолютно бесплатно в рамках ОМС.
Отделение, в котором лечат почечную недостаточность
Жители города Москвы для получения направления и прикрепления к гемодиализному центру должны пройти консультацию у главного внештатного специалиста – нефролога Департамента здравоохранения г. Москвы в консультативно-диагностическом отделении Городской клинической больницы №52.
Жители субъектов РФ могут поступить на лечение в Дневной стационар НИИ урологии и интервенционной радиологии имения Н.А. Лопаткина по направлению формы 057/у.
Платные медицинские услуги предоставляются в виде комплексной программы медицинской помощи, по желанию пациента, или гражданам, обеспечение которых бесплатными медицинскими услугами не предусмотрено законодательством Российской Федерации (гражданам иностранных государств, лицам без гражданства).
Позвоните нам сегодня, чтобы мы смогли Вам помочь!
Москва, 8 (499) 110 — 40 — 67
Нефросклероз ( Сморщенная почка )
Нефросклероз — это патологическое состояние, вызванное гибелью нефронов, их замещением соединительной тканью с нарастанием почечной недостаточности. Проявляется полиурией, никтурией, гипертензией, отечностью, дискомфортом в пояснице, на поздних этапах — олигурией, гематурией, интоксикацией. Диагностируется с помощью лабораторных анализов, УЗИ, КТ, МСКТ почек, нефросцинтиграфии, ангиографии ренальных сосудов, урографии, биопсии. Для лечения применяют этиопатогенетическую терапию основного заболевания, антикоагулянты, антиагреганты, противоанемические, дезинтоксикационные, витаминно-минеральные средства, заместительную терапию, аллотрансплантацию почки.
МКБ-10
Общие сведения
Нефросклероз — вторичное клинико-анатомическое состояние, проявляющееся уплотнением, сморщиванием почек и снижением их функциональной состоятельности вследствие замещения паренхимы волокнами и межуточным веществом соединительной ткани. Сморщенная почка была впервые описана в 1914 году немецкими клиницистом Ф. Фольгардом и патологом К.Т. Фаром.
Обычно нефросклероз осложняет течение урологической и другой соматической патологии. В ХХ веке его ведущей причиной считался гломерулонефрит, в настоящее время — артериальная гипертензия и сахарный диабет (более 60% всех диагностированных случаев). Распространенность нефросклероза в европейских странах составляет 0,06%. При этом 10-20% больных нуждаются в проведении регулярного гемодиализа, а смертность от ХПН достигает 22%.
Причины нефросклероза
Сморщивание почки — полиэтиологический процесс, который осложняет различные сосудистые расстройства и урологические болезни. В зависимости от варианта нефросклероза специалисты в сфере урологии и нефрологии выделяют две группы причин, вызывающих первичное или вторичное замещение почечной паренхимы волокнистыми структурными элементами соединительной ткани. Первично сморщенная почка формируется на фоне поражения ренальных сосудов, обусловленного такими заболеваниями, как:
У некоторых пациентов ангиогенная деструкция почек возникает остро при частичной или полной тромбоэмболии ренальной артерии. Резкое нарушение кровообращения вызывает инфаркт почки — массовую гибель нефронов в результате острой ишемии. Впоследствии некротизированный участок постепенно замещается соединительной тканью, и развивается нефросклероз.
О вторично сморщенной почке говорят в тех случаях, когда пациент изначально страдает урологическим заболеванием, при которых почечная паренхима разрушается под влиянием инфекционных агентов, аутоиммунных комплексов, механических факторов (растяжения, травматизации конкрементами) и др. Основными причинами вторичного (нефрогенного) нефросклероза являются:
Патогенез
Несмотря на разнообразие причин, вызывающих нефросклероз, механизм развития заболевания в целом является общим. Вначале под влиянием различных повреждающих факторов (гипоксии, воспалительных и дистрофических процессов, вызванных факторами патогенности микроорганизмов, аутоиммунными комплексами, прямыми травматическими воздействиями и др.) происходит деструкция клубочкового и канальцевого эпителия с выключение части нефронов из общего кровоснабжения.
Поскольку почечные клетки не способны к регенерации, после фагоцитирования разрушенных клеточных элементов начинается нефросклероз — поврежденный участок замещается соединительными волокнами, а сами почки уплотняются. В оставшихся клубочках усиливаются кровообращение и фильтрация, в результате чего увеличивается объем выделяемой мочи и уменьшается ее относительная плотность. На фоне нарушений кровотока повышается синтез ренина, регулирующего клубочковую фильтрацию, что способствует возникновению или усугублению артериальной гипертензии.
Благодаря высоким компенсаторным возможностям почечной ткани клинические признаки почечной недостаточности появляются только при выраженном нефросклерозе с потерей 70% нефронов обеих почек или 85% — одной. При сохранении 5% клеток и менее возникает функциональная несостоятельность органа, требующая проведения заместительной терапии.
Симптомы нефросклероза
Клиническая картина заболевания на ранней стадии характеризуется повышением количества суточной мочи (более 2 л), учащением актов мочеиспускания в ночное время (свыше 3-х раз за ночь), постоянными тянущими болями в области поясницы, увеличением артериального давления. По мере прогрессирования нефросклероза появляются отеки: сначала на лице, потом они распространяются равномерно по всему телу. Отечность наиболее выражена утром.
На поздней стадии симптоматика усугубляется: объем суточной мочи снижается до 0,5–0,8 л, в моче может появляться примесь крови, пациента беспокоит сухость во рту, постоянная жажда. Возникают и нарастают общие симптомы интоксикации: головная боль, тошнота и рвота, слабость, мышечные боли.
Осложнения
Серьезные нарушения процессов фильтрации и реабсорбции, возникающие при деструкции более 70-75% исходного числа нефронов, приводят к формированию хронической почечной недостаточности. Поскольку сморщенная почка перестает синтезировать эритропоэтин, необходимый для созревания эритроцитов в костном мозге, часто развивается железодефицитная анемия. У пациентов с нефросклерозом повышается риск нефрогенной артериальной гипертензии вследствие избыточной продукции ренина. При нарушении обмена витамина D возникает остеопороз с повышенной ломкостью костей и склонностью к образованию патологических переломов.
Диагностика
Пациентам с подозрением на нефросклероз назначают комплексное обследование, позволяющее определить особенности морфологической структуры почек, выявить признаки атрофии паренхимы, оценить функциональную состоятельность органа. Наиболее информативными лабораторными и инструментальными методами диагностики сморщенной почки считаются:
Дифференциальная диагностика нефросклероза проводится с сахарным и несахарным диабетом, острой почечной недостаточностью, быстропрогрессирующим гломерулонефритом, гепаторенальным синдромом, гипохлоремической азотемией. При необходимости пациента, кроме врача-нефролога и уролога консультируют терапевт, кардиолог, фтизиатр, ревматолог, эндокринолог, онколог, онкогематолог.
Лечение нефросклероза
Консервативная терапия начальных стадий сморщивания почек направлена на коррекцию основного заболевания, спровоцировавшего склеротический процесс, и нарастающей почечной недостаточности. С учётом патологии, вызвавшей нефросклероз, пациенту назначают антибиотики, гипотензивные препараты, статины, глюкокортикостероиды, антигликемические, диуретические, нестероидные противовоспалительные и другие этиопатогенетические средства. Для купирования расстройств, вызванных функциональной почечной недостаточностью, могут применяться:
Если сморщивание почки сочетается с ХПН III-IV стадии, показано проведение заместительной почечной терапии — перитонеального диализа, гемодиализа, гемодиафильтрации, гемофильтрации. Радикальным методом лечения, рекомендованным при нефросклерозе с уменьшением количества жизнеспособных нефронов до 5% и менее, является трансплантация почки после полостной или лапароскопической нефрэктомии.
Прогноз и профилактика
При своевременном выявлении болезни прогноз относительно благоприятный, назначение адекватной терапии позволяет добиться длительного состояния компенсации нефросклероза. Со временем работа нефронов ухудшается, развивается хроническая почечная недостаточность: такие пациенты нуждаются в пересадке органа или регулярном гемодиализе.
Для профилактики нефросклероза необходимо соблюдать рекомендации специалиста по лечению нефрологических заболеваний (особенно воспалительного характера), контролировать уровень артериального давления, глюкозы крови, избегать переохлаждений, не злоупотреблять солью и мясной пищей. Важную роль в предупреждении развития сморщенной почки играет регулярное посещение семейного врача для раннего выявления и коррекции соматической патологии.
Медикаментозная терапия поражений почек, обусловленных нарушениями обмена пуринов
Рассмотрены подходы к медикаментозному лечению пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов. Описаны лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии.
Approaches to drug treatment of patients with renal diseases caused by purines metabolism disorders, are examined. Medications used for pathogenic treatment of gouty nephropathy are described.
Пуриновый обмен представляет собой сложный каскад биохимических реакций, в котором принимают участие многие ферментные системы. Содержание пуринов в организме складывается из их поступления с продуктами питания и эндогенного синтеза. Большая часть солей мочевой кислоты — уратов — образуется эндогенно в процессе метаболизма нуклеиновых кислот, однако существуют и другие пути биосинтеза этих веществ. Во всех вариантах важнейшим промежуточным звеном является инозиновая кислота, которая в дальнейшем подвергается гидролизу. Образующийся гипоксантин под влиянием фермента ксантиноксидазы преобразуется в ксантин и мочевую кислоту. С точки зрения биохимии нарушения пуринового обмена представляют собой различные варианты дисбаланса между ферментными системами, отвечающими за синтез и транспортировку мочевой кислоты и ее предшественников. Существенное значение также имеет поступление значительного количества пуринов с продуктами питания.
Считается, что в организме взрослого здорового человека содержится около 1000 мг мочевой кислоты. При нарушениях обмена пуринов этот показатель может возрастать в несколько раз. Содержание мочевой кислоты в организме не является жестким параметром и не имеет какой-либо диагностической ценности. Даже основной показатель состояния пуринового обмена — концентрация мочевой кислоты в сыворотке крови особой жесткостью не отличается. Минимальное и максимальное значения нормы отличаются примерно в 2,5 раза — 200–450 мкмоль/л у мужчин и 160–400 мкмоль/сут у женщин. У здоровых людей за сутки выводится и вновь синтезируется примерно 750 мг или 2/3 от общего объема мочевой кислоты. Из этого количества около 80% или 600 мг экскретируется почками. Оставшиеся 20% выводятся через желудочно-кишечный тракт. По оценке П. М. Клименко и соавт. (2010) клиренс мочевой кислоты в норме составляет 5,4–9,0 мл/мин [1].
Почечная экскреция уратов представляет собой сложный и многоступенчатый процесс. В клубочках происходит фильтрация уратов плазмы. Попавшие в ультрафильтрат ураты практически полностью реабсорбируются в проксимальном канальце, а затем секретируются в просвет нефрона. Некоторая часть секретированных уратов повторно реабсорбируется. Процесс активной секреции уратов очень чувствителен к различным химическим агентам. Считается, что почечную секрецию уратов повышают оротовая кислота, лозартан, эстрогены, продукты распада тетрациклина (просроченные тетрациклины обладают высокой токсичностью!); почечную экскрецию уратов понижают этамбутол, тиазиды и тиазидоподобные диуретики, в меньшей степени фуросемид и ацетазоламид [2]. Вполне очевидно, что выраженность отмеченных эффектов сильно изменяется от препарата к препарату и далеко не всегда имеет клиническое применение. В частности, урикозурические свойства эстрогенов существенного значения не имеют. Лозартан в последнее время стал фигурировать в схемах лечения подагрического тубулоинтерстициального нефрита у пациентов, не имеющих нефролитиаза [3]. Склонность тиазидов и индапамида уменьшать почечную экскрецию уратов и повышать их сывороточную концентрацию выражена достаточно ярко, что делает эти препараты как минимум нежелательными при суставной подагре и, особенно, при подагрической нефропатии.
Клинические варианты поражения почек вследствие нарушения пуринового обмена
Заболевания, связанные с нарушениями пуринового обмена, встречаются сравнительно часто, что делает актуальными вопросы, связанные с их лечением. Специалисты-урологи, а также большинство врачей общей практики хорошо знакомы с особенностями уратного нефролитиаза. В то же время эти специалисты нередко вовсе не имеют представления о существовании других, подчас более тяжелых заболеваний, обусловленных нарушениями пуринового обмена. Между тем все они встречаются с разной частотой в стационарах, а также при оказании амбулаторной медицинской помощи.
Наиболее значимым следствием нарушений пуринового обмена является повышение уровня мочевой кислоты в крови — гиперурикемия, которая и является основным этиологическим фактором различных патологических состояний. В зависимости от этиологии гиперурикемия подразделяется на первичную (не имеющую явной причины) и вторичную по отношению к какому-либо заболеванию.
Клиническим следствием первичной гиперурикемии является подагра в широком понимании этого термина. Сюда входит и классический острый микрокристаллический артрит, и различные варианты подагрической нефропатии, одним из которых является уратный нефролитиаз, и тофусы различной локализации, и осложнения всех этих состояний.
В группе заболеваний, связанных с первичной гиперурикемией, несколько особняком стоят генетически обусловленные нарушения пуринового обмена. Среди них синдром Леша–Нихена, болезнь Гирке, различные варианты наследственных дефектов транспортных систем почечных канальцев и другие. Отличительными признаками гиперурикемий, наследуемых по моногенному типу (то есть связанных с дефектом конкретного гена, определяющего развитие всего симптомокомплекса), являются манифестация в раннем детском возрасте, высокая гиперпродукция мочевой кислоты, быстрое, иногда даже «злокачественное» прогрессирование заболевания вплоть до формирования терминальной почечной недостаточности, часто весьма умеренная эффективность лечебных мероприятий, несмотря на максимально активную терапию [4].
Клиническая диагностика нарушений пуринового обмена, наследуемых по полигенному типу, в настоящее время затруднена. Проявления и характер течения заболевания в этом случае сильно варьируют в зависимости от внешних факторов, а биологический эффект значительной части генов все еще не до конца ясен [3, 4].
В нефрологической и общетерапевтической практике для определения поражения почек вследствие гиперурикемии несколько десятилетий назад было введено понятие «подагрическая почка», которое в современной медицине трансформировалось в «подагрическую нефропатию». Учитывая экспериментально доказанное повреждающее действие солей мочевой кислоты на почечные структуры, также предлагался термин «уратная нефропатия». Все эти понятия являются обобщающими и объединяют несколько достаточно сильно различающихся по своему патогенезу процессов: острую мочекислую нефропатию, уратный нефролитиаз и хронический тубулоинтерстициальный нефрит. Отдельные авторы также отмечают возможность иммунокомплексного гломерулонефрита, пусковым фактором которого служит гиперпродукция мочевой кислоты [5].
В урологической практике наиболее часто встречаются пациенты с уратным нефролитиазом. До 80% таких пациентов хотя бы один раз в жизни имели эпизод острого артрита, причем совершенно необязательно классической локализации — I плюснефалангового сустава. В последнее время все чаше встречаются атипичные варианты подагрического артрита, например, гонит. Кроме того, широкое и бесконтрольное применение нестероидных противовоспалительных средств зачастую смазывает клиническую картину, увеличивая удельный вес артритов с меньшей активностью воспалительного процесса. Можно отметить, что сочетание артрита и уратного нефролитиаза является не обязательным, а, скорее, характерным [5, 6].
Клиническая картина конкремента почки, мочеточника общеизвестна, поэтому еще раз ее подробно описывать смысла нет. Единственно, стоит отметить, что при наиболее тяжелом, «злокачественном» течении, наряду с образованием уратных камней в просвете мочевых путей, возможно и отложение кристаллов урата в почечном интерстиции, что носит название «нефрокальциноз». В отличие от нефролитиаза, нефрокальциноз при подагре всегда двухсторонний. Нефрокальциноз не имеет каких-либо специфических симптомов. Клинические проявления сводятся к прогрессированию почечной недостаточности за счет нефросклероза. Нефрокальциноз в большинстве случаев выявляется при ультразвуковом сканировании и требует специфической терапии.
Хронический тубулоинтерстициальный нефрит является характерным и частым вариантом подагрической нефропатии. Однако, ввиду меньшей яркости клинической картины, он известен главным образом специалистам-нефрологам и ревматологам.
На начальных стадиях тубулоинтерстициального нефрита патологический процесс затрагивает в основном канальцы и почечный интерстиций, поэтому ведущим симптомом является нарушение концентрационной функции почек — полиурия с низкой плотностью мочи (гипостенурией). Протеинурия не превышает 1 г/сут или вовсе отсутствует — она связана с нарушением реабсорбции белка канальцами. Для подагрического интерстициального нефрита характерна стойкая уратурия, а также стойкая или эпизодическая микрогематурия, особенно после перенесенной респираторной вирусной инфекции.
Уровень урата крови также закономерно повышен, однако необходимо помнить, что сам по себе факт наличия хронической почечной недостаточности также является причиной гиперурикемии. При явной клинической картине хронического тубулоинтерстициального нефрита его связь с нарушениями пуринового обмена не вызывает сомнений при следующих соотношениях уровней урата и креатинина крови: соответственно > 536 мкмоль/л и 595 мкмоль/л и 132–176 мкмоль/л; > 714 мкмоль/л и > 176 мкмоль/л [7].
При иммуногистохимическом исследовании почечных биоптатов у части пациентов с клинической картиной подагрического тубулоинтерстициального нефрита было отмечено свечение С3-фракции комплемента и IgG, что характерно для иммунокомплексных гломерулонефритов. Это позволило выделить хронический гломерулонефрит как отдельный вариант подагрической нефропатии [6].
При прогрессировании подагрического тубулоинтерстициального нефрита закономерно развитие артериальной гипертензии и нефросклероза.
Острая мочекислая нефропатия (острая подагрическая почка) в своей основе имеет обструкцию почечных канальцев кристаллами уратов, что приводит к острой почечной недостаточности. Заболевание начинается с олигурии. Часть пациентов одновременно предъявляет жалобы на болевой синдром по типу почечной колики, макрогематурию, что может объясняться миграцией крупных кристаллов уратов по мочеточнику. Патогномоничной является высокая уратурия, не характерная для острой почечной недостаточности другой этиологии, а также значительное повышение уровня мочевой кислоты в крови (выше 850–900 мкмоль/л). В современной нефрологической практике считается, что диагноз острой мочекислой нефропатии не вызывает сомнений при соотношении уровней урата и креатинина крови (в мг) > 1 [8].
Предположение об острой мочекислой нефропатии основывается на сочетании трех клинических признаков — высокоактивного артрита с характерной локализацией, резкого уменьшения диуреза и кирпично-бурого цвета мочи. Диагноз тем более вероятен, если пациент указывает на имевшую место гипогидратацию любого генеза — от посещения бани и физической работы при высокой температуре воздуха до неадекватной инфузионной терапии и передозировки мочегонных, а также на употребление значительного количества мясных продуктов и/или алкоголя. При естественном течении заболевания олигурия практически всегда прогрессирует до анурии с развернутой клинической картиной острой почечной недостаточности.
Проблема острой мочекислой нефропатии тесно прилежит к вторичным гиперурикемиям. Причины повышения уровня мочевой кислоты в сыворотке крови довольно многочисленны и разнообразны. Среди них: хроническая почечная недостаточность, независимо от этиологии, ожирение, особенно высоких степеней, плохо компенсированный сахарный диабет, акромегалия, гипотиреоз, гипопаратиреоз, токсикоз беременности, миелопролиферативные заболевания, саркоидоз, хроническая интоксикация свинцом, хронический алкоголизм. Прослеживается четкая связь между повышенным риском уратного нефролитиаза и наличием у пациента тяжелого псориаза, особенно суставного. В большинстве случаев выраженность гиперурикемии при этих заболевания небольшая, реже умеренная. Таким образом, нарушения пуринового обмена довольно редко значимо отражаются на клинической картине заболевания.
Самым ярким и клинически значимым вариантом вторичной гиперурикемии является «синдром лизиса опухоли» («синдром распада опухоли»), развивающийся при химиотерапии и радиотерапии лимфопролиферативных заболеваний, реже опухолей другой локализации. Ключевым компонентом этого синдрома, наряду с гиперфосфатемией и гиперкалиемией, является гиперпродукция мочевой кислоты, приводящая к развитию острой мочекислой нефропатии, причем нередко на неизмененных почках [11]. Однако тяжелая гиперурикемия, обусловленная генетическими нарушениями, крайне редко приводит к острой мочекислой нефропатии [3, 4].
Медикаментозная терапия заболеваний почек, обусловленных нарушениями пуринового обмена
Консервативная терапия любого варианта подагрической нефропатии в основе своей имеет снижение уровня гиперурикемии, а следовательно, и гиперурикурии, а также повышение растворимости урата в моче.
Всем пациентам в обязательном порядке назначается диета, цель которой уменьшить поступление пуринов в организм с пищей. Это достигается полным исключением из рациона мяса молодых животных, субпродуктов, мясные бульоны, колбас и т. д., ограниченно разрешается мясо полновозрастных животных, рыба. Пациентам рекомендуется преимущественно растительный стол, обильное щелочное питье, цитрусовые и напитки на их основе, а также полное воздержание от алкоголя.
При наличии почечной недостаточности, артериальной гипертензии, недостаточности кровообращения, ожирения вводятся дополнительные ограничения. Прежде всего, рекомендуют снизить потребление поваренной соли, так как эффективность ингибиторов АПФ, особо показанных при нефропатиях, осложненных артериальной гипертензией, да и вообще всей гипотензивной терапии напрямую зависит от объема поступающего в организм натрия. При выраженном дефиците фильтрации появляется необходимость в ограничении потреблении белка. При ожирении уменьшают общую калорийность рациона.
У ряда пациентов, например, при редко рецидивирующем уратном нефролитиазе без почечной недостаточности, при достаточной мотивации со стороны больного, вообще удается ограничиться коррекцией диеты и питьевого режима, не прибегая к назначению лекарственных препаратов.
Лекарственные средства, применяемые для патогенетического лечения подагрической нефропатии, подразделяются на:
Базовым препаратом, влияющим на метаболизм пуринов, является аллопуринол, являющийся ингибитором фермента ксантиноксидазы. Под действием этого фермента происходит последний этап синтеза мочевой кислоты. Предшественники урата ксантин и гипоксантин имеют практически в 10 раз более высокую растворимость в воде по сравнению с мочевой кислотой. Остановка метаболизма пуринов на этом этапе сводит практически до нуля риск кристаллообразования, а значит, и микрокристаллического артрита, и нефропатии.
Аллопуринол показан при подагрическом тубулоинтерстициальном нефрите, острой мочекислой нефропатии, уратном нефролитиазе в сочетании с гиперурикемией, а также при химиотерапии злокачественных новообразований для профилактики развития вторичной гиперурикемии и острой почечной недостаточности. Минимально эффективная дозировка — 200 мг/сут, среднетерапевтическая — 300–400 мг/сут. При химиотерапии злокачественных новообразований требуются высокие, близкие к максимальным, дозировки аллопуринола — 600–900 мг/сут [2].
Аллопуринол склонен вызывать диспептические расстройства и кожную сыпь, которые отмечаются практически у каждого пятого больного. Побочные действия этого препарата чаще носят характер неприятных, но не опасных, и ввиду практически полной (вплоть по последнего времени) безальтернативности этого препарата большая часть пациентов все-таки продолжает лечение.
В последнее время на отечественном рынке появился новый ингибитор ксантиноксидазы фебуксостат, который отличается от аллопуринола более высокой селективностью [3]. Отечественный опыт применения фебуксостата пока крайне ограничен, однако зарубежные исследователи отмечают его более высокую эффективность в отношении гиперурикемии [9]. Однако уже сейчас можно отметить, что этот препарат является полноценной заменой аллопуринола в условиях его непереносимости, аллергии и т. д.
В заключение необходимо отметить, что ингибиторы ксантиноксидазы противопоказаны пациентам, получающим азатиоприн и 6-меркаптопурин, так как этот фермент принимает участие в их метаболизме. При совместном назначении резко возрастает риск токсичности, прежде всего костномозговой.
За рубежом также применяется рекомбинантная уратоксидаза — расбуриказа. Препарат существенно эффективнее аллопуринола снижает гиперурикемию и применяется, главным образом, в гематологической практике для профилактики острой уратной нефропатии [3].
Лекарственные средства, увеличивающие почечное выведение пуринов, — урикозурические препараты — угнетают процесс реабсорбции урата из просвета почечных канальцев. В современной клинической практике эта группа лекарственных средств применяется очень ограниченно. Далеко не у всех пациентов они демонстрируют достаточную эффективность. Кроме того, результатом прямого фармакологического эффекта — увеличения почечной экскреции урата — является рост риска нефролитиаза. Самый известный урикозурический препарат — пробенецид в настоящее время практически отсутствует на отечественном рынке. Бензбромарон зарегистрирован в России, но имеется лишь в очень небольшом количестве. Все урикозурические средства в организме подвергаются печеночному метаболизму и обладают некоторой гепатотоксичностью. Еще одной особенностью этих препаратов является огромное число лекарственных взаимодействий, что затрудняет их применение в составе многокомпонентных схем.
Цитратная терапия является неотъемлемой составляющей медикаментозного лечения подагрической нефропатии. Действие солей лимонной кислоты на процесс кристаллобразования в моче многогранно. Растворимость мочевой кислоты значительно меняется в зависимости от реакции среды. В кислой среде ураты имеют очень плохую растворимость и легко переходят в твердую фазу — кристаллизуются. При нейтральной или щелочной реакции растворимость этих солей увеличивается. Основным эффектом цитратов является способность защелачивать мочу, что предотвращает кристаллизацию уратов и создает условия для растворения уже сформированных кристаллов. На этом основана литолитическая терапия. Однако при щелочной реакции среды уменьшается растворимость фосфатов. Наслоение пленки фосфата на уратный камень делает практически бесперспективным процесс дальнейшего литолиза. Это диктует необходимость тщательного контроля за реакцией мочи на протяжении всего курса лечения. В современных условиях на смену эмпирическому применению растительного сырья, богатого лимонной кислотой и ее солями, пришли лекарственные средства, включающие в себя химически чистый цитрат и набор тест-полосок для мониторирования реакции мочи.
Исследования 1980–90-х гг. продемонстрировали эффективность литолиза уратных камней с применением цитратных смесей в режиме монотерапии порядка 75–80% [10, 11]. В настоящее время в результате совершенствования методики эффективность литолиза удалось повысить до 85–90% в зависимости от особенностей химического состава конкрементов [1, 12, 13].
В последние годы появились работы, свидетельствующие о целесообразности включения препаратов цитрата в многокомпонентные схемы терапии. В частности, при уратных камнях мочеточника, особенно его дистальной трети, комбинированная терапия, включающая цитрат и тамсулозин, привела к самостоятельному отхождению 84,8% конкрементов, что достоверно отличается от групп пациентов, получавших монотерапию этими препаратами (68,8% и 58,8% соответственно), а также от пациентов, получавших плацебо (26,1%) [14].
Имеются убедительные доказательства эффективности комбинации аллопуринола и цитрата при подагрическом интерстициальном нефрите. Двенадцатинедельный курс комбинированной терапии, включающей цитрат 3 г/сут и аллопуринол 100–200 мг/сут, привел к росту скорости клубочковой фильтрации в среднем на 15 мл/мин по сравнению с контрольной группой. Также существенно повысился и клиренс мочевой кислоты. Отметим низкую дозировку аллопуринола. Минимально эффективной считается 200 мг/сут, а 100 мг/сут — вообще субклиническая дозировка, тем не менее, она оказалась эффективной. Можно сделать предположение о возможном потенцировании эффектов аллопуринола и цитрата. Дополнительным позитивным следствием должно быть снижение частоты побочных действий аллопуринола, что является существенным лимитирующим фактором при медикаментозном лечении подагрической нефропатии. К сожалению, авторы не акцентировали на этом внимание [15].
Более яркий эффект цитрата в отношении функции почек отмечен при лечении хронического интерстициального нефрита, обусловленного гиперурикемией, у пациентов, страдающих ожирением [16].
Механизм действия цитрата не ограничивается защелачиванием мочи. Цитрат является одним из физиологических ингибиторов кристаллообразования. Так как моча в норме представляет собой пересыщенный солевой раствор, присутствие в ней ингибиторов кристаллообразования служит необходимым условием адекватного функционирования всей системы мочевыделения. Гипоцитратурия является одним из факторов, способствующих камнеобразованию. Этим может объясняться эффективность цитратных смесей не только при уратном, но и при кальций-оксалатном нефролитиазе [17–19].
Наряду с вышеописанными механизмами действия, соли лимонной кислоты дополнительно обладают антисептическим, цитопротективным и метаболическим эффектами, которые также могут находить применение в клинической практике. В частности, C. Strassner и A. Friesen сообщают об исчезновении кандидурии у 16 пациентов из 18 на фоне терапии цитратными смесями, что, вероятно, связано с изменением реакции мочи [20]. Заключение о цитопротективном эффекте цитрата сделано на основании успешных попыток P. Bruhl и соавт. предотвращать с его помощью химическую травму слизистой мочевого пузыря при терапии препаратами из группы оксазафосфоринов — циклофосфамидом и ифосфамидом [21] (в современной онкологической и нефрологической практике с этой целью применяется препарат из группы муколитиков — месна, практически не влияющий на кислотно-щелочное состояние). Кроме того, сообщается об использовании цитрата для коррекции ацидоза вследствие уретеросигмостомии [22].
Основная сложность при цитратной терапии уратного нефролитиаза заключается в подборе адекватной дозировки препарата. Н. К. Дзеранов, на протяжении многих лет изучавший и разрабатывавший этот аспект, рекомендует начинать с назначения диеты и оценки реакции мочи в течение 5 дней в строго определенное время суток. На основании полученных средних значений уровня рН мочи определяется начальная доза препарата и, главное, ее распределение в течение суток. Через 5 дней лечения снова определяются средние показатели реакции мочи в строго аналогичное время суток и, при необходимости, проводится коррекция дозировки препарата [23]. «Интерактивное», то есть в реальном времени, изменение дозировки цитрата неэффективно и даже небезопасно, так как приводит к скачкам уровня рН, что может вызвать кристаллизацию фосфата.
Ввиду того, что цитрат в норме присутствует в организме, лекарственные средства на его основе практически лишены токсичности. Тем не менее, существуют клинические ситуации, когда применение этих препаратов требует осмотрительности. Применение цитратных смесей нежелательно при острой мочекислой нефропатии и вообще при острой почечной недостаточности любой этиологии. Лимитирующим фактором здесь выступает не цитрат-ион, а калий, выведение которого в этой клинической ситуации затруднено. При острой мочекислой нефропатии целесообразно введение 4% раствора гидрокарбоната натрия, физиологического раствора и т. д. в сочетании с петлевыми диуретиками. Необходимо поддерживать диурез на уровне не менее 100–150 мл/час, рН мочи не ниже 6,5. При возможности назначаются ингибиторы ксантиоксидазы. Цитратные смеси целесообразны при восстановлении диуреза и достижении скорости клубочковой фильтрации 25–30 мл/мин, когда риск гиперкалиемии практически отсутствует [5, 6].
При тяжелой недостаточности кровообращения лимитирующим фактором является повышенное поступление в организм натрия, также содержащегося в цитратных смесях. Иногда в этой ситуации предпочтительнее оказывается ацетазоламид. Данный препарат из группы диуретиков — ингибиторов карбоангидразы сильно, а главное, неконтролируемо защелачивает мочу, что делает его неконкурентоспособным по сравнению с цитратом при медикаментозной терапии уратного нефролитиаза. Однако ацетазоламид — практически единственная возможность повысить уровень рН мочи, не прибегая к введению солей, что в условиях тяжелой сердечной недостаточности крайне нежелательно.
Таким образом, медикаментозное лечение пациентов с заболеваниями почек, обусловленными нарушениями обмена пуринов, несмотря на весьма ограниченный выбор лекарственных препаратов и кажущуюся простоту их выбора, представляет собой сложную и многогранную проблему, требующую междисциплинарного подхода.
Литература
ФГБУ НИИ урологии МЗ РФ, Москва