стратификация в медицине что это
Национальное общество по изучению атеросклероза
Материалы НОА
Стратификация риска
Риск развития сердечно-сосудистых заболеваний
Существуют две шкалы оценки риска ССЗ – шкала, основанная на результатах Фрамингемского исследования, которая позволяет рассчитать 10-летний риск возникновения основных коронарных событий (смерть от ИБС, нефатальный инфаркт миокарда) и шкала SCORE (Systematic Coronary Risk Evaluation), которая даёт возможность определить 10-летний риск возникновения фатальных сердечно-сосудистых событий. Шкала SCORE предназначена для определения стратегии первичной профилактики среди пациентов европейской популяции. Она учитывает риск не только ИБС, но и всех сердечно-сосудистых событий, принимая во внимание коронарные и некоронарные факторы риска.
Для оценки риска развития ССЗ наиболее оптимально использовать шкалу SCORE, которая приводится в Европейских рекомендациях по профилактике ССЗ [1].
Система оценки риска SCORE
Все указанные показатели этой системы были рассчитаны на основании данных 12 европейских эпидемиологических исследований. Система представлена двумя таблицами для расчёта риска в странах с низким и высоким его уровнем. Помимо цветового деления по уровню риска, каждая клетка графика содержит число для более точной количественной оценки риска. В качестве показателя риска выступает вероятность смерти от любого ССЗ в ближайшие 10 лет жизни пациента. За высокий риск принята цифра 5% и более.
Приоритетные группы пациентов для профилактики ССЗ (Европейские рекомендации 2003 г.) [1]:
Ниже представлены цветные таблицы для расчёта риска ССЗ. В них учитывается пол пациента, возраст, уровень общего холестерина, АД, курение. Зелёным цветом отмечен низкий риск, темно-коричневым – высокий (табл. 3).
Таблица 3. Таблица 10-летнего фатального риска ССЗ (Европейское общество кардиологов, 2003 (12 Европейских когорт, включая Россию))
Следует отметить, что риск ССЗ, рассчитанный по SCORE, может быть занижен при:
Критерии, на основании которых определяют выраженность риска ССЗ
: наличие 2-х и более факторов риска в сочетании с ИБС (инфаркт миокарда, нестабильная стенокардия, стабильная стенокардия, перенесённая операция коронарного шунтирования или транслюминальная коронарная ангиопластика, документированная клинически значимая ишемия миокарда). К высокому риску также относятся наличие 2-х и более факторов риска в сочетании с заболеваниями, эквивалентными по степени риска ИБС: периферический атеросклероз нижних конечностей, аневризма аорты, атеросклероз сонных артерий (транзиторная ишемическая атака или инсульт вследствие поражения сонных артерий или сужение просвета сонной артерии>50%), сахарный диабет. Риск развития тяжёлой ИБС в течение 10 лет > 20%.
: наличие 2-х и более факторов риска. Риск развития тяжёлой ИБС в течение 10-ти лет 10-20%.
наличие 2-х и более факторов риска. Риск развития тяжёлой ИБС в течение 10-ти лет 4.9
В Европейских рекомендациях по профилактике ССЗ рассматривается тактика ведения пациентов без клинических проявлений ИБС и других ССЗ, которая основывается на расчёте категории риска (рис. 8) [23]:
Рисунок 8. Тактика ведения пациентов без клинических проявлений ИБС и других ССЗ, основанная на расчёте категории риска 
Таким образом, расчёт риска для конкретного больного должен производиться во всех случаях. Соответственно, рекомендации и тактика лечения должны разрабатываться с обязательным учётом риска, так как данный подход позволяет снизить вероятность возникновения ССЗ и их осложнений.
Стратификация в медицине что это
Стратификацию риска часто используют для оценки риска и помощи в принятии решений. Этот подход обычно базируется на данных статистических моделей, которые выявляют прогностические факторы, и объединяет их в различные системы оценки риска для помощи врачам в принятии решений. В последние годы появилось множество систем расчета риска для быстрой оценки состояния пациента.
Например, система расчета риска TIMI для пациентов с нестабильной стенокардией (ПС) или ИМ без подъема ST использует 7 доступных показателей для определения риска смерчи и ишемических событий. Диапазон риска варьирует В зависимости от количества обнаруженных ФР: от 5% (наличие 0-1 фактора) до 41% (наличие 6-7 факторов).
В исследованиях, посвященных стратификации риска, важно рассматривать вопрос О возможности применения тех же самых подходов и систем для расчета риска но отношению к определенно популяции, если на практике их применяют только у пациентов. Прогностические показатели следует выбирать независимо от конечных результатов. Конечные результаты (исходы) и временные параметры должны быть доступны.
Понятным должна быть и сама идея стратификации. Необходимо, чтобы увеличение точности в оценке риска имело положительные последствия, т.к. отсутствие пользы аналогично назначению обследований, не имеющих значения для терапии.
Парадокс риск-лечение. В некоторых исследованиях наблюдался парадокс «риск-лечение», иными словами, больным с более высоким риском существенно реже проводили вмешательства, которые должны были стать успешными. Это пример парадоксального подхода, т.к. больные из группы высокого риска могли бы получить наибольшую пользу от вмешательства, направленного на снижение риска. Это вытекает из соображения, что относительное снижение риска одинаково в группах с исходно разным риском.
Возникает проблема и с оценкой большого количества конечных результатов, т.к. в этом случае может увеличиться вероятность получения ложноположи тельных результатов. Другой важный аспект, связанный с результатами, полученными в исследованиях, состоит в том, что промежуточные (или суррогатные) показатели, например фракция выброса (ФВ), не всегда согласуются с «твердыми» конечными точками, такими как выживаемость.
Стратификация в медицине что это
Под термином «артериальная гипертензия«, «артериальная гипертония» понимается синдром повышения артериального давления (АД) при гипертонической болезни и симптоматических артериальных гипертензиях.
Исторически (со времён Г.Ф. Ланга) сложилось так, что в России используется термин «гипертоническая болезнь» и соответственно «артериальная гипертония», в зарубежной литературе применяется термин «артериальная гипертензия«.
Под гипертонической болезнью (ГБ) принято понимать хронически протекающее заболевание, основным проявлением которого является синдром артериальной гипертензии, не связанный с наличием патологических процессов, при которых повышение Артериального давления ( АД ) обусловлено известными, во многих случаях устраняемыми причинами («симптоматические артериальные гипертензии») (Рекомендации ВНОК, 2004).
Классификация артериальной гипертензии
I. Стадии гипертонической болезни:
II. Степени артериальной гипертензии:
Степени артериальной гипертензии (уровни Артериального давления ( АД )) представлены в таблице № 1. Если значения систолического Артериального давления ( АД ) и диастолического Артериального давления ( АД ) попадают в разные категории, то устанавливается более высокая степень артериальной гипертензии (АГ). Наиболее точно степень Артериальной гипертензии ( АГ ) может быть установлена в случае впервые диагностированной Артериальной гипертензии ( АГ ) и у пациентов, не принимающих антигипертензивных препаратов.
Таблица №1. Определение и классификация уровней Артериального давления (АД) (мм рт.ст.)
III. Критерии стратификации риска больных АГ:
I. Факторы риска:
а) Основные:
— мужчины > 55 лет 65 лет
— курение.
б) Дислипидемия
ОХС > 6,5 ммоль/л (250 мг/дл)
ХСЛПНП > 4,0 ммоль/л (> 155 мг/дл)
ХСЛПВП 102 см для мужчин или > 88 см для женщин
д) С-реактивный белок:
> 1 мг/дл)
е) Дополнительные факторы риска, негативно влияющие на прогноз больного с Артериальной гипертензией ( АГ ):
— Нарушение толерантности к глюкозе
— Малоподвижный образ жизни
— Повышение фибриногена
ж) Сахарный диабет:
— Глюкоза крови натощак > 7 ммоль/л (126 мг/дл)
— Глюкоза крови после еды или через 2 часа после приема 75 г глюкозы > 11 ммоль/л (198 мг/дл)
II. Поражение органов-мишеней (гипертоническая болезнь 2 стадии):
б) УЗ признаки утолщения стенки артерии (толщина слоя интима-медия сонной артерии >0,9 мм) или атеросклеротические бляшки
в) Небольшое повышение сывороточного креатинина 115-133 мкмоль/л (1,3-1,5 мг/дл) для мужчин или 107-124 мкмоль/л (1,2-1,4 мг/дл) для женщин
г) Микроальбуминурия: 30-300 мг/сут; отношение альбумин/креатинин в моче > 22 мг/г (2,5 мг/ммоль) для мужчин и > 31 мг/г (3,5 мг/ммоль) для женщин
III. Ассоциированные (сопутствующие) клинические состояния (гипертоническая болезнь 3 стадии)
а) Основные:
— мужчины > 55 лет 65 лет
— курение
б) Дислипидемия:
ОХС > 6,5 ммоль/л (> 250 мг/дл)
или ХСЛПНП > 4,0 ммоль/л (> 155 мг/дл)
или ХСЛПВП 102 см для мужчин или > 88 см для женщин
д) С-реактивный белок:
> 1 мг/дл)
е) Дополнительные факторы риска, негативно влияющие на прогноз больного с Артериальной гипертензией ( АГ ):
— Нарушение толерантности к глюкозе
— Малоподвижный образ жизни
— Повышение фибриногена
з) УЗ признаки утолщения стенки артерии (толщина слоя интима-медия сонной артерии >0,9 мм) или атеросклеротические бляшки
и) Небольшое повышение сывороточного креатинина 115-133 мкмоль/л (1,3-1,5 мг/дл) для мужчин или 107-124 мкмоль/л (1,2-1,4 мг/дл) для женщин
к) Микроальбуминурия: 30-300 мг/сут; отношение альбумин/креатинин в моче > 22 мг/г (2,5 мг/ммоль) для мужчин и > 31 мг/г (3,5 мг/ммоль) для женщин
л) Церебро-васкулярное заболевание:
Ишемический инсульт
Геморрагический инсульт
Преходящее нарушение мозгового кровообращения
м) Заболевание сердца:
Инфаркт миокарда
Стенокардия
Коронарная реваскуляризация
Застойная сердечная недостаточность
н) Заболевание почек:
Диабетическая нефропатия
Почечная недостаточность (сывороточный креатинин > 133 мкмоль/л (> 5 мг/дл) для мужчин или > 124 мкмоль/л (> 1,4 мг/дл) для женщин
Протеинурия (>300 мг/сут)
о) Заболевание периферических артерий:
Расслаивающая аневризма аорты
Симптомное поражение периферических артерий
п) Гипертоническая ретинопатия:
Кровоизлияния или экссудаты
Отек соска зрительного нерва
Таблица №3. Стратификация риска больных с Артериальной гипертензией (АГ)
Стратификация в медицине что это
Факторами риска называют особенности организма или внешние воздействия, приводящие к увеличению риска возникновения заболевания.
2. Стратификация риска в кардиохирургии
Стратификация риска имеет большое значение в хирургии, потому что общепринятое до последнего времени понятие «операционный риск» не может быть приемлемо в современной кардиохирургии. Летальность часто использовали как показатель качества медицинского обслуживания, но бурное развитие кардиохирургии в последние десятилетия и изменение рискового профиля кардиохирургических больных привели к возникновению более сложных и специфических систем, используемых для определения риска предстоящей операции и дающих возможность проводить более детальный анализ результатов хирургического лечения. Оценка риска также важна в рамках медицинского страхования для планирования тактики лечения и медицинского обеспечения. О предстоящем операционном риске больные должны быть информированы при оформлении согласия на операцию [4].
Хирургические вмешательства могут быть разделены на группы с низкой, средней и высокой степенью риска возникновения сердечных осложнений за 30-дневный период: 5% соответственно. Хотя это лишь приблизительная оценка, такая классификация риска дает достаточное представление о необходимости кардиологической оценки, медикаментозной терапии, а также об определении риска осложнений со стороны сердца. Группу повышенного риска составляют хирургические вмешательства на сосудах. Риск средней степени обусловлен объемом, продолжительностью, локализацией оперативного вмешательства, а также кровопотерей, дисбалансом жидкости при конкретной операции. В группе низкого риска сердечных осложнений отсутствуют значимые пациент-специфические факторы их возникновения. Вопрос о необходимости предоперационной кардиологической оценки будет также зависеть от ургентности операции. В случае экстренного хирургического вмешательства (при разрыве аневризмы абдоминальной аорты, при массивной травме или при перфорации органа) ход операции не зависит от результатов кардиологической оценки, но они могут оказать влияние на течение раннего послеоперационного периода. При неэкстренных, но срочных хирургических вмешательствах, таких как шунтирование по поводу острой ишемии конечности или при кишечной непроходимости, летальность от нелеченного основного заболевания будет превышать потенциальный кардиологический риск, связанный с вмешательством. В некоторых случаях риск возникновения сердечных осложнений также может влиять на тип операции и быть причиной выбора менее инвазивного вмешательства, например такого, как ангиопластика периферических артерий вместо шунтирования и др., даже если это будет сопровождаться менее благоприятными результатами в долгосрочной перспективе [9].
3. Классификация систем количественной оценки тяжести состояния и прогнозирования операционного риска
Современные системы объективной оценки тяжести состояния больных на основании методов, лежащих в их основе, можно классифицировать следующим образом [10, 11].
3.3. Методы, основанные на интегральной оценке клинико-лабораторных показателей (системы оценки APACHE, SAPS). Несмотря на более чем двадцатилетнюю историю существования интегральных систем оценки тяжести состояния больных и постоянно увеличивающееся их количество, все они остаются несовершенными. Все используемые шкалы имеют общие недостатки: плохая дискриминационная способность исхода для конкретного больного при относительно точном прогнозе вероятности летального исхода для группы больных. Эти особенности интегральных шкал позволяют разделять пациентов на группы для проведения научных исследований и написания отчетов, но практически делают шкалы непригодными для принятия решения, касающегося тактики лечения 19.
3.4. Модели прогнозирования риска с интегральной оценкой клинико-лабораторных, инструментальных и интраоперационных данных [8].
1) многие факторы риска не являются значимыми;
2) начальная шкала Parsonnet имеет лишь средний уровень предсказательной значимости;
3) в модифицированной шкале Parsonnet, которая также комплексно оценивает риск, многие из используемых факторов риска неопределенны.
На основании этого ряд авторов, исследовавших эту систему, считают необходимым создание новых систем оценки периоперационного риска [26].
3.4.2. Шкала POSSUM, несомненным преимуществом которой по сравнению с другими оценочными системами является возможность наряду с прогнозом летальности учитывать вероятность развития значимых послеоперационных осложнений. К настоящему времени накоплена достаточно обширная доказательная база, свидетельствующая о высокой прогностической способности методологии POSSUM в самых различных областях клинической хирургии. Так, в общехирургической клинике эта шкала признана хорошим инструментом при оценке исходов как экстренных, так и плановых лапаротомий [14]. Анализ данных литературы показывает, что методология POSSUM позволяет осуществить удовлетворительную прогностическую оценку риска осложнений и летальности в сосудистой хирургии [13, 28, 31]. Кроме того, было показано, что с помощью шкалы POSSUM возможно проведение внутреннего аудита в сосудистой и торакальной хирургии [5, 7]. Система POSSUM может применяться в различных областях клинической хирургии для оценки прогноза исходов оперативного лечения в кардиохирургии, а также в общей хирургии.
3.4.3. Система ONTARIO была разработана с 01.04.91 по 31.05.93 г. в штате Ontario (Канада) и совершенствовалась в 2008-2011 гг. В исследование были включены больные из 11 кардиохирургических центров штата Ontario, перенесшие:
1) реваскуляризацию миокарда;
2) протезирование аортального клапана;
2.1. Протезирование аортального клапана.
2.2. Протезирование митрального клапана.
2.3. Пластику митрального клапана.
3. Модель «Клапан + АКШ» включает:
3.1. Протезирование аортального клапана + АКШ.
3.2. Протезирование митрального клапана + АКШ.
3.3. Пластику митрального клапана + АКШ [6, 18].
3.4.5. Шкала EuroSCORE основана на данных обширного исследования, в котором участвовали 19 030 больных из разных стран Европы. Было изучено влияние на летальность 68 предоперационных и 29 интраоперационных факторов. Средний возраст участников исследования составлял 62,5±10,7 года (варьировал от 17 до 94 лет). 28% больных в исследовании были женского пола. Средний индекс массы тела составлял 26,3±3,9. Наиболее распространенными факторами риска были артериальная гипертензия (43,6%), дисфункция левого желудочка (31,4%), сахарный диабет (16,7%), предшествовавшие вмешательства на сердце (7,3%), хронические легочные заболевания (3,9%), хроническая почечная недостаточность (3,5%), атеросклероз периферических артерий (2,9%).
В современной кардиохирургии из-за того, что популяции больных могут значимо различаться в разных медицинских учреждениях и географических областях, сравнение абсолютных чисел и какой-то одной модели некорректно. В связи с этим были разработаны стратификационные рисковые модели для коррекции различий, а также для сравнения фактических результатов с прогнозируемыми [30].
Таким образом, достоверная прогностическая оценка операционного риска (осложнений и летальности) позволяет оценить операбельность и тем самым оптимизировать процессы отбора больных, принятия клинического решения врачом и информированного согласия пациентом; определить направленность лечебной тактики с учетом прогностических данных, полученных на основе интегральных оценочных систем; проводить сравнение данных, полученных в различных лечебных учреждениях, а также результатов, проводимых отдельными хирургами, что дает возможность мониторинга качества хирургической помощи.
Пациенты высокого периоперационного риска: два подхода к стратификации
И.Б. Заболотских, Н.В. Трембач
Для корреспонденции: Заболотских Игорь Борисович — д-р мед. наук, профессор, заведующий кафедрой анестезиологии, реаниматологии и трансфузиологии ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России, Краснодар; e-mail: pobeda_zib@mail.ru
Для цитирования: Заболотских И.Б., Трембач Н.В. Пациенты высокого периоперационного риска: два подхода к стратификации. Вестник интенсивной терапии им. А.И. Салтанова. 2019;4:34–46. DOI: 10.21320/1818-474X-2019-4-34-46
Несмотря на успехи современной медицины, оперативные вмешательства не стали абсолютно безопасными, до сих пор частота послеоперационных осложнений и летальность остаются высокими, а послеоперационная летальность вышла на третье место среди причин смерти после ишемической болезни сердца и инсульта. Проблема оценки периоперационного риска постоянно привлекает внимание специалистов, поскольку выявление пациентов высокого риска является основой профилактики неблагоприятного исхода. Тем не менее, несмотря на всю важность, проблема эта далека от решения. Данный обзор посвящен двум подходам к стратификации риска: оценке риска летальности и риска осложнений. Анализ литературы показывает, насколько противоречивы оба этих подхода: отсутствие общепринятых определений летальности и осложнений, разнообразие критериев выделения высокого риска — все это приводит к отсутствию единого представления о высоком периоперационном риске. Существующие на данный момент системы оценки риска не лишены значительных недостатков и обладают ограниченной прогностической ценностью. Тем не менее в вопросе стандартизации исследований по стратификации риска наметился прогресс за последнее десятилетие: появляются единые определения летальности и осложнений, создаются национальные регистры — все это позволяет надеяться на улучшение качества прогноза.
Ключевые слова: стратификация периоперационного риска, летальность, осложнения
Поступила: 11.10.2019
Принята к печати: 05.11.2019
С медицинской точки зрения периоперационный риск — это многофакторное понятие, характеризующее вероятность развития неблагоприятного исхода (летального исхода, развитие осложнения) в течение определенного периода после операции или во время операции.
Для чего нужна точная оценка периоперационного риска? Во-первых, это помогает лучше информировать пациентов о необходимости и оправданности тех или иных решений в периоперационный период. Во-вторых, оценка периоперационного риска может помочь определить необходимость в дополнительном обследовании, предоперационной оценке легочной функции, стресс-тестах для оценки состояния сердечно-сосудистой системы и т. д. В европейских руководящих принципах оценка функционально- го состояния пациента является ключевым фактором, определяющим, рекомендуется ли дальнейшее специализированное предоперационное кардиологическое обследование [1]. В частности, показано, что пациенты, функциональные возможности которых были более 4 метаболических единиц при объектив- ном тестировании, имели более низкий периоперационный риск [2].
В-третьих, информация о риске может помочь определиться с тактикой периоперационного ведения. Обсервационные исследования показали, что периоперационное применение бета-блокаторов связано со снижением частоты осложнений у пациентов с более высоким сердечно-сосудистым риском, в то время как у лиц с низким риском может даже увеличить вероятность их развития [3, 4].
В-четвертых, информация о рисках может помочь указать требуемый уровень периоперационного мониторинга, а также то, требуется ли применение инвазивного контроля гемодинамики или перевод в отделение интенсивной терапии. Роль оценки периоперационного риска в выборе стратегии послеоперационного ведения является особенно важной, поскольку лечение в отделении реанимации является дорогостоящим, а свободные реанимационные койки — дефицитом. Расширенный и целенаправленный послеоперационный мониторинг способствует более раннему выявлению и своевремен- ному лечению осложнений, что позволяет улучшить результат лечения пациентов высокого риска [5]. Информация о риске неблагоприятных событий также может быть полезной для сравнения показателей деятельности отдельных специалистов и клиник [6, 7].
В настоящее время наиболее распространены два подхода к оценке риска: выделение группы пациентов с высоким риском летального исхода и пациентов с высоким риском развития осложнений (табл. 1).
Таблица 1. Критерии исходов хирургического лечения, детерминирующие высокий периоперационный риск
Исход
Примеры
Летальный исход во время анестезии Суточная летальность
Госпитальная летальность 30-дневная летальность 90-дневная летальность
Летальность в течение 1 года
□ Тромбоэмболия легочной артерии
□ Послеоперационная когнитивная дисфункция
□ Хирургические осложнения, специфичные для данного вида операции
□ Послеоперационная тошнота и рвота
Пациенты высокого периоперационного риска: стратификация по летальному исходу
Традиционно внимание анестезиологов-реаниматологов приковано к риску летального исхода, связанного с оперативным лечением. Успехи современной анесте- зиологии позволили значительно снизить риск анестезии по сравнению с прошлым веком, однако уровень периоперационной внутрибольничной летальности после плановых операций на данный момент составляет в среднем около 0,5 % [8]. Weiser et al. [9] подсчитали, что более 313 миллионов взрослых пациентов во всем мире ежегодно подвергаются оперативным вмешательствам. Таким образом, количество летальных исходов может в результате составлять несколько миллионов каждый год. Несмотря на успехи современной анестезиологии и периоперационной медицины, летальный исход в связи с операцией и анестезией продолжает быть крайне актуальной проблемой, занимая третье место среди всех причин смерти [10].
В определении периоперационной летальности нет единого подхода, в частности, в различных исследованиях под этим понятием подразумевают летальный исход в разные сроки периоперационного периода (табл. 2). Подобные разночтения в понятии летальности создают трудности при сравнении данных различных исследований и ведут к потенциальным ошибкам в трактовке, поскольку летальность, ограниченная коротким сроком наблюдения, может не охватывать случаи, обусловленные отдаленными последствиями операции и анестезии, а долгосрочный летальный исход может быть вызван причинами, не связанными с проведенным лечением.
Таблица 2. Временные характеристики периоперационной летальности
Срок летального исхода
Частота летальности,
Источник
В течение двух лет
Один из наиболее распространенных способов оценки периоперационного риска — шкала физического статуса ASA — основан на субъективном мнении врача относительно общего состояния здоровья пациента. Известно, что эта шкала в высокой степени субъективна и не включает хирургические риски [19]. Многочисленные исследования показали, однако, увеличение летальности с увеличением класса по ASA (табл. 3).
Таблица 3. Влияние физического статуса на летальность
Класс
Летальность, %
Госпитальная
n = 6300
7-дневная
n = 897,733
30-дневная
n = 2,297,629
30-дневная
n = 1206
В настоящее время на основании оценки физического статуса пациентов высокого риска выделяют эмпирически — с 3-го класса и выше. Анализ, представленный в таблице, показывает, что с ухудшением статуса до 3-го класса происходит скачкообразное увеличение летальности. Следует отметить, что применение указанной системы приводит к выделению значительной части пациентов (до 58 %) в группу высокого риска, летальность в которой составляет 7,7 % [17].
Работа Visnjevac [23] показала, что разделение классов на подклассы по наличию функциональной зависимости (способности к самообслуживанию и зависимости от посторонней помощи) значительно изменяет структуру летального исхода на всех этапах 10-летнего наблюдения, начиная с 1-го месяца. Таким образом, внутри одного класса популяция крайне неоднородна и риск находится под влиянием такого фактора, как функциональная зависимость.
Несмотря на свою субъективность и неоднородность групп, шкала ASA демонстрирует приемлемую прогностическую ценность в оценке риска летального исхода (табл. 4).
Таблица 4. Прогностическая ценность шкалы ASA в оценке риска летальности
Летальность
Площадь под ROC-кривой
Источник
Работа Shoemaker [27] убедительно показала эффективность целенаправленной интенсивной терапии в группе риска, имеющей конкретные критерии: пред- шествующие тяжелые кардиореспираторные заболевания (инфаркт миокарда, хроническая обструктивная болезнь легких, инсульт), заболевания сосудов на последних стадиях, включая аорту, возраст более 70 лет с ограничением функциональных резервов одного или более органов, операции по поводу карциномы, абдоминальные «катастрофы» на фоне нестабильной гемодинамики (например, перитонит), массивная кровопотеря (более 8 ЕД крови), септицемия, дыхательная недостаточность, острая почечная недостаточность. Госпитальная летальность в группе риска составила 28 %.
Сопоставимые цифры летальности при применении указанных критериев получили Wilson [28] и Lobo [29], при этом в группах пациентов, интенсивная терапия которых была оптимизирована, получено снижение как госпитальной (с 17 до 3 %), так и 30-дневной (с 33 до 15,7 %) летальности.
Некоторые из интегральных шкал периоперационного риска были первоначально разработаны для других целей и впоследствии адаптированы к прогнозированию периоперационного риска. Индекс коморбидности Чарлсона, предлагаемый для прогнозирования кратко- срочных послеоперационных исходов после хирургических вмешательств, первоначально был разработан для предсказания долгосрочной летальности среди стационарных больных [30] и лишь затем валидизирован для прогноза долгосрочной летальности у пациентов с сахарным диабетом и гипертонической болезнью после плановых оперативных вмешательств [31].
Исследования, направленные на изучение вклада коморбидности в развитие неблагоприятного исхода и применявшие шкалу Чарлсона, выявили значительную корреляцию между летальностью и баллами по шкале. При этом 30-дневная летальность значительно увеличивалась у пациентов с количеством баллов более 4 [16], что позволило выделить группу риска с летальностью 14,9 %. В целом пациенты группы высокого периоперационного риска при использовании этой шкалы составляют 26 % всех пациентов и в структуре летальности занимают 91 %. Прогностическая ценность шкалы в прогнозировании летальности колеблется от отсутствия таковой до хорошей (табл. 5).
Таблица 5. Прогностическая ценность шкалы Чарлсона в оценке риска летальности
Летальность
Площадь под ROC-кривой
Источник
Одной из шкал, непосредственно разработанных для оценки риска летального исхода и развития послеоперационных осложнений, является шкала POSSUM (Physiological and Operative Severity Scoring System for Enumeration of Morbidity and Mortality). В ее основе лежат 12 параметров, которые необходимо регистрировать в предоперационный период, включая возраст, наличие симптомов кардиореспираторных заболеваний и некоторых лабораторных маркеров. Уравнение регрессии, включающее все переменные, позволяет рассчитать риск госпитальной летальности у конкретного пациента. Эмпирически была выделена группа высокого периоперационного риска выше 5 %. Анализ показал, что данному критерию соответствовали примерно 10 % всех пациентов; при этом госпитальная летальность составила около 12 % (табл. 6).
Таблица 6. Летальность в группе пациентов высокого риска по шкале POSSUM
Пациенты высокого риска,%
Госпитальная летальность в группе риска, %
Вклад высокого риска в общую летальность, %
Источник
В настоящее время известно несколько модификаций этой шкалы, в зависимости от области хирургии. Специфические шкалы показывают лучшую прогностическую ценность в оценке риска летальности, чем исходная шкала (табл. 7).
Таблица 7. Прогностическая ценность модификаций шкалы POSSUM в оценке риска летальности после операций по поводу рака желудка
Шкала
Площадь под ROC-кривой
Шкала P-POSSUM, разработанная в Великобритании, была затем валидизирована в нескольких странах: Японии, Австралии и Италии. Данная модификация является наиболее часто используемой моделью. С одной стороны, шкала обладает высокой точностью. Так, два исследования, изучавшие 30-дневную летальность после обширных оперативных вмешательств, выявили высокую прогностическую значимость шкалы [36, 37] (AUROC 0,9 и 0,92), Donati et al. получили подобные данные для госпитальной летальности (AUROC 0,91) [25]. Однако у шкалы есть недостатки — она включает в себя интраоперационные факторы и потому не может считаться предоперационным методом оценки риска: не- которые переменные достаточно субъективны, а их количество велико (18 параметров).
Шкала хирургического риска (Surgical Risk Scale) до недавнего времени наряду с P-POSSUM являлась одной из наиболее часто используемых в оценке риска неблагоприятного исхода. Заключая в себе данные о тяжести операции, виде операции и физическом статусе по ASA (в сумме от 3 до 14 баллов), шкала удобна в применении в предоперационный период. Два исследования показали хорошую прогностическую ценность в оценке риска 30-дневной летальности (AUROC — 0,85 и 0,89) [36, 37] и одно — в оценке госпитальной летальности (AUROC 0,95) [24]. Тем не менее применение шкалы ASA приводит к некоторой субъективизации, а классификация тяжести операций трудна в рутинном использовании. Наконец, шкала не была валидизирована на большой популяции.
Шкала POSPOM (Preoperative Score to Predict Postoperative Mortality) является одной из наиболее со- временных систем оценки риска послеоперационной летальности [38]. В основу модели легли данные почти трех миллионов пациентов из 479 центров, при этом валидизация проводилась на схожей по численности когорте из тех же 479 центров. Оценка включала в себя как факторы, обусловленные состоянием пациента, так и факторы, связанные с оперативным вмешательством. Авторы отметили, что летальность значительно возрастает у пациентов с количеством баллов более 30. На основании этого факта эмпирически было предложено выделить группу высокого периоперационного риска, включающую около 20 % всех пациентов, при этом 30-дневная и 90-дневная летальность составила 3,9 и 11,3 % соответственно [39].
Kim M. et al. [40] на основании кластерного анализа выделили пять классов латентного риска, внутри которых пациенты обладают характерными свойствами (лабораторные показатели, гендерные характеристики, наличие сопутствующих заболеваний):
От 1-го к 5-му классу 30-дневная летальность увеличивается с 0,06 до 22 %, при этом система показывает хорошую прогностическую ценность (AUROC 0,87 при 95 % ДИ 0,866–0,872), а включение в прогностическую модель функционального класса по ASA и характеристик хирургического вмешательства увеличивает ценность еще больше (AUROC 0,915 при 95% ДИ 0,913–0,917).
Еще одной разработанной не так давно системой оценки периоперационного риска является шкала, полученная в результате анализа результатов лечения 211 тысяч пациентов из 250 госпиталей США в рамках национальной программы по улучшению качества хирургической помощи (NSQIP). Целью данной про- граммы служили выявление факторов риска 30-дневной летальности после оперативного вмешательства и раз- работка калькулятора расчета ее риска. В результате анализа более миллиона анестезий такой калькулятор был создан и в настоящее время является системой оценки 21 предоперационного фактора, которые компьютерная программа включает в уравнение логистической регрессии. Результат представляет собой риск 30-дневного летального исхода, выраженный в процентах [41]. Рассчитанный индивидуально риск сравнивается с частотой летальности, полученной в исследуемой популяции (в настоящее время в регистре содержится информация о более чем миллионе пациентов из почти 400 клиник со средней летальностью 1,6 %), таким образом, пациента с риском летального исхода более 1,6 % относят к пациентам высокого риска. Разработанная модель является надежным инструментом оценки риска летальности (C-statistic = 0,944).
Исходя из вышесказанного, становятся понятными различия в полученных цифрах летальности, на которую оказывают влияние принцип выделения группы риска, период, в течение которого регистрируется летальный исход, а также год проведения исследования (табл. 8).
Таблица 8. Летальность в группе высокого риска в зависимости от применяемого критерия
Шкалы
Летальность в группе высокого риска, %
Источник
Исходя из вышесказанного, согласно данному под- ходу, высокий периоперационный риск — это высокая вероятность развития летальности у конкретно- го пациента, определенная одной из систем оценки. И 30-дневная, и госпитальная летальность являются приемлемыми и надежными определениями неблагоприятного исхода. Стратификация пациентов высокого периоперационного риска чаще всего основана на эмпирическом выборе порогового значения шкал ASA-PS, POSSUM, POSCOM и NSQIP, выше которого пациент относится к группе высокого риска, при этом за 30 лет «пороговая» величина послеоперационной летальности в группах высокого риска существенно снизилась. При верификации пациентов высокого периоперационного риска целесообразно указывать шкалу, на основании которой определен риск летального исхода, а для уточнения степени высокого риска важно использовать валидизированные с этой целью факторы.
Пациенты высокого периоперационного риска: стратификация по послеоперационным осложнениям
Вторым подходом к верификации высокого периоперационного риска является оценка вероятности развития существенных и второстепенных послеоперационных осложнений. При этом оценивается как риск осложненного послеоперационного периода в целом (наличие одного или нескольких осложнений, различия по тяжести осложнений), так и риск конкретного осложнения. Частота послеоперационных осложнений колеблется в широком диапазоне, составляя от 3 до 18 % [42–44]. Различия в данных объясняются отсутствием четких определений осложнений и различием в дизайне исследований. В работах, посвященных анализу развития осложнений и выявлению группы риска, также отсутствует единый подход к регистрируемым исходам.
Существенное количество исследований регистрируют некоторый перечень осложнений [27–29] или композитных исходов [40], иногда независимо от тяжести. Ряд авторов выделяет группы осложнений, что позволяет отделить риск серьезных жизнеугрожающих событий [17, 45]. В то же время нередко регистрируемые исходы имеют различное определение от исследования к исследованию, а иногда оно и вовсе отсутствует, что вызывает затруднения в оценке частоты исходов и факторов риска, а также делает сложным сравнение разных исследуемых выборок.
Вид осложнения и его тяжесть — основные характеристики исхода. К настоящему времени разработано несколько классификаций осложнений. В 1992 г. Clavien et al. предложили классификацию тяжести осложнений, состоящую из 4 степеней [46]. В 2005 г. Dindo et al. [47] предложили модификацию этой шкалы. Второй пересмотр расширил классификацию до 5 классов, содержащих 7 уровней тяжести (табл. 9). Вторая измененная классификация добавила точности, включая информацию о том, было ли вмешательство по поводу осложнения связано с общей анестезией, была ли необходима госпитализация в отделение интенсивной терапии по поводу органной недостаточности, и если да, то осложнения подразделялись по степени наличия органной недостаточности.
На основе анализа многочисленных исследований o применении шкалы Clavien—Dindo авторы системы пришли к заключению, что система требует изменений.
Таблица 9. Классификация осложнений по тяжести Clavien—Dindo
Степень тяжести
Критерий
Любые отклонения от нормального послеоперационного течения, не требующие медикаментозного лечения или хирургического, радиологического вмешательства. Разрешается терапевтическое лечение: антипиретики, анальгетики, диуретики, электролиты, физиотерапия. Лечение раневой инфекции
Требуется лечение в виде гемотрансфузии, энтерального или парентерального питания
Требуется хирургическое, эндоскопическое или радиологическое вмешательство без общего обезболивания
Вмешательство под общим обезболиванием
Жизнеугрожающие осложнения (включая осложнения со стороны центральной нервной системы), требующие интенсивной терапии, наблюдения в реанимации, резекции органа. Недостаточность одного органа
Учитывая потребность в единстве определений, в первую очередь для будущих исследований по оценке риска осложнений, в 2016 г. совместной рабочей группой Европейских обществ по анестезиологии и по интенсивной терапии была разработана классификация послеоперационных исходов [50]. Классификация послеоперационных исходов представлена 22 индивидуальными осложнениями с подробным описанием критериев, с помощью которых необходимо установить тот или иной диагноз, а также оценить тяжесть осложнения:
1.1 Острое повреждение почек
1.2 Острый респираторный дистресс-синдром
1.3 Несостоятельность анастомоза
1.5 Остановка сердца
1.6 Кардиогенный отек легких
1.7 Тромбоз глубоких вен
1.9 Желудочно-кишечное кровотечение
1.10 Инфекция без определенного источника
1.11 Лабораторно подтвержденная бактериемия
1.12 Инфаркт миокарда
1.13 Повреждение миокарда после некардиальных операций
1.15 Паралитическая кишечная непроходимость
1.16 Послеоперационное кровотечение
1.17 Тромбоэмболия легочной артерии
1.18 Острое нарушение мозгового кровообращения
1.19 Послеоперационная раневая инфекция (поверхностная)
1.20 Послеоперационная раневая инфекция (глубокая)
1.21 Послеоперационная инфекция (орган/пространство)
1.22 Инфекция мочевыводящих путей
Кроме того, классификация выделяет 4 составные характеристики послеоперационного исхода: большие кардиоваскулярные события, послеоперационные легочные осложнения, анкетирование послеоперационной заболеваемости, качество восстановления. Каждый исход содержит в себе несколько осложнений с критериями их диагностики. Для оценки степени тяжести осложнений рекомендуется применять классификацию Clavien в любой модификации.
Разработка данных дефиниций позволила унифицировать процесс регистрации исходов в проводимых в настоящее время эпидемиологических исследованиях [8, 51]. Тем не менее такой подход имеет свои слабые стороны, поскольку строгое соблюдение номенклатуры приводит к недооценке частоты встречаемости некоторых осложнений вследствие отсутствия в некоторых клиниках необходимых ресурсов для подтверждения соответствия развившегося события критериям исхода [51].
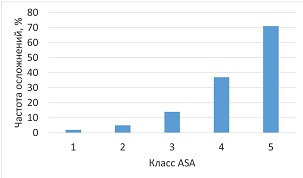
Шкала ASA применялась также для оценки риска осложнений. Ухудшение физического статуса по ASA коррелирует с увеличением риска периоперационных осложнений. Так, в исследовании Hackett et al. [22] участвовало более двух миллионов пациентов (11,7 % операций — экстренные) в некардиальной хирургии. Авторы регистрировали послеоперационные осложнения, развившиеся в течение 30-дневного периода (одно осложнение и более: тромбоз глубоких вен; тромбоэмболия легочной артерии; дыхательная недостаточность, потребовавшая реинтубации; продленная искусственная вентиляция легких; почечная недостаточность; кома; инсульт; остановка кровообращения; инфаркт миокарда; пневмония; инфекция мочевыводящих путей; сепсис; септический шок). В результате анализа количество осложнений прогрессивно возрастало с увеличением класса (рис. 1).
Рис. 1. Частота послеоперационных осложнений в зависимости от физического статуса (цит. по [22])
Наиболее частыми осложнениями являлись: дыхательная недостаточность, потребовавшая проведения продленной искусственной вентиляции легких (> 48 ч) (15,9 %) или реинтубации (10 %), сепсис (15 %), пневмония (12,7 %) и инфекция мочевыводящих путей (14 %).
Следует отметить, что частота осложнений у пациентов 2-го класса ASA и более была в 4 раза выше (16,9 vs 4,3 %); 74 % всех осложнений развились именно в группе высокого риска, при этом данная тенденция оставалась неизменной независимо от вида оперативного вмешательства [22].
Частота периоперационных осложнений всех классов по классификации Clavien—Dindo была выше в группе пациентов со статусом по ASA ≥ 3 (p 48,9*
**Тяжелые осложнения (3–5-я степень по Clavien—Dindo).
Существует два фактора, обусловливающих клиническую ценность шкал оценки периоперационного риска — прогностическая ценность и удобство в еже- дневной рутинной клинической практике. Очевидно, что прогностическая ценность должна стремиться к 100 %, однако очень часто ее увеличение перевешивается трудностью применения. Системы оценки риска, заключающие в себе большое количество независимых предикторов неблагоприятного исхода, обычно более точны в оценке риска, но с большим трудом могут быть встроены в рутинную предоперационную оценку. Более того, клинический опыт подсказывает, что специалисты неохотно пользуются «громоздкими» формулами [62], отдавая предпочтение простым способам стратификации высокого периоперационного риска. Очевидным доказательством этого тезиса является не снижающаяся популярность такой субъективной и не самой точной шкалы, как шкала ASA.
Из вышесказанного следует, что под периоперационным риском также подразумевают вероятность развития послеоперационных осложнений. Основной проблемой, связанной с данным подходом, является отсутствие единой системы классификации и определений послеоперационных осложнений. В настоящее время наиболее часто применяются классификация ESA- ESICM и классификация NSQIP, оценку тяжести осложнений рекомендуется проводить с помощью шкалы Clavien—Dindo. Для определения высокого риска чаще всего применяются те же «пороговые» значения, что и в случае с летальностью, однако такой подход обладает недостатками. Известные системы прогнозирования риска, демонстрировавшие на момент создания хорошую прогностическую ценность в оценке риска осложнений, в настоящее время по ряду причин уже не обладают прежней ценностью; выделение с их по- мощью групп риска вызывает трудности и чревато как недооценкой, так и переоценкой риска. Наибольшей точностью обладают системы, включающие в себя комбинации факторов риска, связанных с состоянием пациента и характеристиками оперативного вмешательства.
Заключение
Оценка периоперационного риска является одним из наиболее важных элементов в работе врача, поскольку позволяет индивидуализировать и рационализировать периоперационное ведение пациента. Однако выявление пациента высокого риска — нетривиальная задача и сопряжено с рядом трудностей. Несмотря на интуитивную простоту понятия «периоперационный риск», каждый понимает под ним что- то свое, и причин этому несколько. Во-первых, отсутствует единый подход к определению исхода, как летальности, так и осложнений. Во-вторых, разработанные на одной когорте пациентов шкалы чаще всего не демонстрируют заявленную прогностическую ценность на другой. В-третьих, большая часть «пороговых» величин в системах оценки риска являются субъективными. Наконец, разработанные несколько десятилетий назад шкалы не отражают реальное состояние медицины, и их эффективность значительно ниже, чем в момент создания. Тем не менее попытки улучшить прогноз ведутся постоянно и небезуспешно. Разработка единых определений исхода, набор больших регистров, позволяющих получить достоверные предикторы неблагоприятного исхода, — все это перспективные направления, которые позволят в будущем точно сказать, кто такой пациент высокого риска.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Заболотских И.Б. — разработка плана статьи, литературный поиск, анализ литературных источников, редакция статьи, подготовка окончательного варианта работы; Трембач Н.В. — литературный поиск, анализ литературных источников, оформление окончательного варианта статьи.