стойкое фетальное кровообращение у новорожденного что это
Стойкое фетальное кровообращение у новорожденного что это
Фетальное кровообращение у новорожденных детей частично функционирует в течение 10—15 ч внеутробной жизни. В это время сохраняется небольшой кровоток через овальное окно и артериальный проток. Возможен и двухсторонний шунт с током крови справа-налево и слева-направо. Установлено, что в первые 4 ч после рождения у большинства детей двухстороннее шунтирование крови через артериальный проток имеет несколько вариантов:
1) право-левый шунт в систолу и лево-правый шунт в диастолу;
2) право-левый шунт в систолу и двухсторонний шунт в диастолу;
3) непрерывный двухсторонний шунт в систолу и диастолу.
Право-левый ток крови обычно регистрируется в раннюю систолу, лево-правый ток крови, наблюдающийся в диастолу, продолжается длительно в течение всей диастолы. Двухсторонний турбулентный кровоток через артериальный проток имеет высокую скорость и продолжительность. С возрастанием скорости кровотока по артериальному протоку в диастолу двухсторонний шунт сменяется на лево-правый. Скорость лево-правого шунта в диастолу возрастает в первые 12 ч после рождения ребенка.
Частично циркулирующие фетальные коммуникации у новорожденного ребенка играют регуляторную роль, снижая гемодинамическую нагрузку на миокард ПЖ во время послеродовой сердечно-легочной адаптации.
После рождения ребенка происходят изменения и в системе общего кровообращения. Плацентарный артериальный кровоток прекращается в течение 45—60 с после рождения. Скорость плацентарного венозного кровотока составляет 75 мл/кг-мин, замедляется через 2 мин после рождения, почти полностью прекращается на 3-й и заканчивается на 5-й минуте жизни.
Перестройка кровообращения приводит к возрастанию выброса ЛЖ примерно на 25%. В первые 2 ч после рождения резистентность периферических регуляторных сосудов низкая, в последующее время она повышается, обеспечивая таким образом необходимый уровень АД крови. В первые сутки после рождения у здоровых доношенных новорожденных наблюдается гиперкинетический тип сокращения межжелудочковой перегородки, который регистрируется до конца первой недели жизни. Такой тип сокращения межжелудочковой перегородки с высоким давлением крови в легочной артерии при транзиторной легочной гипертензии служит для облегчения работы миокарда ЛЖ. После закрытия артериального протока ударный объем ЛЖ в среднем равняется 4,0 мл, а скорость кровотока в общей системе циркуляции составляет 2,3—3,1 л/мин*м2.
Перестройка общего кровообращения сопровождается улучшением оксигенации крови и выделения углекислого газа из организма ребенка. Так, парциальное напряжение кислорода в крови в первые 10 мин жизни равняется 30 мм рт. ст., в последующие 15 мин возрастает до 60 мм рт. ст., в течение 1-го часа — до 80 мм рт. ст. и к концу первых суток жизни устанавливается на уровне 90 мм рт. ст. Парциальное напряжение углекислого газа в крови при рождении высокое (60 мм рт. ст.) и достигает уровня взрослого в течение 2-го часа жизни.
С первых по пятые сутки жизни отмечается нарастание минутного объема кровообращения, с максимальным подъемом на 3-й день после рождения. Увеличение минутного объема кровообращения происходит в значительной мере за счет возрастания ударного объема ЛЖ. Возрастание минутного объема кровообращения вместе с нормализацией общего периферического сопротивления сосудов в конечном итоге приводит к улучшению периферической циркуляции крови, увеличению кровенаполнения периферических сосудов, улучшению оттока крови из тканей и возрастанию скорости кровотока по сосудам.
После рождения постепенно повышается АД крови, особенно максимальное. Системное АД после рождения составляет в среднем 72/47 мм рт. ст., со 2—3-го дня жизни возрастает в среднем до 94/72 мм рт. ст. с наиболее значительным подъемом на 4—5-й день жизни. Возрастание системного АД связано с увеличением не только сердечного выброса, но и общего сосудистого периферического сопротивления, что обусловлено увеличением относительной массы мышечной стенки сосудистого ложа и повышением тонуса сфинктеров периферических регуляторных сосудов.
После рождения имеется устойчивая тенденция к снижению гематокрита, что также влияет на состояние общего кровотока: с уменьшением гематокрита снижается вязкость крови и возрастает скорость кровотока в общем сосудистом русле.
Метаболизм миокарда новорожденных постепенно переходит от утилизации глюкозы как основного источника энергии к потреблению жирных кислот.
Функциональное закрытие венозного протока происходит в течение первых нескольких минут жизни, а полное анатомическое закрытие — на 2—3-й неделе после рождения.
На качестве переходного кровообращения сказывается такой фактор, как время перевязки пуповины. При поздней перевязке пуповины (наложение скобок более чем через 3 мин после рождения плода) происходит возрастание объема циркулирующей крови до 60%. Этот дополнительный объем крови обеспечивает увеличение объема крови в правом и левом предсердиях («плюс-объем»), обусловливая более высокий уровень среднего АД. Среднее давление крови в предсердиях достигает исходного уровня только спустя 2—3 ч. В этом случае на сердце новорожденного ребенка падает дополнительная работа по перекачиванию большего объема крови. Кроме того, при позднем наложении скобок на пуповину происходит увеличение массы эритроцитов на 40—50%, что способствует повышению вязкости крови и, соответственно, гемодинамической нагрузки на сердце ребенка.
Переходная циркуляция сопровождается такими клиническими проявлениями, как акроцианоз, периоральный цианоз, усиливающийся при беспокойстве или крике ребенка, сердечные шумы. В первые несколько часов жизни шумы переходного кровообращения над областью сердца выслушиваются у 85% новорожденных детей. Чаще всего они обусловлены временным функционированием артериального протока с лево-правым шунтированием крови или турбулентным движением потока крови на изгибах крупных кровеносных сосудов. Отдельные сердечные шумы выслушиваются в раннюю или позднюю систолу. В первые полчаса-час после рождения на ЭКГ могут регистрироваться удлинение интервалов P-R, QRS, инверсия зубца Т в отведении VI, который в это время становится положительным за счет систолической перегрузки ПЖ.
Опыт ведения глубоко недоношенных детей с персистирующим фетальным кровообращением
В статье приводятся результаты анализа терапии 134 новорожденных, рожденных с массой тела менее1500 г. Установлено, что частота функционирования артериального протока у детей с массой менее1000 гбольше, чем у недоношенных с большей массой, и составила, соответственно, 75,3 и 63,1%. У недоношенных новорожденных имеет место сниженная толерантность к массивной инфузионной терапии и внутривенному введению коллоидных препаратов.
Reference of experience deeply premature infants with persistent fetal the circulation
The paper presents results an analysis of therapy 134 infants born weighing less than1500 g. It was established that the frequency of the operating ductus arteriosus in children weighing less than1000 gmore than in preterm with more weight, and was, respectively, 75.3% and 63.1%. In preterm infants there is a decreased tolerance to massive fluid resuscitation and intravenous colloid preparations.
По мере развития неонатологии совершенствуются перинатальные технологии выхаживания детей, что привело к существенному увеличению выживаемости недоношенных детей. Сегодня перед специалистами стоят новые задачи — выхаживание детей с очень низкой и экстремально низкой массой тела [1]. Известно, что дети, родившиеся недоношенными, подвергаются высокому риску развития различных осложнений, нарушающих качество их жизни в неонатальном и последующих периодах, большую часть которых можно предотвратить или купировать, среди них синдромы персистирующего фетального кровообращения и транзиторной легочной гипертензии.
Согласно литературным данным, в нашей стране в последние годы увеличивается число детей с гемодинамически значимым функционирующим артериальным протоком (ГЗ ФАП), а число случаев клинически выраженного функционирующего артериального протока увеличивается пропорционально уменьшению гестационного возраста [2]. Длительное сохранение ГЗ ФАП отмечается преимущественно у детей с массой тела при рождении менее1000 ги гестационным возрастом менее 28 нед. ГЗ ФАП негативно воздействует на легочную ткань, приводит к «обкрадыванию» мезентериального кровотока и гипоперфузии желудочно-кишечного тракта, что является фактором риска формирования некротизирующего энтероколита, приводит к флюктуации мозгового кровотока и снижению конечной диастолической и средней скорости кровотока, результатом таких нарушений могут быть внутрижелудочковые кровоизлияния (ВЖК) и гипоксические поражения головного мозга. Разработка тактики терапии недоношенных новорожденных с экстремально низкой массой тела (ЭНМТ) и очень низкой массой тела (ОНМТ) в первые дни и сутки жизни для адаптации гемодинамики — актуальная проблема при выхаживании недоношенных новорожденных.
Целью исследования является анализ эффективности коррекции гемодинамики у недоношенных новорожденных с ЭНМТ и ОНМТ в отделении реанимации и интенсивной терапии новорожденных в первые дни жизни.
Материалы и методы исследования. Под нашим наблюдением было 134 новорожденных ребенка, родившихся недоношенными с массой тела менее1500 г, из них детей с ЭНМТ тела было 50 пациентов (37,3%). Дети находились на лечении в отделении реанимации и интенсивной терапии новорожденных ГУЗ «Президентский перинатальный центр» МЗ СР ЧР по поводу выраженной дыхательной недостаточности. Детям проводился комплекс клинических, лабораторных и инструментальных методов исследования. Эхокардиографическое исследование проводились на 1-е, 2–4-е, 5–7-е сутки жизни аппаратом «ALOKA 1400, 1700», «LOGIQ book XP» c микроконвексными датчиками частотой сканирования 5 мГц в соответствии с рекомендациями фирмы-производителя.
По доминирующему поражению сердечно-сосудистой системы пациенты были разделены на две группы. В первую группу (42 человека) вошли пациенты с ГЗ ФАП. Критериями гемодинамической значимости протока являлись следующие Эхо-КГ признаки [2, 7]: диаметр артериального протока более1,5 мму новорожденных с ЭНМТ и ОНМТ, наличие лево-правого шунтирования крови по протоку, наличие ретоградного кровотока в постдуктальной аорте, составляющего более 50% антеградного кровотока, соотношение «левое предсердие/аорта» (ЛП/Ао) более 1,1, наличие феномена «диастолического обкрадывания» (сниженный диастолический кровоток в аорте, сосудах головного мозга, органов брюшной полости, его отсутствие или наличие диастолического реверса крови), гиперволемия малого круга кровообращения. Во вторую — контрольную — группу вошли 92 новорожденных ребенка без признаков наличия гемодинамически значимого функционирующего артериального протока (ГЗ ФАП) (табл. 1).
При анализе показателей гемодинамики первую группу пациентов разделили на две подгруппы. В подгруппу А (29 детей) вошли пациенты с ГЗ ФАП, в подгруппу В (13 детей) пациенты с транзиторной легочной гипертензией. Критериями легочной гипертензии являлось давление в полости правого желудочка, которое всегда повышено и составляет 35-65 ммрт. ст. (транстрикуспидальный градиент) (норма до30 ммрт. ст.) [8]. Косвенными признаками были отклонение межпредсердной перегородки в сторону левого предсердия, наличие трикуспидальной регургитации, право-левым шунтированием через артериальный проток и/или овальное окно, расширение правых отделов сердца. По данным ЭКГ, во II отведении выявляли признаки P-pulm.
Все дети получали инфузионную, посиндромную и антибактериальную терапию с первых часов жизни. Респираторная поддержка у 97 детей (72,4%) осуществлялась методом искусственной вентиляции легких (ИВЛ), 37 новорожденным (27,6%) проводился назальный СРАР. В связи с большей тяжестью СДР у детей основной группы дополнительными факторами, предрасполагавшими к ГЗ ФАП, явилось использование экзогенного сурфактанта. Применение порактанта альфа потребовалось 28 детям (66,7%) основной группы. В группе сравнения назначение препарата экзогенного сурфактанта потребовалось достоверно реже 27 новорожденным (29,3%).
Характеристика основных групп обследованных недоношенных по сроку гестации, полу и массе тела
Стойкое фетальное кровообращение у новорожденного что это
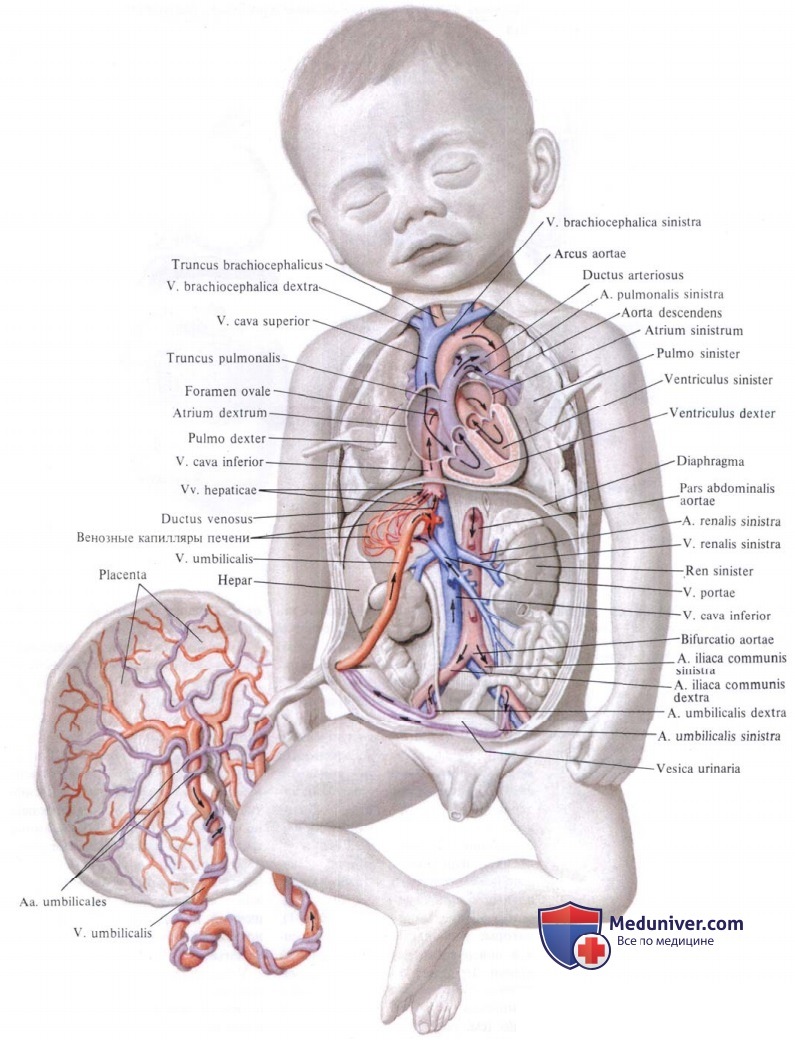
Приспособление кровообращения к внеутробному существованию, протекающее во время рождения и в течение первых нескольких дней жизни, определяется как «переходное кровообращение». Оно является сложным и ответственным периодом в процессе формирования сердечно-сосудистой системы новорожденного ребенка. Наиболее важными в послеродовой перестройке системы кровообращения являются:
— начало легочного дыхания;
— становление легочного кровотока;
— перестройка внутрисердечной и общей гемодинамики.
Начало легочного дыхания происходит следующим образом. В норме при рождении у ребенка возникают мощные сокращения диафрагмы, обеспечивающие правильное и стойкое расширение альвеол. После первых дыхательных движений легкие почти полностью расправляются. Легочные альвеолы раскрываются одновременно с увеличением кровенаполнения легких.
Становление легочного кровотока обусловлено снижением резистентности сосудов легких. После рождения сосуды легких оказываются в воздушной среде, что влечет за собой понижение внесосудистого давления, раскрытие ранее не функционировавших сосудов и расширение уже функционирующих. Установлено, что расширение артериол на уровне респираторных бронхиол происходит не сразу после рождения, а в течение первых 2—7 дней жизни.
Механическое расширение легких является не единственной причиной снижения резистентности сосудов легких. Существенными факторами этого процесса можно считать увеличение р02 и снижение рС02 в крови.
Давление крови в легочной артерии снижается не сразу: после рождения ребенка оно остается приблизительно равным давлению крови в аорте, а затем на протяжении первых часов или нескольких дней жизни медленно уменьшается. В первые часы жизни давление крови в легочной артерии равно системному АД, затем происходит его снижение до 30 мм рт. ст., что составляет примерно 1/2 от системного АД. Артериальный легочный кровоток в это время достигает уровня 4 л/мин*м2. Резистентность легочных сосудов равняется половине общего периферического сопротивления и остается умеренно увеличенной в течение последующих 2 мес.
В первые часы жизни, пока сопротивление в сосудах малого круга кровообращения довольно высокое, сохраняется сброс крови справа-налево. При снижении резистентности в легочных сосудах сброс крови меняется на лево-правый. Продолжительность становления гемодинамики малого круга кровообращения колеблется от 4 ч до конца раннего неонатального периода.
У детей, рожденных путем кесарева сечения, имеются особенности становления легочного кровообращения. Оно характеризуется более значительным легочным сосудистым сопротивлением и длительным существованием транзиторной легочной гипертензии по сравнению с младенцами, родившимися естественным путем. Кроме того, рН артериальной крови пуповины у этих детей достоверно ниже, а дефицит оснований и уровень адреналина выше, что затрудняет сердечно-легочную адаптацию.
Перестройка внутрисердечной гемодинамики осуществляется путем закрытия фетальных коммуникаций.
• Артериальный проток после рождения ребенка на некоторое время остается открытым, обеспечивая ток крови из легочной артерии в аорту. Через него в это время справо-налево шунтируется около 15% сердечного выброса. Установлено, что через 2 ч после рождения артериальный проток имеет еще достаточно большой внутренний диаметр, и конечно-диастолический объем ЛЖ в 1,2 раза больше, чем в последующие часы жизни. Изменения конечно-диастолического объема ЛЖ зависят от изменений кровотока в артериальном протоке. Установлена достоверная высокая корреляция между этими величинами. Максимальное наполнение кровью ЛЖ управляется через ограничение сократимости миокарда во время функционирования артериального протока.
Функциональное закрытие артериального протока происходит под воздействием повышающегося уровня р02 в крови и у большинства детей наступает в течение 24—72 ч после рождения. У 5% здоровых доношенных новорожденных артериальный проток в норме закрывается в течение первых 7 ч после рождения, у 50% — в течение 21 ч и у 95% младенцев — в течение 65 ч. Проток суживается одновременно в нескольких местах вследствие активного сокращения его гладкой мускулатуры, которое происходит из-за снижения синтеза простагландина Е2 в эндотелиальных клетках артериального протока, уменьшения чувствительности к нему рецепторов гладких мышц протока, увеличения концентрации кортизола и трииодтиронина в крови. Вместе с этим в ответ на гипероксию гладкомышечные клетки протока увеличивают синтез простагландина F1, который также способствует его сужению.
Эндотелий и гладкомышечные клетки легочной артерии, по сравнению с артериальным протоком и аортой, имеют более высокий уровень базального синтеза простагландинов. Гипоксемия и гипоксия уменьшают синтез простагландина Е2 и F1 в гладких мышцах легочной артерии.
Физиологические эффекты парциального напряжения кислорода и воздействия простагландинов зависят от гестационного возраста и могут осуществляться только на поздних сроках гестации и в ранние периоды внеутробнои жизни.
Кроме того, имеются и другие факторы, принимающие участие в закрытии артериального протока, такие как брадикинины, а также местные неврологические эффекты.
Стойкое фетальное кровообращение у новорожденного
Рубрика МКБ-10: P29.3
Содержание
Определение и общие сведения [ править ]
Стойкое фетальное кровообращение у новорожденного (СФКН)
Синоним: Персистирующее фетальное кровообращение.
Стойкое фетальное кровообращение у новорожденного встречается с частотой 1-3 на 1000 родившихся. Развивается преимущественно у доношенных и переношенных новорожденных. Эта патология обычно осложняет течение таких заболеваний, как САМ (Синдром аспирации мекония), диафрагмальная грыжа, внутриутробная пневмония, сепсис.
Принято различать первичную и вторичную формы СФКН.
• Первичное (идиопатическое) СФКН возникает у новорожденных, не имеющих клинических и рентгенологических признаков легочной патологии. Стойкая гипоксемия развивается вскоре после рождения, но при этом уровень pCO2 остается нормальным или немного сниженным. Возможно, что причины этой патологии связаны с первичным нарушением функции механизмов легочной вазодилатации.
• Вторичное СФКН развивается у новорожденных с тяжелыми, преимущественно паренхиматозными заболеваниями легких.
Чаще всего вторичное СФКН сочетается с САМ (Синдром аспирации мекония), пневмонией, тяжелыми формами РДС (респираторного дистресс синдрома), диафрагмальной грыжей и другими формами легочной гипоплазии. Возможно, что в этих случаях легочная вазоконстрикция в значительной степени связана с гипоксией и ацидозом.
Этиология и патогенез [ править ]
Существует ряд факторов, способствующих развитию СФКН.
• Внутриутробная гипоксия, приводящая к патологической мускуляризации интраацинарных артерий, в норме не имеющих мышечного слоя. Это создает предпосылки для их последующего сужения и повышения легочного сосудистого сопротивления.
• Острая перинатальная асфиксия, приводящая к высвобождению гуморальных факторов, способствующих вазоконстрикции легочных сосудов и препятствующих вазодилатации.
• Внутриутробное закрытие артериального протока с направлением крови в легочное сосудистое русло. Это может происходить у матерей, употреблявших во время беременности нестероидные противовоспалительные препараты.
• Недоразвитие легочных сосудов у детей с врожденной диафрагмальной грыжей и другими формами легочной гипоплазии.
• Изменения уровня вазоактивных медиаторов при пневмонии или сепсисе, в частности угнетение выработки оксида азота и высвобождение тромбоксанов и лейкотриенов.
При СФКН после рождения легочное сосудистое сопротивление не снижается, а остается близким к системному или выше. Это приводит к продолжающемуся шунтированию крови справа налево через артериальный проток и овальное окно в обход легких. Из-за высокого объема венозной примеси резко падает SpO2. Развиваются рефрактерная гипоксемия, гипоксия и метаболический ацидоз.
В связи с тем что легочное и системное сосудистые сопротивления остаются высокими, возрастает нагрузка на сердце, особенно на правый желудочек. Возникает дилатация правого желудочка и недостаточность трехстворчатого клапана.
Клинические проявления [ править ]
Стойкое фетальное кровообращение у новорожденного: Диагностика [ править ]
Стойкое фетальное кровообращение у новорожденного встречается преимущественно у доношенных и переношенных детей, так как интенсивное развитие гладких мышц артерий происходит в III триместре беременности.
Резко выраженный цианоз, не исчезающий даже при вентиляции гипероксическими смесями. Можно отметить различную степень цианоза верхней и нижней половин тела. Тахипноэ обычно не сопровождается выраженными втяжениями уступчивых мест грудной клетки.
При аускультации сердца можно выслушать акцентированный II тон. Наличие разлитого сердечного толчка или эпигастральной пульсации свидетельствует о гипертрофии и дилатации правого желудочка. При присоединении функциональной недостаточности трехстворчатого клапана можно выслушать систолический шум. Позднее появляются симптомы правожелудочковой недостаточности.
Применяют ряд функциональных исследований.
а) Гипероксический тест. Ребенку дают дышать чистым кислородом в течение 10 мин через маску или эндотрахеальную трубку. Тест сравнивает оксигенацию в крови до впадения и после впадения артериального протока, определяя SpO2 или paO2 на правой руке и левой ноге (артериальный проток впадает в аорту дистальнее места отхождения правой подключичной артерии). Тест считают положительным, если SpO2 справа больше на 20%, чем слева, а paO2 справа больше на 15-20 мм рт.ст., чем слева.
Тест считают положительным при исчезновении цианоза, повышении SpO2 и увеличении paO2 >100 мм рт.ст. Гипероксия и гипервентиляция вызывают расширение легочных артерий и тем самым снижают легочное АД. Тест помогает исключить ВПС «синего» типа.
Дифференциальный диагноз [ править ]
Дифференциальную диагностику проводят с ВПС (врождённые пороки сердца), тяжелой пневмонией, сепсисом.
Стойкое фетальное кровообращение у новорожденного: Лечение [ править ]
Необходима оксигенотерапия. Вазодилатирующий эффект кислорода в наибольшей степени проявляется при paO2, близком к 120 мм рт.ст. Достижение такого уровня не всегда возможно и оправданно, так как требует применение потенциально опасных режимов ИВЛ. Тем не менее целью оксигенации должны быть значения paO2 между 100-120 мм рт.ст.
Проведение ИВЛ в режиме гипервентиляции не показано, так как риск осложнений, возникающих при гипокарбии, превышает возможные положительные эффекты.
Конвенционная ИВЛ в первые 24-48 ч проводится в управляемом режиме (IMV), с обязательной седацией и миорелаксацией.
Обязательным в процессе ИВЛ является мониторинг не только газового состава крови, но и объемных показателей вентиляции и механики дыхания.
Важно поддерживать гематокрит на уровне 40%, а гемоглобин выше 120 г/л. Для коррекции анемии переливают эритроцитную массу или отмытые эритроциты. У детей с полицитемией, напротив, проводят гемодилюцию в объеме 10-15 мл/кг с целью улучшения реологических свойств крови.
Показанием к назначению оксида азота считают потребность в FiO2 >0,6 при проведении ВЧОВ (высокочастотная осцилляторная вентиляция) при наличии ЭхоКГ-признаков легочной гипертензии. Стартовая концентрация оксида азота составляет 20 частей на миллион, при необходимости может быть увеличена до 40. При улучшении оксигенации и снижении давления в легочной артерии концентрацию оксида азота постепенно (за 3-4 дня) снижают до 5 частей на миллион, а затем отменяют.
При лечении СФКН особое значение имеет поддержание лечебно-охранительного режима. Для предупреждения легочной вазоконстрикции необходимо избегать гипоксии, гипотермии, ацидоза, анемии, системной гипотензии. При стабилизации состояния отмена интенсивной терапии должна быть очень осторожной и постепенной.
У выживших детей нередко диагностируют нейросенсорные расстройства слуха, причем имеется прямая связь с длительностью гипервентиляции в процессе лечения. Часть детей отстают в развитии. Более чем у четверти детей обнаруживается нарушение реактивности бронхов.
Профилактика [ править ]
Прочее [ править ]
Персистирующая легочная гипертензия новорожденных
Определение и общие сведения
Персистирующая легочная гипертензия может быть представлена тремя следующими типами:
Идиопатическая легочная артериальная гипертензия составляет 10-20% всех новорожденных с ПЛГН.
Этиология и патогенез
Структурные заболевания легких и сердца:
Перинатальные клинические предикторы:
Постнатальные факторы риска:
Дородовое воздействие лекарственных средств, токсинов:
Материнские факторы риска:
Новорожденные с персистирующей легочной гипертензией при рождении имеют низкую оценку по шкале Апгар, диффузный цианоз и тахипноэ. В анамнезе у новорожденных с синдромом ПЛГН часто отмечается перинатальный дистресс, амниотическая жидкость окрашена меконием. Характерна неустойчивая оксигенация.
Для стойкой легочной гипертензии новорожденных характерно сохранение сброса крови справа налево через артериальный проток и/или овальное окно Это приводит к цианозу, который обычно не поддается лечению кислородом. Дыхательная недостаточность и цианоз позволяют поставить диагноз вскоре после рождения. Наблюдается втяжение податливых участков грудной стенки на вдохе, часто слышен шумный выдох. Дифференцированный цианоз (то есть цианоз, более выраженный на ногах, чем на руках) патогномоничен для ПЛГН; он возникает из-за сброса венозной крови через артериальный проток в нисходящую аорту. Однако этот признак не всегда определяется. Сброс крови справа налево через артериальный проток приводит к тому, что раО2 в правой лучевой артерии оказывается больше, чем в ветвях нисходящей аорты; если эта разница превышает 10-15 мм рт.ст., следует думать о стойкой легочной гипертензии новорожденных. При аускультации сердца часто слышен грубый систолический шум трикуспидальной недостаточности с акцентом II тона над легочной артерией. Громкий II тон, иногда даже ощутимый при пальпации, возникает из-за большой силы, с которой захлопывается клапан легочной артерии под действием легочной гипертензии. Этот признак исчезает, когда развивается правожелудочковая дисфункция.
Вследствие большой нагрузки на правый желудочек повреждается его эндокард с развитием эндокардиальной ишемии и инфаркта.
Газовый состав крови
При персистирующей легочной гипертензии новорожденных определяется высокий гематокрит, который обусловлен повышенной вязкостью крови и полицитемией.
Общий анализ крови позволяет дифференцировать персистирующую легочную гипертензию новорожденных от состояний, связанных с воспалением (сепсиса, пневмонии). Количество тромбоцитов обычно снижено, особенно у новорожденных с мекониальной аспирацией или асфиксией.
У новорожденных с персистирующей легочной гипертензией необходимо постоянно мониторировать содержание электролитов и глюкозы в крови. Поддержание глюкозы и ионизированного уровня кальция в пределах нормальных диапазонов очень важно, так как гипогликемия и гипокальциемия имеют тенденцию ухудшать течение персистирующей легочной гипертензии.
На ЭКГ у новорожденных с ПЛГ регистрируются перегрузка правого желудочка, изменения процесса реполяризации в виде смещения сегмента ST вниз от изолинии в правых грудных отведениях, часто определяется неполная блокада правой ветви пучка Гиса.
Рентгенография грудной клетки
Рентгенография грудной клетки позволяет определить паренхиматозную болезнь легких типа мекониальной аспирации, пневмонии или дефицита сурфактанта. Она также помогает исключить врожденные пороки сердца и врожденную диафрагмальную грыжу.
При ПЛГН легочные поля выглядят чистыми, с обедненным сосудистым рисунком. Размеры сердца обычно нормальные или несколько увеличены.
Эхокардиографическое исследование необходимо для исключения цианотических пороков сердца. Выявление анатомии легочных вен может быть очень трудным, если присутствует внелегочный право-левый шунт. В этих случаях может потребоваться катетеризация сердца.
Эхокардиография позволяет выявить при персистирующей легочной гипертензии право-левый шунт крови через артериальный проток или открытое овальное окно. Допплерографически определяют пиковую скорость регургитантного трикуспидального потока. На основании данного показателя рассчитывают систолическое давление в правом желудочке и легочное сосудистое сопротивление.
Эхокардиография особенно необходима перед началом терапии ингаляцией оксидом азота (iNO). Полученные данные позволяют исключить левосторонние обструктивные пороки, такие как перерыв дуги аорты, гипоплазия левого желудочка и критический аортальный стеноз. Данные пороки требуют, чтобы сохранялся шунт справа налево через артериальный проток, который поддерживает системную перфузию. Данные пороки (дуктусзависимые) являются противопоказаниями к iNO-лечению.
С помощью эхокардиографии важно определить направление шунта через фетальные коммуникации при ПЛГН. Обычно имеет место право-левый шунт. Если определяется шунт слева направо, это свидетельствует о левожелудочковой дисфункции.
Непрерывная оксиметрия пульса чрезвычайно важна в определении тактики лечения новорожденных с ПЛГН. Этот метод позволяет оценить адекватность доставки кислорода на уровне тканей. Зонд оксигемометра устанавливают предуктально (правая рука) и постдуктально (любая нога), чтобы определить величину право-левого сброса на уровне артериального протока.
Катетеризацию сердца проводят в редких случаях, если эхокардиография не позволяет полностью исключить врожденный порок сердца, например, аномальный дренаж легочных вен.
Катетеризация центральной вены
Всем новорожденным с тяжелой ПЛГН показана катетеризация вены (вены пупочного канатика или бедренной вены) для введения гипертонических растворов (например, глюконата кальция) и инотропных средств. Венозный катетер устанавливают не более чем на 5 дней, поскольку в дальнейшем возникает высокий риск развития инфекционных осложнений. Не рекомендуют катетеризировать яремную вену, поскольку она может потребоваться для проведения экстракорпорального кровообращения.
Искусственная вентиляция легких
Искусственная вентиляция легких почти всегда необходима у новорожденных с постоянной легочной артериальной гипертензией новорожденного. Цель искусственной вентиляции легких состоит в том, чтобы поддерживать нормальный функциональный остаточный объем, ликвидировать ателектазы и избежать перерастяжения легких. Параметры вентиляции настраивают таким образом, чтобы поддерживать нормальное расширение легких (то есть приблизительно 9 ребер) на рентгенограмме легких. Контроль за дыхательным объемом и легочной механикой необходим для предотвращения сверхрасширения, которое может увеличиться ЛСС и усугубить шунтирование справа налево.
Точную стратегию искусственной вентиляции легких определяют по основному заболеванию легких. Например, у новорожденных с пневмонией или респираторным дистресс-синдромом используют вентиляцию с более высоким давлением в дыхательных путях, а при идиопатической ПЛГН применяют вентиляцию с более низким давлением. У новорожденных с патологией легких ожидается лучший ответ на назначение сурфактанта и/или на высокочастотную вентиляцию легких.
Мало известно, какие концентрации кислорода максимизируют выгоду и минимизируют риски ИВЛ. Уровень 50 мм рт.ст. или более, как правило, обеспечивает соответствующую доставку кислорода. Стремление к более высоким концентрациям рaO2 может привести к увеличению вентиляционной поддержки и баротравме. Чрезмерная гипероксия при ПЛГН также оказывает токсический эффект в развивающемся легком.
Вследствие способности бороться против ИВЛ у новорожденных с постоянной легочной артериальной гипертензией почти всегда требуется седативный эффект. Обычно используют фентанил (часто в комбинации с бензодиазепином), потому что эти препараты уменьшают симпатическую реакцию на боль и другие вредные стимулы.
Желательно ИВЛ проводить с седативными препаратами, без миорелаксантов, выключающих спонтанное дыхание. Использование миорелаксантов ассоциируется с повышенной летальностью.
Коррекция ацидоза и алкалоза
Для лечения метаболического ацидоза обычно используют бикарбонат натрия. Однако, если клиренс углекислого газа нарушен, применение бикарбоната может произвести к дыхательному ацидозу. В этих случаях применяют трометамол в дозе 1-2 ммоль/кг массы тела. Трометамин противопоказан новорожденным с анурией и/или уремией.
Принудительный алкалоз при использовании бикарбоната натрия и гипервентиляция ранее были популярными методами лечения из-за их способности вызывать легочную вазодилатацию и увеличение PaO2. Однако гипокарбия приводит к спазму мозговых сосудов и уменьшению мозгового кровотока. Выраженный алкалоз и гипокарбия приводят к неврологическим нарушениям, включая сенсоневральную глухоту.
Инфузии бикарбоната натрия следует проводить в таком объеме, чтобы pH был в пределах 7,45-7,5, при этом необходимо контролировать уровень натрия в сыворотке крови и параметры вентиляции для поддержания адекватного клиренса углекислого газа.
Хотя назначение сурфактанта может быть полезно при персистирующей легочной гипертензии новорожденных, его применение еще не одобрено для других использований, кроме лечения респираторного дистресс-синдрома и синдрома аспирации мекония.
Важным условием для применения сурфактанта является то, что новорожденный должен быть интубирован и ему следует проводить аппаратную ИВЛ.
Назначение сурфактанта уменьшает потребность в экстракорпоральной поддержке и наиболее эффективно на ранних стадиях течения болезни.
Берактант вводят интратрахеально в дозе 100 мг (4 мл)/кг массы тела в 4 приема через каждые 6 ч.
Инотропная поддержка допамином, добутамином и/или милриноном часто необходима для поддержания соответствующего функционального состояния сердца и системного артериального давления. Эти препараты особенно показаны при миокардиальной недостаточности.
Допамин стимулирует α2-, α1-, и β2-рецепторы и специфические допаминергические рецепторы. В исследованиях препарат увеличивает системное и легочное сосудистое сопротивление у новорожденных [Cheung P.Y. et al., 2001; Barrington K.J. et al., 1995]. Увеличение постнагрузки может привести к уменьшению системной перфузии и системной доставки кислорода, тогда как парциальное давление кислорода увеличивается. У недоношенных новорожденных допамин уменьшает слева направо шунтирование через артериальный проток из-за увеличения ЛСС. Допамин новорожденным назначают в виде постоянной внутривенной инфузии в дозе 2-20 мкг/(кг×мин).
Добутамин стимулирует α- и β-рецепторы. В больших дозах это может вызвать значительное увеличение давления легочной артерии. Добутамин в педиатрической практике назначают в виде постоянной внутривенной инфузии в дозе 2-25 мкг/(кг×мин).
Использование ингаляций оксида азота
Ингаляции NO противопоказаны у новорожденных с ВПС, проявляющимися левожелудочковой обструкцией (перерывом дуги аорты, критическим аортальным стенозом, синдромом гипоплазии левого желудочка), и с тяжелой левожелудочковой дисфункцией.
Адекватная стартовая доза обычно составляет 20 ppm. Более высокие дозы не были эффективными и ассоциировались с отрицательными воздействиями, включая метгемоглобинемию и увеличение уровня диоксида азота (NO2).
Использование других вазодилататоров
Экстракорпоральная мембранная оксигенация (ECMO)
Экстракорпоральную мембранную оксигенацию используют для оптимальной поддержки оксигенации и перфузии у новорожденных с ПЛГН.
В последние годы экстракорпоральную мембранную оксигенацию проводят двухпросветным катетером, введенным через внутреннюю яремную вену, что позволяет избежать необходимости перевязки правой общей сонной артерии.
Основные критерии, когда можно проводить экстракорпоральную мембранную оксигенацию у новорожденных, следующие:
Применение экстракорпоральной мембранной оксигенации (ECMO) и других новых методов лечения существенно повлияло на снижение смертности, связанной с ПЛГН [Farrow K.N. et al., 2005; Bahrami K.R. et al., 2005].
В рандомизированном исследовании эффективности ECMO у новорожденных с тяжелой ПЛГН показано, что уровень смертности новорожденных, которые получили терапию ECMO, составил 32%, в то время как смертность новорожденных, которые получали обычную терапию, составила почти 60% [UK Collaborative ECMO Trail Group, 1996].
В России метод ECMO стали применять в единичных кардиохирургических центрах. Пока нет данных о применении ECMO при персистирующей легочной гипертензии у новорожденных.
Новорожденные с персистирующей легочной гипертензией должны получать парентеральное питание.
В целом выживание новорожденных с персистирующей легочной гипертензией при выполнении всех адекватных терапевтических мероприятий, включая экстракорпоральную мембранную оксигенацию, достигает 75%.
Обычно выжившие новорожденные не имеют остаточных изменений в легких, легочное артериальное давление нормализуется.
Большинство выживших новорожденных с персистирующей легочной гипертензией в последующем имеют нормальное неврологическое развитие.
Длительная искусственная вентиляция легких ассоциируется с высокой частотой неврологических нарушений, включая нейросенсорную тугоухость.