стивен хокинг что за болезнь у него
Наперегонки со смертью Как Стивену Хокингу удалось дожить до старости
Боковой амиотрофический склероз (БАС), или мотонейронная болезнь, также известная в США как болезнь Лу Герига, — редкое заболевание центральной нервной системы, приводящее к параличам конечностей и атрофии мышц. Оно стало широко известно в 1939 году, когда установивший несколько рекордов американский бейсболист Генри Луи Гериг ушел из спорта в возрасте 36 лет. Оказалось, что он страдал от быстро прогрессировавших неизлечимых нарушений двигательных функций. Спортсмен скончался через два года после постановки диагноза.
Большинство пациентов живут не дольше пяти лет после того, как болезнь обнаружена. Физику-теоретику Стивену Хокингу был двадцать один год, когда ему диагностировали БАС, однако он дожил до 75-летнего возраста, хотя и был на грани смерти в 1985 году из-за воспаления легких.
Каждая мышца управляется мотонейронами, расположенными в двигательной коре в задней части лобной доли мозга или в мозговом стволе. Они передают сигналы мотонейронам, которые находятся в спинном мозге. Первые называют верхними мотонейронами, а вторые — нижними. В ряде стран выделяют различные формы мотонейронных заболеваний, затрагивающий одну или обе группы нервных клеток. Например, первичный боковой склероз (ПБС) поражает верхние моторные нейроны, прогрессирующая мышечная атрофия (ПМА) — нижние, а при БАС нарушаются функции всех мотонейронов. Тем не менее, по словам специалистов, вскрытие умерших пациентов показывало, что при ПБС и ПМА наблюдаются также патологические изменения в нижних и верхних нейронах соответственно.
Лео Маккласки (Leo McCluskey), профессор неврологии Пенсильванского университета, в своем интервью изданию Scientific American назвал заблуждением представление о том, что БАС затрагивает только моторные нейроны. Примерно у 10 процентов пациентов с мотонейронными заболеваниями наблюдались нарушения функций в других частях мозга, например, в лобных и височных долях, где не содержатся мотонейроны. Хотя считается, что болезнь Лу Герига не влияет на умственные способности, у некоторых больных все же отмечалось развитие лобно-височной деменции.
Фото: Public Domain / Wikimedia
Продолжительность жизни пациентов с БАС часто зависит от того, как долго работают нейроны, отвечающие за движение диафрагмы и, соответственно, вентиляцию легких. Когда они отказывают, возникает дыхательная недостаточность, которая является основной причиной смерти. Если нарушается функция глотательных мышц, больные умирают от голода и обезвоживания. Если ничего из этого не происходит, человек может жить многие годы, хотя качество его жизни сильно ухудшается. Так, Стивен Хокинг передвигается только с помощью компьютеризированного инвалидного кресла, снабженного синтезатором речи и инфракрасным датчиком движения. Эти устройства позволяют ему писать статьи и общаться с другими людьми.
Одной из причин того, что болезнь Хокинга не затронула работу диафрагмы и глотательных мышц, может быть ранняя форма БАС. По словам Маккласки, в его практике встречались пациенты, у которых заболевание было диагностировано в подростковом возрасте, и они дожили до 60 лет. Однако точные причины долгожительства нескольких процентов пациентов пока не ясны.
БАС до сих пор неизлечим, хотя выяснение его причин и механизмов являются целью активных исследований. Было выяснено, что, как и в случае многих других нейродегенеративных заболеваний, в клетках головного мозга накапливаются аномальные белки в нейронах центральной нервной системы. 5-10 процентов всех случаев бокового амиотрофического склероза вызваны наследственными факторами, однако заболеванию может способствовать не один, а множество генов. Для того чтобы вылечить БАС или хотя бы замедлить его прогрессирование, необходимо найти соединения, которые регулируют активность этих генов.
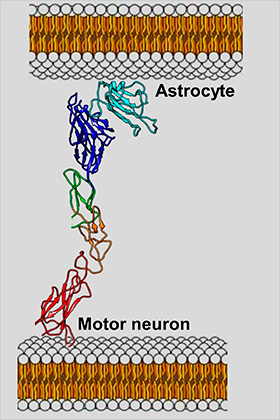
Американские ученые из Калифорнийского университета в Риверсайде выяснили, какие молекулы подавляют активность рецепторного белка EphA4, который связывают с быстрым развитием БАС. В своих исследованиях биологи использовали мышиную модель бокового амиотрофического склероза — мыши, которые страдали от заболевания, аналогичного болезни Лу Герига у человека. Статья исследователей опубликована в журнале Cell Biology.
EphA4 опосредует взаимодействие между моторными нейронами и астроцитами, которое, по мнению авторов работы, является одной из причин быстрой гибели первых.. Фото: Pellecchia lab / UC Riverside
Синтез белка EphA4 связан не только с прогрессирующим нарушением функций мотонейронов, но и с заболеваниями крови, при которых нарушается свертываемость, болезнью Альцгеймера, а также язвами желудка и поджелудочной железы. Однако нельзя точно сказать, каким образом можно подавить активность белка и как это повлияет на состояние пациента, поскольку исследователи не знали, какие соединения могут быть ингибиторами EphA4. Однако было точно известно, что мутации в гене, кодирующем белок, увеличивают продолжительность жизни больных животных.
Чтобы выявить подходящее соединение, ученые проанализировали молекулярное строение более ста тысяч химических веществ, применяя спектроскопию ядерного магнитного резонанса. Они искали молекулу, которая могла бы связаться с EphA4, используя подходы по оценке белок-белковых взаимодействий. Исследователи обнаружили, что таким соединением является 123C4.
Это вещество не подавляет рецептор EphA4, однако вызывает его интернализацию. Иными словами, белок после связывания с 123C4 уходит с поверхности клетки внутрь через процесс, называемый эндоцитозом. По словам ученых, 123C4 эффективно удаляет EphA4 с поверхности моторных нейронов.
Чтобы подтвердить способность препаратов на основе 123C4 продлевать жизнь, необходимо провести клинические исследования. Пока больным ряда стран (в США и Европе) доступен рилузол — единственное одобренное средство, которое продлевает жизнь пациентов на несколько месяцев.
Вопреки болезни: кем был Стивен Хокинг?
Биография Стивена Хокинга – пример торжества человеческой личности над любыми преградами. Даже если преградой становится собственное тело.
Ограничения и безграничность
Стивен появился на свет в самом известном университетском городе – Оксфорде. Его родители работали в медицинском центре Хампстеда. В Оксфорд семья переехала, спасаясь от бомбёжек. Ребёнок родился 8 января 1942 года, под грохот вершившейся истории. Для Изабел и Фрэнка Хокинга он стал первенцем. Через несколько лет Изабел родила дочерей Мэри и Филиппу. Также Хокинги усыновили мальчика Эдварда.
Стивен Хокинг в детстве
Оксфорд оказался идеальным местом для Хокинга. Стивен с детства интересовался наукой. В 1962 году он завершил курс учёбы в Оксфорде со степенью бакалавра. Затем он взялся за диссертацию о расширяющихся вселенных. Защита состоялась в 1966 году, уже в другом городе-университете – Кембридже.
Знания открывали перед Хокингом Вселенную. Но более близкая реальность, напротив, ограничивала возможности. Тело переставало слушаться. Чем болел Стивен Хокинг? В 1963 году у учёного обнаружили боковой амиотрофический склероз. Это дегенеративное заболевание центральной нервной системы: при БАС происходит поражение моторной коры головного мозга и нижних двигательных нейронов. Болезнь неуклонно прогрессирует, приводя к параличу и атрофии мышц. На поздних стадиях страдает даже дыхательная мускулатура.
Боковой амиотрофический склероз
Точная причина БАС до сих пор неизвестна. Лечение тоже пока не найдено. Разработана поддерживающая терапия, позволяющая облегчить симптомы. С конца ХХ века стали появляться медикаменты, замедляющие прогрессирование БАС.
Как говорила Мария Кюри, «в жизни нет ничего, чего нужно бояться, есть лишь то, что нужно понять». И история медицины подтверждает, что к слову «неизлечимый» всегда можно добавлять «пока». Цитата из материала «Терри Пратчетт и болезнь Альцгеймера»
К концу 60-х годов Стивен Хокинг уже не мог передвигаться без инвалидной коляски. При этом он продолжал работать. Преподавал студентам. В 1973 и 1981 году приезжал в Москву: обсуждал проблемы чёрных дыр с Яковом Борисовичем Зельдовичем, участвовал в международном семинаре 1981 года по квантовой теории гравитации. В 1974 году был принят в Лондонское королевское общество по развитию знаний о природе. В 1979 году получил звание Лукасовского профессора. Это одно из самых престижных академических званий в мире. Кембриджский университет учредил его в XVII веке.
Работы Хокинга внесли весомый вклад в современную науку. Стивен Хокинг стал одним из основателей нового направления – квантовой космологии. Он первым применил к описанию чёрных дыр законы термодинамики. Уже в 1971 году учёный ввёл понятие «микроскопические чёрные дыры». В 1974 – 1975 годах выдвинул гипотезу излучения элементарных частиц в процессе испарения чёрной дыры. Явление получило название «излучение Хокинга». В 2019 году учёные из Израиля смогли воссоздать это явление в лабораторных условиях.
Болезнь не помешала и семейной жизни. В 1965 году Стивен Хокинг вступил в брак с Джейн Уайльд. Вместе они воспитали троих детей.
Семья Стивена Хокинга
В 1995 году супруги развелись, второй женой учёного стала Элайн Мэйсон.
В 1985 году Стивен Хокинг перенёс тяжёлую пневмонию. Из-за нарушений дыхания он утратил способность самостоятельно говорить. На помощь вновь пришла наука: друзья встроили в инвалидное кресло учёного компьютер с синтезатором речи. Хокинг управлял им сперва при помощи указательного пальца, затем при участии мышцы щеки.
«Если вы не сдаётесь».
Стивен Хокинг был гуманистом. Сам он при всей тяжести основного заболевания отчасти был защищён известностью, заботой друзей-учёных. Но всегда помнил, что доступная медицинская помощь необходима каждому человеку. Он выступал в поддержку общедоступного здравоохранения, инициировал судебный иск против коммерциализации национальных медицинских служб.
«Если вы не сдаётесь, это имеет значение»
Но особенно волновало Хокинга просвещение. Он понимал, что разум, знание, представление – основа личности. Можно потерять многое, но нельзя ограничивать человеческий ум. Взгляды Стивена Хокинга основывались на осознании непрочности жизни и величия человеческого духа. Учёный был атеистом, он считал, что имеют значение лишь действия человека перед лицом небытия. Одно из известных его высказываний: «Если вы не сдаётесь, это имеет значение». Хокинг призывал человечество развивать космическую отрасль, потому что жизнь на Земле в любой момент может подвергнуться глобальной угрозе. И сам в 2007 году совершил на самолёте компании Zero Gravity полёт в невесомости. Через два года учёный планировал совершить космический полёт, но этот план не удалось воплотить в жизнь.
Знаменитый учёный отстаивал преподавание теории эволюции в школах. Занимался популяризацией науки. Известны книги Стивена Хокинга «Теория всего. От сингулярности до бесконечности: происхождение и судьба Вселенной», «На плечах гигантов», «Мир в ореховой скорлупке». В соавторстве с дочерью Люси он написал серию книг о мальчике Джордже и его друзьях, постигающих важные научные проблемы. С участием Хокинга снимали документальные телефильмы.
Ключ от гробницы. Как мы учимся лечить болезнь Стивена Хокинга
«Лечения не существует. Шансы сохранить меня таким, какой я есть, 50 на 50. Возможно, лет через 10 мне понадобится трость», — писал в 1939 году «Железный конь», легенда американского бейсбола, своей жене из клиники Мэйо. Спортсмену было всего 36, а через два года он скончался, потеряв способность не только ходить, но даже подписывать документы без помощи жены. Тогда уже было известно, что дело в прогрессирующей гибели двигательных (моторных) нейронов головного и спинного мозга, но причина ее оставалась неясна. «Дело, наверно, в каком-то микробе, — рассказывал он в том же письме. — Но никто не слышал, чтобы это передавалось между супругами».
Через 35 лет тот же диагноз получил 80-летний диктатор. К тому времени версию о микробах-возбудителях всерьез уже не рассматривали, а нейродегенерацию считали одним из проявлений старения нервной системы. Было понятно, что в ткани мозга появляются какие-то бляшки — как при болезни Альцгеймера или Паркинсона — которые и вызывают прогрессирующий паралич. Именно эти бляшки, тогда еще неясной природы, за десять лет превратили бодрого старика, который и в 72 года переплывал Янцзы, — в безнадежного пациента, который мог дышать, только лежа на боку. От диагноза до смерти, как и в случае с бейсболистом, прошло около двух лет.
Британскому астрофизику повезло больше. Свой приговор он услышал еще до того, как его собрат по несчастью пересек Янцзы в последний раз, но болезнь остановилась в полушаге от летального финиша. Медленно теряя подвижность головы, ученый прожил еще 55 лет, стал иконой научпопа и новым символом своей болезни. За это время стало понятно, что агрегаты в мозге состоят из белков, у этих белков появились имена, а на горизонте замаячили возможные гены-виновники. Полсотни клинических испытаний лекарств стартовали и сошли с дистанции досрочно. Миллионы людей вылили на себя ведра ледяной воды, собирая деньги на исследование болезни. Но никто так и не понял, как ее лечить.
Боковой амиотрофический склероз (БАС), который погубил Лу Герига, Мао Цзэдуна и Стивена Хокинга — лишь одно из множества нейродегенеративных заболеваний, против которых человечество до сих пор бессильно. И хотя далеко не всегда БАС заканчивается деменцией, с болезнями Альцгеймера и Паркинсона его сравнивали не зря. Препятствия, которые отделяют нас от лекарства, во всех этих случаях примерно одни и те же: предсказать болезнь невозможно, диагностировать на ранних стадиях удается не всегда, причины многоообразны, а список их не полон.
МРТ-снимок мозга человека с БАС
Frank Gaillard / Radiopaedia / CC BY-SA 3.0
Вдобавок к этому, повреждения быстро становятся необратимыми, поскольку нейроны, в отличие от множества других клеток, не так просто заменить на новые.
Как и в случае с болезнями Альцгеймера и Паркинсона, единственные лекарства, которые существуют от бокового амиотрофического склероза, помогают лишь компенсировать симптомы. В случае БАС, они блокируют либо избыточное выделение глутамата, ненадолго отдаляя гибель нейронов, либо подавляют окислительный стресс — но как это работает, не знают даже в FDA (американском Минздраве), где одобрили соответствующий препарат. Остановить нейродегенерацию не удалось пока никому.
Изобрести оружие
Передача информации в клетке строится по принципу липучки. Двунитевая липучка-ДНК разделяется на две половины, а копирующие ферменты достраивают к одной из половин парную (комплементарную) липучку-РНК. Получается РНК-копия гена, которая отправляется из ядра в цитоплазму для синтеза белка. К информационной РНК-липучке по очереди подплывают транспортные РНК, несущие аминокислоты. Прилипание в правильной последовательности позволяет построить из аминокислот белковую цепь.
«Заблокировать» ген или остановить его экспрессию можно множеством разных способов, но проще всего — комплементарно заклеить, чтобы никто другой к нему уже не прилип. Так умеют делать даже бактерии, и этот способ регулировать экспрессию у них обнаружили еще в 1967 году, спустя всего несколько лет после открытия информационной РНК. Тогда оказалось, что в клетках кишечной палочки производится некодирующая РНК, которая прилипает к определенным участкам информационной РНК и мешает им передавать информацию дальше.
Принцип работы антисмысловой терапии
Robinson R / PLOS Biology, 2004
Через 10 лет так научились поступать и люди, уже в своих целях. Гарвардские ученые создали короткую цепочку (олигонуклеотид) ДНК, которая была комплементарна участку вируса саркомы Рауса. Прилипая к вирусной РНК, олигонуклеотид мешал вирусу размножаться, а клеткам, зараженным вирусом, — превращаться в опухолевые. Так появилась технология антисмысловых олигонуклеотидов — коротких цепочек, которые комплементарны «осмысленным» частям гена и благодаря этому могут и останавливать его работу.
С тех пор наше представление о «липучках» и «антилипучках» сильно усложнилось. Среди некодирующих РНК выделили множество разных типов — они отличаются по длине, происхождению и функциям. Оказалось, что действовать они могут на самых разных уровнях: блокировать создание РНК, ее созревание и последующий синтез белка, или просто заставлять клеточные ферменты разрезать ее на куски. И все это можно было использовать для антисенс-терапии — научиться строить комплементарные ДНК— или РНК-нити к нужному гену, чтобы управлять его работой.
Найти мишень
Первое лекарство, в состав которого вошли антисмысловые олигонуклеотиды, появилось в 1998 году. Оно эксплуатировало ту самую идею, с которой началась история антисенс-терапии — заблокировать размножение вируса. Лекарство охотилось на цитомегаловирус, который здоровым людям обычно не страшен, а вот по организму больных СПИДом распространяется бесконтрольно.
Однако довольно быстро оказалось, что проще предотвратить сам СПИД, чем бороться с его последствиями — и в 2006 году цитамегаловирусное лекарство исчезло с рынка, уступив место антиретровирусным препаратам. Испытания олигонуклеотидов против других вирусов начались, но успехом до сих пор не увенчались. И наступило затишье.
К тому моменту, когда появилось антисенс-лекарство против цитомегаловируса, геном человека еще даже не был прочтен целиком. А до первого полногеномного поиска ассоциаций (GWAS-исследования), с помощью которого сегодня ищут генетические причины чего угодно (от болезней до их предположительной связи с поведением), оставалось еще четыре года.
С боковым амиотрофическим склерозом в этом смысле нам повезло чуть больше, чем с другими болезнями — о нем мы что-то знали еще до первых полногеномных поисков. Несмотря на то, что далеко не всегда он передается по наследству (а значит, не все его случаи можно соотнести с конкретной мутацией), примерно каждый пятый случай связан с мутацией в гене SOD1. Он кодирует белок супероксиддисмутазу, один из главных клеточных антиоксидантов. Однако участие SOD1 в развитии БАС никак не связано с его основными функциями: судя по всему, белок-мутант ведет себя как прион — в двигательных нейронах спинного мозга он образует белковые агрегаты, которые растут, подобно снежному кому. Они нарушают внутриклеточный транспорт в двигательных нейронах, постепенно приводя к их гибели.
Структура белка SOD1
Emw / wikimedia commons / CC BY-SA 3.0
Обвинение в адрес SOD1 ученые выдвинули еще в 1993 году. Дело за малым: осталось только прочесть ген, собрать антисмысловую нить и заблокировать его работу. Но в процессе возникли новые трудности. Например, выяснилось, что мутаций в SOD1 существует не менее двух сотен, и не все они в равной степени связаны с развитием БАС. Кроме того, антисмысловые РНК оказались довольно нестабильными: в клетке их быстро расщепляют РНКазы, а в крови иммунные клетки принимают их за вирусы — и все заканчивается воспалением и разрушением лекарства.
Чтобы подобрать нужную антисмысловую цепочку, сделать ее устойчивой и отработать на мышах, понадобилось еще двадцать лет. За это время в области антисенс-терапии появились обнадеживающие примеры — препараты против спинальной мышечной атрофии и некоторых форм миодистрофии Дюшенна. Теперь выходить на клинические испытания с антисмысловой РНК гораздо проще — мы знаем наверняка, что такое лечение может сработать.
Предупредительный выстрел
Две исследовательские группы, которые опубликовали свои результаты в NEJM, сделали одно и то же, но разными способами. Первая группа, из Массачусетса, пошла по пути генной терапии, то есть поместила нить РНК внутрь аденовируса, чтобы «заразить» ей мотонейроны. В испытании приняли участие только двое пациентов — первый шаг на пути к более серьезным проверкам — с подтвержденными мутациями в гене SOD1.
Один из них получил экспериментальную терапию спустя несколько месяцев после постановки диагноза. Лечение не вызвало значимого клинического улучшения, и через 15 месяцев он скончался. Однако на вскрытии исследователи обнаружили, что в его спинном мозге количество мутантного SOD1 на 90 процентов ниже, чем в среднем у пациентов с БАС. Это может означать, что терапия работает, хотя и не спасает на той стадии нейродегенерации, на которой испытуемый был на момент начала лечения. Второй пациент после терапии стабилизировался и до сих пор жив, поэтому количество SOD1 в его спинном мозге остается неизвестным.
Другая исследовательская группа представляет крупную фармацевтическую компанию Biogen, которая, среди прочего, производит антисенс-олигонуклеотиды против спинальной мышечной атрофии. Это не первое их исследование антисенс-терапии БАС, результаты отражают 1-2 фазу испытания, а результаты 3 фазы они ожидают через год.
В этом испытании приняли участие 50 пациентов с мутациями в SOD1: четыре группы получали разные дозы препарата, пятая служила контролем. В первую очередь ученых интересовала безопасность: оказалось, что многие побочные эффекты связаны с уколом в спинной мозг и не зависят от того, вводили в него плацебо или олигонуклеотид. Кроме того, они измеряли концентрацию SOD1 в спинномозговой жидкости (она служит косвенным маркером того, насколько активно белок образуется в нейронах) — самые высокие дозы препарата снизили ее в среднем на 32 процента. При этом когда исследователи постфактум разделили пациентов на группы с быстрым и медленным развитием болезни, то оказалось, что для первых лечение могло оказаться эффективнее: внешние признаки дегенерации у них стали возникать медленнее, а в спинномозговой жидкости стало меньше маркеров гибели нейронов.
График эффекта антисмысловой терапии БАС на первых двух фазах клинических испытаний
T. Miller et al. / The New England Journal of Medicine, 2020
Что принесли в ведре воды
Авторы обеих статей стараются избегать громких утверждений и прогнозов — особенно учитывая, что до конца вылечить никого не удалось, и даже цели такой не стояло (как это обычно бывает в первых фазах исследований). Но давайте на минуту представим себе, что третья фаза пройдет успешно и разрушение нейронов у пациентов удастся если не обратить, то хотя бы остановить. Будет ли это означать, что боковой амиотрофический склероз повержен, и на очереди Паркинсон и Альцгеймер?
В 2014 году фейсбук заполнили миллионы роликов с людьми, выливающими на себя ледяную воду. Флешмоб Ice Bucket Challenge за пару месяцев собрал более 200 миллионов долларов на исследования бокового амиотрофического склероза, поддержку пациентов и поиск лекарств. На эти деньги, среди прочего, удалось провести GWAS и пополнить список мишеней тремя новыми мутациями, и теперь он «закрывает» почти все случаи наследственного БАС. Для каждой из мутаций понадобится свой антисмысловой олигонуклеотид, и, возможно, не один.
С точки зрения «одна мутация — одна таблетка» можно сказать, что мы имеем дело не с одной болезнью, а со множеством. Теперь мы не можем даже быть уверенными, что три самых известных жертвы БАС болели одним и тем же. Судя по тому, что у Лу Герига болезнь проявилась рано, у Мао Цзедуна — поздно, а у Стивена Хокинга приостановилась на десятки лет, они могли нести в своих генах разные мутации. Но тогда никому не приходило в голову это проверить, и теперь мы не узнаем, могли бы мы сейчас кого-то из них спасти.
Эта же проблема встанет перед нами и в случае других нейродегенеративных патологий. Ни у болезни Альцгеймера, ни у болезни Паркинсона, ни у множества других менее известных синдромов до сих пор не найден единый ген-виновник. Списки множатся, ставки растут. И несмотря на то, что мы знаем наверняка, что антисмысловая терапия работает, а индивидуальные лекарства возможны, страшно представить, сколько ведер ледяной воды придется на себя вылить, прежде чем мы найдем таблетку для каждого.
Жизнь, личность и болезнь Стивена Хокинга – человека, который искал «теорию всего»
Статья просмотрена: 1874 раза
Библиографическое описание:
В среду, 14 марта 2018 года мир потерял одного из своих самых блестящих научных умов. Легендарный физик Стивен Хокинг умер в возрасте 76 лет. В этой биографии мы поговорим о пути Хокинга и его болезни, которая лишала его мобильности и речи, но не способности мыслить.
Сложная и поразительная жизнь
Британский космолог Стивен Уильям Хокинг родился в Англии 8 января 1942 года – ровно через 300 лет после смерти астронома Галилея Галилео. Он учился в Университетском колледже в Оксфорде, где изучал физику, несмотря на то, что отец старался сосредоточиться на медицине. Хокинг отправился в Кембридж, чтобы исследовать космологию, изучать вселенную в целом.
В начале 1963 года, когда Хокингу едва исполнился 21 год, был поставлен диагноз: болезнь двигательных нейронов, более известная как болезнь Лу Герига или боковой амиотрофический склероз (БАС). Он не должен был прожить более двух лет. Завершение его докторской степени не представляется возможным. Тем не менее, Хокинг бросил вызов, планировал не только получить докторскую степень, но также проложить новые дороги в понимании вселенной в последующие десятилетия.
По мере распространения болезни Хокинг стал менее мобильным, начал пользоваться инвалидной коляской. Разговаривать стало сложнее, в 1985 году экстренная трахеотомия вызвала у него полную потерю речи. Созданное в Кембридже устройство для генерации речи в сочетании с программным обеспечением служило его электронным голосом, позволяя Хокингу выбирать слова, двигая мышцами по щеке.
Незадолго до постановки диагноза Хокинг познакомился с Джейн Уайльд, они поженились в 1965 году. У пары было трое детей до расставания. Хокинг вступил в повторный брак в 1995 году, однако развелся в 2006 году.
Время, проведенное с момента постановки диагноза, было связано не только с выживанием – он создал работу, которая изменила мир. Его блестящие теории, продвигающие идеи Эйнштейна, привели Хокинга в пантеон важных современных физиков. Его удивительная книга-бестселлер полюбилась среди широкой публики, но его идеи о гравитации, черных дырах и теория «Большого взрыва» станут его самым большим наследием.
Диагноз
После падения во время катания на коньках в первый год учёбы в аспирантуре Кембриджского университета, Хокингу сказали, что у него дегенеративное заболевание двигательного нейрона – боковой амиотрофический склероз (БАС). Прогнозы врачей были неутешительны – ему максимум оставалось жить всего 2,5 года. Большинство пациентов с БАС диагностированы в возрасте около 50 лет, живут еще два-пять лет. Однако пациенты, у которых болезнь диагностирована ранее, имеют тенденцию к прогрессирующей форме заболевания. Кроме того, потеря двигательных навыков вынудила космолога стать более креативным и находчивым. «Потеряв подвижность, ловкость рук, я был вынужден путешествовать по вселенной в своем уме, пытаясь визуализировать, как она функционирует», – отметил он позже.
Что такое БАС?
БАС, также известный как болезнь Лу Герига, является прогрессирующим нейродегенеративным заболеванием, которое разрушает двигательные нейроны – клетки головного, спинного мозга, контролирующие мышечную функцию, до тех пор, пока человеку становится невозможно говорить, глотать, дышать, ходить. По данным Ассоциации учёных, симптомы БАС начинаются с невнятной речи, мышечной слабости, их подергиваний.
Кто заболевает БАС?
Врачи не совсем уверены, что вызывает БАС в большинстве случаев, однако, по мнению учёных, у некоторых людей заболевание имеет генетический компонент. Обычно диагностируется у людей в возрасте от 40 до 60 лет, мужчины подвергаются чаще, чем женщины, могут заболеть, по крайней мере, до 65 лет.
Насколько редко долголетие Хокинга?
Долголетие Стивена Хокинга довольно редкое. Согласно данным, только 5% пациентов с БАС живут дольше 20-ти лет, практически нет шансов на жизнь после 50 лет. Хокингу удалось избежать деменции, которую испытывают некоторые люди с БАС на поздних стадиях заболевания. Науке известен ещё одни случай долгожительства с БАС: пациент из Северной Америки, канадец по имени Стивен Уэллс, жил с заболеванием на протяжении 40 лет.
Блестящий ум
Хокинг продолжил работу в Кембридже после окончания учебы в качестве научного сотрудника, а затем профессором. В 1974 году был включен в состав Королевского общества, всемирного научного сообщества. В 1979 году был назначен Лукасовским профессором математики в Кембридже, самой известной академической кафедре в мире (вторым заведующим был сэр Исаак Ньютон, также член Королевского общества).
Используя две теории вместе, Хокинг определил, что черные дыры не являются полностью темными, а вместо этого испускают излучение. Он предсказал, что после Большого взрыва были созданы черные дыры размером с протон, управляемые как общей теорией относительности, так и квантовой механикой.
В 2014 году Хокинг пересмотрел свою теорию, написав, что «черных дыр не существует» – по крайней мере, так, как их традиционно понимают космологи. Его теория устранила существование «горизонта событий», точки, где ничто не может избежать. Вместо этого он предположил, что будет существовать «видимый горизонт», который изменится в соответствии с квантовыми изменениями внутри черной дыры. Но теория остается спорной.
Хокинг является одним из немногих выживших с БАС
На протяжении многих лет о Хокинге заботились его жены, дети, он неоднократно выражал благодарность Государственной службе здравоохранения за заботу, говоря: «Меня бы не было здесь без нее». Позже он получал круглосуточную помощь от трех медсестер, которые кормили его вручную, подавали респиратор, чтобы помочь ему дышать.
Хокинг большую часть своей жизни общался с помощью голосового компьютера, используя свои руки для управления им. Его ассистентом было разработано устройство, которым можно было координировать щекой. Инфракрасный датчик, прикрепленный к очкам, способен был фиксировать движения мышцы щеки Хокинга. По мере того, как его состояние ухудшалось, он продолжал общаться, двигая мышцами щёк, разговаривая со скоростью шесть слов в минуту. Он оставался в невероятно здравом уме, являясь одним из самых блестящих физиков-теоретиков.
Заключение
Стивен Хокинг был самым узнаваемым ученым современности. Его жизнь очаровывала людей на протяжении десятилетий, кульминацией которых стала британская драматическая биографическая картина режиссера Джеймса Марша «Теория всего», вышедшая в 2014 року. Название фильма было данью его научной жизни. Хокинг потратил годы на поиски единой теории, которая описывает нашу Вселенную. Несмотря на изнурительную болезнь, он был одним из великих популяризаторов науки, передавая свои идеи миллионам. «Я прожил большую часть своей жизни в ожидании ранней смерти, поэтому время всегда было для меня драгоценным», – сказал Хокинг в 2006 году.
При подготовке использованы материалы:
Wikipedia, BBC, biography.com, medscape.com, sosudinfo.ru, 24СМИ