стимулятор репаративных процессов в глазах что такое
Препараты для регенерации роговицы (кератопротекторы)

При этом, необходимо отметить, что эффективность применяемого также гидроксиэтиламиноаденина гидробромида не имеет научно обоснованных доказательств.
Фармакологическое действие
Стимуляция регенеративных процессов в тканях при применении кератопротекторов осуществляется за счет повышения миграции эпителиальных клеток на раневые поверхности с неповрежденных участков, а также увеличения митотического действия базальных клеток. Гликозаминогликаны при этом, не только активизируют процессы регенерации, но и оказывают значительно противовоспалительное действие.
Фармакокинетика
Механизмы абсорбции, распределения или элиминации данных препаратов не подлежит изучению традицонными фармакокинетическими методами (к примеру, радиоактивной маркировкой и пр.), так как они включают низкомолекулярные компоненты, которые в норме присутствуют в организмах любых млекопитающих.
Показания к применению
Стимуляторы регенерации роговицы назначаются в терапии следующих заболеваний:
Кроме того, кератопротекторы применяют для сокращения времени адаптации к контактным линзам (мягким и жестким), улучшения их переносимости. Рекомендованы они и после проведения диагностических исследований с применением контактных линз (ретиноскопии, гониоскопии и пр.).
Побочные эффекты
Кератопротекторы не вызывают серьезных системных побочных эффектов и, как правило, имеют хорошую переносимость. Среди местных реакции, можно отметить кратковременное слабое жжение и аллергические реакции.
Противопоказания
Противопоказанием к применению данных препаратов должна служить индивидуальная непереносимость их компонентов, а также онкологические заболевания и сахарный диабет, хотя то касается только гликозаминогликанов.
Лекарственные взаимодействия
Кератопротекторы нежелательно сочетать с антинуклеозидными производными, имеющими виростатическое действие (к примеру, естественные метаболиты депротеинизированного диализата крови молочных телят снижают противовирусный эффект ацикловира).
Заполните форму и получите скидку 15 % на диагностику!
Корнерегель – новый стимулятор репаративной регенерации
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Corneregel – new stimulator of reparative regeneration
Rybakova E.G., Yegorova G.B., Kalinich N.I.
Authors represent the results of treatment of anterior eye chamber diseases, following by various corneal disorders, and patients with keratoconus, developed because of hard contact lenses, using the new stimulator of reparative regeneration Corneregel. Comparative trials showed that Corneregel turned out to be more effective than Solcoseryl in treatment of erosions and traumatic keratitis, eye burns, in combined treatment of epithelial–endothelial dystrophy in conjunction with therapeutic contact lenses and in improvement of tolerance of hard contact lenses in patients with keratoconus II–III.
В настоящее время травматические повреждения и заболевания роговой оболочки глаза остаются актуальной проблемой в офтальмологии и являются частой причиной снижения зрения и слепоты.
Несмотря на обилие средств и способов консервативного лечения повреждений роговицы, клинические результаты их использования не всегда являются удовлетворительными. В связи с этим поиск и изучение новых средств, способствующих регенерации тканей роговицы при ее повреждениях и заболеваниях, является важной задачей и представляет существенный научный и практический интерес.
В настоящее время в арсенале средств, усиливающих процессы репаративной регенерации, имеются такие препараты, как 20% глазной гель солкосерила, 1% раствор эмоксипина, 4% раствор тауфона. В основе действия этих препаратов лежит активация кислородного метаболизма и энергетического обмена на клеточном уровне.
Усиление процессов репаративной регенерации отмечено при применении пептидных биорегуляторов (цитомединов) тималина и тимогена. Достаточно эффективным средством является метилурацил, который широко используется в клинике в виде 10% мази, а также входит в состав глазных лечебных пленок и губок (гентамекон, метуракол).
Препараты нуклеинового ряда, такие как энкад, витасик (комплекс нуклеотидов), оказывают многофакторное действие на все стадии репаративного процесса и также ускоряют эпителизацию раны.
Новый препарат корнерегель – 5% гель декспантенола, содержащий пантотеновую кислоту, является эффективным стимулятором процессов регенерации в роговице. Пантотеновая кислота, как компонент коэнзима А, присутствует во всех живых тканях, а их повреждение резко увеличивает потребность в ней. Применение Д–пантенола стимулирует митоз и сокращает сроки эпителизации. Гистохимические исследования показали, что корнерегель усиливает пролиферативную активность эпителиальных клеток, а также стимулирует миграцию клеток, способствуя более быстрой эпителизации раневого дефекта. Следует отметить, что за счет стимуляции процессов миграции эпителиальных клеток под воздействием корнерегеля происходит более ранняя реэпителизация раневой поверхности, закрываются ворота для инфекции и повышается процент прозрачного заживления роговицы.
Было проведено клиническое изучение местного применения корнерегеля при эрозиях роговицы и травматических кератитах (41 глаз), ожогах глаз (31 глаз), эпителиально–эндотелиальной дистрофии роговицы (12 глаз), герпетических кератитах (24 глаза), а также у больных с кератоконусом 2–3 стадии на фоне ношения жестких контактных линз (10 глаз).
Контрольную группу составили 40 больных, получавших солкосерил.
Критерием клинической эффективности лечения являлось наступление эпителизации, что контролировалось с помощью флюоресцеиновой пробы. Также учитывались и другие критерии: выраженность и продолжительность роговичного синдрома и воспалительных изменений в глазу (отек век, инъекция конъюнктивы, отек стромы роговицы, десцеметит).
Оценка действия препаратов проводилась на фоне лечения с применением средств, которые при необходимости назначали дополнительно в каждом конкретном случае.
Выраженное действие корнерегеля было отмечено при лечении эрозий и травматических кератитов. Его использование в сочетании с основным лечебным комплексом позволило повысить эффективность лечения. Эпителизация роговичных дефектов при этой патологии наступала в среднем на 3–5 день. Ускорение эпителизации по сравнению с контрольной группой больных, получавших солкосерил–гель, составило 3–4 дня. Назначение корнерегеля не вызывало побочных реакций, в том числе и аллергических.
При поверхностных травматических кератитах помутнений роговицы не наблюдалось, при глубоких кератитах в обеих группах исходом процесса было различной степени интенсивности помутнение, но при лечении корнерегелем помутнение было неинтенсивным, в основном в виде «облачка».
Установлено выраженное положительное влияние корнерегеля на течение и исход ожогового процесса. Этот препарат в сочетании с комплексным лечением способствовал снижению выраженности и укорочению сроков купирования воспалительной реакции, что выражалось в уменьшении болевого и роговичного синдромов, явлений отека и десцеметита. Наряду с этим у больных в более короткие сроки наступала полная эпителизация ожоговой поверхности. Сроки эпителизации в зависимости от степени тяжести ожога – от 3 до 16 дней, тогда как в контрольной группе при использовании солкосерила они составили от 6 до 24 дней.
Отмечено положительное влияние корнерегеля на предупреждение образования симблефаронов, особенно при тяжелых химических ожогах.
При герпетических кератитах корнерегель применялся только как дополнение к специфическому лечению. Однако в случаях поверхностных герпетических поражений его эффективность была достаточно выражена: применение корнерегеля приводило к завершению эпителизации к концу первой недели лечения.
При эпителиально–эндотелиальной дистрофии корнерегель применяли в сочетании с мягкими лечебными контактными линзами. При наличии буллезных изменений роговицы целесообразно применение лечебных контактных линз, на фоне ношения которых происходит постепенное уплощение и редуцирование буллезных элементов. Затем возможна отмена лечебной мягкой контактной линзы с одновременным назначением дезинфицирующих средств в сочетании с корнерегелем. Назначение данного препарата приводило к эпителизации дефектов эпителия и к значительному улучшению состояния поверхности роговицы. Больные отмечали уменьшение болевого и роговичного синдромов, а в ряде случаев и полное исчезновение болезненных ощущений. Положительное действие корнерегеля является очень ценным в случае потери линзы пациентом и невозможности ее быстрой замены или при других обстоятельствах, когда возникает необходимость отмены контактной линзы.
При наличиии буллезных изменений роговицы применение одного корнерегеля не давало такого положительного эффекта. Однако все больные отмечали некоторое субъективное улучшение в виде уменьшения болевого синдрома и светобоязни.
Все пациенты с эпителиально–эндотелиальной дистрофией ранее применяли солкосерил–гель, который не давал такого ощутимого эффекта.
Корнерегель был также применен у больных с кератоконусом 2–3 стадии на фоне ношения жестких контактных линз. Гель назначали два раза в день: утром за 15 минут до одевания контактной линзы и на ночь после ее удаления.
У всех пациентов подбор жестких контактных линз был затруднен из–за сложной формы роговицы. Пациенты по разным причинам воздерживались от хирургического лечения и продолжали носить жесткие контактные линзы, несмотря на то, что посадка линз была неудовлетворительной. У всех пациентов периодически появлялись жалобы на дискомфорт при ношении контактных линз, покраснение глаз, затуманивание.
Объективно при биомикроскопии выявлялись признаки отека эпителия, множественные его поверхностные дефекты, окрашивающиеся флюоресцеином. Более выраженные изменения отмечались в области вершины кератоконуса. В одном случае у пациента со смещенной вниз вершиной кератоконуса и при низкой посадке контактной линзы на обоих глазах было отмечено диффузное прокрашивание эпителия роговицы под всей поверхностью контактной линзы.
После назначения корнерегеля все пациенты отметили улучшение переносимости контактных линз с первого дня применения препарата. Через неделю лечения у всех пациентов исчезли жалобы на дискомфорт при ношении линз. Только один пациент отмечал неприятные ощущения и усталость к концу дня.
Объективно при биомикроскопиии и проведении флюоресцеиновой пробы через 7 дней применения корнерегеля не наблюдалось отека и дефектов эпителия у 4 больных. У одного пациента отмечались незначительные явления эпителиопатии, но на фоне значительного субъективного улучшения переносимости жестких контактных линз.
Таким образом, высокая эффективность местного применения корнерегеля – нового стимулятора репаративной регенерации – позволяет рекомендовать данный препарат для включения в комплекс медикаментозных средств для лечения травматических, воспалительных заболеваний роговицы, ожогов глаз, а также эпителиально–эндотелиальных дистрофий в сочетании с применением лечебных контактных линз и для профилактики повреждений роговицы при ношении жестких контактных линз.
Литература
1. Егоров Е.А., Калинич Н.И., Киясов А.П. Новые стимуляторы репаративной регенерации роговицы. – Вестник офтальмологии. – 1999, т. 115, № 6. С. 13–16.
2. Егорова Г.Б. Повышение толерантности к жестким контактным линзам с помощью солкосерила. – Офтальмологический журнал. – 1983, № 4. С. 198–200.
Репаративная терапия при экзогенном повреждении роговой оболочки
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Цель: изучить эффективность применения корнеопротекторов (Корнерегеля) при комплексном лечении микроповреждений роговицы, оценить продолжительность периода нетрудоспособности и заживления оболочки.
Материал и методы: обследовано 120 пациентов с микроповреждениями роговицы. Всей группе больных выполнена комплексная офтальмологическая диагностика: визометрия, биомикроскопия переднего отрезка глазного яблока, офтальмотонометрия, прокрашивание поврежденной роговицы флюоресцеином. В случае подтверждения диагноза назначена этиопатогенетическая и симптоматическая терапия, в т. ч. репаративное лечение роговицы. Вся выборка была разделена на 2 группы: в 1-ю включили 50 пациентов, во 2-ю – 70 пациентов. В качестве репаративной терапии роговицы 1-й группе был назначен глазной гель декспантенол 5% (Корнерегель), 2-й – депротеинизированный диализат (ДД) из крови здоровых молочных телят. Выполнен статистический анализ полученных результатов с использованием статистического пакета Statistica10.0 (StatSoft, США).
Результаты: при использовании глазного геля декспантенол 5% (Корнерегель) при микроповреждениях роговицы доказано статистически достоверное сокращение периода репарации оболочки и сроков нетрудоспособности пациентов. При использовании Корнерегеля среднее значение сроков заживления роговицы составило 3,88±0,94 сут, при применении глазного геля ДД – 5,08±1,00 сут. Различия статистически достоверны (t-критерий Стьюдента = 0,87). Аналогичная тенденция, статистически подтвержденная, наблюдалась при сравнении сроков нетрудоспособности наблюдаемых пациентов: в случае назначения Корнерегеля – 5,88±0,94 сут, ДД – 7,3±1,05 сут (t-критерий Стьюдента = 1,01). Отмечается выраженный субъективный комфорт применения Корнерегеля при экзогенном повреждении роговицы.
Заключение: глазной гель декспантенол 5% (Корнерегель) может быть рекомендован для репаративной терапии роговицы с целью сокращения сроков нетрудоспособности пациентов и увеличения скорости заживления оболочки. Корнерегель может быть рекомендован в качестве препарата для домашней аптечки.
Ключевые слова: корнеопротектор, репаративная терапия, Корнерегель, микроповреждение роговицы, синдром «сухого глаза».
Для цитирования: Кадышев В.В., Халлуф З. Репаративная терапия при экзогенном повреждении роговой оболочки. РМЖ. Клиническая офтальмология. 2016;17(4):200-203.
1 City clinic №210, Moscow
2 Research Centre for Medical Genetics, Moscow
Key words. Corneal protector, reparative therapy, Corneregel, microdamage of cornea, dry eye syndrome.
For citation: Kadyshev V.V., Halluf Z. Reparative therapy in patients with exogenous corneal damage // RMJ. Clinical ophthalmology. 2016. № 4. P. 200–203.
В статье освещен вопрос возможностей применения репаративной терапии при экзогенном повреждении роговой оболочки
Стимулятор репаративных процессов в глазах что такое
Травма вызывает целый комплекс различных изменений в травмированном глазу. Хирургическими методами можно восстановить анатомическую целость глазного яблока, устранить повреждения внутренних оболочек и сред, удалить внедрившиеся инородные тела, однако реактивный ответ на травму глаза включает, помимо анатомических изменений, целый комплекс глубоких сосудистых и нейрогенных повреждений. Устранение этих изменений требует адекватного медикаментозного лечения, а в ряде случаев использования и других методов консервативного лечения.
Лечение механических травм глаза производят с учетом имеющихся травматических изменений, а также осложнений, нередко развивающихся после проникающих ранений глазного яблока. Анализ современного медикаментозного лечения, применяемого в офтальмотравматологии, позволяет выделить следующие основные направления:
• репаративная терапия, направленная на стимуляцию регенерации поврежденных тканей;
• противовоспалительная терапия, направленная на лечение травматического увеита;
• антибактериальная терапия, обеспечивающая профилактику и лечение раневой инфекции;
• антигеморрагическая терапия, стимулирующая рассасывание внутриглазных кровоизлияний и обеспечивающая профилактику их рецидива;
• гипотензивная терапия, обеспечивающая нормализацию ВГД при его повышении;
• терапия гипотонических состояний, обеспечивающая повышение ВГД при его посттравматическом снижении.
Репаративная терапия травм глаза
Нарушение процессов регенерации при механической и ожоговой травме приводит к замедленному формированию рубца в месте проникающей травмы или контузионного разрыва роговицы и склеры, возникновению эрозий роговицы, торпидных язв, десцеметоцеле, перфорации оболочек, внутриглазной инфекции. Для улучшения регенерации и восстановления угнетенных обменных процессов предложено много различных препаратов, преимущественно биологического происхождения: рыбий жир, облепиховое масло, эвкалиптовая эмульсия или мазь, сок каланхоэ, экстракт алоэ, спермацет в различных лекарственных формах.
В настоящее время изучен ряд биологически активных веществ, повышающих скорость эпителизации роговицы. К ним относятся эпидермальный и мезодермальный факторы роста, фактор роста фибробластов, ретиноиды, фибронектин. Нами предложен новый репаративный стимулятор — адгелон, представляющий раствор низкомолекулярного сывороточного полипептида и влияющий на клеточную адгезию.
С этой же целью употребляют различные субстанции, создающие биологическое покрытие на поврежденных наружных оболочках, в первую очередь на роговице, и препятствующие ее травматизации при экскурсии век, а также стимулирующие репаративные процессы: актовегин, солкосерил, корнегель и др.
Большое значение для стимуляции репаративных процессов имеют препараты, воздействующие на механизмы внутриклеточного обмена. Это антиоксиданты (эмоксипин, дибунол, токоферол) и стабилизаторы клеточных мембран (тауфон).
В отделе травматологии в комплекс обязательного медикаментозного лечения травм глаза включены желе актовегин (солкосерил) и тауфон. Указанные препараты применяются местно в виде инстилляций.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Стимулятор репаративных процессов в глазах что такое
Изучение процессов репаративной регенерации до сих пор остается актуальным в биологии и медицине [2, 5]. Особенно это важно для биологических тканей, в которых регенерация очень низка или практически отсутствует, в частности, в офтальмологии ‒ в ходе манипуляции для укрепления наружной стенки глаза при ее дистрофических процессах [3, 9, 10].
В предварительных исследованиях эффективности применения различных аллоплантов и имплантатов выявлено их значительное модулирующее влияние на поврежденные ткани [7]. Использование измельченных в порошок биологических материалов в виде крупнодисперсной взвеси уменьшает травматичность методики за счет минимизации разрезов слизистой оболочки, однако репаративная регенерация возникает также только на поверхности склеры в зоне ее введения [5, 6].
Известно, что измельчение до наноразмерной структуры вещества без изменения его химического состава изменяет в сторону увеличения его физические свойства: проникающую способность, гидрофильность и т.д. [4]. Однако изучение влияния имплантации биологических материалов, измельченных до наноразмерного уровня, на динамику репаративных процессов в соединительнотканных структурах передней стенки глаза в настоящее время не проводилось.
Цель исследования – изучить закономерности репаративной регенерации соединительнотканных структур передней стенки глаза в ответ на имплантацию нанодисперсной плаценты.
Материалы и методы исследования
Экспериментальные исследования выполнены на самцах белых крыс трехмесячного возраста с массой тела 220–300 г. В первой группе животным (опыт) под слизистую на склеру глаза под местной анестезией имплантировали биологический контейнер (БК) размерами 3,0 ± 0,5×1,0 ± 0,2 мм. Биоконтейнер представлял собой отрезок сосуда амниотической оболочки человека и был наполнен 0,05 ± 0,01 г порошком нанодисперсной плаценты, полученной методом механоактивации [1]. Порошок состоял [8] из отдельных частиц размером от 200 до 500 нм, сформированных зернами размером от 40 до 100 нм. Частицы в свою очередь образовывали слабосвязанные агломераты размером от 2 до 10 мкм. Во второй опытной группе животным под слизистую на склеру глаза под местной анестезией имплантировали биологический контейнер, заполненный порошком из крупноизмельченной плаценты с размерами частиц более 45 мкм, в аналогичной дозе. Третья группа животных (контроль) состояла из ложнооперированных крыс, которым под анестезией проводили разрез, аналогичный таковому в ходе имплантации.
Экспериментальные исследования проведены с соблюдением «Правил проведения работ с использованием экспериментальных животных». Забой производили под тиопенталовым наркозом путем декапитации. Изучены группы животных к концу 3, 7, 30 и 60 суток после манипуляций (по 5 животных в каждой группе). Фиксацию осуществляли в 10 % растворе нейтрального формалина, заливали в парафин. Исследование структуры порошка измельченной плаценты человека и поверхности гистологических срезов зоны оперативного вмешательства проводились на сканирующей зондовой лаборатории Ntegra (NT-MDT) в прерывисто-контактной методике на воздухе после предварительной химической очистки от парафина. Аналогичным образом изучена структурная организация коллагеновых волокон в участках предварительно проведенных манипуляций. Для общего морфологического анализа препараты окрашивали гематоксилин-эозином. Изучение пролиферативной активности соединительнотканного окружения трансплантируемого материала выявляли иммуногистохимически с определением экспрессии Ki-67 ПАП методом.
Результаты исследования и их обсуждение
В ходе проведенных экспериментальных исследований выявлено, что постимплантационный период у животных протекал без видимых осложнений: отсутствовали признаки отторжения и вторичной инфекции.
В ранние сроки (3–7-е сутки) после имплантации БК во всех рассмотренных случаях имплантат сохранялся в обеих опытных группах. Отмечалась умеренная воспалительная инфильтрация как оболочки БК, представленной стенкой сосуда, так и окружающей конъюнктивы и субконъюнктивальной основы. Это проявлялось в лимфоцитарно-моноцитарных клеточных ответах, умеренной инфильтрации мононуклеарами тканей прилежащей склеры и конъюнктивы, появлении отдельных лейкоцитов в стенке и в содержимом БК. В контроле же проявления клеточных реакций были значительно менее выражены. Прилегающий участок склеры реципиента в первой опытной группе характеризовался разрыхлением стромы, между коллагеновыми волокнами которой видны нейтрофилы и лимфоциты, а также мелкие полихромно окрашенные пылевидные частицы, аналогичные наблюдаемым при исследовании гистологического среза БК. При этом отмечено сохранение наноразмерной структуры измельченной плаценты 40–100 нм. Разволокнение поверхностных слоев склеры во второй опытной группе было незначительное, их инфильтрация под БК не отмечалась. В контроле склера была интактна.
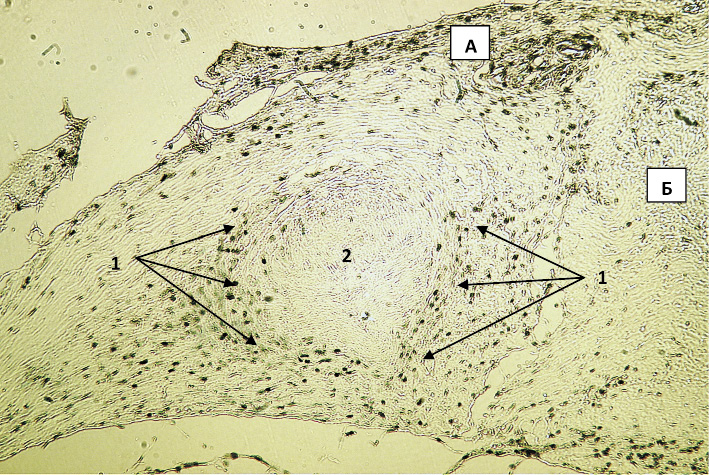
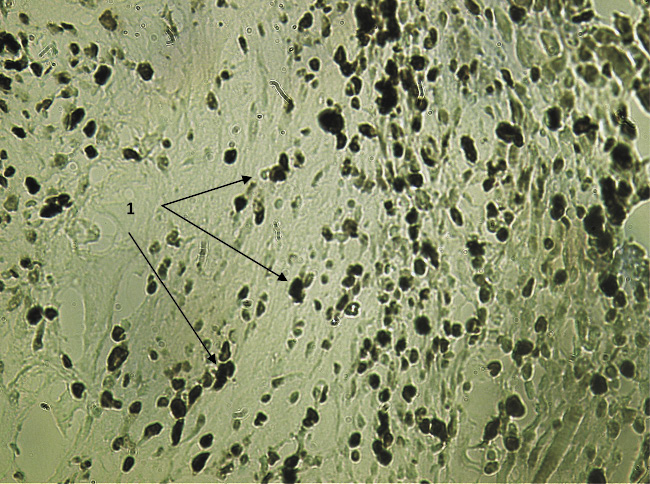
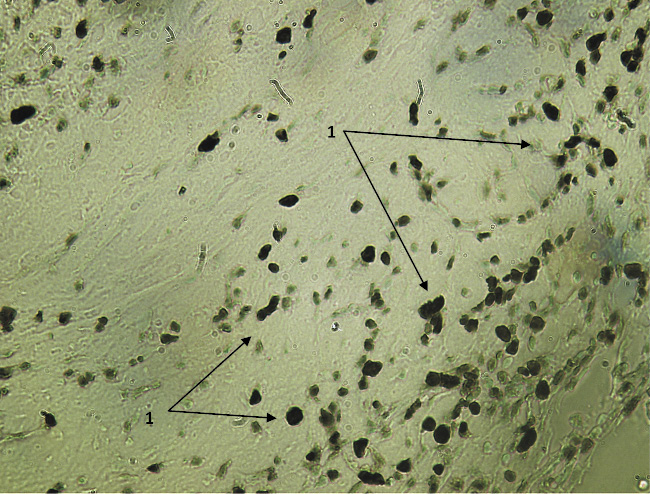
Иммуногистохимическое исследование с определением экспрессии Ki-67 ПАП методом показало выраженную пролиферативную активность клеток соединительно-тканной основы слизистой оболочки глаза вокруг БК (рис. 1, 2) в первой контрольной группе, умеренновыраженную пролиферативную активность в зоне имплантации БК с крупноизмельченной плацентой (рис. 3) и низкую пролиферативную активность в зоне разреза слизистой и подслизистой оболочек в опытной группе (рис. 4).
Через 30 суток после проведенной манипуляции как у контрольных, так и опытных животных зона внешней поверхности раневого повреждения подвергалась полной реэпителизации. В контроле на месте хирургического вмешательства сформировался рубец в виде ограниченного участка плотной волокнистой соединительной ткани с сетевидно распределенными коллагеновыми волокнами. Лейкоцитарно-клеточные реакции в зоне и непосредственно вокруг повреждения у контрольных животных отсутствовали. У животных опытных групп в зоне имплантации наблюдались остатки стенки БК в виде небольших скоплений участков эластических и коллагеновых волокон с наличием лимфоцитарно-клеточного ответа в них. У животных обеих опытных групп в непосредственном окружении БК наблюдались значительные клеточные скопления, включающие лимфоциты, пролиферирующие и зрелые клетки фибробластического ряда, эпителиоидные клетки.
При этом фибробласты формировали тонкую соединительную капсулу вокруг БК с множеством гемокапиляров и наличием эпителиоидных клеток, однако в первой опытной группе при имплантации БК с нанодисперной плацентой процессы клеточных реакций, а также формирование новых капилляров было более выражено. Кроме того, отмечалась пролиферативная активность клеток фибробластического ряда в прилежащей к БК склере реципиента, в ее поверхностных и средних слоях, а также формирование в них гемокапилляров, что практически отсутствовало во второй группе животных с имплантацией БК с крупноизмельченной плацентой.
Рис. 1. Обзорное изображение экспрессии Ki-67 в зоне имплантации биоконтейнера в 1-й опытной группе на 7-е сутки после вмешательства. Вторые антитела, меченные пероксидазой. Ув. х50: 1 – участок соединительной ткани с признаками высокой пролиферативной активности, 2 – остатки биоконтейнера; А – слизистая оболочка; Б – подслизистая оболочка
Рис. 2. Экспрессия Ki-67 в зоне, непосредственно прилежащей к имплантируемому биоконтейнеру в 1-й опытной группе на 7-е сутки после вмешательства. Вторые антитела, меченные пероксидазой. Ув. х200: 1 – пролиферативно активные клетки
Рис. 3. Экспрессия Ki-67 в зоне, непосредственно прилежащей к имплантируемому биоконтейнеру во 2-й опытной группе на 7-е сутки после вмешательства. Вторые антитела, меченные пероксидазой. Ув. х200: 1 – пролиферативно активные клетки
Рис. 4. Экспрессия Ki-67 в зоне механической травмы в контрольной группе на 7-ые сутки после вмешательства. Вторые антитела, меченные пероксидазой. Ув. х200: 1 – пролиферативно активные клетки
Через 60 суток в области разреза у контрольных животных участок хирургического вмешательства выявлялся в виде ограниченной зоны рубцовой ткани конъюнктивы. В обеих опытных группах БК практически полностью рассасывался. Вокруг донорских структур в первой опытной группе образовалась капсула, внутренние слои которой состояли из эпителиоидных клеток и крупных макрофагов. Наружные слои капсулы состояли из вновь образованной рыхлой соединительной ткани с множеством вновь сформированных сосудов, активных фибробластов. Новообразованная соединительная ткань по плотности приближалась к отдаленной от зоны имплантации. Макромолекулярная организация вновь образованных коллагеновых волокон указывала на достаточную степень их морфологической зрелости. Волокнистая организация межклеточного вещества склеры приобретала упорядоченный характер. При имплантации БК с крупноизмельченной плацентой данные процессы проявлялись в значительно меньшей степени. Толщина склеры во второй опытной группе была на 23 %, а в контроле на 31 % меньше по отношению к первой опытной группе.
Таким образом, нанодисперсная плацента, по всей видимости, за счет приобретения ею новых физических свойств вследствие механоактивации, таких как повышенная проницаемость и гидрофильность, значительно усиливает процессы пролиферации в соединительнотканных структурах реципиента в зоне ее введения. Кроме того, повышаются репаративные свойства склеральной ткани при ее изначально низкой пролиферативной активности.
Рецензенты:
Васильев Ю.Г., д.м.н., профессор кафедры гистологии, эмбриологии и цитологии, ГБОУ ВПО «Ижевская государственная медицинская академия» Минздрава России, г. Ижевск;
Селякин С.П., д.м.н., профессор кафедры анатомии человека, ГБОУ ВПО «Ижевская государственная медицинская академия» Минздрава России, г. Ижевск.