стимулятор репаративных процессов что это
Стимулятор репаративных процессов что это
Травма вызывает целый комплекс различных изменений в травмированном глазу. Хирургическими методами можно восстановить анатомическую целость глазного яблока, устранить повреждения внутренних оболочек и сред, удалить внедрившиеся инородные тела, однако реактивный ответ на травму глаза включает, помимо анатомических изменений, целый комплекс глубоких сосудистых и нейрогенных повреждений. Устранение этих изменений требует адекватного медикаментозного лечения, а в ряде случаев использования и других методов консервативного лечения.
Лечение механических травм глаза производят с учетом имеющихся травматических изменений, а также осложнений, нередко развивающихся после проникающих ранений глазного яблока. Анализ современного медикаментозного лечения, применяемого в офтальмотравматологии, позволяет выделить следующие основные направления:
• репаративная терапия, направленная на стимуляцию регенерации поврежденных тканей;
• противовоспалительная терапия, направленная на лечение травматического увеита;
• антибактериальная терапия, обеспечивающая профилактику и лечение раневой инфекции;
• антигеморрагическая терапия, стимулирующая рассасывание внутриглазных кровоизлияний и обеспечивающая профилактику их рецидива;
• гипотензивная терапия, обеспечивающая нормализацию ВГД при его повышении;
• терапия гипотонических состояний, обеспечивающая повышение ВГД при его посттравматическом снижении.
Репаративная терапия травм глаза
Нарушение процессов регенерации при механической и ожоговой травме приводит к замедленному формированию рубца в месте проникающей травмы или контузионного разрыва роговицы и склеры, возникновению эрозий роговицы, торпидных язв, десцеметоцеле, перфорации оболочек, внутриглазной инфекции. Для улучшения регенерации и восстановления угнетенных обменных процессов предложено много различных препаратов, преимущественно биологического происхождения: рыбий жир, облепиховое масло, эвкалиптовая эмульсия или мазь, сок каланхоэ, экстракт алоэ, спермацет в различных лекарственных формах.
В настоящее время изучен ряд биологически активных веществ, повышающих скорость эпителизации роговицы. К ним относятся эпидермальный и мезодермальный факторы роста, фактор роста фибробластов, ретиноиды, фибронектин. Нами предложен новый репаративный стимулятор — адгелон, представляющий раствор низкомолекулярного сывороточного полипептида и влияющий на клеточную адгезию.
С этой же целью употребляют различные субстанции, создающие биологическое покрытие на поврежденных наружных оболочках, в первую очередь на роговице, и препятствующие ее травматизации при экскурсии век, а также стимулирующие репаративные процессы: актовегин, солкосерил, корнегель и др.
Большое значение для стимуляции репаративных процессов имеют препараты, воздействующие на механизмы внутриклеточного обмена. Это антиоксиданты (эмоксипин, дибунол, токоферол) и стабилизаторы клеточных мембран (тауфон).
В отделе травматологии в комплекс обязательного медикаментозного лечения травм глаза включены желе актовегин (солкосерил) и тауфон. Указанные препараты применяются местно в виде инстилляций.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Стимулятор репаративных процессов что это
Кафедра термических поражений, ран и раневой инфекции РМАПО, Москва.
Наличие длительно существующих ран, как правило, определяет показания к применению средств для их заживления.
Существует ряд фармакологических препаратов, называемых адаптогенами или биогенными стимуляторами (современное название – «регенеранты и репаранты»), которые повышают способность организма адаптироваться к изменившимся условиям существования и, в частности, улучшают процессы заживления ран (Лазарев Н. В. и др., 1960; Дардымов И. В. и др., 1978). Нормальная жизнедеятельность организма сопровождается непрерывным процессом замены отмирающих клеток и тканей, получившим название физиологической регенерации. Лекарственные средства, способные увеличивать скорость и интенсивность физиологической регенерации получили название стимуляторов регенерации или регенерантов. Восстановление участков тканей и органов, погибших в результате травм, повреждений или дистрофии (интоксикации, гипоксия, инфекции и др.) представляет собой процесс репаративной регенерации. В итоге репарации происходит замещение очагов некроза специфической и/или соединительной тканью, которая имеет самый высокий потенциал регенерации. Соответственно, препараты, обладающие способностью стимулировать репаративную регенерацию называются репарантами. В клинической практике используется множество подобных препаратов. Так, по данным «Регистра лекарственных средств России – РЛС» за 2008 год, по теме «Регенеранты и репаранты» было найдено 885 записей и 132 торговых названий препаратов. При этом среди них выделяют общеклеточные (универсальные) препараты — действующие на любую регенерирующую ткань и тканеспецифические стимуляторы процесса регенерации, представляющие собой препараты с разным механизмом действия, объединенные в подгруппы по избирательному действию на ту или другую ткань или систему органов. Наибольшее число препаратов среди тканеспецифических стимуляторов регенерации оказывает влияние на регенерацию и репарацию кожных покровов. Соответственно, вялая эпителизация ожоговых ран определяет показания к применению препаратов, стимулирующих процессы их регенерации.
Имеются работы, в которых клиницисты стремятся ускорить регенеративные процессы в ране путем общего воздействия на организм. Сюда следует отнести применение гормонов различных эндокринных желез (половых, щитовидной, надпочечников), анаболических гормонов (Ретаболил), нестероидных анаболиков (натрия дезоксирибонуклеат (Деринат), инозин, метилурацил, пентоксил, оротат калия и др.),витаминов и других витаминоподобных средств (декспантенол, b-каротин, токоферолы и др.) (М.Ф.Камаев, В.И.Русаков, 1970). Метилурацил, например, стимулирует клеточную пролиферацию, а также клеточные и гуморальные факторы иммунитета (Машковский М.Д., 1998).Как в эксперименте, так и при клинических наблюдениях установлено, что в условиях гиповитаминоза резко снижаются регенеративные и защитные иммунологические процессы, а присоединение витаминов, особенно аскорбиновой кислоты, их отчетливо стимулирует. В тоже время, местное применение витаминов при вялотекущих ранах большого лечебного значения, по-видимому, не имеет.
Однако, признавая важную роль средств общего воздействия на организм для улучшения течения раневого процесса, нужно подчеркнуть, что это возможно только в пределах физиологической нормы. Нельзя ставить перед собой задачу ускорения процессов заживления ран до срока, превышающего физиологические возможности данного организма, так как при этом неизбежно пострадает организм в целом. Поэтому более обоснованным представляется местное использование подобных препаратов.
Для лечения ожоговых ран по разным литературным данным используются различные местные стимуляторы регенерации как на основе природных препаратов и их производных (5% линимент коланхоэ, 10% эмульсия пихтовой смолы, препараты на основе облепихового, пихтового масел, Витаон, Микоран, Кератан, Хитозан и др.), так и синтезированные искусственно. Большую группу средств, активирующих репарацию, составляют биогенные стимуляторы; апилак, прополис, мумие, вулнузан, солкосерил, актовегин и др. Препараты солкосерил и актовегин представляют собой депротеинизированный гемодиализат из крови телят, являющийся, по данным литературы, мощным стимулятором репаративных процессов (Назаренко Г.И. и соавт., 2002). Однако в исследовании, например, на лошадях (Wilmink J.M. et al., 2000), было выявлено, что местное использование солкосерила, вызывая выраженную длительную воспалительную реакцию, наоборот, задержало эпителизацию. Поэтому его лучшее использовать для лечения глубоких ран только на ранних стадиях воспаления, а применение должно быть прекращено при первых признаках эпителизации. В тоже время в доступной литературе не было обнаружено исследований по доказанной эффективности солкосерила и актовегина для местного лечения ожоговых ран.
Для ускорения заживления ран также местно используют различные лекарственные средства, содержащие витаминоподобные вещества (декспантенол, b-каротин и токоферолы). Известно, что в процессах метаболизма и обмена веществ в клетках эпидермиса активное участие принимает коэнзим А, незаменимым компонентом которого является пантотеновая кислота (витамин В5). Коэнзим А участвует в процессах ацетилирования и является одним из важнейших коферментов сложных ферментных систем, под влиянием которых улучшается обеспечение клеток энергией и питательными веществами, увеличивается прочность коллагеновых волокон, стимулируется рост и восстановление клеток. Местное применение пантотеновой кислоты оказывает положительное влияние на процессы заживления поврежденной различными агентами кожи. Для наружного применения используют препараты с декспантенолом (провитимином В5), который в организме образует активный метаболит – пантотеновую кислоту. Препараты с декспантенолом (Пантенол, Д-пантенол, Бепантен, Пантодерм, Венолайф и др.) широко применяются в клинической практике, особенно в дерматологии. Очень широко препарат Пантенол в виде аэрозоля применяется в качестве средства первой помощи при ожогах. В то же время стимулирующие влияние этого средства на процессы заживления ожоговых ран, в том числе длительно существующих, требует проведения «доказательных» комплексных исследований для определения возможности, показаний и методики их применения у обожженных.
Многие авторы (Гамалея Н.Ф., 1946; Волков В.Г., Строителев В.В., Федорищев И.А., 2000; Матчин Е.Н., Потапов В.Л., 1998;) положительно оценивают действие на регенерацию гиалуроновой кислоты (ГК) как в виде раствора (Куриозин), так и в составе повязок (Hydac, Гиаплюс). Применение ГК при подготовке ожоговых ран к кожной пластике обеспечивает приживление кожного лоскута по всей поверхности с хорошим косметическим эффектом, а также ускорение заживления ран донорских мест (Матчин Е.Н., Потапов В.Л., 1998). По мнению С.П.Перетягина с соавт. (2001) и В.А.Евсеева с соавт. (2002), использование Куриозина значительно уменьшает нагноение ожоговых ран, снижает частоту перевязок, ускоряет процессы заживления. В тоже время не рекомендуется применять эти препараты в ранние сроки после травмы.
Имеются данные, что деминерализованный костный матрикс (ДКМ) является не только индуктором остеогенеза, но и стимулятором регенеративных процессов в раневых дефектах кожи (Мовсарова З.М., 1998). Он усиливает миграцию и пролиферацию клеток в области дефекта, активирует синтез коллагена и сокращает сроки эпителизации ран кожи (Anfimov P.E. et. аl., 1997). Следовательно, мелкодисперсный ДКМ можно использовать в качестве биологически активного компонента в раневых покрытиях (Денисов В.М. с соавт., 1999).
Oсобое внимание уделялось местному применению для лечения ожогов различных гормональных препаратов. Теоретическими предпосылками для этого явились исследования H.Conway и R.Stark (1951), указавших, что кортизон и гидрокортизон, активно воздействуя на мезенхимальную ткань, тормозят образование и рост грануляционной и рубцовой ткани, а также исследования R.Lattes и др. (1953), доказавших противовоспалительное действие указанных гормональных препаратов. Фишер в 1958 г. сообщил, что при местном применении гидрокортизона заживление гранулирующих ран после ожогов ускорялось, патогенная микрофлора уменьшалась и улучшалось самочувствие больных. R.Vilain (1959) показал, что гидрокортизон значительно усиливал антибактериальное действие местных антибиотиков и антисептиков, для лечения ожоговых ран в периоде развития грануляций. и др. Е.Mеese и др. (1959) наблюдали более быстрое заживление поверхностных ожогов при местном применении гидрокортизоновой мази. В тоже время по данным Каноф, Вильсон, Кимбал и Свенсон (цит. по Mеese Е., 1959) в клинических условиях и в эксперименте не было обнаружено благоприятного влияния гидрокортизона без антибиотиков на течение раневого процесса, особенно в ранние сроки после ожога.
По данным Братусь В.Д. с соавт. (1963) при использовании за 3-4 дня до намеченной операции ежедневных орошений гранулирующих ран гидрокортизоном совместно с антибиотиками как в виде эмульсии, так и перевязки с 1-2,5% мазью быстро и надежно улучшается состояние грануляций. В связи с уменьшением соединительнотканной пролиферации грануляции становились плоскими, теряли зернистость, но приобретали розовый цвет, значительно уменьшалось раневое отделяемое и воспалительная реакция в ране, активизировался краевой рост эпидермиса и островковая эпителизация в участках ожога IIIА степени. По мнению авторов, «гидрокортизон совместно с антибиотиками является самым эффективным из всех испытанных средств местного лекарственного лечения ожогов». В тоже время у больных с тяжелым ожоговым истощением никакого эффекта при местном применении гидрокортизона не было получено. Зато системное применение глюкокортикостероидов в комплексе лечебных мероприятий обуславливает значительное ослабление симптомов ожогового истощения, в том числе – изменяет течение раневого процесса, способствуя снижению экссудации, уменьшению деструктивных процессов и усилению проявлений репарации (Долгина М.И., 1969).
Известно, что половые гормоны эстрогены также играю значительную роль в процессе заживления повреждений кожи (Jorgensen O, Schmidt A., 1962). Так, эстрогеновые рецепторы обнаружены в коже, раневых фибробластах и воспалительных клетках кожи. Механизм действия эстрогенов связан со стимуляцией накопления матричных волокон, увеличением содержания коллагена, усилением васкуляризации (Jorgensen O, Schmidt A., 1962; Brincat MP., 2000; Singer AJ, Clark RA., 1999; Calvin M etall., 1998; Pallin B, Ahonen J, Zederfeldt B., 1975; Pirila E. et all., 2001; Pirila E et all., 2002).Они также уменьшают воспалительную реакцию, влияя на белок-ингибитор фактора миграции (MIF) (Ashcroft GS. et all., 1999). В ходе исследования Margolis DJ с соавт. (2002) было выявлено, что эстрогены предотвращали развитие хронических венозных трофических язв нижних конечностей. Данные обстоятельства определили возможность клинического использования препаратов эстрогенов для лечения ран. Одним из таких препаратов является 17β-эстрадиол (Zesteem) – вещество естественного происхождения с малой молекулярной массой. Проведенные доклинические и клинические исследования показали, что препарат 17β-эстрадиола играл значительную роль в процессах заживления повреждений кожи (Singer AJ, Clark RA., 1999; MargolisDJ, Knauss J, Bilker W., 2002; Ashcroft GS et all., 1997; 1999), в том числе у лиц пожилого возраста (Balfour JA, McTavish D., 1992). Однако 17β-эстрадиол не влиял на сроки заживления поверхностных термических поражений кожи, в то время как при ранениях всех слоев кожи препарат принимал активное участие в процессе восстановления (Batra RS et all., 2003). При этом местное применение эстрогенов было эффективнее, чем системное введение. Однократная внутрикожная инъекция 17β-эстрадиола непосредственно перед нанесением повреждения ускоряла процесс заживления ран, в том числе донорских участков, как у подопытных животных, так и у здоровых добровольцев (Drill VA. 1979; Maier WE, Herman JR., 2001). В то же время 2-3 кратные инъекции в последующие дни не ускоряли ре-эпитализацию. Большие дозы Зестима стимулировали закрытие раны путем сокращения, а малые дозы (0,1-0,2 мкг/100 мкл) стимулировали ре-эпителизацию (Renovo Internal Report RN 1002 (RE059), (RE066). Использование препарата в указанных дозах было безопасно и не вызывало побочных реакций (Drill VA. 1979; Lehmann M. Et all., 1989; Toole J. Et all., 2002). В тоже время проведенные в 2007-2008 гг. многоцентровые сравнительные исследования по применению препарата Зестим для стимуляции эпителизации ран донорских участков после взятия расщепленных аутодермотрансплантатов показали отсутствие его эффективности.
В патогенезе ожогов и ожоговой болезни одно из важных мест занимают нарушения иммунитета, поэтому вопросы его коррекции с использованием системных препаратов постоянно рассматриваются в литературе. В тоже время местное применение подобных препаратов ограничено. Поремский В.В. (1987) рекомендовал использование в комплексном лечении обожженных локальных орошений ожоговых ран 5% раствором аминокапроновой кислоты, которая обеспечивала коррекцию гуморального звена иммунной системы, препятствуя образованию иммунных комплексов. По данным литературы положительный эффект отмечен при местном применении иммуномодулятора «Гепон» в комплексном лечении трофических язв (Дудченко М.А. с соавт., 2002), местных лучевых повреждений (Бардычев М.С., 2003), эрозивных циститов (Бардычев М.С., Терехов О.В., Белая Н.С., 2003), вульвовагинитов (Телунц А.В., 2004) и гнойных ран (Чадаев А.П., Нурписов А.М., 2004). В доступной литературе мы не обнаружили сообщений о местном применении «Гепона» при лечении ожоговых ран.
В репаративной регенерации активно участвуют полипептидные факторы роста, являющиеся эндогенными регуляторами (модуляторами) восстановления утраченных тканей. Выделяемые активными клетками (в первую очередь макрофагами, фибробластами и кератиноцитами) в окружающую их среду (ЭЦМ) факторы bFGF, TGF,TNF, EGF, IL 1, 6 и 8 осуществляют широкий спектр функций – от контроля хемотаксиса, пролиферации, миграции клеток до ангиогенеза, коллагеногенеза и синтеза основного вещества ЭЦМ, а также обладают цитокинными функциями (Назаров П.Г., Полевщиков А.В., 1993; Саркисов Д.С. с соавт., 1997). Одним из современных направлений в лечении ран, в том числе и хронических, является использование компонентов ЭЦМ и ростовых факторов, которые биотехнологическими методами могут быть получены в количествах, достаточных для применения их в лечебных целях для заживления ран (Cooper D., Hennessey P. et al., 1994; Greenhalah G., 1996; Blumenfeld I., Ullmann Y., Laufer D., Livne E., 2000). Это может быть достигнуто тремя способами: добавлением экзогенных ростовых факторов; активизацией неактивных эндогенных факторов роста; посредством инактивации эндогенных факторов роста, имеющих антагонистическое действие (Mellin T.N., MennieR.J., Chashen D.E. et al, 1992; Альбертс Б. и соавт., 1994; Whitby D., 1995). При этом наиболее оправданно местное использование факторов роста(Greenhalah G., 1996).
Среди факторов роста наиболее широко изучен эпидермальный фактор роста (EGF), представляющий собой цепочку полипептидов из 53 аминокислот с молекулярной массой около 6 кДа, который был открыт в 1962 г., а получен в виде препарата в 1975 г. EGF присутствует в клетках всех тканей организма, регулирует рост клеток. Специфически связывается с рецепторами на поверхности клеточных мембран, стимулирует таксис противовоспалительных клеток, а также модулирует пролиферацию и дифференциацию восстанавливающихся после повреждения клеток, особенно эпидермоцитов, что способствует быстрому и качественному заживлению ран (Andree C, Swain WF, Page CP, et al., 1994; Blumenfeld I., Ullmann Y., Laufer D., Livne E., 2000). Кроме того, эпидермальный фактор роста стимулирует пролиферацию фибробластов и влияет на продукцию ими простагландинов, протеогликанов, коллагена, ростовых факторов и ряда цитокинов, включая колониестимулирующие факторы, интерлейкины и интерферон (Zhang L. et al., 2006; Yang J., 2007).
В нормальных условиях содержание этого фактора роста в организме человека относительно невелико и стабильно. Но при повреждениях в ране возрастает количество рецепторов, чувствительных к эпидермальному фактору роста, благодаря этому повышается концентрация EGF, который стимулирует пролиферацию и дифференцирование оставшихся на поверхности ран или в ее краях кератиноцитов. Интересно, что кератиноциты продуцируют неактивную форму цитокина, и лишь в случае поражения кожи образующиеся при этом раневые протеазы превращают неактивную форму вещества в активную (Yang J., 2007). В тоже время при различных заболеваниях, анемии, инфекции, истощении достаточного количества EGF не вырабатывается, поэтому заживление повреждений происходит гораздо дольше и значительно менее эффективно. В тоже время дополнительное использование EGFпозволяет удовлетворить потребности тканей в этом веществе, что подтверждают клинические испытания (Marikowsky M, Breuing K, Liu PY, et al., 1992; Vogt PM,Thompson S, Andree C. et al., 1994).
В настоящее время предпринимаются активные попытки включения ростовых факторов в состав лечебных препаратов. В препарате “Hebermin”(Куба) содержится эпидермальный фактор роста в сочетании с сульфадиазином серебра. Включение фактора роста эпидермиса (EGF) в состав крема, по данным Borges et al. (1994), приводило к снижению времени заживления глубоких ожогов дермы у детей с 15,9±0,6 до 10,6±3,1 дня по сравнению с группой с применением только сульфадиазина серебра.
Группа японских биоинженеров (Kiyohara Y. Et al., 1993) разработала мазевую повязку, содержащую наряду с EGF ингибитор протеаз под названием «Нафамостат». На основании исследований авторы пришли к выводу о выраженном цитопротективном и стимулирующем заживление действии повязки и о перспективности дальнейших исследований в этом направлении. Кроме того, было показано, что ингибитор протеаз нивелирует катаболический эффект при массивных ожогах, помогая их заживлению.
В литературе встречаются также данные об успешном применении фактора роста фибробластов (Mellin T.N., Mennie R.J., Chashen D.E. et al, 1992; Косов И.С., 1994; Парамонов Б.А. и соавт., 2000; Назаренко Н.Г., 2002).
В тоже время, имеются работы, в которых применение ростковых факторов при лечении длительно существующих ран не показало достоверных отличий по сравнению с традиционными методами (Harris I.R., 1995). Кроме этого, при местном использовании часть препарата может всасываться в системный кровоток. А известно, что EGF является мощным индуктором митотического деления клеток (Парамонов Б.А. и соавт., 2000) и, соответственно, может увеличивать риск развития опухолевого процесса.
В отдельных публикациях положительно оценивается эффективность использования клеточных технологий для лечения хронических ран. Ряд исследователей с успехом применяли культуру кератиноцитов для лечения трофических язв и длительно незаживающих ран (Leigh I. et al., 1987; Madden M. et al., 1986; Phillips T. et al., 1995). В1989 г. В.П.Туманов с соавт. впервые сообщили о применении культивированных аллофибробластов в лечении длительно незаживающих донорских ран. В диссертационном исследовании Ш.Р.Гурукова (1992), показано, что трансплантация культивированных аллофибробластов на такие раны, после безуспешного их предшествующего лечения практически всеми традиционными методами, в среднем, в течение 50±12 дней, приводила к заживлению этих ран уже через 6-8 суток. По данным Гаврилюка Б.К. соавт. (1998), при лечении длительно незаживающих ран, в том числе в амбулаторных условиях, хороший клинический эффект наблюдался при применении раневых пленочных покрытий «Биокол-1» и «Цитокол» с культурой аллофибробластов.
Однако многочисленные медикаментозные методы лечения полностью не решают проблему лечения длительно существующих и вялогранулирующих ожоговых ран (M.D.Pinnegar et al., 1986; Н.И.Атясов с соавт., 1989). В связи с этим используются дополнительные физические методы воздействия на рану: световое и лазерное излучение, низкочастотный ультразвук, воздействие постоянным и импульсным электрическим током (Сиджанов Ж.М.Сиджанов с соавт., 1978; A.T.Barker, 1986; Гогия Б.Ш., 1990; Lembelembe J-P, 2010; Maillard H. Et all., 2010), лечение ран «отрицательным давлением» и др.
Электростимулирующая терапии осуществлялась с использованием на ранах углеродсодержащих повязок (АУТ-М2, Карпема), обладающих хорошей токопроводностью (Гогия Б.Ш., 1990).
В лечении больных с длительно-незаживающими ранами и трофическими язвами, возникшими после ожоговой травмы, также применяли комплексную терапию, заключающуюся в использовании озона, озонированного 0,9% раствора натрия хлорида, масла шиповника, облепихи и преобразованного красного света «Полисветан» (Гречко В.Н., Гречко Г.В., 2004). Применение такой методики, по данным авторов, позволило активно бороться с раневой микрофлорой. Очищение ран и трофических язв от гнойно-некротических тканей в основной группе происходило на 5-6 сутки после начала лечения, в то время как в контрольной группе это происходило на 18-20 сутки. Полное заживление раневой поверхности у больных основной группы происходило на27-32 сутки, а в контрольной группе эти сроки составили 58-62 дня.
Последнее время за рубежом и в России проводятся исследования возможности и эффективности вакуумной терапии при лечении ран различной этиологии, в том числе при подготовке глубоких ожоговых ран к операции (Schintler M.V. et all., 2006;Tamir J. et all., 2006; Stremitzer S. et all., 2006; Matzi V. et all., 2006; Simek M. et all., 2006). Имеются клинические данные, подтверждающие эффективность метода вакуум-терапии для лечения хронических ран (Сафронов А.А., 1962; Клецкин З.С., 1963; Чернавский В.А., Миразимов Б.М., 1970; Синявский М.М., 1973; Cozart R.F. et all., 1999;Ferreira M.C. et al., 2003; Kopp J. et al., 2004). Используемый метод вакуум-терапии положительно влияет на хроническую рану за счёт удаления избыточной тканевой жидкости из интерстиция тканей раны, позитивного изменения кровообращения с раскрытием капиллярного звена микроциркуляторного русла, что способствует улучшению окислительно-восстановительных процессов как в ране, так и в пересаженных кожных трансплантатах. (Ларичев А.Б., 2003; Nakayama Y. et al., 1990;Webb L.X., Schmidt U., 2001; Evans D., Land L., 2001). По данным проведенных исследований (Ларичев А.Б., Антонюк А.В., Кузьмин В.С., 2007; Антонюк А.В., 2007), использование в комплексе лечебных мероприятий серийной вакуумной обработки хронической раны позволяло очистить раневую поверхность от некрозов в 2 раза быстрее по сравнению с традиционным лечением, при этом достигалось объективное уменьшение её бактериальной обсеменённости, что позволило добиться полного заживления раневых дефектов в 85,4% клинических наблюдений, в остальных случаях достигалась готовность раневой поверхности к аутодермопластике.
Также эффективно применение низкочастотного ультразвука для кавитации хронических ран, позволяющее совместить процесс механической очистки и его антибактериальное действие (В.Н.Храмилин, 2005).
Дополнительное использование физических методов на всех этапах лечения хронических длительно существующих ран позволяет вмешаться в течение раневого процесса и разорвать «порочный» круг патологических реакций, составляющих основу пролонгированного существования локального воспаления, что способствует привлечению в зону воспаления макрофагов, которые участвуют в очищении раны от дегенеративных клеток, девитализированных тканей и продуктов жизнедеятельности микроорганизмов. Усиленный фагоцитоз сопровождается увеличением в тканях раны кислой фосфомоноэстеразы, а в крови количества нормальных антител (Ларичев А.Б., 2003). Кроме того, объясняя клиническую эффективность физических методов, стоит иметь в виду, что любое раздражающее ткань воздействие способствует повышению окислительных процессов в ней и способствует ускорению её заживления (Ф.Бриккер с соавт., 1926-1935).
В тоже время понятно, что медикаментозные и физические методы стимуляции заживления ран будут наиболее эффективны только при своем комплексном воздействии вместе с активным местным и общим лечением. Однако данные об эффективности такого комбинированного применения раневых повязок, местных антибактериальных препаратов и факторов стимуляции ограничиваются в основном отдельными диссертационными исследованиями, в которых представлены различные сочетания средств и методов воздействия. В тоже время они по ряду причин не находят в дальнейшем широкого клинического применения.
В заключение следует заметить, что ускорить сроки заживления ран невозможно, т.к. скорость деления клеток строго лимитирована, реально только создать оптимальные условия для их заживления в оптимальные сроки, а при глубоких, особенно обширных, ранах основным все-таки является хирургический метод лечения. В тоже время задержка процесса заживления ран и его искажение могут быть обусловлены множеством эндогенных и экзогенных факторов, в том числе нерациональным местным лечением. В связи с этим при лечении раны должны быть соблюдены следующие условия: удержание раневого процесса в естественно-биологическом русле и устранение отрицательного влияния различных факторов (инфекция, нежизнеспособные участки в ране, гематомы и т.д.) на заживление раны (Гостищев В.К., 2001; Назаренко И.Г. с соавт., 2002). В этом контексте местное использование стимуляторов регенерации является весьма перспективным. Поэтому необходимо продолжать исследования по изучению возможности и эффективности их применения. В частности, нами изучена эффективность местного применения некоторых стимуляторов регенерации ран у пострадавших от ожогов.
Изучение эффективности эпидермального фактора роста. Проведенные в ходе ограниченного клинического применения клинико-лабораторное изучение рекомбинантного эпидермального фактора роста (EGF) — препарата Gene Time в видеспрея для местного лечения остаточных длительно существующих ран у 5 обожженных показали его стимулирующие влияние на эпителизацию небольших ожоговых ран, что, кроме клинических данных, подтверждают цитологические исследования раневых отпечатков в динамике.
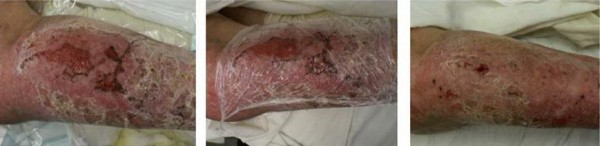
При стандартном применении препарата Gene Time на марлевых салфетках отмечено его впитывание в повязку и высыхание, а удаление такой повязки приводило к травмированию новообразованного эпидермиса. Поэтому наилучший эффект наблюдался при применении препарата Gene Time под окклюзирующими пленочными повязками (см. рис 1).
Рис. 1 Применение рекомбинантного эпидермального фактора роста (препарат GeneTime) в комплексе с пленочными повязками для длительно существующих ожоговых ран.
В целом при использовании препарата Gene Time раны быстрее, чем в сравниваемой группе при использование повязок с мазью на водорастворимой основе Левомеколь, переходили в 3 фазу раневого процесса (на 3,4±0,6 и 4,6±0,8 сутки лечения соответственно), при этом полная эпителизация небольших до 2 см в диаметре ран наблюдалась в среднем на 10,5±2,5 и 12,3±2,9 сутки после его начала соответственно, а площадь более обширных ран значительно сократилась за счет активной краевой эпителизации.
При цитологическом исследовании раневых отпечатков у больных обеих сравниваемых групп с остаточными ожоговыми ранами до начала лечения определялся воспалительный (40%) и воспалительно-регеренаторный (60% случаев) типы цитограмм. На фоне лечения повязками с Gene Time на 7 сутки тип цитограммы сменялся на воспалительно-регенераторный в 80% случаев и регенераторный в 20%. При этом в сравниваемой группе в те же сроки, сохранялись те же типы цитограммы, что и до лечения
При оценке отдельных клеток в раневых отпечатках получено, что в отношении нейтрофилов, лимфоцитов, моноцитов и полибластов динамика в обеих сравниваемых группах была сопоставимой. Особенностью цитологической картины при лечении препаратом Gene Time остаточных длительно существующих ожоговых ран в отличие от сравниваемой группы являлось быстрое появление и преобладание в ране макрофагов и фибробластов (табл. 1), в тоже время разница в значении их показателей была недостоверной (р>0,05).
Характеристика изменений клеточного состава раневых отпечатков на фоне лечения у больных в основной и сравниваемой групп