стилл синдром что это
Нарушение мозгового кровообращение при окклюзии артерии руки
В отделение рентгенэндоваскулярной хирургии Инновационного сосудистого центра скорой помощью был доставлен пациент 1976 г.р., который спеша на работу утром, трижды упал на остановке без сознания. При обследовании на месте бригада СМП не обнаружила пульсации на артериях левой руки пациента и экстренно госпитализировала его в наш сосудистый центр.
В приемном покое пациент был в сознании и обращал внимание на появление головокружения, особенно при физической нагрузке последние несколько месяцев. Эпизод потери сознания возник впервые. При обследовании отмечалась существенная разница артериального давления на правой и левой руках. 140/90 мм.рт.ст справа и 70/50 мм.рт.ст слева. При УЗИ брахиоцефальных артерий выявлена окклюзия левой подключичной артерии, которая подтвердилась и при ангиографическом исследовании. Так же удалось определить, что донором позвоночной и подключичной артерии является левая сонная артерия. Учитывая интраоперационные находки, пациенту сразу же предложено выполнить стентироание левой подключичной артерии и восстановить магистральный кровоток. Операция стентирования выполнялась под местной анестезией через пункцию (прокол 2 мм) в правой бедренной артерии. Вмешательство длилось менее часа и прошло без осложнений. В зону поражения левой подключичной артерии заведен, позиционирован и имплантирован стент на баллоне. Магистральный кровоток восстановлен. На следующие сутки при пробе с физической нагрузкой пациент не отмечал никаких неврологических нарушений, и выписан на амбулаторное долечивание с рекомендациями.
Через закрытый участок подключичной артерии проведен стент на баллоне
Окклюзию удалось преодолеть с помощью специального проводника и установить стент на баллоне.
Ангиография после стентирования
Стрелкой показана открытая подключичная артерия. Стент отлично раскрылся и поддерживает просвет сосуда.
Кровоток по позвоночной артерии в сторону мозга
При синдроме обкрадывания рука кровоснабжается через позвоночную артерию. Кровоток из мозга течет в руку. С этим и связан эпизод потери сознания при физической нагрузке. Теперь кровоток идёт правильным путём из подключичной артерии в головной мозг, а не в обратном направлении.
Стилл синдром что это
ГАУЗ АО «Амурская областная клиническая больница», Благовещенск, Россия; ГБОУ ВПО «Амурская государственная медицинская академия», Благовещенск, Россия
Синдром позвоночно-подключичного обкрадывания
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(1): 72-77
Заваруев А. В. Синдром позвоночно-подключичного обкрадывания. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(1):72-77.
Zavaruev A V. Subclavian steal syndrome. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2017;117(1):72-77.
https://doi.org/10.17116/jnevro20171171172-77
ГАУЗ АО «Амурская областная клиническая больница», Благовещенск, Россия; ГБОУ ВПО «Амурская государственная медицинская академия», Благовещенск, Россия
Приведен обзор литературы и обобщены данные по вопросам этиологии, клинической картины, диагностики и лечения синдрома позвоночно-подключичного обкрадывания. Описываются различные клинические варианты синдрома, его неврологические проявления. Для диагностики синдрома и его причин важное значение имеет не только ультразвуковое исследование, но и применение мультиспиральной компьютерной ангиографии. Для более точной диагностики и профилактики периоперационных осложнений необходимо применение других методов исследования. В выборе оптимального способа хирургического лечения обязательно учитывают характер поражения подключичных артерий или брахиоцефального ствола.
ГАУЗ АО «Амурская областная клиническая больница», Благовещенск, Россия; ГБОУ ВПО «Амурская государственная медицинская академия», Благовещенск, Россия
У 15% больных симптомная церебральная ишемия обусловлена поражением подключичных артерий (ПКА) или брахиоцефального ствола (БЦС) с развитием синдрома позвоночно-подключичного обкрадывания (СППО) [1].
Феномен обкрадывания возникает при наличии двух сосудистых бассейнов с разным периферическим сопротивлением. К развитию позвоночно-подключичного steal-синдрома (англ.: «steal» — красть, воровать, грабить) приводят окклюзионно-стенотические поражения I сегмента ПКА или БЦС, в результате чего кровь по ипсилатеральной позвоночной артерии ретроградно течет в руку, обкрадывая головной мозг — вертебрально-базилярную систему (ВБС). При этом головной мозг может терять до 20% необходимого кровотока [2].
Согласно определению группы экспертов ВОЗ (1970), вертебрально-базилярная недостаточность (ВБН) — это «обратимое нарушение функций мозга, вызванное уменьшением кровоснабжения области, питаемой позвоночными и основной артериями». В соответствии с МКБ-10 ВБН находится под рубрикой G45.0 — «синдром вертебрально-базилярной артериальной системы».
Ишемия в ВБС может проявляться не только в виде обратимых транзиторных ишемических атак или хронической сосудисто-мозговой недостаточности, но и развития инсультов. В течение 5 лет у 30% пациентов с симптомами ВБН возникает инсульт [3]. Инсульты в ВБС на фоне СППО носят гемодинамический характер.
Формирование СППО возможно также при поражении БЦС, одновременном поражении первого сегмента ПКА и аномальном отхождении позвоночной артерии от дуги аорты [4, 5], окклюзии проксимальной части позвоночной артерии и первого сегмента ПКА [6]. Обкрадывание в таких случаях развивается через подключично-позвоночную коллатеральную сеть (ветви щито-шейного и реберно-шейного стволов). Окклюзия БЦС несет дополнительную опасность обкрадывания правого каротидного бассейна с развитием синдрома позвоночно-подключично-сонного обкрадывания [7—9]. У пациентов, перенесших маммарно-коронарное шунтирование, при стенозе или окклюзии первого сегмента ПКА может развиваться синдром коронарно-подключичного обкрадывания через внутреннюю грудную артерию [2, 10, 11].
Впервые СППО описал L. Contorni в 1960 г. [12]. В 1961 г. C. Fisher [13] предложил устоявшийся термин СППО. В литературе СППО можно встретить также под названием «обратный синдром Робин Гуда». В 1965 г. J. Vollmar и соавт. [14] выделили четыре варианта обкрадывания при окклюзии первого сегмента ПКА: вертебрально-вертебральный, каротидно-базилярный, экстерно-вертебральный, сонно-подключичный. Наиболее частой причиной развития окклюзии или критического стеноза проксимального сегмента ПКА и других брахиоцефальных артерий являются атеросклероз, реже неспецифический аортоартериит [15—20], а также деформации проксимальных сегментов ПКА с формированием септального стеноза [21]. Атеросклеротические окклюзии и стенозы БЦС и ПКА возникают чаще в возрасте 50—60 лет. Левая ПКА страдает в 2—3 раза чаще, чем правая [22, 23].
В 70% случаев левая позвоночная артерия в 1,5—2 раза шире правой [24], являясь основным источником кровоснабжения задних отделов мозга, поэтому даже малейшее изменение кровотока по ней может приводить к расстройству во всей ВБС.
Сочетанное поражение позвоночной артерии и ПКА с развитием синдрома обкрадывания встречается в 6,1% случаев [25]. Поражение позвоночной артерии наиболее часто локализуется в начальном отделе V1 сегмента — в области устья [26]. Сопутствующий стеноз сонных артерий встречается у 82—84% пациентов с СППО [27]. Среди сочетанных гемодинамически значимых поражений каротидного бассейна наиболее часто встречается стеноз бифуркации общей сонной артерии [23, 28].
Разнообразие структур кровоснабжаемых ВББ и выполняемых ими функций обусловливает полиморфизм клинических проявлений ВБН. Хронические окклюзии артерий верхней конечности обычно бессимптомны из-за хорошего коллатерального кровотока на уровне плеча, а ВБН на начальных стадиях имеет множество клинических масок (шейный остеохондроз, заболевания внутреннего уха и др.) [18—20]. Симптомный стеноз первого сегмента ПКА встречается гораздо реже, чем при поражении сонной артерии. При этом симптомы со стороны верхней конечности возникают в 54% случаев, мозговая симптоматика — в 77% [29]. Асимптомное течение отмечается у 20% больных с изолированным поражением ПКА [30]. Стенозы ПКА могут осложняться дистальными атероэмболиями [31].
Клинически синдром обкрадывания проявляется симптомами ВБН. Клинические проявления ВБН могут включать признаки дисциркуляторной энцефалопатии, полушарную симптоматику в виде развития сенсорных и пирамидных нарушений (альтернирующий синдром), вестибулярных (атаксия, нистагм, интенционный тремор) и кохлеарных (одностороннее снижение слуха, шум в ухе), зрительных (выпадение полей зрения, фотопсии) симптомов, симптомов нарушения функции черепных нервов (стволовая симптоматика в виде глазодвигательных расстройств, периферический парез мимической мускулатуры, бульбарный и псевдобульбарный синдромы); характерны дроп-атаки (синдромы Унтернхарншейдта), синкопы, системное и несистемное головокружение. Возможны сопутствующие вегетативные проявления: тошнота, рвота, изменение артериального давления, частоты сердечных сокращений, гипергидроз [20]. Степень выраженности этих признаков зависит от локализации и размера очага ишемии, а также состояния коллатерального кровообращения [32]. Описан случай преходящей антеградной амнезии на фоне СППО [33].
СППО и симптомы ишемии головного мозга чаще выявляются у больных с сочетанным поражением ПКА и других брахиоцефальных артерий [30]. ВБН может протекать по тромбоэмболическому или гемодинамическому типу [34]. Выраженность клинических проявлений при тромбоэмболическом типе намного выше [35].
Изменение кровотока по позвоночной артерии не всегда ведет к ВБН за счет компенсированного кровотока по виллизиевому кругу замкнутого типа [36]. Функциональная неполноценность или разобщение виллизиева круга за счет отсутствия одной или двух передних или задних соединительных артерий может привести к развитию внутримозгового синдрома обкрадывания [37].
Субъективными признаками брахиальной ишемии являются зябкость, похолодание, онемение пальцев кисти, «перемежающаяся хромота» руки, на поздних стадиях развиваются боль в покое, трофические нарушения. Заподозрить наличие синдрома обкрадывания можно уже на этапе физикального обследования — различие артериального давления (АД) и пульса на обеих руках (вероятно полное их отсутствие), систолический шум над проекцией стенозированной ПКА [15, 38—40]. Градиент А.Д. на обеих руках более 20 мм рт.ст. говорит в пользу наличия СППО [41, 42].
Для диагностики ВБН могут использоваться функциональные пробы де Клейна, Хотана и др. Подтверждается СППО при ультразвуковом триплексном сканировании — коллатеральный тип кровотока дистальнее места поражения ПКА, а также постоянный или преходящий в фазу систолы ретроградный кровоток по позвоночной артерии на этой же стороне.
Тем не менее антеградный тип кровотока по позвоночной артерии при поражении первой порции ПКА не исключает наличие синдрома обкрадывания за счет хорошо развитой позвоночно-подключичной коллатеральной сети [43]. Чтобы выявить так называемый латентный синдром обкрадывания выполняют пробу с реактивной гиперемией — в момент декомпрессии плечевой артерии регистрируют ускорение кровотока в подключично-позвоночных ветвях и снижение в дистальных отделах (V4) позвоночной артерии.
В зависимости от результатов триплексного сканирования с тестом реактивной гиперемии различают три вида СППО [44]: 1) постоянный (при окклюзии или критическом стенозе устья ПКА или БЦС более 90%) — кровоток по позвоночной артерии имеет обратное направление, а тест реактивной гиперемии регистрирует стойкий усиленный ретроградный кровоток, сохраняющийся в течение нескольких секунд; 2) преходящий (при стенозе более 50%) — кровоток в позвоночной артерии имеет обратное направление только в фазу систолы, тест реактивной гиперемии показывает медленное восстановление исходной картины; 3) латентный (при стенозах менее 50%) — кровоток в позвоночной артерии антеградный, но изменен. Тест реактивной гиперемии в таких случаях показывает быстрое возвращение исходной допплерограммы.
Другим подтверждающим методом исследования является традиционная селективная рентгенконтрастная ангиография — заполнение пораженной ПКА через систему позвоночной артерии. Количество тяжелых осложнений при проведении этого исследования достигает 3,5%, летальность — 2,4% [45], а использование однопроекционной ангиографии в ряде случаев не позволяет достоверно определить степень стеноза. Для диагностики характера и детализации поражения, определения морфологии бляшки, состояния виллизиева круга в последнее время все чаще используют МСКТ-ангиографию, а применение ТКДГ помогает определить нарушение и резерв церебральной гемодинамики [46, 47].
Морфология атером играет значительную роль в развитии цереброваскулярных событий за счет микроэмболизации или острой окклюзии.
Комбинация МСКТ- и магнитно-резонансной ангиографии имеет большие возможности для определения морфологии атеросклеротических бляшек [1].
Для функциональной оценки мозгового кровообращения применяют динамическую ангиосцинтиграфию и допплерографию в сочетании с нагрузочной пробой, которая позволяет выявить функциональные нарушения церебрального кровообращения уже на ранних стадиях атеросклероза брахиоцефальных артерий и оценить эффективность хирургического лечения [48].
Описана [23] функциональная проба с дозированной физической нагрузкой, показывающая зависимость нарастания синдрома обкрадывания от объема физических нагрузок и доказывающая неуправляемость СППО.
Для оценки кислородного статуса головного мозга возможно применение церебральной оксиметрии с расчетом коэффициента экстракции кислорода и пробой с задержкой дыхания [49].
В случаях сочетанных поражений брахиоцефальных артерий определение наиболее гипоперфузируемой зоны головного мозга возможно благодаря МРТ- или КТ-перфузии [50]. Идеальным диагностическим методом выявления недостаточности мозгового кровотока признано исследование фракции экстракции кислорода с помощью позитронно-эмиссионной томографии. Использование МСКТ и МРТ является ведущим в диагностике острых нарушений мозгового кровообращения [50].
Наличие даже асимптомного СППО в силу непредсказуемого течения является абсолютным показанием к операции [23, 30, 51]. С 1980 г. в мире для лечения больных СППО применяют эндоваскулярные способы реканализации пораженного сегмента. Их неоспоримым преимуществом является малая инвазивность и травматичность [52—57]. Вероятность успешной эндоваскулярной реканализации снижается при наличии грубого атерокальциноза или окклюзии. Потенциал технического успеха реканализации окклюзий ПКА намного ниже, чем стенотических поражений [58]. Технический и ангиографический успех реканализации окклюзий БЦС и ПКА возможен в 57—96% случаев [54, 59—64]. Дополнительным негативным фактором является вариабельность анатомии позвоночно-подключичной артериальной зоны, сказываясь на результатах не только эндоваскулярных вмешательств, но и открытых реконструктивных операций. При наличии извитостей или вариантов отхождения ПКА и БЦС, не позволяющих подойти катетером к месту стеноза/окклюзии, в качестве операций выбора должны рассматриваться открытые вмешательства [59].
При патологии БЦС в качестве открытой операции обычно выполняют протезирование либо шунтирование БЦС непосредственно от дуги аорты. Доступ к стенозированному БЦС возможен из срединной стернотомии. Летальность при шунтировании БЦС находится в пределах 5,8—8% [65], а количество осложнений — 16,7% [56]. При этом 5-летняя проходимость шунтов составляет 94%.
Реконструкции ПКА могут выполняться как из грудного, так и шейного доступа. Более безопасным не только в плане летальности, но и ишемических осложнений считается шейный доступ [17, 59, 66, 67]. Летальность после операций на БЦС или ПКА, выполненных из грудного доступа, колеблется от 3 до 19% [59, 66, 68, 69].
При окклюзии ПКА предпочтение отдают реконструктивным операциям, при стенозах — эндоваскулярным [70, 71]. В случаях, когда при патологии ПКА выбирают открытую хирургическую тактику, методом выбора является сонно-подключичное шунтирование или сонно-подключичный анастомоз [23].
Сосудистые протезы, используемые для сонно-подключичного шунтирования, характеризуются отличной проходимостью [72]. Послеоперационная летальность составляет менее 1%, с 95% первичной 10-летней проходимостью шунтов [73]. В качестве пластического материала используют протезы из политетрафторэтилена, дакрона, реже аутовену. Во время пережатия сонной артерии рекомендуется прекращать обкрадывание ВБС путем пережатия позвоночной артерии или 2-го сегмента ПКА [74].
Подключично-сонный анастомоз, впервые выполненный в 1964 г. J. Parrot, является отличным методом лечения, но требует более широкого доступа в области шеи и невозможен без применения дополнительных эксплантов при пролонгированных поражениях с переходом на второй сегмент ПКА. Послеоперационная летальность при этом составляет менее 1%, а проходимость анастомоза в отдаленном периоде достигает 96—100% [75—77]. Некоторые авторы [30, 59, 78—80] считают, что транспозиция ПКА в общую сонную артерию имеет ряд преимуществ перед сонно-подключичным шунтированием.
Различные варианты экстраанатомического перекрестного шунтирования применяются редко ввиду большей длины шунта, противоположной направленности кровотока в донорской артерии, физического дискомфорта и возможно предстоящей в будущем операции аорто-коронарного шунтирования.
Некоторые сторонники шунтирующих операций наряду с сонно-подключичным шунтированием говорят о хорошем эффекте сонно-подмышечного [81].
Редким вариантом реконструктивной операции при патологии первого сегмента ПКА и достаточном диаметре вертебральной артерии является сонно-позвоночный анастомоз «бок в бок» [82].
Частота развития рестенозов и реокклюзий ПКА и БЦС после эндоваскулярного вмешательства составляет от 7,3 до 29,8% [59, 60]. Непосредственные и отдаленные результаты открытых и эндоваскулярных вмешательств на БЦС статистически не различаются [83]. Первичная и 5-летняя проходимость ПКА после стентирования достигает 80—100%, а после баллонной ангиопластики — лишь 54%, причем при стенозах она выше [60, 84—87]. Для превертебрального сегмента ПКА лучше использовать баллонорасширяемые стенты, для поствертебрального — самораскрывающиеся [2, 54, 88, 89]. При стентировании устья ПКА стент должен выступать в просвет аорты на 2 мм и не перекрывать устья позвоночной и внутренней грудной артерии.
Интервенции являются операцией выбора при проксимальных поражениях ветвей дуги аорты [17, 84, 89, 90]. Некоторыми авторами отмечено [91—93], что результаты операции сонно-подключичного шунтирования в отдаленном периоде лучше, чем стентирования ПКА.
В настоящее время с целью уменьшения частоты реокклюзий и рестенозов после стентирования рекомендуется двухкомпонентная антиагрегантная терапия. При эндовмешательствах на БЦС необходимо использовать дистальные устройства для защиты головного мозга от микроэмболии. Вероятность церебральных эмболических осложнений при выполнении эндоваскулярных операций на левой ПКА при наличии реверсивного кровотока по позвоночной артерии минимальна [88].
В большинстве случаев для стентирования брахиоцефальных артерий используется трансфеморальный доступ. При выраженном поражении аорто-подзвдошно-бедренного сегментов, их деформации или извитости, а также окклюзии ПКА от устья используются ретроградные (лучевой, локтевой, плечевой, подмышечный) либо комбинированные доступы. Наиболее предпочтителен доступ через плечевую артерию. Подмышечную артерию труднее пунктировать и тяжелее достичь эффективной постпункционной компрессии. Вероятность ятрогенной окклюзии артерий предплечья выше, чем плечевой. Однако в случае окклюзии одной из артерий предплечья, при положительном тесте Аллена, вторая будет компенсировать кровообращение в кисти [88]. Для проведения пробы Аллена одномоментно пережимают лучевую и локтевую артерии, при этом больного просят сжать руку в кулак, затем отпускают одну из артерий. Если в течение 5—10 с появилась реактивная гиперемия, тест считается нормальным. Выполнение стентирования из радиального доступа является безопасной методикой [94].
Решение вопроса об объеме и первоочередности оперативного лечения при сочетанном лечении брахиоцефальных артерий является одной из важнейших задач в хирургии ишемической болезни головного мозга. При сочетанном поражении первого сегмента позвоночной артерии и ПКА одномоментное эндоваскулярное вмешательство приводит к лучшему клиническому результату [95]. При сочетанном поражении контралатеральной сонной артерии первым этапом реконструируют ее, при гомолатеральной локализации рекомендуется одномоментная коррекция кровотока, так как реваскуляризация только ВБС приводит к обкрадыванию каротидного бассейна [30, 51, 96, 97]. Одномоментную реконструкцию безопаснее выполнять в случае возможности одного хирургического доступа и наличия высокой толерантности головного мозга к пережатию сонной артерии [98].
Болезнь Стилла
Болезнь Стилла — тяжелое заболевание, проявляющееся лихорадкой, полиартритом. Преходящими высыпаниями на коже и системным воспалительным поражением соматических органов. Болезнь Стилла диагностируется с применением методики исключения других заболеваний на основании клинических симптомов, лабораторных данных, результатов исследования пораженных суставов, лимфоретикулярной и сердечно-легочной системы. Лечение болезни Стилла проводят в основном нестероидными противовоспалительными и глюкокортикоидами, препаратами резерва являются цитостатики.
Общие сведения
Болезнь Стилла была описана еще в 1897 году британским врачом Джорджем Стиллом. Долгое время она считалась тяжелой формой ювенильной формы ревматоидного артрита. Лишь в 1971 году Эриком Байуотерсом были опубликованы многочисленные наблюдения этого заболевания у взрослых пациентов. Согласно статистике, которую приводит современная мировая ревматология, распространенность болезни Стилла в последнее время составляет примерно 1 человек на 100 тыс. населения. Лица женского и мужского пола одинаково подвержены заболеваемости. Наибольшее число случаев болезни Стилла приходится на детей в возрасте до 16 лет.
Из-за отсутствия специфических симптомов заболевания, пациентам с болезнью Стилла зачастую, несмотря на отрицательные результаты бактериологических посевов крови, ставят диагноз «сепсис», по поводу которого они проходят неоднократные курсы антибиотикотерапии. Отмечено, что около 5% случаев болезни Стилла первоначально трактуются врачами как «лихорадка неясного генеза».
Причины возникновения болезни Стилла
Многочисленные исследования в области этиологии болезни Стилла так и не дали ответа на вопрос о ее причинах. Внезапное начало, высокая лихорадка, лимфоаденопатия и лейкоцитоз крови указывают на инфекционный характер заболевания. Однако единый возбудитель пока не выявлен. В отдельных случаях болезни Стилла у пациентов был выявлен вирус краснухи, в других — цитомегаловирус. Наблюдались случаи заболевания ассоциированные с вирусом парагриппа, вирусом Эпштейна-Барра, микоплазмой, эшерихиями.
Нельзя исключить наличие наследственной предрасположенности к развитию болезни Стилла. Но окончательные результаты, подтверждающие связь заболевания с локусами HLA, пока не получены. Иммунологическая теория, относящая болезнь Стилла к аутоиммунным заболеваниям, подтверждается лишь в некоторых случаях, когда у больных обнаруживаются ЦИК, обуславливающие развитие аллергического васкулита.
Симптомы болезни Стилла
Лихорадка при болезни Стилла отличается подъемом температуры до высоких цифр (39°С и выше). В отличие от большинства инфекционных заболеваний она не является постоянной. Наиболее характерен одноразовый подъем температуры в течение суток, обычно в вечернее время. Реже наблюдаются 2 температурных пика за сутки. У большинства больных температура между пиками снижается до нормальных цифр, что сопровождается значительным улучшением общего состояния. Примерно у 20% пациентов с болезнью Стилла нормализации температуры тела не происходит.
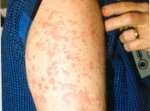
Высыпания при болезни Стилла, как правило, возникают на высоте подъема температуры тела и носят приходящий характер: то исчезают, то появляются вновь. Элементы сыпи представлены в основном плоскими розовыми пятнами (макулами) или папулами, расположенными в проксимальных отделах конечностей и на туловище, реже — на лице. В 30% случаев болезни Стилла высыпания возвышаются над общей поверхностью кожного покрова и возникают в местах травмирования или сдавления кожи (феномен Кебнера). Иногда они сопровождаются зудом. Розовый цвет сыпи, ее периодическое исчезновение и отсутствие субъективных ощущений часто делают высыпания незаметными для пациентов. В некоторых случаях для выявлении сыпи врачу приходится осматривать пациента сразу после теплого душа или прибегать к тепловому воздействию на кожу, например, путем наложения теплых салфеток. Встречаются атипичные кожные проявления болезни Стилла: петехиальные кровоизлияния, узловатая эритема, алопеция.
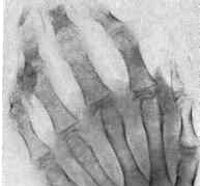
Суставной синдром. Артралгии, наряду с миалгиями, в начале болезни Стилла относят к общим проявлениям заболевания, обусловленным высоким подъемом температуры. На начальном этапе артрит может поражать лишь один сустав. Затем поражение принимает характер полиартрита с вовлечением голеностопных, коленных, лучезапястных, локтевых, тазобедренных, височно-челюстных, межфаланговых, плюсне-фаланговых суставов. Наиболее типичным для болезни Стилла является развитие артрита межфаланговых дистальных суставов кисти. Эта особенность позволяет дифференцировать заболевание от ревматоидного артрита, ревматической лихорадки, системной красной волчанки, для которых не характерно поражение этих суставов в молодом возрасте.
Поражение лимфоретикулярных органов включает гепатоспленомегалию и лимфаденопатию. У 65% заболевших болезнью Стилла наблюдается лимфаденит. В половине случаев заболевания наблюдается увеличение шейных лимфоузлов. Увеличенные лимфоузлы при болезни Стилла сохраняют свою подвижность, имеют умеренно плотную консистенцию. Выраженное уплотнение лимфатического узла, его изолированное увеличение или спаянность с окружающими тканями должны настораживать в онкологическом плане. В атипичных случаях лимфаденит может принимать некротический характер.
Боль в горле беспокоит 70% пациентов с болезнью Стилла и проявляется обычно в начале заболевания. Она характеризуется выраженным жжением в горле и носит постоянный характер.
Сердечно-легочные проявления болезни Стилла наиболее часто носят характер серозита: плеврита и/или перикардита. В 20% случаев наблюдается асептический пневмонит, зачастую протекающий с симптомами двусторонней пневмонии (кашель, одышка, высокая температура), которые не проходят на фоне интенсивной антибиотикотерапии. К более редким поражениям, встречающимся при болезни Стилла, относятся: миокардит, тампонада сердца, появление клапанных вегетаций с клинической картиной инфекционного эндокардита, респираторный дистресс-синдром.
Диагностика болезни Стилла
Отсутствие специфических диагностических признаков болезни Стилла делают ее диагностику затруднительной для ревматолога, требующей определенного периода наблюдения пациента и часто основанной на исключении других заболеваний. В клиническом анализе крови отмечается выраженный лейкоцитоз и ускоренное СОЭ. У подавляющего большинства пациентов с болезнью Стилла СОЭ выше 50 мм/ч. В биохимическом анализе крови выявляется повышенный уровень белков, характерных для острой воспалительной фазы: СРБ, ферритина, сывороточного амилоида А. При этом, не смотря на типичные для болезни Стилла клинические признаки выраженного системного воспаления, в крови не обнаруживаются ревматоидный и антинуклеарный фактор, а бакпосев крови на стерильность дает отрицательный результат. Биохимические пробы печени показывают увеличение активности ее ферментов.
Рентгенологическое исследование суставов выявляет выпот в полости сустава, отечность мягких тканей, реже — остеопороз образующих сустав костей. У пациентов с хронической формой болезни Стилла типичным является наличие анкилозов в суставах запястья. При проведении пункции суставов получают асептическую синовиальную жидкость с воспалительными изменениями.
При необходимости пациентам с болезнью Стилла проводится биопсия лимфатического узла, позволяющая исключить его злокачественное метастатическое поражение. Сердечно-легочные проявления болезни Стилла требуют консультации кардиолога и пульмонолога, проведения рентгенографии легких, УЗИ плевральной полости, ЭКГ, УЗИ сердца и т. п. Дифференциальный диагноз болезни Стилла проводят с ревматоидным артритом, псориатическим артритом, дерматомиозитом, лимфомой, туберкулезом, саркоидозом, гранулематозным гепатитом, инфекционным эндокардитом, системными васкулитами и др.
Лечение болезни Стилла
В остром периоде для 25% пациентов достаточно назначения препаратов из группы нестероидных противовоспалительных. Их прием в зависимости от клиники болезни Стилла занимает от 1 до 3 месяцев. Изменения со стороны сердца и легких являются показанием к глюкокортикостероидной терапии препаратами преднизолона или дексаметазона. Однако эти препараты не всегда оказывают достаточный эффект. При хроническом течении болезни Стилла для уменьшения дозы кортикостероидов может применяться метотрексат. Препаратом резерва для пациентов с тяжелыми формами заболевания может являться циклофосфамид. В отдельных, резистентных к традиционному лечению случаях болезни Стилла, возможно применение инфликсимаба и этанерцепта.
Прогноз болезни Стилла
Исходом болезни Стилла может быть спонтанное выздоровление, переход в рецидивирующую или хроническую форму. Выздоровление наступает у 1/3 больных, обычно в течение 6-9 месяцев от начала заболевания. Рецидивирующее течение болезни Стилла у 2/3 пациентов характеризуется возникновением лишь одной атаки (обострения) заболевания, которая может случиться в период от 10 мес до 10 лет. У незначительной части пациентов наблюдается циклическое рецидивирующее течение заболевания с повторными атаками. Наиболее тяжелой является хроническая форма болезни Стилла, протекающая с выраженным полиартритом, приводящим к ограничению движений в суставах. Причем, ранее появление симптомов артрита является неблагоприятным прогностическим признаком.
Среди взрослых пациентов с болезнью Стилла пятилетняя выживаемость сравнима с таковой при СКВ и составляет 90-95%. Больные могут погибнуть от вторичной инфекции, амилоидоза, печеночной недостаточности, нарушений свертывания, сердечной недостаточности, туберкулеза легких, респираторного дистресс-синдрома.