сплайсинг генов для чего
Cell Biology.ru
Справочник
Сплайсинг
| продукт гена | организм | длина экзонов, пн | ||
| число | общая длина, пн | |||
| аденозиндезаминаза | человек | 1500 | 11 | 30000 |
| аполипротеин B | человек | 14000 | 28 | 29000 |
| β-глобин | мышь | 432 | 2 | 762 |
| цитохром b | митохондрии дрожжей | 2200 | 6 | 5100 |
| дигидрофолатредуктаза | мышь | 568 | 5 | 31500 |
| эритропоэтин | человек | 582 | 4 | 1562 |
| фактор V[1] | человек | 9000 | 25 | 177000 |
| фиброин шелка | шелкопряд | 18000 | 1 | 970 |
| гипоксантин-фосфорибозилтрансфераза | мышь | 1307 | 8 | 32000 |
| α-интерферон | человек | 600 | 0 | 0 |
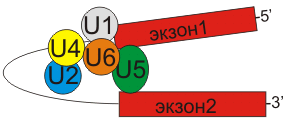
Сплайсосомы
рис.2 Консервативные последовательности в экзонах и интронах необходимые для сплайсинга.
рис.3 Сплайсосома и взаимодействие ее компонентов с экзонами и интронами РНК.
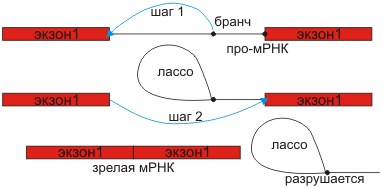
рис.4 Механизм удаления интронов.
Сплайсинг может иметь позитивную и негативную регуляцию. При позитивной регуляции из первичного транскрипта вырезается интрон при действии белка активатора. При негативной первичный транскрипт не подвергается сплайсингу при действии
белка репрессора.
Транс-сплайсинг
Альтернативный сплайсинг
mРНК кальцитонинового гена у млекопитающих (крыса)
Сплайсинг осуществляется белковыми комплексами – сплайсосомами-ферменты, вырезающие и сшивающие участки про-mРНК, белки, придающие про-mРНК нужную конформацию, sPНК. Сплайсосома связана с ферментами полиаденилирования.
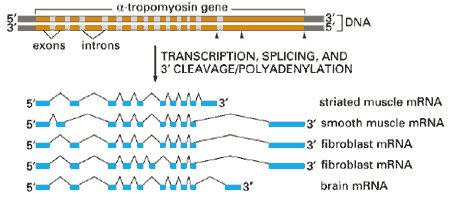
рис. Схема образования различных мРНК из
одного тропомиозинового гена в различных клетках.
Автосплайсинг
Small nuclear RNAs (snRNAs), ranging in size from about 80 to 350 nucleotides, are ubiquitous components of eukaryotic cells. The U (uridine-rich) family of snRNAs are thought to be important for RNA splicing and have been highly conserved in evolution. They are associated with specific polypeptides, forming small nuclear ribonucleoprotein complexes (snRNPs). These are often targets of the autoimmune disorder systemic lupus erythematosus. The polypeptide associated with U1 snRNA appears to be unique (Wooley et al., 1983). Multigene families for human U1, U2, U3, U4 and U6 snRNAs have been demonstrated. Transcription of U1-U5 RNAs is accomplished by RNA polymerase II, whereas U6 snRNA is thought to be transcribed by RNA polymerase III. Kunkel and Pederson (1988) studied the upstream regulatory elements for the human U6 RNA gene and found a marked similarity to the proximal control elements of U1 and U2 snRNA genes, despite the transcription by different polymerases. Most of the human genes complementary to these snRNAs are pseudogenes, which are dispersed in the genome. Although most of the U1 genes are on chromosome 1, they probably are separated by intergenic spacer regions larger than 15 kb, because none of the recombinant phages isolated to date contains more than one U1 gene. By way of contrast, U2 snRNA genes are organized as a nearly perfect tandem array of 10 to 20 copies per haploid genome (Van Arsdell and Weiner, 1984). Bostock et al. (1984) concluded that the genes for human U1 snRNA are clustered on the short arm of chromosome 1. By somatic cell hybrid studies, Naylor et al. (1984) found that RNU1 segregated with PEPC (170000) and AK2 (103020), chromosome 1 markers. By in situ hybridization, they showed that most of the grains were concentrated in band 1p36.3. By in situ hybridization, Lindgren et al. (1985) found that the U1 snRNA pseudogenes (called class I) are coded in a cluster in 1q12-q22, separate from the true genes (in about 30 copies) in 1p36. Bernstein et al. (1985) presented evidence in support of the idea that the true U1 genes were derived by gene amplification and transposition from a more ancient family of U1 genes (represented now by class I U1 pseudogenes). The clustering of both U1 true genes and pseudogenes and the conservation of at least 44 kb of DNA flanking the U1 coding region in a large fraction of the 30 true U1 genes
are explained by gene amplification.
Pseudogenes for U1 snRNA outnumber the true genes by 15- to 30-fold. Some of the pseudogenes have no flanking homology to the true genes, but others, the class I pseudogenes, share several kilobases of flanking homology. Lindgren et al. (1985) noted that the site of the U1 pseudogenes corresponds to a site of chromosomal modification by adenovirus-12. They postulated that class I U2 pseudogenes may be affected by the virus because they retain flanking regulatory sequences.
Сплайсинг
Сплайсинг (от англ. splice — сращивать или склеивать концы чего-либо) — процесс вырезания определенных нуклеотидных последовательностей из молекул РНК и соединения последовательностей, сохраняющихся в «зрелой» молекуле, в ходе процессинга РНК. Наиболее часто этот процесс встречается при созревании информационной РНК (мРНК) у эукариот, при этом путём биохимических реакций с участием РНК и белков из мРНК удаляются участки, не кодирующие белок (интроны) и соединяются друг с другом кодирующие аминокислотную последовательность участки — экзоны. Таким образом незрелая пре-мРНК превращается в зрелую мРНК, с которой считываются (транслируются) белки клетки. Большинство генов прокариот, кодирующих белки, не имеют интронов, поэтому у них сплайсинг пре-мРНК встречается редко. У представителей эукариот, бактерий и архей встречается также сплайсинг транспортных РНК (тРНК) [1] и других некодирующих РНК.
Содержание
Введение
Работа Шарпа и Робертса, опубликованная в 1977 году, показала, что гены высших организмов имеют «прерывистую» структуру: кодирующие отрезки гена перемежаются с некодирующей ДНК, которая не используется при экспрессии генов. «Прерывистая» структура гена была обнаружена, когда аденовирусная мРНК была гибридизована с фрагментами одиночной цепи ДНК. В результате выяснилось, что мРНК-участки этих гибридных двухцепочечных молекул мРНК-ДНК содержат 5′- и 3′-концы участков, не обладающие водородными связями. Более длинные отрезки ДНК при гибридизации закольцовывались и образовывали ответвления. Стало ясно, что эти закольцованные участки, содержащие «ненужные» последовательности, извлекаются из пре-мРНК в результате процесса, который и был назван «сплайсингом». Впоследствии было также выяснено, что прерывистая структура крайне широко распространена у эукариотических генов.
Варианты сплайсинга
В природе обнаружены несколько вариантов сплайсинга. Какой из них будет проходить в каждом случае, зависит от структуры интрона и катализатора, необходимого для реакции.
Сплайсосомные интроны
Сплайсосомные интроны часто находятся в генах, кодирующих белки. Для сплайсинга необходимо наличие специальных 3′- и 5′ — последовательностей. Важная роль в защите 5′-конца мРНК от деградации экзонуклеазами принадлежит 5′-кэпу. Сплайсинг катализируется сплайсосомой — большим комплексом, состоящим из РНК и белков и включающим пять малых ядерных рибонуклеопротеидов (мяРНП). РНК-составляющая мяРНП взаимодействует с интроном и, возможно, участвует в катализе. Обнаружены два типа сплайсосом (главная и дополнительная), отличающиеся по входящим в их состав мяРНП.
Главная сплайсосома принимает участие в сплайсинге интронов, содержащих гуанин и урацил (GU) в 5′ сайте, и аденин и гуанин (AG) в 3′ сплайсинг-сайте. Она состоит из мяРНП: U1, U2, U4, U5 и U6.
Альтернативный сплайсинг
Показано, что у человека 94 % генов подвержено альтернативному сплайсингу (у остальных 6 % генов нет интронов). Геном круглого червя Caenorhabditis elegans по количеству генов практически не отличается от генома человека, однако альтернативному сплайсингу подвергаются пре-мРНК только 15 % генов. Таким образом, альтернативный сплайсинг позволяет увеличить разнообразие белковых продуктов генов, не увеличивая пропорционально этому размер генома, в том числе не создавая дополнительных копий генов. Биологический смысл альтернативного сплайсинга для многоклеточных эукариот состоит в том, что он, по-видимому, является ключевым механизмом увеличения разнообразия белков, а также позволяет осуществлять сложную систему регуляции экспрессии генов, в том числе тканеспецифической [4]
Белки против РНК — кто первым придумал сплайсинг?
Splice (англ.) — соединение двух отрезков верёвки или каната путём сплетения их концов (морской термин)
Автор
Редакторы
Белковым сплайсингом называется процесс, в результате которого внутренняя часть белка (интеин) пост-трансляционно вырезается, а фланкирующие ее последовательности (экстеины) лигируются. От обычного процессинга белковый сплайсинг отличается тем что он «самодостаточен» — не требует присутствия каких-либо кофакторов или ферментов. А необычное и сложное поведение самого интеина поражает и дает в руки биологов точный инструмент для исследований молекулярного мира белков.
Введение
В настоящее время кардинально меняются многие взгляды на основы жизни. Молекулярная биология — не исключение. Например, еще лет 10–15 назад термин «катализ» связывали исключительно с белками, а «сплайсинг» — с нуклеиновыми кислотами (в основном РНК). Однако постепенно стало понятно, что каждый класс макромолекул обладает намного большей функциональностью. Например, в 1982–1983 гг. было показано, что некоторые разновидности РНК, подобно белкам, обладают каталитической активностью (они получили название рибозимов). В последние годы было открыто, что некоторые малые РНК способны регулировать и даже блокировать экспрессию генов. А в 1990 г. было обнаружено явление белкового автосплайсинга — процесса, аналогичного сплайсингу РНК. С этого момента стало ясно, что канонические законы молекулярной биологии, недавно еще казавшиеся абсолютными и незыблемыми, отражают только наиболее общие принципы живого, и должны дополняться, исправляться, а иногда и заново переписываться.
Сплайсинг (от англ. to splice — сшивать, соединять) — это процесс дозревания молекул, в результате которого из предшественника удаляется внутренняя часть с последующим лигированием (т. е. образованием ковалентной связи) фланкирующих последовательностей (т. е. тех частей молекулы, что примыкали к концам удалённой внутренней части).
Сплайсинг нуклеиновых кислот является одним из мощнейших способов быстрой перетасовки наследственной информации, что в некоторых случаях помогает живым организмам быстро приспособиться к изменившимся условиям. Поэтому его обнаружение у белков еще раз подтвердило универсальный для всего живого принцип «разумной бережливости» — удачные процессы, характерные для одних типов молекул, часто обнаруживаются и у других (в данном случае — и у нуклеиновых кислот, и у белков).
Впервые белковый сплайсинг был открыт при исследовании дрожжевого гена VMA1, кодирующего субъединицу Vma1 вакуолярной ATФазы [1]. Оказалось, что в результате дозревания центральная часть белка удаляется, а фланкирующие ее последовательности лигируются («сшиваются» между собой). При этом для концевых последовательностей дрожжевого гена VMA1 характерна высокая степень гомологии с аналогичными последовательностями других микроорганизмов, тогда как в центральной части она нарушалась. Так стало ясно, что и у белков в некоторых случаях может происходить процесс, аналогичный сплайсингу пре-мРНК. Также как и в автосплайсинге РНК, для сплайсинга белков не требуются ни ферменты, ни кофакторы. По аналогии центральную часть белка (которая самовырезается) назвали интеином (от internal protein), фланкирующие последовательности — N- и С-экстеинами (external protein), а весь процесс — белковым сплайсингом [2] (рис. 1).
Рисунок 1. Схематическое строение основных типов интеинов. Сверху — Классический интеин, содержащий эндонуклеазный домен. Снизу — Мини-интеин. Консервативные аминокислотные остатки, необходимые для сплайсинга, обозначены однобуквенными аббревиатурами (один остаток с N-конца интеина и триада остатков — на стыке с C-конца и C-экстеина).
Структура интеинов
Условно интеины можно поделить на две большие группы — классические интеины и мини-интеины. Классический интеин состоит из двух доменов — сплайсингового домена, который как раз и катализирует вырезание интеина из белка-хозяина и последующее его сшивание (так сказать, «заметает следы»), и центрального эндонуклеазного домена (который может разрезать ДНК по определенным сайтам), обеспечивающего так называемый «хоуминг» интеина. Хоуминг — настолько интересный процесс, что подробнее мы его рассмотрим ниже. В двух словах скажем только, что он (хоуминг) отвечает за распространение гена интеина (что даже больше похоже на размножение, если б этот термин можно было применить к отдельному белку). Мини-интеины не имеют центрального эндонуклеазного домена и хоумингом не занимаются.
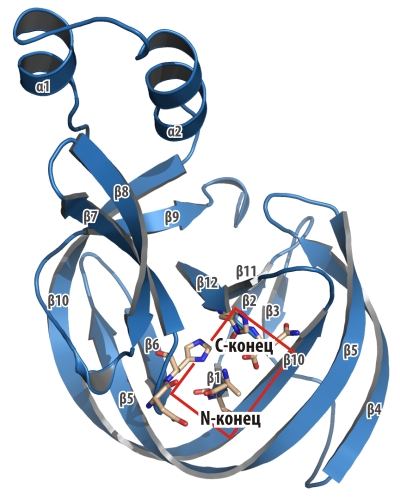
Эндонуклеазный и сплайсинговый регионы образуют в молекуле интеина два пространственно разделенных домена. Сплайсинговый домен образуется N- и С-концевыми частями интеина. Он имеет характерную подковообразную форму. Концы интеина жёстко зафиксированы друг напротив друга в пространстве, и по сути формируют активный центр (АЦ), очень похожий на АЦ трипсина или любой другой сериновой протеазы. Оба конца интеина, по которым происходит разрезание, находятся около АЦ (рис. 2).
Рисунок 2. Пространственная структура интеина (мини-интеин Mxe GyrA). Сближенные концы интеина обозначены квадратом. Изображение получено из PDB-структуры 1AM2.
Современные представления о механизме белкового сплайсинга
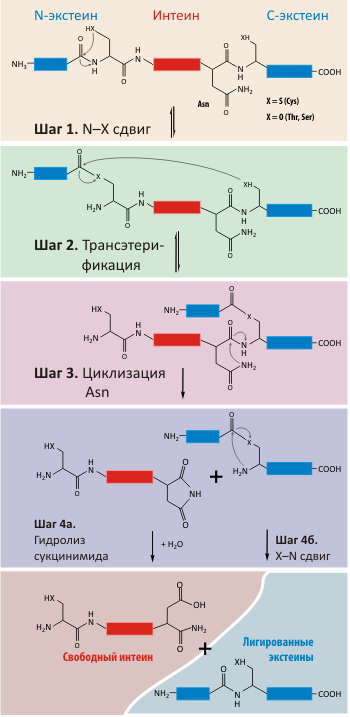
Многими исследователями было показано, что белковый сплайсинг является аутокаталитическим процессом и для своего осуществления не требует присутствия ферментов или кофакторов. Однако определить точный механизм сплайсинга белков долгое время не удавалось — процесс происходит очень быстро, и обычными методами обнаружить промежуточные соединения не представлялось возможным. Главная проблема заключалась в том, что интеин в составе белка нельзя было даже выделить — сплайсинг проходил сразу после синтеза белка, и пока клетки собирались и лизировались — следов уже не оставалось. Решить эту задачу удалось группе Ф. Перлер (Francine Perler) довольно очевидным (как это теперь представляется) способом. Они изменяли ряд консервативных аминокислотных остатков в интеинах методом направленного мутагенеза. Как только мутации касались активного центра интеина — белковый сплайсинг блокировался на разных этапах, и в среде накапливались промежуточные продукты реакции. Например, изменение С-конца интеина вызывало накопление «разветвлённых» белков, у которых было. два N-конца. Исследование этих необычных белков и позволило предложить механизм белкового сплайсинга (рис. 3).
Рисунок 3. Механизм белкового сплайсинга.
Событием, запускающим белковый сплайсинг, является автокаталитический N–O или N–S-сдвиг (первый аминокислотный остаток на N-конце интеина Ser или Cys, соответственно) на N-концевом сайте сплайсинга (шаг 1). В результате образуется высокореакционная эфирная или тиоэфирная связь.
С точки зрения химии, N–O/N–S-сдвиг не является энергетически выгодным процессом, поскольку в результате реакции происходит разрыв амидной (пептидной) связи и образуется высокоэнергетическая эфирная/тиоэфирная связь. Поэтому этот процесс должен катализироваться. Действительно, протекание реакции разрыва пептидной связи на N-конце облегчается как минимум двумя факторами. Во-первых, процесс катализируется самим сплайсинговым доменом интеина. Во-вторых, на эффективность N-концевого расщепления определенное влияние оказывают экстеины. Показано, что у некоторых интеинов пептидная связь, связывающая N-экстеин и первую аминокислоту интеина, находится в редкой и не характерной для белков цис-конформации. Поскольку такая связь энергетически невыгодна, ее наличие провоцирует протекание N–О или N–S сдвига, т. е. инициирует сплайсинг.
На втором этапе белкового сплайсинга происходит нуклеофильная атака образовавшейся эфирной связи OH— или SH-группой первого остатка С-экстеина. В результате происходит реакция трансэтерификации, т. е. перенос Ν-концевого экстеина на боковую группу первого остатка С-экстеина (шаг 2). В результате образуется разветвленное промежуточное соединение (те самые белки с двумя N-концами, с помощью изучения которых был и предложен данный механизм сплайсинга). Такая перестановка приводит к смещению зарядов, что в свою очередь, индуцирует циклизацию боковой цепи Asn на С-конце интеина (шаг 3).
Циклизация боковой группы Asn приводит к разрыву пептидной связи между интеином и С-экстеином — разветвленная структура распадается на свободный интеин и лигированные экстеины, связанные друг с другом эфирной связью (шаг 3). Последний шаг сплайсинга белка происходит спонтанно (шаги 4а и 4б).
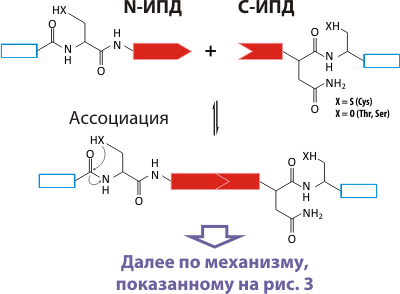
Согласно принятой на сегодня теории, белковый сплайсинг состоит из серии последовательных перестановок. Детальное описание (с точки зрения химии) в этом обзоре мы давать не будем, поскольку оно достаточно сложное (его можно увидеть в работе [4]). Но самое удивительное, что помимо цис-сплайсинга (т. е. автокаталитического удаления интеина из белка-предшественника), у многих организмов обнаружено явление транс-сплайсинга. На пальцах это можно объяснить так: у двух белков на соответствующих концах есть по половинке интеина (назовем их интеин-подобные домены, ИПД), которые, соединяясь по типу «ключ-замок», образуют вполне функциональный интеин. А этот образованный интеин вырезает сам себя, сшивая два белка в единое целое. То есть, в результате транс-сплайсинга происходит сшивание двух белков, кодируемых двумя различными генами (рис. 4). И это не лабораторная экзотика: по такому механизму, например, происходит образование белка DnaE (одна из субъединиц ДНК-полимеразы) у Synechocystis sp. [5].
Рисунок 4. Механизм транс-сплайсинга
Эндонуклеазная активность интеинов
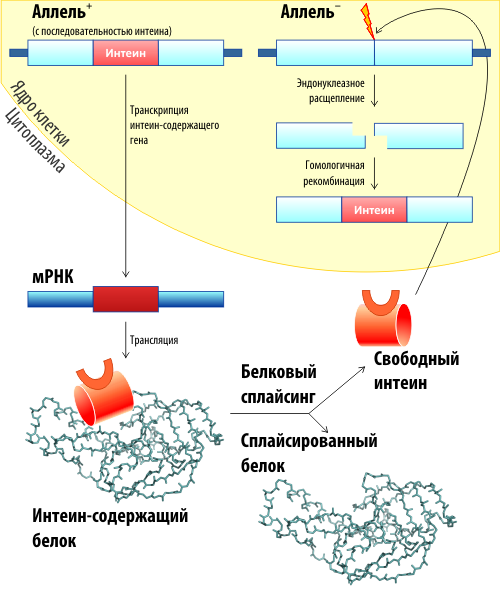
Следующей удивительной особенностью интеинов (правда, не всех) является их эндонуклеазная активность. Интеин обеспечивает (с определенными ограничениями) распространение своего гена в геноме клетки. Такой процесс, как мы уже говорили, и называется хоумингом интеинов. Другими словами, интеин-белок может амплифицировать (множить) количество своих генов в клетке. Также за счет этого свойства он может обеспечивать передачу интеинового гена другим особям данного вида или передавать другим видам (т. н. горизонтальный и вертикальный перенос соответственно). Причем эволюционный анализ распространения разных интеинов (а их открыто больше 1000, причем и у прокариот, и у низших эукариот) свидетельствует, что интеины распространяются довольно активно, и притом, оказавшись в разных видах, могут мутировать и менять последовательность. В общем, интеины в данном случае ведут себя подобно транспозонам или даже примитивным вирусам (если такое в принципе можно сказать про белки). Хотя. ряд вирусов также несет в себе интеины. Например открытый недавно гигантский Мими-вирус имеет интеин (APMV Pol) в гене ДНК-полимеразы. Но об этом давайте поговорим в другой раз.
Механизм хоуминга схематически показан на рис. 5 [4]. На самом деле, хоуминг — это не такая уж экзотика. Хоуминг-эндонуклеазы были известны еще до открытия интеинов. Это большой класс сайт-специфических ДНКаз, которые часто кодируются мобильными генетическими элементами.
Хоуминг интересен в первую очередь тем, что обеспечивает так называемый «горизонтальный» перенос гена — т. е. перенос последовательности в гомологичные области других видов. Осуществляется это, вероятнее всего, вирусами. Действительно, интеины чаще всего встречаются в белках, вовлечённых в метаболизм нуклеиновых кислот (полимеразы, лигазы, гиразы, хеликазы, белки репарации ДНК и т. п.). А ведь это те белки, которые присутствуют у вирусов и фагов! В общих чертах механизм горизонтального переноса можно описать так: дополнительные копии ДНК, которые появляются во время формирования новых вирусов, могут узнаваться как мишень для хоуминга. Интеин катализирует перенос своей последовательности в вирусную ДНК. Таким образом ген попадет в вирус, а вирус во время следующей инфекции может внести его в геном другого, близкого вида. Так гены интеинов могут путешествовать по видам. Однако тут стоит отметить, что распространяются они только между одноклеточными организмами — у многоклеточных они пока не найдены. Зато обнаружено несколько семейств ферментов и молекул, активирующихся по механизмам, похожим на белковый сплайсинг [4]. Произошли ли они от предков интеинов или возникли самостоятельно — пока что неизвестно.
Использование интеинов в биотехнологии
На мой взгляд, интеины являются одним из наиболее удачных и перспективных инструментов в биотехнологии белков и протеомных исследованиях. Про возможные способы использования белкового сплайсинга в практических целях можно писать отдельные обзоры (интересующиеся отсылаются на мою страницу или к работам [2], [4], [6]). Тут же мы коротко рассмотрим основные из методов, а также самые экзотические из них — например, создание белков-«колечек» или способ контроля размножения генно-модифицированных растений.
Очистка рекомбинантных белков
После открытия феномена белкового сплайсинга внимание исследователей сразу привлек факт самодостаточности интеина и точности его самовырезания. Т. е., если пришить интеин на уровне гена к интересующему нас белку (белок-Х), то теоретически мы сможем экспрессировать слитый белок (интеин–белок-Х), который при определенных условиях разрежется (интеин + белок-Х). Если же вставить интеин между двумя белками (белок-Х–интеин–белок-Y), то в результате можно получить сшитый двойной белок (белок-Х–белок-Y). Логичным является вопрос: а можно ли использовать для этих целей искусственный интеин с аффинной меткой (*–интеин)? Это бы позволило очистить полученный продукт (*–интеин–белок-Х), а потом отделить от белка-Х его метку (*–интеин). В результате мы получили бы целевой белок без каких-либо дополнительных модификаций. В целом интеин-опосредованная очистка предлагает все преимущества аффинной хроматографии (быстрая и эффективная очистка меченного белка), позволяя обойти главный недостаток этого метода — необходимость точного и стопроцентного отщепления аффинной метки от уже чистого препарата.
Тщательное исследование показало, что это действительно возможно. Сейчас созданы несколько систем на основе разных интеинов, которые несут His-tag, хитин-связывающий домен бактерий (CBD) и другие классические аффинные метки. Ряд из них уже коммерчески доступены (например системы IMPACT, IMPACT-СΝ, TWIN-IMPACT фирмы NEB). Аналогичные системы создаются и у нас [7], [8]. Потенциал таких технологий огромен — в первую очередь потому, что позволяет упростить очистку рекомбинантного белка до одного этапа (против 4–5 этапов на ионно-обменных носителях, какие используются в многих фармацевтических производствах) и не требует изменений самого целевого белка (обязательных при использовании традиционных аффинных меток, которые внедряются в сам белок).
Использование белкового сплайсинга для создания биосенсоров
После открытия того, что с помощью интеина можно биологически приемлемо сшить два разных белка, начались работы по созданию нового типа биосенсоров. Главной проблемой в этой области является сложность иммобилизации сенсорного белка на поверхности (т. е. покрытие им поверхности сенсора так, чтобы белок не утратил работоспособности). С помощью интеинов можно «сшивать» между собой два разных белка, один из которых может служить молекулярным якорем, связываясь с нужной поверхностью, а второй — самим сенсором. Так, например, с помощью такой технологии удалось сшить мальтоза-связывающий белок (МВР) и Т4 ДНК-лигазу [9]. В результате активность Т4-лигазы сохранилась, а пришитый МВР позволяет её закрепить или очистить на поверхности биосенсора. Другая технология — протеомный микроанализ (protein microarray) — требует создания матриц, на которых были бы ковалентно пришиты определённые белки-маркёры. Проблема заключается в том, что, с точки зрения технологичности (т. е. простоты хранения, транспортировки и использования), белки должны быть пришиты ковалентно. При этом они, естественно, не должны терять активности (что проблематично, поскольку на твёрдых поверхностях белки часто слипаются и инактивируются) и не содержать примесей (которые могут искажать результаты). Поэтому интеины как посредники, которые могут нативно сшивать целевой белок с любой поверхностью, модифицированную каким-то образом (например, покрытую недорогим серосодержащим полимером), являются весьма ценным инструментом. Первые работы в этой области уже дали довольно хорошие результаты [10]. Эти работы позволяют надеяться, что в ближайшем будущем мы получим мощный инструмент для анализа белок-белковых взаимодействий и картирования протеома организма — ведь это, как известно, следующая глобальная задача после картирования генома (о котором я уже писал [11]).
Циклизация ферментов
Такое трудно даже представить. Однако это осуществлено — белок «скрутили в баранку» без начала, без конца. Для этого был использован феномен транс-сплайсинга, только интеин-подобные N- и С- домены находились не в разных белках, а на разных концах одного белка. Методика, с помощью которой возможно циклизировать белки, получила название SICLOPPS (Split Intein-mediated Circular Ligation Of Peptide and ProteinS) [12]. Кстати, закольцованный таким способом фермент (со сложным названием дегидрофолатредуктаза), после этого не только не потерял своей активности, но даже наоборот — стал менее чувствительным к изменению температуры среды. А в промышленности, где из-за больших объемов температуру реакции контролировать намного сложнее, такие катализаторы будут очень востребованы.
Экспрессия токсичных для клетки продуктов
Часто эукариотические белки, экспрессируемые в клетках прокариот, убивают организм-продуцент. Это явление называется токсичностью. Из-за неё ряд практически важных белков (например, протеазы) в достаточных количествах наработать в бактериях не удается. Использование систем экспрессии на основе интеинов может решить эту проблему. Токсичные для клетки белки можно нарабатывать в виде неактивных химерных предшественников, слитых с интеинами. Последние нарушают структуру продукта и не дают ему активироваться. После наработки такие химерные белки очищаются и активируются путем индукции самоудаления интеина из их структуры.
Заключение
Сказать по правде, об интеинах и белковом сплайсинге я могу писать много и увлеченно. И особенно это относится к возможным функциям интеинов в клетке. О том, что дают интеины клеткам, что с ними происходит после сплайсинга, как часто происходит явление сплайсинга или хоуминга — до сих пор не известно. С одной стороны, это дает широкое поле для фантазии. Но с другой, к сожалению, публиковать непроверенные фантазии для естествоиспытателя — дурной тон. Однако бесспорно одно — явление белкового сплайсинга дает еще бóльшую гибкость и приспособляемость организмам, поскольку позволяет уже пост-трансляционно изменять продукт гена (или генов). Мы видим, что к известным, и без того изощрённым и многогранным, механизмам живой клетки добавляется еще один. И по всей вероятности — далеко не последний.