спиноцеребральная атаксия что это
Спиноцеребральная атаксия что это
а) Атаксия Фридрейха. Атаксия Фридрейха — наиболее четко описанная и часто встречающаяся спиноцеребеллярная дегенерация. Частота встречаемости гена составляет 1:110 человек в Англии (Harding 1981a), и примерно один из 10000 человек в Швеции имеет клинические проявления.
Ген атаксии Фридрейха включает повторы ГА А последовательности в интроне 1, который распространен у пациентов (120-1700 повторов). Продуктом нормального гена является белок фратаксин, функция которого не полностью ясна. 94% пациентов с типичной атаксией Фридрейха являются гомозиготами по ГАА экспансии, тем не менее продолжительность повтора на каждой хромосоме из пары неодинакова (Durr et al., 1996a).
В редких случаях отмечается только одна мутация, но в такой ситуации выявляется точечная мутация в гомозиготном локусе (Campuzano et al., 1996). Выраженная длина повтора коррелирует с началом в раннем возрасте, более стремительным течением и наличием кардиомиопатии (Durr et al., 1996a).
Второй ген на хромосоме 9p23-p11 является причиной редких случаев (Фридрейха 2), клинически нечетко отличаемых от 1 типа (Christodoulou et al., 2001).
Основным патологическим проявлением является дистальная аксональная нейропатия, которая поражает нейроны длинных восходящих и нисходящих трактов спинного мозга и крупные сенсорные волокна периферических нервов и ганглии задних корешков (Said et al., 1986). Также зарегистрирована утрата нервных волокон в зрительных путях, а мозжечок остается непораженным.
Сердце увеличено, и более чем в половине случаев отмечается гипертрофическая кардиомиопатия с некрозом волокон и фиброзом, преимущественно затрагивающим левый желудочек.
Критерии диагностики атаксии Фридрейха (Harding, 1981a) включают начало до 25 лет (обычно до 16 лет), аутосомно-рецессивное наследование и сочетанное поражение крупных сенсорных волокон периферических нервов, мозжечкового тракта, пирамидного тракта и задних столбов.
Тем не менее, степень фенотипической вариабельности велика, в некоторых случаях отмечается позднее начало и/или меньшая выраженность симптомов и вариабельное течение, и некоторые пациенты прикованы к инвалидной коляске в раннем подростковом возрасте, в то время как другие способны самостоятельно передвигаться почти до 40 лет (Montermini et al., 1997).
По неофициальным данным, к доминантным случаям относится большая часть наследственной моторной и сенсорной нейропатии со скелетными деформациями и утратой чувствительности, но некоторые случаи не поддаются классификации.
Клинические проявления атаксии Фридрейха были описаны у 115 пациентов из 90 семей (Harding, 1981b). Основные проявления представлены в таблице ниже.
Заболевание чаще всего начинается в возрасте 5-16 лет, в редких случаях — в возрасте 2-5 лет. Прогрессирующая атаксия нижних конечностей с нарушением походки является основным проявлением, в то время как поражение верхних конечностей, приводящее к неуклюжести, в ранние сроки отмечается только в 25% случаев.
Сколиоз, тремор и изменения со стороны сердца редко являются первыми проявлениями, но формируются со временем, особенно при раннем начале заболевания. Конская стопа также является ранним симптомом. При осмотре в 70-95% случаев выявляется отсутствие глубоких рефлексов.
Дизартрия, пирамидные знаки со стороны ног и утрата глубокой и вибрационной чувствительности могут появляться позже, но относятся к постоянным симптомам. Нистагм встречается нечасто (20% случаев), медленные изломанные следящие движения глаз выявляются в 12% случаев (Harding, 1981b). Нестабильность фиксации является типичным проявлением (Alper и Narayanan, 2003).
Нередко встречается атрофия зрительного нерва, а глухота отмечается только у 10% пациентов. Дистальная атрофия отмечается практически в половине случаев. Интеллект не страдает.
Поражение сердца по результатам ЭКГ обнаруживается в трети случаев и даже чаще, если ЭКГ проводится систематически. Изменения зубца Т и аномалии сегмента ST являются ранними признаками сердечной недостаточности и единственным ее проявлением.
В конечном счете формируется прогрессирующая сердечная недостаточность или аритмия с фибрилляцией предсердий, половина пациентов умирает от сердечной недостаточности (Leone et al., 1988).
Течение заболевания медленное, но прогрессирующее. В среднем пациенты утрачивали способность ходить к 25 годам, со средней продолжительностью заболевания 15,5 лет.
Сахарный диабет является дальнейшим осложнением и развивается у 10% пациентов. Он имеет тенденцию сочетаться с атрофией зрительного нерва, в некоторых случаях диабетическая кома является причиной смерти.
Атипичные формы включают легкие случаи, которые, возможно, связаны с одним и тем же локусом 9-й хромосомы. К данной группе относятся случаи сохранения сухожильных рефлексов (Palau et al., 1995) и поздние формы с началом в раннем взрослом возрасте (De Michele et al., 1994).
Результаты одной из недавних работ, в которой использовалось возможное выявление мутантного гена, предполагают, что клиническая картина более вариабельна, чем считалось раньше (Palau et al., 1995; Pandolfo 2003). 25% пациентов в рамкам одного крупного исследования имели одно или более атипичное проявление (начало после 25 лет, сохранение или даже оживление сухожильных рефлексов или отсутствие симптома Бабинского).
Возраст начала превышал 20 лет у 19 из 114 пациентов (De Michele et al., 1994). Сохраненные рефлексы среди пациентов, которые в остальном соответствуют всем критериям, зарегистрированы у значимого числа пациентов (Palau et al., 1995). Большая часть случаев, ранее отнесенных к рано начинающейся атаксии с сохранением глубоких сухожильных рефлексов (состояния, отличного от атаксии Фридрейха) (Harding, 1981b; Klockgether et al., 1991), по результатам молекулярно-генетических исследований, вероятно, имеют отношение к болезни Фридрейха.
Эта группа, очевидно, была гетерогенной как при раннем (
Вторая подгруппа Кенига включает атаксию со зрительной моторной апраксией (АОА), которая делится на два типа: AOA1 является одной из наиболее распространенных форм детского возраста и описана вместе с атаксией-телеангиэктазией, несмотря на то, что ее физиология кажется более сходной с спиноцеребеллярными атаксиями (SCA, см. далее). Одним из важных биологических признаков является гипоальбуминемия, которая практически постоянно обнаруживается и имеет диагностическую значимость. АОА 2 типа встречается реже и начинается позже (в позднем подростковом или раннем взрослом возрасте). Умеренно повышенный уровень альфа-фетопротеина отмечается в 75% случаев.
Клинические проявления AOA1 очень напоминают проявления атаксии-телеангиэктазии, но без признаков экстраневрологических поражений.
В отличии от атаксии-телеангиэктазии, AOA1 не связана с повышением уровня альфа-фетопротеина, хромосомными аномалиями, склонностью к раковым опухолям или повышенной радиочувствительностью культуры фибробластов (Le Ber et al., 2005). Редким, но интересным состоянием является спиноцеребеллярная атаксия с аксональной нейропатией 1 (SCA1), которая фактически является нарушением репарации ДНК, вызванной отсутствием фермента топоизомеразы-фосфодиэстеразы-1 (TDP1) (E1-Khamisy et al., 2005).
В третьей подгруппе Кенига четко описана атаксия Шарлевуа-Сагеней. Изначально синдром был описан в Квебеке, но с тех пор регистрировался и в других частях света (Gucuyener et al., 2001). Заболевание связано с мутацией гена сакцина на 13-й хромосоме (Engert et al., 2000). Фенотипические проявления включают заметную спастичность и постоянное наличие полос на глазном дне с преобладанием миелиновых волокон, радиально расходящихся от диска зрительного нерва.
Два редких аутосомно-рецессивных синдрома включают очень медленно прогрессирующую атаксию и могут рассматриваться вместе с SCA. Несмотря на то, что патология и механизмы заболеваний отличаются, они проявляются несколькими общими клиническими симптомами.
Синдром Маринеску-Шегрена включает атрофию мозжечка, преимущественно затрагивающую червь, раннее начало медленно прогрессирующей атаксии, катаракту, легкую задержку умственного развития, иногда гипогонадизм (Sewry et al., 1988) и позднее развитие специфической миопатии (Superneau et al., 1987). Заболевание развивается в результате мутации гена SLI1, кодирующего белок-шаперон, ключевой регулятор основных функций эндоплазматической сети.
РЕНО синдром (прогрессирующая энцефалопатия с периферическими отеками, гипсаритмией и атрофией зрительного нерва, также называемая церебелло-оптический синдром) является рецессивным заболеванием, зарегистрированным преимущественно в Финляндии (Salonen et al., 1991), хотя регистрировались случаи и в других странах. Основными проявлениями являются рано начинающиеся припадки, легкий дисморфизм, периферические отеки и регрессия, начинающаяся в возрасте 3-5 месяцев. Атрофия зрительного нерва развивается к концу первого года (Haltia и Somer, 1993).
Видео этиология, патогенез атаксии Фридрейха
— Вернуться в оглавление раздела «Неврология.»
Редактор: Искандер Милевски. Дата обновления публикации: 12.3.2021
Спиноцеребеллярная атаксия
1. Общие сведения
Нейродегенерация – патологический процесс, с развитием которого нервная ткань утрачивает свою сложнейшую организацию, вырождается, постепенно атрофируется (уменьшается в объеме и отмирает), становясь, в целом, функционально несостоятельной. Учитывая, что нервная система контролирует и регулирует в организме буквально всё, нейродегенеративные заболевания, – даже самые медленные и вялотекущие, – всегда составляют серьезную проблему, которая усугубляется еще и тем, что на данный момент все усилия по разработке репаративных (восстановительных) и этиопатогенетических (устраняющих первопричину болезни) видов терапии не принесли ощутимых результатов.
В большинстве своем нейродегенеративные болезни обусловлены или, по крайней мере, достоверно связаны с наследственными, хромосомными факторами. Эти заболевания традиционно считаются редкими, и в пересчете на десятки и сотни тысяч населения многие из них действительно кажутся спорадическими, почти случайными аномалиями. Однако если просуммировать частоту встречаемости достаточно известных болезней Альцгеймера, Пика, Паркинсона, демиелинизирующего рассеянного или бокового амиотрофического склероза, ДТЛ (деменция с тельцами Леви), картина будет выглядеть более тревожной. Так, со ссылкой на данные посмертных патоморфологических исследований в литературе неоднократно подчеркивалось, что та же ДТЛ (один из лобно-височных вариантов нейродегенерации) диагностируется значительно реже, чем в действительности встречается.
Большое число отдельных нозологических единиц (т.е. официально устанавливаемых диагнозов этой группы) служит предметом критических дискуссий, поскольку дегенерация нейронной ткани является основным и общим механизмом развития таких болезней; напр., крайнее крыло сторонников обобщения предлагало «для удобства» считать все заболевания такого рода лишь частными вариантами болезней Альцгеймера или Паркинсона. Едва ли такой подход можно считать оправданным: клиническая картина, темпы протекания, прогноз, стратегия симптоматического лечения – все это детерминируется рядом значимых факторов (прежде всего, преимущественной локализацией процесса) и отличается в достаточной степени, чтобы говорить именно о самостоятельных заболеваниях.
Вышесказанное в полной мере относится к спиноцеребеллярной атаксии. Это наследственное нейродегенеративное заболевание с выраженной собственной спецификой, которое может манифестировать в любом возрасте (обычно в интервале 5-40 лет) и отличается многообразием форм: к настоящему времени выделено и описано свыше двадцати сравнительно самостоятельных типов (SCA, SCA 2, болезнь Фридрейха и мн.др.).
2. Причины
В основе спиноцеребеллярных атаксий лежит наследуемая мутация определенных генов (тип наследования, как правило, таков, что если оба родителя являются носителями, то вероятность «срабатывания» патологии у ребенка составляет 1/4 или 25%). В результате нарушается ряд сложнейших электрохимических процессов, управляющих энерго- и белковым балансом (значительную роль играет дефектная структура белка фратаксина), передачей нервных импульсов от центра к периферии и обратно, и пр. Объединяющей особенностью для всей группы атаксий является то, что в нейронную дегенерацию вовлекаются структуры как головного мозга (прежде всего, мозжечок), так и спинного, а также проводниковые пути между ними, периферические нервы и, в отдельных случаях, ткань миокарда. Термин «атаксия» в дословном переводе означает «отсутствие порядка, согласованности», и, по определению, главным проявлением спиноцеребеллярной атаксии становятся прогрессирующие нарушения координации движений и, вообще, нервно-мышечной согласованности.
3. Симптоматика, диагностика
Вероятные симптомы спиноцеребеллярной нейронной дегенерации настолько полиморфны, что описать хотя бы основные из двадцати ее типов в одной статье нет никакой возможности. Отмечаются расстройства зрительно-моторной координации и мышечного тонуса (тремор, экстрапирамидная «скованность»); частичные параличи глазодвигательных мышц и дегенеративные ретинопатии в сочетании с атрофией зрительного нерва; общая атрофия мышечных волокон; разнообразные неврологические симптомокомплексы. Если нейродегенеративный процесс затрагивает кору головного мозга, постепенно развивается деменция – ослабоумливающее снижение когнитивных функций (память, внимание, различные виды распознавания и пр.), логического мышления, организации речи. В случае поражения продолговатого мозга развивается «бульбарная» симптоматика: деградация глотательного, небного, жевательного, дыхательного рефлексов.
Заболевания этой группы прогрессируют относительно медленно: течение может занимать до 20 лет и более, хотя описаны и значительно более быстрые развития. Больные постепенно утрачивают способность к самообслуживанию и, вообще, к продуктивному контакту с миром; они все больше зависят от опеки и ухода со стороны окружающих, к терминальной стадии впадая в полную беспомощность и погибая, как правило, от присоединившихся пневмоний, истощения, дыхательной недостаточности и пр.
Нейродегенеративные заболевания, в том числе атаксии, диагностируются клинически, в ходе неврологического осмотра и тщательного анализа жалоб и анамнестических сведений. Дополнительно могут назначаться методы томографической визуализации, нейропсихологическое обследование и пр., однако окончательно диагноз устанавливается и дифференцируется, как правило, лишь патоморфологически.
4. Лечение
В настоящее время не существует лечения, которое обращало бы вспять или хотя бы останавливало процессы нейродегенерации. Все виды практикуемой сегодня терапии носят сугубо паллиативный характер и направляются на смягчение наиболее дезадаптирующих, снижающих качество жизни симптомов, доминирующих в конкретной клинической картине. Как правило, назначают препараты для улучшения нейротрофики (питания нервных тканей), витаминные комплексы, массаж, лечебная физкультура для коррекции и/или компенсации двигательных расстройств.
Спиноцеребеллярные атаксии
Спиноцеребеллярные атаксии – группа генетически разнородных наследственных заболеваний неврологического характера, которые проявляются различными расстройствами работы мозжечка и иногда базальных ядер головного мозга. Симптомами этого состояния являются: развитие атаксии и неустойчивой походки, нарушение координации движений и другие неврологические проявления. Диагностика спиноцеребеллярных атаксий производится на основании данных неврологического осмотра, изучения наследственного анамнеза больного, магнитно-резонансной томографии и молекулярно-генетических исследований. Специфического лечения этой патологии на сегодняшний момент не существует, для сохранения оптимального качества жизни больного используют методы поддерживающей и симптоматической терапии.
Общие сведения
Спиноцеребеллярные атаксии – группа наследственных неврологических состояний, характеризующихся развитием прогрессирующей дегенерации клеток мозжечка и иногда базальных ядер вплоть до их полной атрофии. Впервые одно из заболеваний этой группы было описано еще в 1891 году немецким невропатологом П. Менцелем, который выявил развитие атаксии, офтальмоплегии и других неврологических нарушений в рамках одной семьи. Дальнейшие исследования показали, что это состояние (известное сейчас как спиноцеребеллярная атаксия 1-го типа) наследуется по аутосомно-доминантному механизму.
В настоящий момент методами современной генетики удалось обнаружить более 20 различных генетических вариантов этого заболевания, при этом более 90% всех случаев обуславливает только 6 из них (1, 2, 3, 6, 7 и 8-й типы). Все формы спиноцеребеллярных атаксий характеризуются аутосомно-доминантным наследованием с явлениями антиципации (усиления выраженности патологии от поколения к поколению) и «отцовской передачи» – более яркой клинической картине заболевания при его наследовании от отца. Поэтому в ряде регионов в общей структуре патологии наблюдается незначительное превалирование больных мужского пола. Общая встречаемость спиноцеребеллярной атаксии колеблется в широких пределах (1-24:100 000), при этом 1-й тип распространен в России и большей части Европы, 2-й – в Индии, 3-й – в Германии и Японии.
Причины и классификация спиноцеребеллярных атаксий
Несмотря на значительное генетическое и отчасти клиническое разнообразие спиноцеребеллярных атаксий, молекулярные механизмы генетических нарушений при этих заболеваниях очень сходны. Основная причина патологии заключается в изменении количества тринуклеотидных последовательностей (CAG) в кодирующей части ассоциированных с заболеванием генов. Это приводит к увеличению количества аминокислоты глутамина в полученном белке, что изменяет физико-химические свойства протеина и нарушает его функции. В ряде случаев вышеуказанные белки прямо или косвенно участвуют в метаболизме нервной ткани, поэтому изменение их структуры приводит к спиноцеребеллярной атаксии. В настоящее время лучше всего изучены молекулярные механизмы 6 основных разновидностей этого заболевания – данные формы патологии встречаются наиболее часто и в совокупности составляют более 90% случаев спиноцеребеллярной атаксии.
Спиноцеребеллярная атаксия 1-го типа считается самым распространенным и самым изученным вариантом данной патологии. Ее причиной выступают мутации в гене ATXN1, который располагается на 6-й хромосоме. В норме данный ген имеет не более 36 CAG-повторов, увеличение их количества приводит к развитию заболевания. Продуктом экспрессии гена ATXN1 является особый ДНК-связывающий белок, активно участвующий в метаболизме клеток Пуркинье мозжечка – при наличии мутантной разновидности гена это приводит к появлению агрегантов и постепенной дегенерации, что и становится причиной спиноцеребеллярной атаксии.
Спиноцеребеллярная атаксия 2-го типа – менее распространенный вариант заболевания, этиология не так тщательно изучена. Причиной патологии является увеличение количества CAG-повторов в гене ATXN2, локализованном на 12-й хромосоме. В здоровом варианте гена количество вышеуказанных последовательностей составляет от 15 до 36, тогда как при спиноцеребеллярной атаксии их может быть свыше 100. Функции белка, который кодируется геном ATXN2, на сегодняшний момент неизвестны.
Спиноцеребеллярная атаксия тип 3 (другое название – болезнь Мачадо-Джозефа в честь двух больных, у которых впервые было описано данное состояние) – причиной этого варианта патологии выступают нарушения в гене ATXN3, расположенном на 14-й хромосоме. В норме количество CAG-повторов в этом гене не превышает 47, при развитии заболевания обнаруживается от 53 до 68 повторов. Данный ген кодирует белок, который предположительно участвует в энергетическом обмене нейронов мозжечка и базальных ядер.
Спиноцеребеллярная атаксия тип 6 – сравнительно редкий вид заболевания, обусловленный дефектами в гене CACNA1A, локализованном на 19-й хромосоме. Для развития патологии достаточно очень незначительного увеличения количества CAG-повторов – если в нормальном варианте гена их обнаруживают 5-20, то при наличии атаксии – 21-26. Ген CACNA1A кодирует белок-субъединицу кальциевых каналов, расположенных на нейронах мозжечка. Помимо спиноцеребеллярной атаксии, нарушения в гене CACNA1A обуславливают развитие эпизодической атаксии и некоторые наследственные формы мигрени.
Спиноцеребеллярная атаксия тип 7 – данная разновидность патологии вызывается нарушениями структуры гена ATXN7, который располагается на 3-й хромосоме. У здорового человека количество CAG-повторов составляет не более 35, тогда как при заболевании их количество может достигать нескольких сотен. Функции белка, который кодирует ген ATXN7, на сегодняшний момент изучаются.
Спиноцеребеллярная атаксия тип 8 обусловлена генетическим дефектом гена ATXN8, расположенного на 13-й хромосоме. Как и в других случаях, суть генетического дефекта при этом состоянии заключается в изменении количества тринуклеотидных последовательностей CAG – обычно их около 15-50, тогда как при патологии количество повторов может составлять свыше 1200.
Практически при любом типе спиноцеребеллярной атаксии патологическая форма белка, чрезмерно богатая глутамином, формирует отложения в ядрах или цитоплазме нейронов мозжечка и базальных ядер в виде плотных агрегатов. Этот процесс идет тем быстрее, чем сильнее количество CAG-повторов в ключевом гене отличается от нормы. Этим же объясняется механизм антиципации симптомов спиноцеребеллярной атаксии – в процессе мейоза при образовании половых клеток количество вышеуказанных тринуклеотидных последовательностей может увеличиваться, что приводит к усилению симптомов.
Так как подобное явление чаще имеет место при формировании мужских половых клеток, это становится причиной так называемой «отцовской передачи», когда антиципация регистрируется только при передаче заболевания от отца потомству. Многие врачи-генетики полагают, что основная причина спиноцеребеллярных атаксий лежит не в увеличении «гистидиновых» тринуклеотидов, а в делеции так называемых регулирующих триплетов, разделяющих участки CAG-повторов. Например, при первом типе заболевания это CAT, при втором CAA – они регулируют количество CAG-повторов и сохраняют стабильность их количества во время мейоза.
Симптомы спиноцеребеллярных атаксий
Несмотря на значительное генетическое разнообразие спиноцеребеллярных атаксий, проявления разных типов этого заболевания в целом сходны и различаются только второстепенными деталями – возрастом манифестации, особенностями некоторых симптомов. Практически все формы патологии не регистрируются в детском возрасте – лишь отдельные случаи 1 и 2-го типов были замечены у детей младше 7 лет, средний возраст их манифестации – 18-30 лет. Спиноцеребеллярные атаксии 3, 6 и 7-го типов характеризуются еще более поздним развитием – их манифестация практически всегда происходит у лиц старше 30 лет. Нередко подобные нарушения выявляются и у пожилых людей, что затрудняет дифференциальную диагностику этого состояния с болезнью Паркинсона и другими нейродегенеративными заболеваниями старшего возраста.
Чаще всего развитие спиноцеребеллярной атаксии начинается с появления простой неуклюжести в движениях, особенно при ходьбе, беге. В дальнейшем возникает тремор рук, нарушения походки, паралич глазодвигательных мышц (офтальмоплегия), изменяется почерк больного (становится крупнее, строки неровные). В конечном итоге заболевание приводит к выраженной мозжечковой атаксии, расстройствам пирамидальных и экстрапирамидальных путей, паркинсонизму. Некоторые формы патологии характеризуются выраженными нарушениями зрения – развитием атрофии зрительного нерва, пигментной дегенерации сетчатки и других процессов.
Спиноцеребеллярная атаксия 6, 7 и 8-го типов также проявляется расстройствами речи (дизартрия) и глотания, что является причиной затрудненного питания и истощения больных. Именно это обстоятельство и связанные с ними нарушения (например, атрофия мозжечка, сердечная недостаточность) часто становятся причиной смерти пациентов. В зависимости от формы заболевания, объема поддерживающего лечения и качества ухода за больными продолжительность жизни при спиноцеребеллярной атаксии может составлять от 10 до 25 лет с момента возникновения первых симптомов патологии.
Диагностика
Выявление спиноцеребеллярной атаксии производится на основании данных неврологического осмотра, изучения наследственного анамнеза, магнитно-резонансной томографии головного мозга и молекулярно-генетических исследований. При осмотре больных на разных стадиях развития патологии определяются различные по выраженности неврологические нарушения – тремор конечностей, атаксия, изменения речи и голоса, на конечных этапах – дисфагия. Некоторые формы спиноцеребеллярной атаксии сопровождаются достаточно быстрым развитием нарушений зрения, приводящим к полной слепоте. Многолетнее наблюдение за такими больными подтверждает неуклонно прогрессирующее течение заболевания. При изучении наследственного анамнеза могут определяться характерные признаки спиноцеребеллярной атаксии – аутосомно-доминантное наследование, наличие антиципации при передаче болезни от отца.
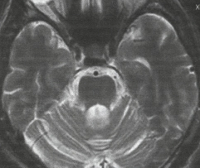
На МРТ головного мозга при спиноцеребеллярной атаксии обнаруживаются очаги демиелинизации и нейродегенерации в области полушарий, червя мозжечка и базальных ядер. На терминальных стадиях развития заболевания может отмечаться полная атрофия мозжечка. Молекулярно-генетические исследования при спиноцеребеллярной атаксии сводятся к поиску патологически увеличенного количества CAG-повторов в генах, ассоциированных с этим заболеванием. В настоящее время большинство лабораторий мира осуществляет поиск этого дефекта в генах, наиболее часто приводящих к развитию патологии – ATXN1, ATXN2, ATXN3, ATXN7, ATXN8 и CACNA1A.
Лечение спиноцеребеллярной атаксии
Прогноз и профилактика
В долгосрочной перспективе прогноз любой формы спиноцеребеллярной атаксии неблагоприятный – это заболевание характеризуется выраженным прогрессирующим течением и со временем приводит сначала к инвалидизации, а затем к смерти больного. Однако в конкретном случае прогноз может быть и менее негативным – например, при развитии патологии в пожилом возрасте и своевременно начатом поддерживающем лечении большинство тяжелых симптомов попросту не успеет проявиться. Если спиноцеребеллярная атаксия возникла в молодом или детском возрасте, продолжительность жизни таких больных даже при интенсивном лечении и тщательном уходе будет резко снижена.
Профилактика осуществляется методом медико-генетического консультирования родителей, наследственный анамнез которых отягощен по этому состоянию, и генетической пренатальной диагностики. При этом необходимо учитывать аутосомно-доминантный характер наследования спиноцеребеллярной атаксии и такие особенности ее передачи, как антиципация.