спейсер тазобедренного сустава что это
Спейсер тазобедренного сустава что это
Изобретение относится к медицине, а именно к оперативной травматологии и ортопедии, и может быть использовано при лечении парапротезной инфекции, в частности инфекционных осложнений, возникших после эндо-протезирования тазобедренного сустава.
В настоящее время известны следующие спейсеры тазобедренного сустава, используемые для лечения парапротезной инфекции.
Известен артикулирующий спейсер тазобедренного сустава с метадиа-физарной фиксацией, полезная модель РФ №110262. Спейсер выполнен в виде усеченного конуса на срезе крестообразной формы за счет четырех продольно расположенных ребер жесткости. На ребрах сформированы ступенеобразные выступы, а между ребрами расположены продольные желоба, обеспечивающие отток патологического отделяемого из костномозгового канала. Однако, поскольку антибиотик выделяется только с поверхности спейсера, то количество лекарственного средства, поступающего в область воспаления, является недостаточным, что требует дополнительного перорального (или парентерального) приема антибиотиков.
из самого спейсера. Также недостатком данного спейсера является то, что в костный цемент, из которого он изготавливается, может быть помещен только один вид антибиотика (в связи с возможными химическими реакциями между лекарственными препаратами и снижением прочности костного цемента).
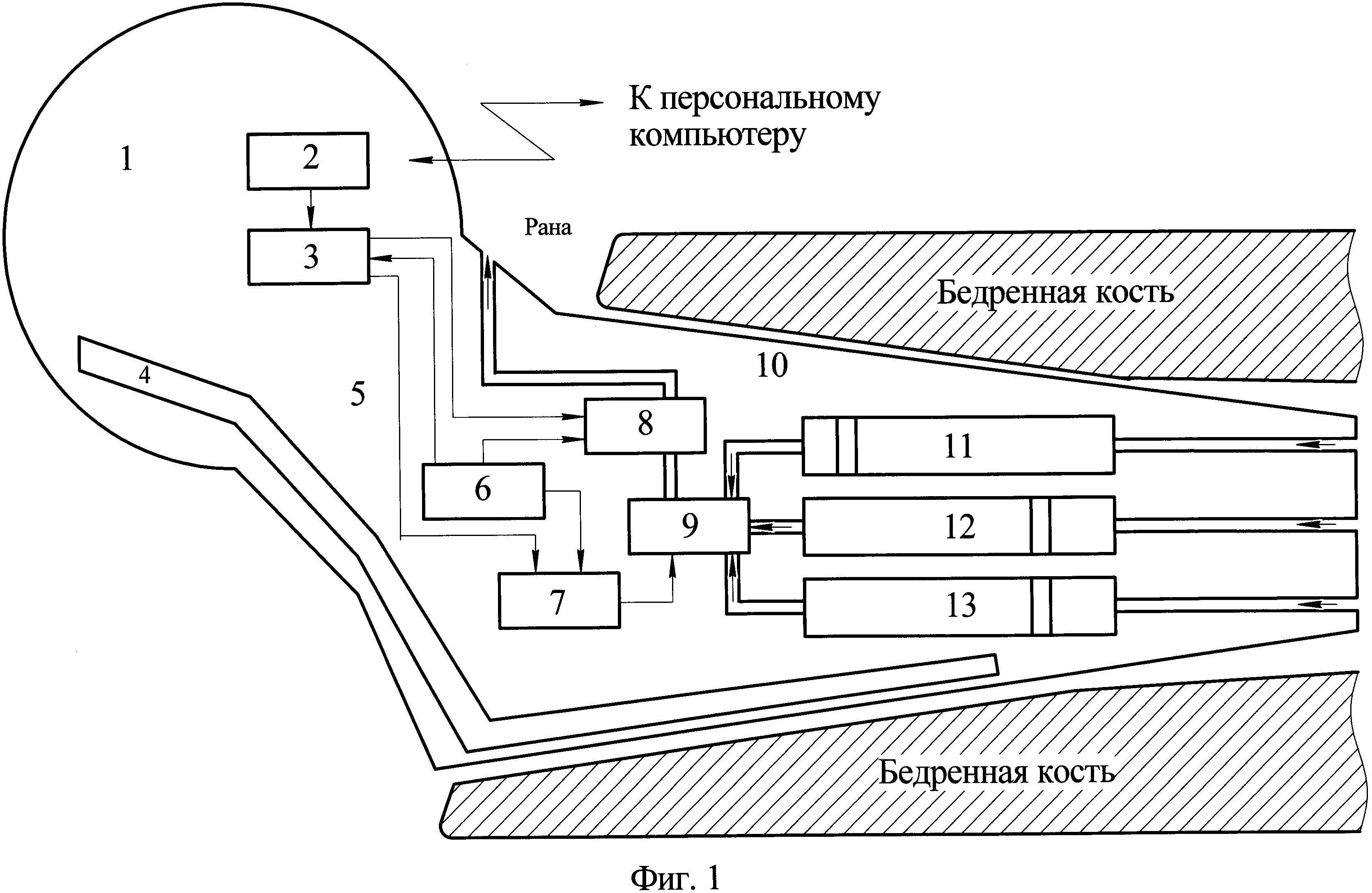
Для решения поставленной задачи в спейсере тазобедренного сустава, состоящем из головки, шейки, ножки, изготовленных из костного цемента с расположенным внутри металлическим стержнем (каркасом), дополнительно введены последовательно соединенные приемо-передатчик, блок управления, шаговый двигатель и коммутатор, три цилиндрические емкости с разными антибиотиками, выход каждой из которых посредством трубки подключен к соответствующему входу коммутатора, причем в каждой емкости имеется поршень, к входу каждой емкости присоединена трубка, выходящая на поверхность спейсера в области нижней части ножки, также введены последовательно соединенные элемент питания и насос, второй вход которого соединен со вторым выходом блока управления, второй вход которого соединен с выходом элемента питания, причем выход коммутатора посредством трубки подключен к третьему входу насоса, к выходу которого присоединена трубка, выходящая на поверхность спейсера в области его шейки.
При изучении других известных конструктивно-технических решений в данной области медицины указанная совокупность признаков, отличающая изобретение от прототипа, не была выявлена.
На фиг. 1 приведена структурная схема спейсера тазобедренного сустава. На фиг. 1 приняты следующие обозначения:
Заявляемый спейсер тазобедренного сустава состоит из головки 1, шейки 5, ножки 10, изготовленных из костного цемента с расположенным внутри металлическим стержнем (каркасом) 4. Также внутри спейсера расположены последовательно соединенные приемо-передатчик 2, блок управления 3, шаговый двигатель 7 и коммутатор 9, три цилиндрические емкости с разными антибиотиками 11, 12, 13, выход каждой из которых посредством трубки подключен к соответствующему входу коммутатора 9, в каждой емкости имеется поршень, а к входу каждой емкости присоединена трубка, выходящая на поверхность спейсера в области нижней части ножки 10. Также внутри спейсера располагаются последовательно соединенные элемент питания 6 и насос 8, второй вход которого соединен со вторым выходом блока управления 3, второй вход которого соединен с выходом элемента питания 6, причем выход коммутатора 9 посредством трубки подключен к третьему входу насоса 8, к выходу которого присоединена трубка, выходящая на поверхность спейсера в области его шейки 5.
Составные части заявляемого спейсера тазобедренного сустава могут быть реализованы следующим образом.
Головка 1, шейка 5 и ножка 10 изготавливаются из типового костного цемента, применяемого в травматологии и ортопедии. Металлический стержень
4 может быть выполнен в виде металлического стержня, изогнутого соответственно профилю спейсера или в виде каркаса, т.е. неподвижно соединенных (например, сваренных) между собой металлических стержней. Изготовление спейсера возможно путем застывания костного цемента в силиконовой форме, повторяющей форму эндопротеза или модели спейсера.
Таким образом, реализация заявляемого спейсера не вызывает сомнений, так как для его изготовления используются типовые материалы, применяемые в травматологии и ортопедии и радиоэлектронике.
Спейсер используют следующим образом.
При развитии парапротезной инфекции перед операцией проводится микробиологическое исследование отделяемого из раны с целью определения наибольшей чувствительности «высеянных» микроорганизмов к антибиотикам. Перед изготовлением спейсера (в силиконовой форме) емкости для антибиотиков заполняют наиболее эффективными лекарственными средствами согласно результатам посева. Возможно добавление антибиотика также и в костный цемент.
После установки спейсера связь между персональным компьютером и блоком управления 3 осуществляется посредством радиосвязи с использованием приемопередатчика 2. Из блока управления 3 подается команда на шаговый двигатель 7, который осуществляет переключение коммутатора 9 для введения первого лекарственного средства из емкости 11. Также из блока управления подается команда на насос 8, задающая скорость введения первого лекарственного средства из емкости 11. При этом первое лекарственное средство через отверстие в области шейки 5 спейсера поступает в рану. По мере выделения первого лекарственного средства в рану емкость 11 заполняется содержимым костно-мозгового канала. Продолжительность введения первого лекарственного средства задается автоматически исходя из скорости его введения. После того, как первое лекарственное средство полностью выделится в рану, из персонального компьютера (автоматически, через промежуток времени, равный продолжительности действия первого лекарственного средства) поступает команда на переключение коммутатора 9 к следующей емкости со вторым лекарственным средством 12.
Выделение второго и третьего лекарственного средства из соответствующих емкостей 12 и 13 осуществляется аналогично выделению первого лекарственного средства.
Таким образом, предлагаемый спейсер позволяет последовательно вводить несколько наиболее эффективных антибиотиков в рану. При этом скорость и последовательность их введения может регулироваться врачом в зависимости от клинической картины, состояния раны и других факторов. Последовательное введение антибиотиков позволяет обеспечить необходимую их концентрацию в ране, что способствует усилению бактерицидного и/или бактериостатического эффекта антибиотиков.
Вокруг очага воспаления формируется лейкоцитарный вал, который препятствует проникновению антибиотиков, поступающих в рану из спейсера, в окружающие мягкие ткани, и, соответственно, в кровоток, таким образом, уменьшается количество побочных эффектов антибиотиков.
Техническим результатом изобретения является:
— повышение эффективности лечения парапротезной инфекции за счет увеличения количества и видов антибиотиков, поступающих в рану с необходимыми скоростью и последовательностью их введения;
— уменьшение побочных явлений антибиотикотерапии за счет местного введения лекарственных средств и, соответственно, отсутствия или уменьшения количества перорально или парентерально вводимых антибиотиков.
Спейсер тазобедренного сустава, состоящий из головки, шейки, ножки, изготовленных из костного цемента с расположенным внутри металлическим стержнем, отличающийся тем, что дополнительно введены последовательно соединенные приемопередатчик, блок управления, шаговый двигатель и коммутатор, три цилиндрические емкости с разными антибиотиками, выход каждой из которых посредством трубки подключен к соответствующему входу коммутатора, причем в каждой емкости имеется поршень, к входу каждой емкости присоединена трубка, выходящая на поверхность спейсера в области нижней части ножки, также введены последовательно соединенные элемент питания и насос, второй вход которого соединен со вторым выходом блока управления, второй вход которого соединен с выходом элемента питания, причем выход коммутатора посредством трубки подключен к третьему входу насоса, к выходу которого присоединена трубка, выходящая на поверхность спейсера в области его шейки.
Спейсер тазобедренного сустава что это

Поиск
Использование двухполюсного спейсера в лечении инфекционных осложнений при артропластике крупных суставов
Авторами разработан и апробирован при оперативном лечении 11 пациентов (2011-2012 гг.) новый вариант цементного спейсера для двухэтапного реэндопротезирования тазобедренного сустава. Возможность безболезненного функционирования сустава в период лечения, профилактика вывиха эндопротеза обеспечивают преимущественный выбор этого устройства. Успешный опыт применения спейсера позволяет авторам рекомендовать его для широкого внедрения в специализированных клиниках при лечении гнойных осложнений эндопротезирования.
Two pole spacers use in the treatment of infectious complications in major joint arthroplasty
The authors have developed and tested in the surgical treatment of 11 patients (2011-2012) new version of the cement spacer for two-stage replacement hip. Ability to smooth functioning of the joint during the treatment, prevention of stent dislocation provides preferential choice of the device. The successful experience of the spacer allows the authors to recommend it for wide use in specialized clinics for the treatment of septic complications arthroplasty.
Интенсивное развитие эндопротезирования неизбежно сопровождается увеличением числа случаев осложнений. Одним из них является глубокая инфекция в области хирургического вмешательства, что составляет, по данным отечественных и зарубежных авторов, от 0,3% до 2% при первичной артропластике и до 40% и более при ревизионных операциях [2, 7]. Глубокое нагноение представляет, вероятно, наиболее грозное осложнение тотального эндопротезирования тазобедренного и коленного суставов. Даже строжайшее соблюдение асептики при современном оборудовании операционной, профилактическая антибиотикотерапия, иммунокоррекция позволили снизить частоту инфекций только до 0,7-1,0% [8, 9, 10].
Острый и хронический инфекционный процесс требует различного подхода к лечению. К острым инфекционным осложнениям относят нагноения, развившиеся на протяжении первых трех месяцев после первичного эндопротезирования, хронические включают инфицирование, диагностированное после этого срока. При остром инфекционном осложнении могут использоваться такие методы лечения, как открытый дебриджмент, длительное промывание полости сустава антисептиками, массивная патогенетически оправданная антибактериальная терапия, либо одноэтапное реэндопротезирование, хотя их успех, по данным различных авторов, отмечен только у 27-30% больных. При лечении гнойных осложнений, развившихся в более поздние сроки, перечисленные выше методы, как правило, не приводят к положительным результатам. Оптимальным на современном этапе считается сочетание антимикробной терапии, радикальной хирургической обработки гнойного очага с обязательным удалением имплантатов и костного цемента, продолжительного по времени дренирования, адекватного дезинтоксикационного лечения и установки цементного спейсера с антибиотиками [3, 4, 5].
Эффективность локального использования антибиотиков, а именно антибиотика в цементе, для лечения глубоких инфекций области хирургического вмешательства (ИОХВ) в оперативной ортопедии считается общепризнанной [12]. Доказано, что как минимум3,6 гантибиотика в40 гакрилового цемента (АЦ) обеспечивают терапевтическое действие антибиотика. В цементных спейсерах и бусах предпочтительно содержание антибиотика в количестве 6-8 гна40 гцемента. Применение таких высоких доз антибиотика позволяет поддерживать терапевтическую концентрацию при лечении остеомиелита. Однако, в случаях, когда АЦ используется для профилактики, а не для лечения, содержание антибиотика может быть снижено, поскольку высокие дозы оказывают отрицательное влияние на механические свойства цемента, особенно важные при фиксации имплантата [3].
В последние годы в публикациях появились обнадеживающие результаты двухэтапного реэндопротезирования как тазобедренного, так и коленного суставов при лечении хронического послеоперационного нагноения. Эти работы свидетельствуют о том, что число положительных исходов при подобных вмешательствах составляет от 89% до 100% при продолжительности наблюдений более 24 месяцев [1].
Однако существуют негативные стороны удаления эндопротеза. Во-первых, с элементами имплантата изымается значительный массив прилежащей кости. После его удаления ретракция мышц приводит к проксимальному смещению бедренной кости. Попытки воспрепятствовать этому путем ношения ортопедического ортеза оказываются неэффективными. Наложение аппарата внешней фиксации чревато большим риском обострения инфекционного процесса. Во-вторых, подобное смещение бедра вынуждает хирурга полностью отсекать ягодичные мышцы от большого вертела для низведения бедренной кости до необходимого уровня, а подчас и отсекать вертел. В-третьих, после удаления компонентов эндопротеза все пространство области вертлужной впадины заполняется рубцовыми тканями. Как следствие — травматичность при их удалении, повышенная кровопотеря [6].
Цель исследования: апробирование нового цементного спейсера при двухэтапном ревизионном эндопротезировании тазобедренного сустава.
В отделении гнойной хирургии ГАУЗ «Республиканская клиническая больница МЗ РТ» была введена в клиническую практику разработка сотрудников кафедры травматологии, ортопедии и хирургии экстремальных состояний Казанского медицинского университета «Двуполюсный спейсер тазобедренного сустава» (Заявка № 2011106737/14(009579). Спейсор состоит из трех элементов: шара, соответствующего размерам вертлужной впадины пациента, опорной части, устанавливаемой в область культи проксимального отдела бедренной кости и односторонне вогнутой шайбы, укладываемой на дно вертлужной впадины.
Устройство применяется на первом этапе лечения при инфицировании эндопротеза тазобедренного сустава, непосредственно после удаления имплантата. Оно позволяет заполнить образующиеся пустоты в области вертлужной впадины и проксимального отдела бедренной кости, сохранить объем и длину параартикулярных тканей, создать депо антибиотиков непосредственно в области инфекционного очага.
Одним из недостатков, используемых в клинической практике спейсеров, является болевой синдром. Предлагаемая разработка исключает эту проблему, поскольку движения в спейсоре происходят между шаром и опорной частью. Второй проблемой является частый вывих головки традиционного спейсора из вертлужной впадины. Возможность регулировать высоту и сферичность опорной части спейсора позволяют обеспечить стабильность в суставе и снижается риск вывиха.
Устройство изготавливается непосредственно во время оперативного вмешательства, после удаления эндопротеза из костного цемента с антибиотиком. Учитываются индивидуальные размеры и дефекты вертлужной впадины, проксимального отдела бедренной кости, а также степень необходимого восстановления длины конечности.
Технику первого этапа ревизионного эндопротезирования тазобедренного сустава можно описать следующим образом. Свищевой ход в области послеоперационного рубца прокрашивается раствором бриллиантовой зелени. Заднебоковым разрезом обнажают вертельную область бедренной кости и заднюю стенку капсулы тазобедренного сустава. После артротомии, вывихивают головку эндопротеза и поэтапно удаляют его элементы. Проводят тщательный дебриджмент, иссекаются нежизнеспособные ткани, рубцы, в т.ч. и по ходу свищевого хода. Проводят тщательную промывку образовавшихся полостей растворами антисептиков. Из костного цемента, имеющего в составе антибиотик (гентамицин, ванкомицин), интраоперационно изготавливается три части (рис. 1). Первоначально формируется шар, соответствующий размерам вертлужной впадины пациента. На дно вертлужной впадины укладывается кусок застывающего костного цемента и распластывается по средней и верхней частям её периметра. Третий, бедренный компонент спейсора изготавливается в виде «седловидной» ножки с опорной выемкой, соответствующей размеру шара для более плотного их соприкосновения. Цемент в стадии застывания полностью заполняет все неровности проксимального отдела бедренной кости. Шар укладывается в вертлужную впадину, а опорная часть ориентируется относительно него. Далее восстанавливают целостность капсулы сустава и рану ушивают послойно с установкой дренажной системы. На второй день после операции пациента активизируют. Ходьбу разрешают через 2-3 дня с частичной нагрузкой (используют костыли). Пациенту проводят соответствующую антибиотикотерапию, лечебную физкультуру. Общий срок первого этапа лечения с использованием спейсора, при отсутствии признаков воспалительного процесса, составляет 2-3 месяца.
В дальнейшем производят замену спейсора на ревизионный протез.
Рисунок 1. Двухполюсный спейсер тазобедренного сустава, где:
позицией А обозначена подвздошная кость, В – первая часть устройства (в виде вогнутой шайбы), С – вторая часть в виде шара, Д – опорная часть в форме «седловидной» ножки бедренного компонента спейсера, Е – бедренная кость
Клинический пример. У больного Б., 47 лет, оперированного в декабре2006 г. по поводу левостороннего идиопатического коксартроза, произошло расшатывание чашки эндопротеза вследствие вялотекущей хронической инфекции третьего типа по (Coventry-Fitzgerald-Tsukayama). Через три года после операции появились периодические боли в оперированном суставе и открылся свищ. Прием антибиотиков и нестероидных противовоспалительных препаратов купировал болевой синдром лишь на некоторое время. В ноябре2009 г. произведено ревизионное вмешательство: обнаружена толстая гиперемированная рубцовая капсула сустава, при вскрытии которой выделился гной с белыми хлопьями. Иссечены нежизнеспособные ткани, свищевой ход, рубцы. Был выполнен тщательный туалет раны с растворами антисептиков. Эндопротез удален вместе с цементом. Интраоперационно из костного цемента с гентамицином изготовлен и установлен двухполюсной спейсер. В область сустава введена дренирующая промывная система. Анализ бактериологического исследования показал наличие гемолитического стафилококка, чувствительного к цефтриаксону. Этот антибиотик больной получал в послеоперационном периоде в течение 14 дней. Дренажно-промывная система использована до 7 дней. В послеоперационном периоде повышения температуры не было. Рана зажила первичным натяжением. Больной выписан на амбулаторное лечение. Пациент повторно оперирован через 3 месяца. Было выполнено удаление спейсера и ревизионное тотальное бесцементное эндопротезирование тазобедренного сустава. Осмотрен через 3, 6, 12 месяцев, послеоперационный рубец состоятелен, без признаков воспаления. Температуры за весь постгоспитальный период не было.
Заключение
Наш опыт 11 случаев применения двухполюсного спейсера показал преимущества этого метода лечения, так как наряду с санацией, созданием депо антибиотиков обеспечивает сохранение длины ноги, безболезненных движений в тазобедренном суставе. Из-за высокой сложности реэндопротезирования и дороговизны этот вид операций должен выполняться только в специализированных ортопедических центрах при наличии подготовленной операционной бригады, соответствующего оборудования и инструментария.
И.Ф. Ахтямов, Г.Г. Гарифуллов, И.Ш. Гильмутдинов, М.И. Митронин, Л.Б. Резник, Э.Б. Гатина
Казанский государственный медицинский университет
Республиканская клиническая больница, г. Казань
Ахтямов Ильдар Фуатович — доктор медицинских наук, профессор, заведующий кафедрой травматологии, ортопедии и хирургии экстремальных состояний
1. Ахтямов И.Ф., Кузьмин И.И. Ошибки и осложнения эндопротезирования тазобедренного сустава. — Казань: Центр оперативной печати, 2006. — 328 с.
2. Даниляк В.В., Ключевский В.В., Гильфанов С.И., Репин С.В. Профилактика инфекционных осложнений при эндопротезировании тазобедренного сустава. Материалы конгресса травматологов-ортопедов с международным участием. — Ярославль, 1999. — С. 117-118.
3. Ефименко Н.А., Грицюк А.А., Середа А.П., Давыдов Д.В., Самойлов А.С. Профилактика инфекций области хирургического вмешательства в травматологии и ортопедии: использование антибиотиков в костном цементе // Инфекции в хирургии. — 2009. —№ 2.
4. Зубков М.Н., Уразгильдеев З.И. Антибиотикопрофилактика и антибиотикотерапия гнойных осложнений в травматологии и ортопедии. Пособие для врачей. — М., 2000.
5. Кузьмин И.И. Патогенетические особенности инфекционного процесса в травматологии и ортопедии // Вестник травматологии и ортопедии им. Н.Н. Приорова. — 2000. — № 4. — С. 67-71.
6. Прохоренко В.М. Первичное и ревизионное эндопротезирование тазобедренного сустава. — Новосибирск, 2007. — 196 с.
7. Сабодашевский О.В., Сабодашевский В.В., Пописьянц Р.А. Способ создания цементного спейсера тазобедренного сустава. Патент на изобретение 2003116645/14, 04.06.2003.
8. Руководство по эндопротезированию тазобедренного сустава / под. ред. Р.М. Тихилова, В.М. Шаповалова. — СПб., 2008. — 141 с.
Спейсер тазобедренного сустава что это
Периимплантная инфекция у пациентов с эндопротезированием тазобедренного сустава выявляется в 1-2 % случаев [1, 46]. При этом после ревизионного эндопротезирования частота инфекционных осложнений колеблется от 4,7 % (при использовании цемента с антибиотиками) до 28 % (без использования цемента с антибиотиками). При сохраняющейся динамике к 2030 году доля ревизионных эндопротезирований составит 22-25 % от числа первичных [5, 7].
Непосредственной причиной воспаления в суставе является попадание возбудителя в операционную рану, которое возможно при непосредственном прямом проникновении агента во время хирургического вмешательства, контаминации раны в раннем послеоперационном периоде, гематогенном попадании возбудителя из отдаленных очагов хронической инфекции в организме, реактивации «дремлющей» инфекции в суставе [1, 4].
При инфекционных осложнениях используются открытый дебридмент, длительное промывание полости сустава антисептиками, массивная патогенетически оправданная антибактериальная терапия, одноэтапное реэндопротезирование, хотя эффективность их применения отмечается только у 27-30 % больных [3, 4, 19]. Оптимальным на современном этапе считается сочетание антимикробной терапии, радикальной хирургической обработки гнойного очага с обязательным удалением имплантов и костного цемента, продолжительного по времени дренирования, адекватного дезинтоксикационного лечения и установки цементного спейсера с антибиотиками [3].
Факторы, влияющие на выбор тактики лечения инфекции в области тазобедренного сустава после его тотального эндопротезирования. При эндопротезировании крупных суставов ситуация осложняется возникновением имплантат-ассоциированной инфекции, главными особенностями которой являются:
Большинство используемых в настоящее время подходов к лечению инфекционных осложнений заключается в применении традиционной антибактериальной терапии, при этом протоколы лечения периимплантной инфекции тазобедренного сустава после тотального эндопротезирования базируются на результатах микробиологических исследований, выполняемых периоперационно. Безусловно, ряд возбудителей могут быть элиминированы с помощью системной антибиотикотерапии, однако при развитии инфекций, связанных с ортопедическими имплантами, специалисты сталкиваются с фенотипически иными формами бактерий [15, 38, 40]. Было показано, что при использовании рутинных культуральных методов выявляется лишь относительно небольшая доля широкого спектра патогенных микроорганизмов. Установлено, что в этиологии периимплантной инфекции существенное значение имеют антибиотико-резистентные возбудители внутрибольничных инфекций и разнообразные оппортунистические микробы-сапрофиты [7, 19, 40].
Особенностью инфекции при эндопротезировании является и факт адгезии микроорганизмов на поверхности эндопротеза. Микроорганизмы аккумулируются на ней в большом количестве, образуя биопленку, персистируя и становясь устойчивыми к антибиотикам [2].
Известно, что микроколониальные варианты стафилококков и других бактерий могут выживать и размножаться внутриклеточно: в остеобластах, эндотелиальных клетках и даже в полиморфноядерных лейкоцитах и макрофагах [43]. Такие внутриклеточные формы микроорганизмов часто не выявляются традиционно используемым культуральным методом.
Проблема диагностики инфекционных осложнений становится еще более острой с учетом необходимости изучения фенотипов бактерий, способных образовывать биопленки в организме человека [26]. Применение иммунофлюоресцентной микроскопии позволяет обнаружить в 3 раза больше колоний возбудителей, выделяемых из биопленок, чем при световой микроскопии. Амплификация генома при помощи ПЦР показывает наличие бактериальной ДНК более чем в 70 % случаев при развитии инфекционных осложнений эндопротезирования тазобедренного сустава, включая те случаи, которые ранее рассматривались как неблагоприятный исход «асептической» операции [47].
Применение современных высокочувствительных методов выявления микроорганизмов подтвердило, что полимикробная колонизация после длительно существующей инфекции после тотального эндопротезирования тазобедренного сустава представляет скорее правило, чем исключение [28]. Эти результаты позволили большинству исследователей прийти к выводу, что возможность наличия инфекции протеза тазобедренного сустава после тотального эндопротезирования, как правило, существенно недооценивается, поскольку применение культуральных методов нередко не позволяет выявить возбудителей [14].
Большинство видов бактерий, обнаруживаемых на ортопедических имплантах, демонстрируют низкую чувствительность к антибиотикам [47]. Показано, что полная элиминация микроколониальных форм бактерий требует примерно в сто раз более высоких, чем обычно, концентраций антибиотиков. В то же время эти формы возбудителей, как правило, успешно поддаются лечению препаратами системного действия, обладающими внутриклеточной активностью [41]. При этом микроорганизмы, находящиеся в составе биопленки, требуют для элиминации в 10 3 раз более высоких концентраций антибактериальных препаратов [44]. В большинстве случаев эти возбудители устойчивы как к системной антибактериальной терапии, так и действию антибиотиков, высвобождающихся из импрегнированного полиметилметакрилата [22].
Срок выполнения второго этапа лечения варьирует, при этом решение о возможности реимплантации обязательно основывается на клинических, лабораторных данных и результатах визуализации, свидетельствующих о разрешении инфекции, при этом отмечается нормализация уровней СОЭ и C-реактивного белка.
Радикальная санация очага инфекции является необходимым условием успешного лечения любой ортопедической инфекции, однако инфицированное операционное поле не может быть стерилизовано только с помощью хирургической обработки без применения других методов. При этом хирургическая санация устраняет большую часть биологического загрязнения, но не может предупредить замещение остаточного количества бактериальных колоний в санированной области другими микроорганизмами.
Концентрации антибиотиков, которые могут быть достигнуты системным введением антибактериальных препаратов или применением локальной антибиотикотерапии доступными препаратами, позволяют осуществить эрадикацию планктонных форм возбудителей, но не являются эффективными в отношении микрокластеров, оставшихся после удаления биопленок микроорганизмов. Вследствие этого возможно повторное развитие инфекции в течение любого промежутка времени. При этом исследователи считают, что отдельные фрагменты биопленок более чувствительны к антибактериальной химиотерапии, чем интактные биопленки [12, 25], тем не менее их элиминация требует использования высоких доз антибактериальных средств, которых невозможно достичь путем применения системной или местной антибиотикотерапии с помощью традиционных средств. Для элиминации остаточных фрагментов биопленок необходимы новые подходы к антимикробной терапии, обеспечивающие достаточно высокие концентрации антибактериальных средств в области инфицированного импланта в течение длительного периода времени [45].
После удаления инфицированного эндопротеза и радикальной некрэктомии образуются костные дефекты. Обязательным этапом хирургической обработки раны традиционно с момента зарождения гнойной хирургии рассматривается устранение «мертвого пространства». Предполагается, что независимо от того, какой наполнитель используется для его ликвидации, необходимо предупредить микробную колонизацию «мертвого пространства», которая возникает вследствие остаточного бактериального загрязнения. Устранение «мертвого пространства» при инфицировании протеза после тотального эндопротезирования тазобедренного сустава осуществляется путем применения цемента, импрегнированного антибиотиком, спейсеров или цементных бус с антибиотиком [36, 49]. Однако эти устройства выполняют лишь механическую функцию и не могут рассматриваться в качестве основной антибиотикотерапии. Антибактериальный компонент в составе таких устройств обеспечивает краткосрочную профилактику, направленную против планктонных бактерий, не позволяющую стерилизовать область, контаминированную так называемыми «сидячими» формами бактерий, а также предупредить образование биопленок [3, 6, 11, 20, 33].
Независимо от срока с момента удаления предыдущего импланта при установке нового протеза в недавно инфицированную область хирург должен учитывать повышенный риск неблагоприятного исхода операции как при одно-, так и при двухэтапном ревизионном эндопротезировании. Возможное последующее удаление протеза должно быть легко осуществимым и сопряженным с низким риском дополнительных повреждений костных структур.
При использовании таких спейсеров становится возможной профилактика усиления биологического загрязнения в области сустава и снижение риска развития контрактуры мягких тканей [15, 31]. Недавние исследования позволяют предположить, что использование цемента, импрегнированного антибиотиком, избавляет от необходимости использования системной антибактериальной терапии, что способствует значительному снижению расходов на их лечение [8, 24, 42]. Полагают, что при смешении цемента с антибактериальным средством важно создать как можно более пористый материал для улучшения высвобождения гентамицина, а также использовать цемент на поздних стадиях полимеризации для предупреждения его врастания в костные структуры, что может значительно усложнить удаление цемента на втором этапе ревизионного эндопротезирования [10]. Смешивание цемента с антибиотиком в вакууме обеспечивает увеличение его механической прочности, однако при этом снижается пористость, вследствие чего может снижаться высвобождение антибиотика [17].
Лекарственные средства для изготовления цемента, импрегнированного антибиотиком, подбирают на основании результатов оценки чувствительности к ним инфекционных агентов. Эти препараты должны соответствовать критериям, разработанным W.R. Murray (1984), которые включают: безопасность, термостабильность, гипоаллергенность, водорастворимость, адекватный спектр бактерицидной активности, возможность получения препарата в форме стерильного порошка [39].
Механические свойства цемента, импрегнированного антибиотиком, зависят от их соотношения в смеси. Установлено, что масса антибактериального средства не должна превышать 10 % массы цемента для того, чтобы предупредить возможный перелом цементного спейсера [7, 20]. Добавление к цементу антибактериального препарата в форме раствора ухудшает механические свойства цемента, импрегнированного антибиотиком, вследствие чего увеличивается риск перелома спейсера. Однако P.H. Hsieh et al. (2009) в исследовании на 42 пациентах, подвергшихся ревизионному эндопротезированию по поводу инфекционных осложнений эндопротезирования тазобедренного сустава, показали, что использование для спейсеров костного цемента с гентамицином в форме раствора обеспечивает эффективную доставку антибактериального средства в область сустава в отсутствие системных побочных эффектов [30].
К наиболее часто используемым в составе костного цемента антибиотикам относятся тобрамицин, гентамицин и ванкомицин [39, 44]. Комбинация ванкомицина и препарата из группы аминогликозидов обеспечивает широкий спектр антибактериальной активности, в том числе против бактерий, которые чаще всего являются возбудителями глубокой инфекции протеза тазобедренного сустава, при этом не наблюдается образование устойчивых штаммов [7].
При использовании временных спейсеров дозировка антибиотиков может достигать 20 г на 40 г костного цемента при отсутствии системных побочных эффектов. При наличии грибковой инфекции наряду с антибактериальными препаратами добавляют от 100 до 150 мг амфотерицина B на каждые 40 г костного цемента [17].
Было показано, что имплантация спейсера из цемента, импрегнированного антибиотиком, сокращает необходимую длительность системной антибиотикотерапии, что позволяет снизить системную токсичность антибактериальных средств и частоту появления устойчивых штаммов [24, 42]. Кроме того, благодаря ранней мобилизации при их применении снижается частота развития осложнений, связанных с длительным лежачим положением пациентов [19].
Спейсеры разделяют на статические (неартикулирующие), интрамедуллярные штифты и шарнирные (артикулирующие, мобильные) спейсеры. Несмотря на удовлетворительные характеристики выделения антибиотика цементными бусами [7], в настоящее время они используются редко вследствие сопряженного с их применением укорочения конечности, которое сопровождается увеличением затрат энергии при ходьбе, потерей ткани, контрактурой мягких тканей и рубцовым процессом, что, в свою очередь, вызывает сложности при последующем обнаружении и удалении бус на втором этапе лечения инфекции [41].
Статические или простые блоковидные спейсеры обеспечивают высокие местные концентрации антибактериальных средств, реализуя при этом функцию сохранения суставного пространства для выполнения последующей операции ревизионного эндопротезирования. Такие конструкции облегчают хирургический доступ во время реимплантации протеза и позволяют доставить в область сустава антибиотики, подобранные в соответствии с результатами оценки чувствительности микроорганизмов [12, 29].
Недостатком статического спейсера является то, что его использование не обеспечивает физиологические движения в суставе, вызывая образование рубцов вокруг импланта и развитие мышечных контрактур и, как следствие, снижение частоты успешных исходов и ухудшение качества жизни пациентов в течение длительного периода лечения. Другим недостатком статического спейсера является повреждение костных структур, связанное с миграцией импланта. В то же время применение таких устройств более эффективно в отношении профилактики развития остаточной микрофлоры по сравнению с использованием мобильных спейсеров [12, 29].
Основным общим недостатком при использовании артикулирующих спейсеров является их нестабильность при исходной дисплазии, деструкции вертлужной впадины или пострезекционных дефектах проксимального отдела бедренной кости. Отсутствие большого (свыше 40 %) фрагмента площади крыши или дна вертлужной впадины наряду с утратой мест прикрепления ротаторов бедренной кости может приводить к послеоперационному вывиху спейсера, снижению его антибактериальных свойств и в полной потере опороспособности конечности [15, 10, 31].
Основной целью использования шарнирных (мобильных, артикулирующих) устройств является сохранение функции сустава и мягких тканей в течение периода ожидания реимплантации для того, чтобы облегчить проведение операции на втором этапе лечения. Было показано, что применение шарнирных спейсеров уменьшает степень повреждения костных структур в процессе лечения по сравнению с применением статических спейсеров [31]. C.P. Duncan, C.A. Beauchamp (1993) впервые описали успешное использование данного вида устройств для двухэтапного ревизионного эндопротезирования при лечении инфекционных осложнений после тотального эндопротезирования тазобедренного сустава [21]. Исследователи отмечают, что контакт между головкой бедренной кости, выполненной из цемента, и костной поверхностью вертлужной впадины может вызывать развитие эрозий кости и дискомфорт. Поэтому было предложено использование цементного компонента и для поверхности вертлужной впадины с целью предупреждения повреждения седалищной кости [34]. Использование такой тактики дает возможность увеличения местных концентраций антибиотиков вследствие наличия большей площади поверхности цемента, высвобождающей антибактериальный препарат, а также длительного взаимодействия цементных компонентов между собой. В то же время артикуляция цементных компонентов снижает объем движений в суставе, что способствует ощущению дискомфорта у пациентов [48].
Следует отметить, что у шарнирных спейсеров имеется и ряд недостатков, к которым относят:
Шарнирные спейсеры собирают непосредственно в операционной, что позволяет регулировать дозировку антибиотиков. Однако еще одним недостатком является дополнительное время, необходимое на сборку импланта в ходе операции. Кроме того, повышается риск перелома импланта вследствие гетерогенности цемента, существует вероятность токсического действия антибиотиков, поскольку они добавляются к цементу в больших количествах [12].
В настоящее время используются различные варианты шарнирных спейсеров, в частности при реимплантации удаленного протеза после интраоперационной стерилизации. Используется специально разработанный силикон для многократного применения, могут применяться также металлические формы для импланта на металлическом эндоскелете, в качестве которого могут выступать интрамедуллярные штифты или спицы Киршнера [19, 35].
После радикальной хирургической обработки очага инфекции, удаления всех компонентов импланта и отбора, как минимум, пяти образцов ткани для бактериологического и гистологического исследования устанавливают вертлужный цементный компонент без фиксации [24, 29]. Для бедренного компонента применяют бесцементную или цементную фиксацию в проксимальном отделе, вследствие чего возможно легкое удаление обоих компонентов на втором этапе без повреждения костных структур.