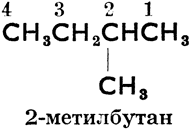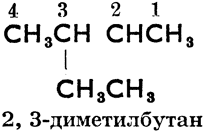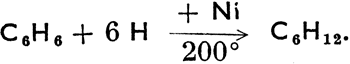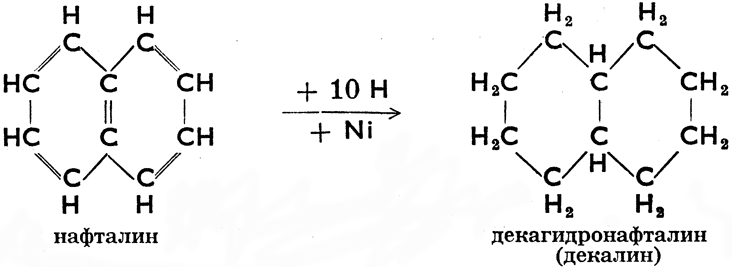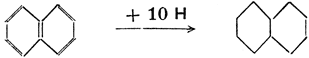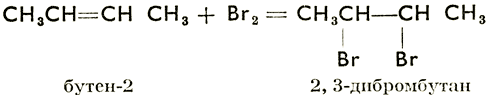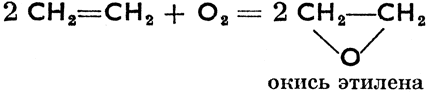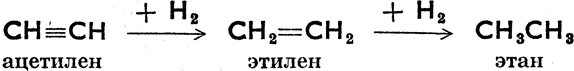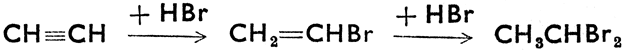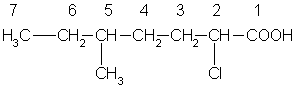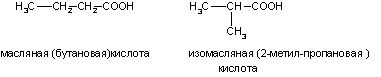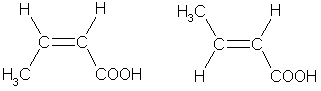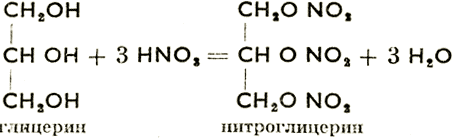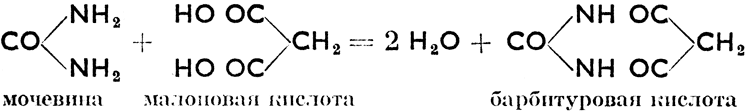сн3 сн2 сн3 что это
Сн3 сн2 сн3 что это
2. Углеводороды
* ( Изомеры, т. к. у них может быть замещен первый или какой-нибудь другой водород. Обозначаем их префиксом «изо», нормальные же углеводороды буквой «н».)
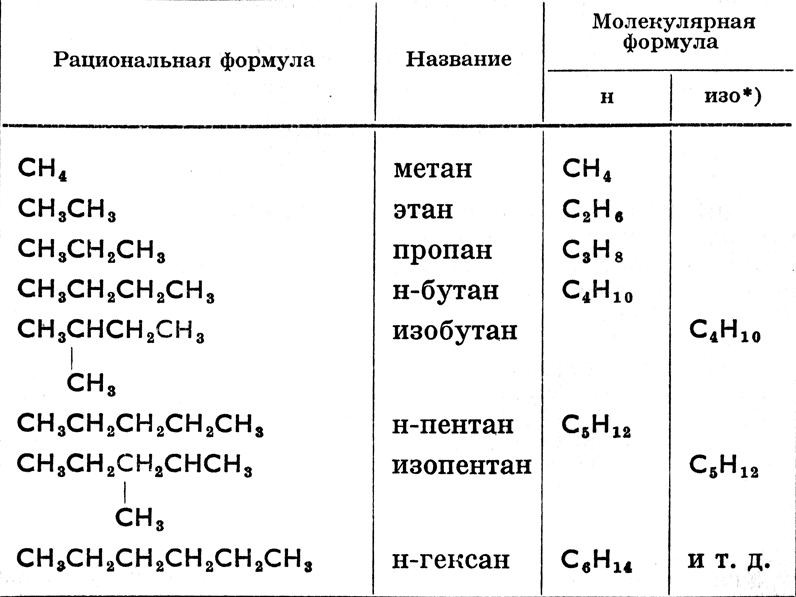
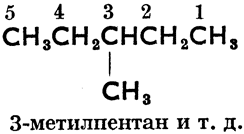
От слова «алкил» произошло также, согласно женевской номенклатуре органических соединений (установленной на международном съезде химиков в Женеве в 1892 году), название парафинов «алканы». Основное правило женевской номенклатуры требует, чтобы зная международное название соединения, можно было написать его формулу и, наоборот, на основании структурной формулы можно было узнать название соединения. Так напр. женевские названия более сложных парафинов произведены от n-углеводородов, углеродные атомы которых перенумерованы, как правило, справа налево следующим образом:
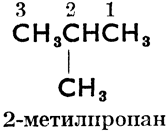
2-метилпропан
2-метилбутан
2, 3-диметилбутан
3-метилпентан
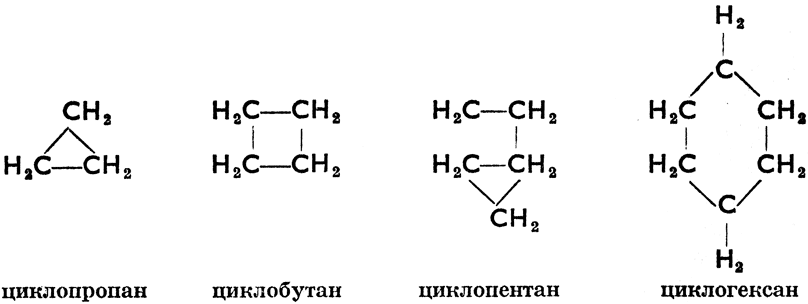
Некоторые циклопарафины находятся в кавказской нефти и называются нафтенами. * Циклогексан можно получить методом каталитической гидрогенизации (действием водорода при высокой температуре в присутствии катализатора, чаще всего тонкорассеянного никеля) из бензина, согласно схеме
* ( Примечание переводчика. Нафтенами в русской литературе называются все циклопарафины.)
Некоторые циклопарафины образуют несколько колец. Мы называем их полициклическими (би-, трициклическими и т. д.). Для того, чтобы и из их молекулярных формул было ясно, что речь bдет о циклических соединениях, к ним приписывается буква R, а у соединений с двумя кольцами 2 R. Точно так же двойную связь обозначаем знаком =, две двойных связи 2 =, тройную связь = и т. д. Из полициклических парафинов особенно важен декалин, известный растворитель. Он получается путем каталитической гидрогенизации нафталина, поэтому иначе и называется декагидронафталин. Эта реакция пробегает по следующей схеме:
Выписывать все углеродные и водородные атомы в формулах органических соединений слишком долго, поэтому принято пользоваться упрощенными формулами, в которых кольца обозначаются многоугольниками. При этом следует обозначать двойные связи. Вышеприведенная схема, таким образом, пишется так:
Если молекула органического соединения содержит две двойных связи, то для его физических и химических свойств важно взаимное положение связи, в зависимости от которого различаем двойные связи кумулированные, С=С=С, конъюгированные, С=С—С=С, и изолориванныеC=C—C—C=C.
Этой реакцией доказывается наличие двойной или тройной связи, т. е. ненасыщенность органических соединений. Испытуемое вещество прибавляется к раствору Вг в хлороформе. Если вещество не насыщено, то раствор брома обесцветится.
Присоединение водородных соединений галогенов:
Реакция присоединения HCl протекает только в присутствии соответствующих катализаторов.
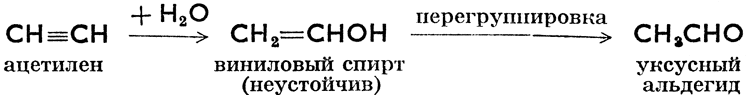
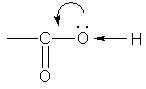
Гидратация (присоединение воды):
может быть осуществлена лишь в случае пропускания смеси этилена и водяных паров при 225°С через подходящий катализатор.
Окисление при двойной связи:
Из сказанного видно, что двойная связь намного реактивнее простой; это проявляется в разнообразнейших химических реакциях, которые обыкновенно с насыщенными соединениями не удаются, или могут проводиться лишь при исключительных условиях.
Эта реакция лежит в основании производства некоторых пластических масс и полимеризации бутадиена:
полимер которого служит исходным продуктом для получения синтетического каучука, тогда как натуральный каучук является полимером изопрена (С5Н8)n, где n неизвестное число.
Гидрогенизация (присоединение водорода);
Присоединение водородных соединений галогенов:
Ацетилиды возникают действием ацетиленов на аммиачные растворы гидроокисей меди и серебра: СН ≡ ССu и CH ≡ CAg; это взрывчатые вещества.
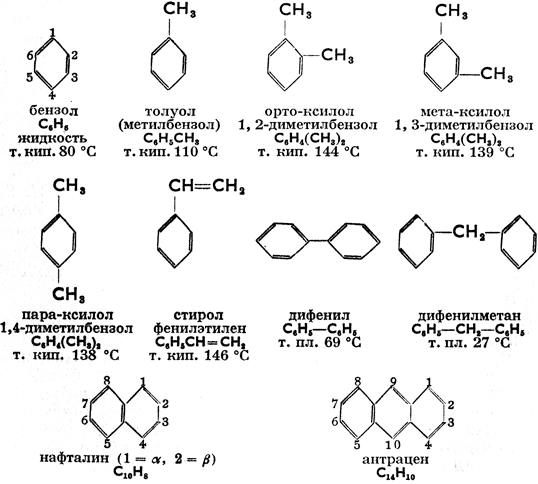
д) Ароматические углеводороды (бензольный ряд)
В молекуле ароматических углеводородов имеется одно или несколько бензольных ядер. Название «ароматические», которое распространяется и на производные этих углеводородов, возникло вследствие того, что первые известные вещества этой группы обладали запахом (ароматом). Ниже приводятся формулы и свойства наиболее важных ароматических углеводородов:
Большинство ароматических углеводородов производится в больших количествах путем фрационированной перегонки каменноугольного дегтя; некоторые, кроме того, путем алкилирования более простых ароматических углеводородов.
В соответствии со структурой ароматические углеводороды должны были бы, имея три двойных связи в ядре, обладать ярко выраженными свойствами ненасыщенных соединений. На самом же деле двойные связи теряют в бензольном ядре свой ненасыщенный характер. Об этом свидетельствует тот факт, что реакции соединения протекают у них лишь при особых условиях. Так напр. они гидрогенизируются в присутствии катализаторов (см. выше о гидрогенизации нафталина). Под действием солнечных лучей бензол дает с хлором соединение С6Н6Сl6 (гексахлорциклогексан). Много легче ароматические углеводороды вступают в реакцию замещения. Напр.:
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Сн3 сн2 сн3 что это
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункционапьными. Среди них различают галогенкарбоновые (например, CH2Cl—COOH), нитро-кислоты (например, NO2—С6Н4СООН), аминокислоты, оксикислоты (например, молочная СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Название «жирные» эти кислоты получили потому, что большинство из них могут быть выделены из жиров.
В свою очередь, группа ОН «гасит» положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:
Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание «карбоновая кислота» и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают:
Гептадецен-8-карбоновая (олеиновая) кислота
Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса «диовая» и слова «кислота». Например, этандиовая (щавелевая) кислота (НООС-СООН).
При рассмотрении карбоксильной группы как заместителя, название двухосновной кислоты производят от названия углеводородного радикала с добавлением словосочетания «дикарбоновая кислота». Например, малоновую кислоту (НООС-СН2-СООН) называют метандикарбоновой кислотой.
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
2. Изомерия положения кратной связи, например:
СН2=СН—СН2—СООН СН3—СН=СН—СООН
Бутен-3-овая кислота Бутен-2-овая кислота
(винилуксусная кислота) (кретоновая кислота)
3. Цис-транс- изомерия, например:
4. Межклассовая изомерия: например, масляной кислоте (СН3—СН2—СН2—СООН) изомерны метиловый эфир пропановой кислоты (СН3—СН2—СО—О—СН3) и этиловый эфир уксусной кислоты (СН3—СО—О—СН2—СН3).
5. У гетерофункциональных кислот имеется изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты:
СН3—СН2—СНСl—СООН СН3—СНСl—СН2—СООН
2-хлорбутановая кислота 3-хлорбутановая кислота
Для гетерофункциональных кислот возможна также оптическая изомерия.
Кислоты, содержащие 1-3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
В жидком состоянии и в неводных растворах молекулы монокарбоновых кислот димеризуются в результате образования между ними водородных связей. Это объясняет гораздо более высокие температуры кипения карбоновых кислот по сравнению со спиртами и альдегидами с тем же числом атомов углерода; температуры плавления и кипения с ростом молекулярной массы возрастают.
Сн3 сн2 сн3 что это
3. Обзор важнейших органических соединений
а) Галогенопроизводные (галогениды)
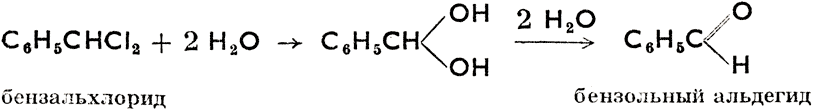
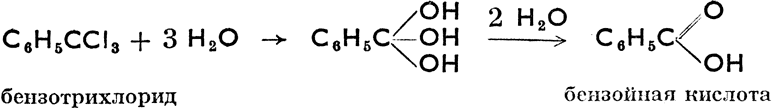
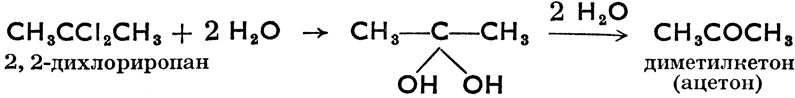
Галогеновые производные углеводородов теоретически образуются из углеводородов замещением атомов водорода галогенами, получают же их или из углеводорода путем галогенирования, или из спиртов действием водородных соединений галогенов или хлоридов фосфора. Из их химических свойств важнейшими являются их способность к гидролизу (действием водяного пара под давлением или растворов щелочей), в результате которого получаются спирты, альдегиды, кетоны и карбоновые кислоты, как это показывают следующие примеры:
Путем разложения дигалогенпроизводных и тригалогенпроизводных должны были бы образоваться дигидрокси- производные и тригидроксипроизводные, но эти соединения неустойчивы (в момент возникновения теряют воду) и тотчас же переходят в альдегиды, кетоны или органические кислоты. Например:
Из приведенных схем видно, что спирты характеризуются функциональной группой 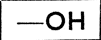
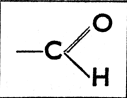
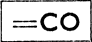
Реакции Вюрца подобна реакция Фиттига:
с ее помощью можно получить более сложные ароматические углеводороды. В присутствии безводного АlСl3 галогениды вступают в реакцию с простыми ароматическими углеводородами, причем получаются углеводороды более сложные. В честь открывших ее химиков она называется реакцией Фриделя-Крафтса. Например:
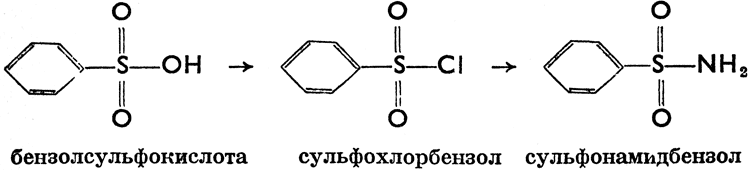
б) Сульфоновые кислоты
Эта реакция является основной при синтетическом производстве фенола.
Сейчас анилин производят, восстанавливая бензол водородом в момент его образования (в новейшее время электрохимически) по схеме: C6H5NО2 (нитробензол) + 6 Н → C6H5NH2 (анилин, аминобензол, фениламин) + 2 Н2О. При восстановлении в кислой среде образуется ряд промежуточных продуктов, которые, однако, не удается выделить. При восстановлении в основной среде побочные реакции проходят по схемам:
Все промежуточные продукты можно получить также непосредственно.
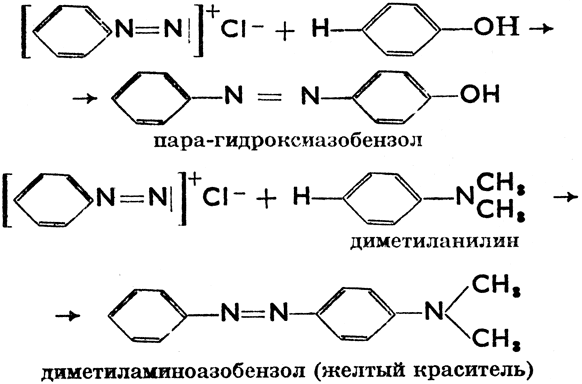
Так как соли диазония в сухом состоянии взрывчаты, то их обыкновенно, немедленно, разными способами обрабатывают дальше.
Эти и подобные реакции (их много, ибо разные диазоамины можно комбинировать с разными фенолами) называются азосочетаниями. Они составляют основу производства искусственных (анилиновых) красителей.
Щелочные металлы вытесняют водород гидроксильной группы с образованием алкоголятов: 2 СН3ОН + 2 Na = 2 CH3ONa + Н2.
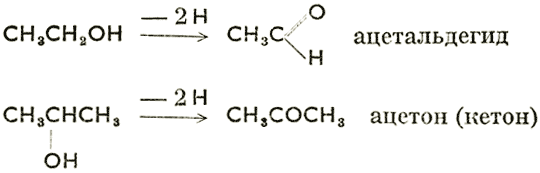
При пропускании паров первичного или вторичного спирта через соответствующий катализатор происходит дегидрогенизация:
С минеральными кислотами спирты дают минеральные сложные эфиры. Важнейшие из этих соединений: диметилсульфат, CH3O—SO2—ОСН3, и нитроглицерин, получаемый согласно схеме:
При нитровании глицерина температуру нельзя поднимать выше 30°С, т. к. нитроглицерин сильнейшее взрывчатое вещество. Это бесцветная ядовитая жидкость (применяется в медицине при сердечных заболеваниях и в технике при производстве динамита).
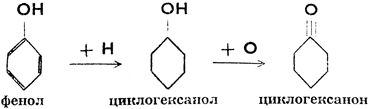
Циклогексанол служит сырьем для получения синтетических волокон (найлон, силон). При окислении превращается в циклогексанон (кетон).
з) Альдегиды и кетоны
т. е. из альдегида получаются первичный спирт и карбоновая кислота.
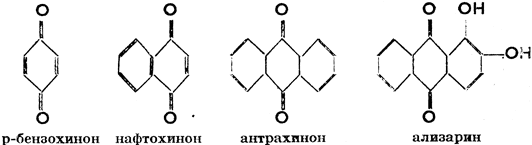
Добытые из ароматических углеводородов двухатомные кетоны зовутся хинонами. Получаются они окислением двухатомных фенолов и имеют структуру:
Из хинонов наибольшее значение имеет антрахинон. Кристаллизуется он в виде желтоватых иголочек с т. пл. 285 °С. Производится окислением антрацена (из дегтя); служит ценным сырьем для производства красок, в особенности ализарина (путем сульфирования антрахинона получается сульфокислота, соль которой сплавляется с NaOH).
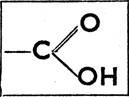
и) Карбоновые кислоты и их производные
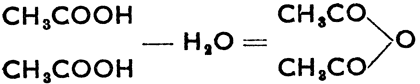
Получаются нагреванием хлорангидрида с уксуснокислым натрием. Амиды кислот образуются действием NH, на хлорангидриды кислот, напр.: СН3СОСl + HNH2 = HCl + CH3CONH2, амид уксусной кислоты (ацетамид). Могут быть получены также путем нагревания:
Нитрилы кислот получаются действием дегидратационных реактивов на амиды, теряя воду по формуле:
— нитрил уксусной кислоты (метилцианид). Простейшим нитрилом является нитрил муравьиной кислоты HCN,
Сложные эфиры кислот получаются путем этерификации, напр.:
которое является основой производства глицерина и мыла из жиров.
Растительные масла, содержащие глицериды ненасыщенных высших кислот (линолевой и линоленовой), на воздухе подвергаются полимеризации, т. е. превращаются в смолистые вещества. Такие «высыхающие» на воздухе масла (напр. льняное) используются для приготовления олифы.
Многоосновные кислоты имеют в молекулах две или больше карбоксильные группы. В зависимости от этого различаются кислоты двуосновные, трехосновные и т. д., напр.:
Этим названием обозначаются широко распространенные в природе вещества, возникающие в растительных организмах путем ассимиляции, сложной химической реакции, в которой участвуют вода, СО2 из воздуха и которой содействуют зерна хлорофилла, находящиеся в зеленой листве растений, и солнечный свет. Различаются углеводы:
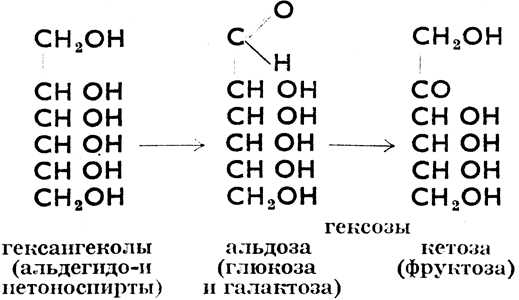
а) простые, с определенным молекулярным весом (моносахариды: глюкоза, фруктоза и галактоза, дисахариды: сахароза, мальтоза и лактоза).
б) сложные, полисахариды, молекулярный вес которых неизвестен (крахмал, декстрин, целлюлоза),
Моносахариды производятся из шестиатомных спиртов, гекситов, которые могут быть окислены по схеме:
У всех одна и та же молекулярная формула C6H12O6.
Сложные сахара характеризуются тем, что при гидролизе (кислотами) они, разлагаясь, дают моносахариды. Напр.:
Полисахариды гидролизом разлагаются по схеме:
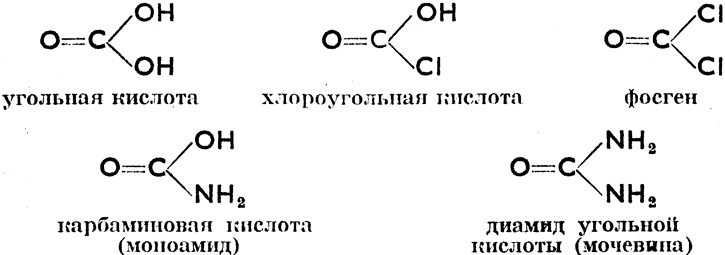
л) Производные угольной кислоты
м) Гетероциклические соединения