Овариальная супрессия что это
Овариальная супрессия что это
Т.Ю. Семиглазова (1, 2), И.В. Берлев (1, 2), Е.А. Ульрих (1, 3), В.В. Семиглазов (1, 3), А.Э. Протасова (2, 4), Н.А. Бриш (1), Е.А. Коробейникова (1), Ю.В. Алексеева (1), Л.В. Филатова (1, 2), А.И. Семенова (1), Д.Х. Латипова (1), Г.М. Телетаева (1), Е.В. Ткаченко (1), В.В. Клименко (1), Г.А. Дашян (1), С.А. Проценко (1), Р.М. Палтуев (1), А.Ф. Урманчеева (1, 2), П.В. Криворотько (1, 2), В.Ф. Семиглазов (1, 2)
1 Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия; 2 Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия; 3 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия; 4 Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Эволюция эндокринной терапии рака молочной железы (РМЖ) насчитывает более 120 лет, с того момента как в 1896 г. G. Beatson впервые осуществил овариальную супрессию больным РМЖ путем хирургической кастрации – овариэктомии [1]. В 1939 г. P. Ulrich первым описал положительный опыт применения тестостерона двумя больными РМЖ [2]. В 1962 г. с помощью радиоактивного эстрадиола были обнаружены рецепторы к эстрагенам, позднее, в 1985 г., стали определять и рецепторы к прогестерону [3]. В 1971 г. Walpole и Cole в ходе клинических исследований впервые установили эффективность тамоксифена. В 1977 г. FDA зарегестрировала тамоксифен в качестве препарата для лечения метатстатического РМЖ, с того момента начался современный этап лекарственной терапии РМЖ.
В 1982 г. J. Klijn описал применение агонистов гонадотропин-релизинг гормона (аГнРГ) вместо овариоэктомии у женщин с метастатическим РМЖ и сохраненной менструальной функцией [4].
В настоящее время, согласно современным клиническим рекомендациям, у женщин в постменопаузе с первично операбельным РМЖ в качестве адъювантной гормональной терапии применяются селективные антиэстрогены (тамоксифен) и ингибиторы ароматазы (ИА). Механизм действия ИА состоит в том, что за счет блокировки фермента ароматазы снижается синтез эстрогенов в перефирических тканях, что приводит к повышению синтеза эстрогенов в яичниках. Следовательно, ИА противопоказаны при сохранной функции яичников и могут назначаться только больным, достигшим стойкой менопаузы, в т.ч. с помощью медикаментозной или хирургической овариальной супрессии (ОС). При назначении ИА в пременопаузе необходимо использовать их только в комбинации с ОС [6, 7].
Методы овариальной супрессии
Подавление функции яичников, или «овариальная супрессия», обычно достигается одним из трех методов: хирургическим, лучевым, лекарственным.
Термин ОС подразумевает необратимость воздействия, т.е. хирургическую кастрацию или облучение [6].
К обратимым методам подавления функции яичников относится лекарственный метод посредством применения аГнРГ, но при этом не всегда обеспечивается полное подавление функции яичников, особенно у женщин молодого возраста. Так как определение ФСГ в период лечения аГнРГ неинформативно, для подтверждения полной ОС необходимо определение эстрадиола в сыворотке крови. Прием ИА следует начинать через 6 недель после первого введения аГнРГ.
Зависимость частоты наступления аменореи от возраста и режима химиотерапии
Бесплодие после ХТ у женщин репродуктивного возраста встречается с частотой от 30 до 70%. До наступления пубертатного периода воздействие ХТ на яичники менее выражено. Широко известно, что ХТ разрушает овариальный резерв яичников, цитостатики вызывают деструкцию в ядрах клеток гранулезы, приводят к атрезии ооцита. Таким образом, подавление оогенеза с помощью аГнРГ может оказать защитное действие на фолликулогенез.
Многие исследования международного уровня доказали зависимость наступления аменории от возраста и выбора схемы ХТ. В процессе лечения женщине детородного возраста необходимо назначать надежные средства контрацепции как в период лекарственной терапии, так и в ближайший срок после ее окончания. Врачам следует предупреждать пациентов о возможном негативном влиянии лекарственного лечения на функцию яичников и фертильность. Данные о возможности сохранения фертильности с помощью аГнРГ противоречивы, поэтому до начала лечения молодым женщинам, планирующим беременность в перспективе, необходимо рекомендовать консультацию врача-репродуктолога для решения вопроса о возможных вариантах реализации детородной функции.
Самая низкая частота развития аменореи (13–15%) наблюдается у женщин моложе 40 лет, тогда как в возрасте старше 50 лет частота наступления менопаузы достигает 97% [8–10].
В недавно опубликованных результатах исследования «DATA», в которое были включены 329 пациенток с диагнозом РМЖ и установленной аменореей в результате проведения ХТ, было показано, что у 12% когорты произошло восстановление функции яичников в течение 30 месяцев после назначения гормонотерапии селективным нестероидным ИА (анастрозол) [11]. Также было отмечено, что у 5,1% пациенток с восстановленной менструальной функцией средний возраст на момент начала терапии ИА превышал 50 лет (у 25,2% пациенток, средний возраст – менее 50 лет). Также было показано, что уровень эстрадиола при приеме ИА был выше у женщин с восстановленной функцией яичников по сравнению с группой пациенток с аменореей после ХТ, которые также принимали ИА.
Исходя из данных этого исследования, следует сделать вывод, согласно которому при назначении гормональной терапии ИА необходимо определять уровни эстрадиола и ФСГ в крови, это связано с тем, что аменорея после проведения ХТ не является достаточным признаком достижения стойкой менопаузы. С учетом данных исследований, а также уровня заболеваемости РМЖ и структуры заболевания по возрасту можно предполагать, что назначение препаратов, приводящих к ОС, показано приблизительно 10% больным РМЖ [12–13].
Место аГнРГ в международных рекомендациях по сохранению фертильности у женщин со злокачественным новообразованием
Следует помнить, что задачей лечения больных ранним РМЖ в пременопаузе служит не только достижение клинического эффекта, но и сохранение фертильной функции с восстановлением исходного качества жизни по завершении адъювантной ХТ, что достижимо при применении лекарственной ОС с помощью аГнРГ: трипторелин 3,75 мг внутримышечно 1 раз в 28 дней; гозерелин 3,6 мг внутримышечно 1 раз в 28 дней; бусерелин 3,75 мг внутримышечно 1 раз в 28 дней; лейпрорелин 3,75 мг внутримышечно 1 раз в 28 дней.
По данным исследования J.M. Letourneau et al. (2012), около 47% молодых женщин, страдающих ранним РМЖ, хотели бы реализовать свою репродуктивную функцию после окончания лечения [14].
В последние годы было проведено множество крупных рандомизированных клинических исследований пациенток с РМЖ, получающих ОС с помощью аГнРГ на фоне адъювантной ХТ с целью оценки наиболее безопасной стратегии сохранения фертильной функции.
В исследовании (PROMISE-GIM6; Del Mastro L. et al., 2011) показано значительное снижение частоты развития преждевременной недостаточности яичников (ПНЯ) в группе, получавшей «ХТ+трипторелин» в течение года наблюдения после завершения курса ХТ (9 против 26%; относительный риск [OР]=0,28, 95% доверительный интервал [ДИ] – 0,14–0,59), а также при последующем длительном наблюдении (медиана – 7,3 года) [15]. Кроме того, отмечено увеличение частоты спонтанных беременностей в группе, получавших «ХТ+трипторелин».
Эта информация подтверждается данными мета-анализа 12 рандомизированных клинических исследований, опубликованного в 2015 г.: ОС с помощью аГнРГ значительно снижает риск развития преждевременной недостаточности яичников (ОР=0,36; p
1. Beatson G., Edin M. On the treatment of inoperable 10 cases of carcinoma of the mamma: Suggestions for a new method of treatment of illustrative cases. Lancet. 1896:104–7.
2. Ulrich P. Testosterone (hormone mâle) et son rôle possible dans le traitement de certains cancers du Sein, Unio. Internat. Contra Cancrum. 1939;4:377.
3. Horwitz K., Wei L., Sedlacer S., d’Arville C.N. Progestin action and progesterone receptor structure in human breast cancer: a review. Recent Prog. Horm. Res. 1985;41:249–316.
4. Klijn J.G.M., de Jong F.H. Treatment with luteinising hormone releasing hormone analogue (Buserelin) in premenopausal patients with metastatic breast cancer. Lancet. 1982:1213–16.
5. Покровский В.М., Коротько Г.Ф. Физиология человека. 2-е изд., перераб. и доп. М.: 2003. 656 с.
6. Стенина М.Б., Жукова Л.Г., Королева И.А., и др. Практические рекомендации по лекарственному лечению инвазивного рака молочной железы. Злокачественные опухоли. Практические рекомендации RUSSCO. 2017;7:105–34.
7. Семиглазов В.Ф., Палтуев Р.М., Манихас А.Г. и др. Клинические рекомендации РООМ по диагностике и лечению РМЖ. Санкт-Петербург, 2017.
8. Fornier M.N., Modi S., Panageas K.S., et al. Incidence of chemotherapy-induced, long-term amenorrhea in patients with breast carcinoma age 40 years and younger after adjuvant anthracycline and taxane. Cancer. 2005;104(8):1575–79.
9. Abusief M.E., Missmer S.A., Ginsburg E.S., et al. The effects of paclitaxel, dose density, and trastuzumab on treatment-related amenorrhea in premenopausal women with breast cancer. Cancer. 2010;116(4):791–98.
10. Swain S., Land S.R., Ritter M., et al. Amenorrhea in premenopausal women on the doxorubicin-and-cyclophosphamide-followed-by-docetaxel arm of NSABP B-30 trial Breast Cancer. Res. Treat. 2009;113:315–20.
11. Hellemond I., Vriens I., Peer P., et al. Ovarian function recovery during anastrozole in breast cancer patients with chemotherapy-induced ovarian function failure. J. Natl. Cancer Inst. 2017 Dec 1;109(12).
12. de Pedro M., Otero B., Martín B. Fertility preservation and breast cancer: a review. Ecancermedicalscience. 2015;9:503.
13. Kim S., Klemp J., Fabian C. Breast cancer and fertility preservation. Fertil. Steril. 2011;95(5):1535–43.
14. Letourneau J.M., Smith J.F., Ebbel E.E., et al. Racial, socioeconomic, and demographic disparities in access to fertility preservation in young women diagnosed with cancer. Cancer. 2012;118(18):4579–88.
15. Del Mastro L, Boni L., Michelotti A., et al. Effect of the gonadotropin releasing hormone analogue triptorelin on the occurence of chemotherapy-induced early menopause in premenopausal women with breast cancer: a randomized trial. JAMA. 2011;306(3):269–76.
16. Lambertini M., Ceppi M., Poggio F., et al. Ovarian suppression using luteinizing hormone releasing hormone agonists during chemotherapy to preserve ovarian function and fertility of breast cancer patients: a metaanalysis of randomized studies. Ann. Oncol. 2015;26(12):2408–19.
17. Venturelli М., Guaitoli G., Omarini C., Moscetti L. Spotlight on triptorelin in the treatment of premenopausal women with early-stage breast cancer. Breast Cancer. 2018;10:39–49.
18. Lambertini M. Cancer and fertility preservation: international recommendations from an expert meeting. BMC Medicine. 2016;14:1.
19. Lambertini M. Pooled analysis of five randomized trials investigating temporary ovarian suppression with gonadotropin-releasing hormone analogs during chemotherapy as a strategy to preserve ovarian function and fertility in premenopausal early breast cancer patients. San Antonio Breast Cancer Symposium. 2017. Abstract GS4-01.
20. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005;365(9472):1687–717.
21. Coates A., Winer E., Goldhirsch A., et al.; Panel Members. Tailoring therapies improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann. Oncol. 2015;26:1533–46.
22. Gradishar W., Anderson B., Balassanian R. NCCN guidelines Breast Cancer version 1.2016. J. Natl. Compr. Canc. Netw. 2015;13(12):1475–85.
23. Senkus E., Kyriakides S., Ohno S., et al.; ESMO Guidelines Committee. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2015;26 (Suppl. 5):v8–30.
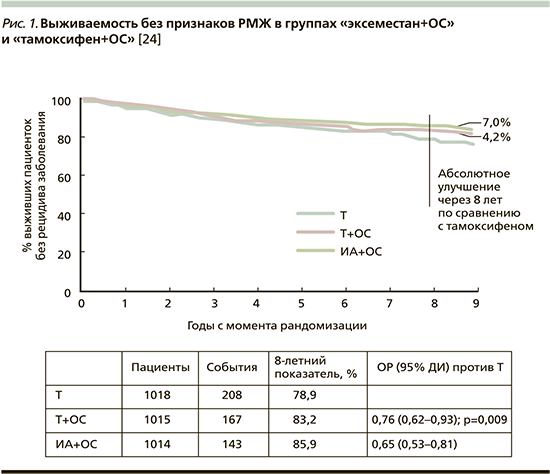
24. Burstein H.J., Lacchetti C., Anderson H. Adjuvant Endocrine Therapy for Women With Hormone Receptor–Positive Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update on Ovarian Suppression. J. Clin. Oncol. 2016;34:1689–701.
25. Francis P.A., Regan M.M., Fleming G.F., et al.; SOFT Investigators; International Breast Cancer Study Group. Adjuvant ovarian suppression in premenopausal breast cancer. N. Engl. J. Med. 2015;372:436–46.
26. Pagani О., Regan M.M., Walley B.A. et al; TEXT and SOFT Investigators; International Breast Cancer Study Group. Adjuvant exemestane with ovarian suppression in premenopausal breast cancer. N. Engl. J. Med. 2014;371:107–18.
27. Regan M.M., Francis P.A., Pagani O., et al. Absolute Benefit of Adjuvant Endocrine Therapies for Premenopausal Women With Hormone Receptor–Positive, Human Epidermal Growth Factor Receptor 2–Negative Early Breast Cancer: TEXT and SOFT Trials. J. Clin. Oncol. 2016;34:2221–31.
28. Fleming G, Francis PA, Láng I, et al. Randomized comparison of adjuvant tamoxifen (T) plus ovarian function suppression (OFS) versus tamoxifen in premenopausal women with hormone receptor-positive (HR+) early breast cancer (BC): Update of the SOFT trial. SABCS. 2017. Abstract 844 GS4-03.
29. Francis P. on behalf of Pagani O., Regan M.M., Fleming G.F., et at. Randomized comparison of adjuvant aromatase inhibitor exemestane (E) plus ovarian function suppression (OFS) vs tamoxifen (T) plus OFS in premenopausal women with hormone receptor positive (HR+) early breast cancer (BC): Update of the combined TEXT and SOFT trials. SABCS. 2014. Abstract 844 GS4-02.
30. Ribi K., Luo W., Bernhard J., et al. Adjuvant tamoxifen plus ovarian function suppression versus tamoxifen alone in premenopausal women with early breast cancer: patient-reported outcomes in the suppression of ovarian function trial. Clin. Oncol. 2016;34:1601–10.
31. Hadji P., Coleman R.E., Wilson C., et al. Management of Aromatase Inhibitor-Associated Bone Loss (AIBL) in postmenopausal women with hormone sensitive breast cancer: Joint position statement of the IOF, CABS, ECTS, IEG, ESCEO, IMS, and SIOG. J. Bone Oncol. 2017;7:1–12.
32. Coleman R., Body J.J., Aapro M., et al.; ESMO Guidelines Working Group. Bone health in cancer patients: ESMO clinical practice guidelines. Ann. Oncol. 2014;25(Suppl. 3):124–37.
33. Committee on Gynecologic Practice ACOG Tamoxifen and uterine cancer. Comm. Opin. 2014;601:1–4.
Овариальная супрессия что это
Т.Ю. Семиглазова (1, 2), И.В. Берлев (1, 2), Е.А. Ульрих (1, 3), В.В. Семиглазов (1, 3), А.Э. Протасова (2, 4), Н.А. Бриш (1), Е.А. Коробейникова (1), Ю.В. Алексеева (1), Л.В. Филатова (1, 2), А.И. Семенова (1), Д.Х. Латипова (1), Г.М. Телетаева (1), Е.В. Ткаченко (1), В.В. Клименко (1), Г.А. Дашян (1), С.А. Проценко (1), Р.М. Палтуев (1), А.Ф. Урманчеева (1, 2), П.В. Криворотько (1, 2), В.Ф. Семиглазов (1, 2)
1 Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия; 2 Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия; 3 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия; 4 Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
Эволюция эндокринной терапии рака молочной железы (РМЖ) насчитывает более 120 лет, с того момента как в 1896 г. G. Beatson впервые осуществил овариальную супрессию больным РМЖ путем хирургической кастрации – овариэктомии [1]. В 1939 г. P. Ulrich первым описал положительный опыт применения тестостерона двумя больными РМЖ [2]. В 1962 г. с помощью радиоактивного эстрадиола были обнаружены рецепторы к эстрагенам, позднее, в 1985 г., стали определять и рецепторы к прогестерону [3]. В 1971 г. Walpole и Cole в ходе клинических исследований впервые установили эффективность тамоксифена. В 1977 г. FDA зарегестрировала тамоксифен в качестве препарата для лечения метатстатического РМЖ, с того момента начался современный этап лекарственной терапии РМЖ.
В 1982 г. J. Klijn описал применение агонистов гонадотропин-релизинг гормона (аГнРГ) вместо овариоэктомии у женщин с метастатическим РМЖ и сохраненной менструальной функцией [4].
В настоящее время, согласно современным клиническим рекомендациям, у женщин в постменопаузе с первично операбельным РМЖ в качестве адъювантной гормональной терапии применяются селективные антиэстрогены (тамоксифен) и ингибиторы ароматазы (ИА). Механизм действия ИА состоит в том, что за счет блокировки фермента ароматазы снижается синтез эстрогенов в перефирических тканях, что приводит к повышению синтеза эстрогенов в яичниках. Следовательно, ИА противопоказаны при сохранной функции яичников и могут назначаться только больным, достигшим стойкой менопаузы, в т.ч. с помощью медикаментозной или хирургической овариальной супрессии (ОС). При назначении ИА в пременопаузе необходимо использовать их только в комбинации с ОС [6, 7].
Методы овариальной супрессии
Подавление функции яичников, или «овариальная супрессия», обычно достигается одним из трех методов: хирургическим, лучевым, лекарственным.
Термин ОС подразумевает необратимость воздействия, т.е. хирургическую кастрацию или облучение [6].
К обратимым методам подавления функции яичников относится лекарственный метод посредством применения аГнРГ, но при этом не всегда обеспечивается полное подавление функции яичников, особенно у женщин молодого возраста. Так как определение ФСГ в период лечения аГнРГ неинформативно, для подтверждения полной ОС необходимо определение эстрадиола в сыворотке крови. Прием ИА следует начинать через 6 недель после первого введения аГнРГ.
Зависимость частоты наступления аменореи от возраста и режима химиотерапии
Бесплодие после ХТ у женщин репродуктивного возраста встречается с частотой от 30 до 70%. До наступления пубертатного периода воздействие ХТ на яичники менее выражено. Широко известно, что ХТ разрушает овариальный резерв яичников, цитостатики вызывают деструкцию в ядрах клеток гранулезы, приводят к атрезии ооцита. Таким образом, подавление оогенеза с помощью аГнРГ может оказать защитное действие на фолликулогенез.
Многие исследования международного уровня доказали зависимость наступления аменории от возраста и выбора схемы ХТ. В процессе лечения женщине детородного возраста необходимо назначать надежные средства контрацепции как в период лекарственной терапии, так и в ближайший срок после ее окончания. Врачам следует предупреждать пациентов о возможном негативном влиянии лекарственного лечения на функцию яичников и фертильность. Данные о возможности сохранения фертильности с помощью аГнРГ противоречивы, поэтому до начала лечения молодым женщинам, планирующим беременность в перспективе, необходимо рекомендовать консультацию врача-репродуктолога для решения вопроса о возможных вариантах реализации детородной функции.
Самая низкая частота развития аменореи (13–15%) наблюдается у женщин моложе 40 лет, тогда как в возрасте старше 50 лет частота наступления менопаузы достигает 97% [8–10].
В недавно опубликованных результатах исследования «DATA», в которое были включены 329 пациенток с диагнозом РМЖ и установленной аменореей в результате проведения ХТ, было показано, что у 12% когорты произошло восстановление функции яичников в течение 30 месяцев после назначения гормонотерапии селективным нестероидным ИА (анастрозол) [11]. Также было отмечено, что у 5,1% пациенток с восстановленной менструальной функцией средний возраст на момент начала терапии ИА превышал 50 лет (у 25,2% пациенток, средний возраст – менее 50 лет). Также было показано, что уровень эстрадиола при приеме ИА был выше у женщин с восстановленной функцией яичников по сравнению с группой пациенток с аменореей после ХТ, которые также принимали ИА.
Исходя из данных этого исследования, следует сделать вывод, согласно которому при назначении гормональной терапии ИА необходимо определять уровни эстрадиола и ФСГ в крови, это связано с тем, что аменорея после проведения ХТ не является достаточным признаком достижения стойкой менопаузы. С учетом данных исследований, а также уровня заболеваемости РМЖ и структуры заболевания по возрасту можно предполагать, что назначение препаратов, приводящих к ОС, показано приблизительно 10% больным РМЖ [12–13].
Место аГнРГ в международных рекомендациях по сохранению фертильности у женщин со злокачественным новообразованием
Следует помнить, что задачей лечения больных ранним РМЖ в пременопаузе служит не только достижение клинического эффекта, но и сохранение фертильной функции с восстановлением исходного качества жизни по завершении адъювантной ХТ, что достижимо при применении лекарственной ОС с помощью аГнРГ: трипторелин 3,75 мг внутримышечно 1 раз в 28 дней; гозерелин 3,6 мг внутримышечно 1 раз в 28 дней; бусерелин 3,75 мг внутримышечно 1 раз в 28 дней; лейпрорелин 3,75 мг внутримышечно 1 раз в 28 дней.
По данным исследования J.M. Letourneau et al. (2012), около 47% молодых женщин, страдающих ранним РМЖ, хотели бы реализовать свою репродуктивную функцию после окончания лечения [14].
В последние годы было проведено множество крупных рандомизированных клинических исследований пациенток с РМЖ, получающих ОС с помощью аГнРГ на фоне адъювантной ХТ с целью оценки наиболее безопасной стратегии сохранения фертильной функции.
В исследовании (PROMISE-GIM6; Del Mastro L. et al., 2011) показано значительное снижение частоты развития преждевременной недостаточности яичников (ПНЯ) в группе, получавшей «ХТ+трипторелин» в течение года наблюдения после завершения курса ХТ (9 против 26%; относительный риск [OР]=0,28, 95% доверительный интервал [ДИ] – 0,14–0,59), а также при последующем длительном наблюдении (медиана – 7,3 года) [15]. Кроме того, отмечено увеличение частоты спонтанных беременностей в группе, получавших «ХТ+трипторелин».
Эта информация подтверждается данными мета-анализа 12 рандомизированных клинических исследований, опубликованного в 2015 г.: ОС с помощью аГнРГ значительно снижает риск развития преждевременной недостаточности яичников (ОР=0,36; p
1. Beatson G., Edin M. On the treatment of inoperable 10 cases of carcinoma of the mamma: Suggestions for a new method of treatment of illustrative cases. Lancet. 1896:104–7.
2. Ulrich P. Testosterone (hormone mâle) et son rôle possible dans le traitement de certains cancers du Sein, Unio. Internat. Contra Cancrum. 1939;4:377.
3. Horwitz K., Wei L., Sedlacer S., d’Arville C.N. Progestin action and progesterone receptor structure in human breast cancer: a review. Recent Prog. Horm. Res. 1985;41:249–316.
4. Klijn J.G.M., de Jong F.H. Treatment with luteinising hormone releasing hormone analogue (Buserelin) in premenopausal patients with metastatic breast cancer. Lancet. 1982:1213–16.
5. Покровский В.М., Коротько Г.Ф. Физиология человека. 2-е изд., перераб. и доп. М.: 2003. 656 с.
6. Стенина М.Б., Жукова Л.Г., Королева И.А., и др. Практические рекомендации по лекарственному лечению инвазивного рака молочной железы. Злокачественные опухоли. Практические рекомендации RUSSCO. 2017;7:105–34.
7. Семиглазов В.Ф., Палтуев Р.М., Манихас А.Г. и др. Клинические рекомендации РООМ по диагностике и лечению РМЖ. Санкт-Петербург, 2017.
8. Fornier M.N., Modi S., Panageas K.S., et al. Incidence of chemotherapy-induced, long-term amenorrhea in patients with breast carcinoma age 40 years and younger after adjuvant anthracycline and taxane. Cancer. 2005;104(8):1575–79.
9. Abusief M.E., Missmer S.A., Ginsburg E.S., et al. The effects of paclitaxel, dose density, and trastuzumab on treatment-related amenorrhea in premenopausal women with breast cancer. Cancer. 2010;116(4):791–98.
10. Swain S., Land S.R., Ritter M., et al. Amenorrhea in premenopausal women on the doxorubicin-and-cyclophosphamide-followed-by-docetaxel arm of NSABP B-30 trial Breast Cancer. Res. Treat. 2009;113:315–20.
11. Hellemond I., Vriens I., Peer P., et al. Ovarian function recovery during anastrozole in breast cancer patients with chemotherapy-induced ovarian function failure. J. Natl. Cancer Inst. 2017 Dec 1;109(12).
12. de Pedro M., Otero B., Martín B. Fertility preservation and breast cancer: a review. Ecancermedicalscience. 2015;9:503.
13. Kim S., Klemp J., Fabian C. Breast cancer and fertility preservation. Fertil. Steril. 2011;95(5):1535–43.
14. Letourneau J.M., Smith J.F., Ebbel E.E., et al. Racial, socioeconomic, and demographic disparities in access to fertility preservation in young women diagnosed with cancer. Cancer. 2012;118(18):4579–88.
15. Del Mastro L, Boni L., Michelotti A., et al. Effect of the gonadotropin releasing hormone analogue triptorelin on the occurence of chemotherapy-induced early menopause in premenopausal women with breast cancer: a randomized trial. JAMA. 2011;306(3):269–76.
16. Lambertini M., Ceppi M., Poggio F., et al. Ovarian suppression using luteinizing hormone releasing hormone agonists during chemotherapy to preserve ovarian function and fertility of breast cancer patients: a metaanalysis of randomized studies. Ann. Oncol. 2015;26(12):2408–19.
17. Venturelli М., Guaitoli G., Omarini C., Moscetti L. Spotlight on triptorelin in the treatment of premenopausal women with early-stage breast cancer. Breast Cancer. 2018;10:39–49.
18. Lambertini M. Cancer and fertility preservation: international recommendations from an expert meeting. BMC Medicine. 2016;14:1.
19. Lambertini M. Pooled analysis of five randomized trials investigating temporary ovarian suppression with gonadotropin-releasing hormone analogs during chemotherapy as a strategy to preserve ovarian function and fertility in premenopausal early breast cancer patients. San Antonio Breast Cancer Symposium. 2017. Abstract GS4-01.
20. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005;365(9472):1687–717.
21. Coates A., Winer E., Goldhirsch A., et al.; Panel Members. Tailoring therapies improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann. Oncol. 2015;26:1533–46.
22. Gradishar W., Anderson B., Balassanian R. NCCN guidelines Breast Cancer version 1.2016. J. Natl. Compr. Canc. Netw. 2015;13(12):1475–85.
23. Senkus E., Kyriakides S., Ohno S., et al.; ESMO Guidelines Committee. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2015;26 (Suppl. 5):v8–30.
24. Burstein H.J., Lacchetti C., Anderson H. Adjuvant Endocrine Therapy for Women With Hormone Receptor–Positive Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update on Ovarian Suppression. J. Clin. Oncol. 2016;34:1689–701.
25. Francis P.A., Regan M.M., Fleming G.F., et al.; SOFT Investigators; International Breast Cancer Study Group. Adjuvant ovarian suppression in premenopausal breast cancer. N. Engl. J. Med. 2015;372:436–46.
26. Pagani О., Regan M.M., Walley B.A. et al; TEXT and SOFT Investigators; International Breast Cancer Study Group. Adjuvant exemestane with ovarian suppression in premenopausal breast cancer. N. Engl. J. Med. 2014;371:107–18.
27. Regan M.M., Francis P.A., Pagani O., et al. Absolute Benefit of Adjuvant Endocrine Therapies for Premenopausal Women With Hormone Receptor–Positive, Human Epidermal Growth Factor Receptor 2–Negative Early Breast Cancer: TEXT and SOFT Trials. J. Clin. Oncol. 2016;34:2221–31.
28. Fleming G, Francis PA, Láng I, et al. Randomized comparison of adjuvant tamoxifen (T) plus ovarian function suppression (OFS) versus tamoxifen in premenopausal women with hormone receptor-positive (HR+) early breast cancer (BC): Update of the SOFT trial. SABCS. 2017. Abstract 844 GS4-03.
29. Francis P. on behalf of Pagani O., Regan M.M., Fleming G.F., et at. Randomized comparison of adjuvant aromatase inhibitor exemestane (E) plus ovarian function suppression (OFS) vs tamoxifen (T) plus OFS in premenopausal women with hormone receptor positive (HR+) early breast cancer (BC): Update of the combined TEXT and SOFT trials. SABCS. 2014. Abstract 844 GS4-02.
30. Ribi K., Luo W., Bernhard J., et al. Adjuvant tamoxifen plus ovarian function suppression versus tamoxifen alone in premenopausal women with early breast cancer: patient-reported outcomes in the suppression of ovarian function trial. Clin. Oncol. 2016;34:1601–10.
31. Hadji P., Coleman R.E., Wilson C., et al. Management of Aromatase Inhibitor-Associated Bone Loss (AIBL) in postmenopausal women with hormone sensitive breast cancer: Joint position statement of the IOF, CABS, ECTS, IEG, ESCEO, IMS, and SIOG. J. Bone Oncol. 2017;7:1–12.
32. Coleman R., Body J.J., Aapro M., et al.; ESMO Guidelines Working Group. Bone health in cancer patients: ESMO clinical practice guidelines. Ann. Oncol. 2014;25(Suppl. 3):124–37.
33. Committee on Gynecologic Practice ACOG Tamoxifen and uterine cancer. Comm. Opin. 2014;601:1–4.