Оловянная чума что поражает
«Оловянная чума» прошлого, от которой пострадало немало людей
Принято считать, что олово было известно человечеству еще в первом тысячелетии до нашей эры. О его удивительных свойствах во все времена слагались легенды, объяснить которые ученые смогли лишь в XX веке, когда стали использовать для изучения свойств металлов рентгеновский анализ. Издревле люди замечали, что изделия из олова, например посуда, на холоде вдруг начинали «заболевать»: покрывались пятнами, а потом и «язвами», которые, разрастаясь, превращали вещь в серый порошок. Если «простудившийся» оловянный предмет прислоняли к «здоровому», тот тоже начинал «болеть». Вот так родилось понятие под названием «оловянная чума», от которой порою страдали не только сами вещи, но и люди.
Много позже ученые выяснили, что при температуре ниже 13 градусов по Цельсию олово из пластичного металла белого цвета постепенно превращается в «грязный» порошок. Новая его модификация, о чем исследователям «рассказал» рентгеновский анализ, имеет кристаллическую решетку, в которой атомы связаны менее плотно. Чем ниже температура воздуха, тем «оловянная чума» протекает интенсивнее и быстрее, достигая максимальной скорости при 33 градусах мороза.
Считается, что «оловянная чума» немало поспособствовала гибели британской экспедиции «Терра Нова» под руководством Роберта Скотта, организованной в 1911-1912 годах к Южному полюсу. Продвигаясь по антарктическим льдам к своей цели, полярники оставляли склады с запасами продовольствия и керосина. На обратном пути команда обнаружила, что емкости с горючим пусты, поскольку они были запаяны оловом, а его поразило загадочное разрушение. Без керосина же измученные члены экспедиции не могли согреться и приготовить себе горячую пищу…
Еще более впечатляет легенда о том, что и армия Наполеона Бонапарта потерпела в России полное поражение, оттого что на мундирах солдат и офицеров были оловянные пуговицы. Конечно, данное обстоятельство не могло сыграть решающую роль в трагедии французов, но ощутимо увеличило страдания и потери наполеоновской армии во время отступления при сильных российских морозах. Эту легенду очень любят рассказывать в университетах преподаватели химии, хотя у нее, как считают историки, есть немало слабых мест. Например, неоспоримым является факт, что к тому времени «оловянная чума» была хорошо известна в северных странах Европы и не учесть этого великий стратег Наполеон просто не мог. Но, с другой стороны, он многого не предвидел, а иначе просто не пошел бы на Россию. Так что, как говорится, дыма без огня не бывает.
Многочисленные легенды о «коварстве» металла подтверждают задокументированные случаи. Так, в конце XIX века из Голландии в Москву отправилось несколько вагонов с оловянными слитками. Но по прибытии в Россию вместо брусков белого металла в вагонах оказался лишь серый, ни на что не годный порошок. Или еще такой факт: в начале XX столетия вокруг военных складов Санкт-Петербурга разгорелся настоящий скандал, когда в ходе ревизии выяснилось, что на всех формах и мундирах нет пуговиц. Складских работников даже хотели отдать под суд, но экспертиза странного серого порошка на одежде подтвердила, что это и есть олово, из которого были изготовлены пуговицы, – опять поработала «оловянная чума».
В конце концов человечество справилось с этим «недугом» металла. Попробуйте сегодня найти изделие из чистого олова – у вас ничего не получится. И даже оловянный припой содержит примеси других металлов, которые легко предотвращают эту удивительную метаморфозу, свойственную только олову. Самым стойким сплавом считается пьютер, который состоит из 93 процентов олова, 2 процентов меди и 5 – сурьмы. Из пьютера изготавливают предметы быта, посуду, украшения и так далее. И даже знаменитые оскаровские статуэтки и «Кубок Америки» отлиты из пьютера и только потом покрыты серебром и золотом. Вот так была побеждена предательская «оловянная чума»»…
И не слова о причинах, ради этого только читал и такой облом.
Самое главное забыли написать:
Простое вещество олово полиморфно. В обычных условиях оно существует в виде β-модификации (белое олово), устойчивой выше +13,2 °C. Белое олово — серебристо-белый, мягкий, пластичный металл, образующий кристаллы тетрагональной сингонии, пространственная группа I4/amd, параметры ячейки a = 0,58197 нм, c = 0,3175 нм, Z = 4. Координационное окружение каждого атома олова в нём — октаэдр. Плотность β-Sn равна 7,228 г/см3. При сгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов[8].
При охлаждении белое олово переходит в α-модификацию (серое олово). Серое олово образует кристаллы кубической сингонии, пространственная группа Fd3m, параметры ячейки a = 0,646 нм, Z = 8 со структурой типа алмаза. В сером олове координационный полиэдр каждого атома — тетраэдр, координационное число 4. Фазовый переход β-Sn в α-Sn сопровождается увеличением удельного объёма на 25,6 % (плотность α-Sn составляет 5,75 г/см3), что приводит к рассыпанию олова в порошок. Энтальпия перехода α → β ΔH = 2,08 кДж/моль. Одна модификация переходит в другую тем быстрее, чем ниже температура окружающей среды. При −33 °C скорость превращений становится максимальной. Тем не менее белое олово можно переохладить до гелиевых температур. Белое олово превращается в серое также под действием ионизирующего излучения[9].
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, β-Sn — металл, а α-Sn относится к числу полупроводников. Ниже 3,72 К α-Sn переходит в сверхпроводящее состояние. Атомы в кристаллической решётке белого олова находятся в электронном s2p2-состоянии. Серое олово — ковалентный кристалл со структурой алмаза и электронным sp3-состоянием. Белое олово слабо парамагнитно, атомная магнитная восприимчивость χ = +4,5·10−6 (при 303 К), при температуре плавления становится диамагнитным, χ = −5,1·10−6. Серое олово диамагнитно, χ = −3,7·10−5 (при 293 К).
Соприкосновение серого олова и белого приводит к «заражению» последнего, то есть к ускорению фазового перехода по сравнению со спонтанным процессом из-за появления зародышей новой кристаллической фазы. Совокупность этих явлений называется «оловянной чумой». Нынешнее название этому процессу в 1911 году дал Г. Коэн. Начало научного изучения этого фазового перехода было положено в 1870 году работами петербургского учёного, академика Ю. Фрицше. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Что такое чума? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
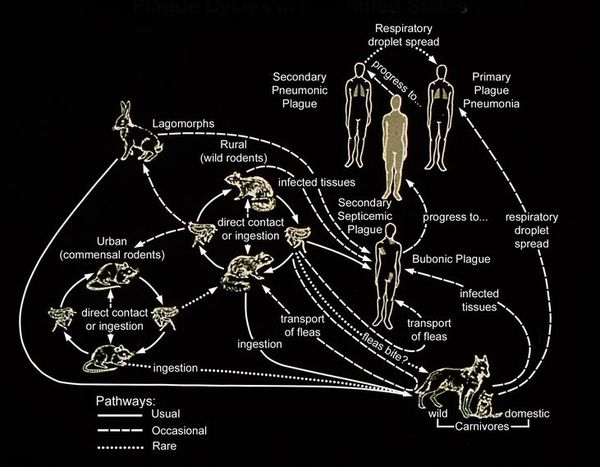
Чума («чёрный мор», «чёрная смерть») — острое заболевание, вызываемое бактерией Yersinia pestis. Относится к группе особо опасных карантинных инфекций. Клинически характеризуется синдромом общей инфекционной интоксикации, лихорадкой, поражением лимфоузлов, ретикулоэндотелиальной системы (тканей, богатых макрофагами, например микроглии), лёгких и других тканей человека. Передаётся различными путями, из которых наиболее опасен воздушно-капельный. Без адекватного лечения чума может привести к смерти. Описаны случаи применения в качестве биологического оружия: в летописях XIV, XVIII века и японцами в 1939 и 1942 гг.
Этиология
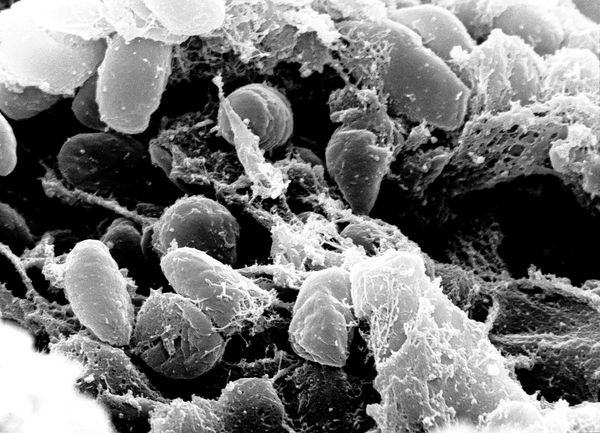
Возбудитель чумы — чумная палочка (Yersinia pestis), открытая в июне 1894 года в Гонконге французом Александром Йерсеном и японцем Китасато Сибасабуро. Выявлено, что чумной микроб возник при мутации бактерии псевдотуберкулёза (Y. Pseudotuberculosis) не более 20 000 лет назад. Впервые чумные эпидемии описаны в летописях древнего мира, упоминаются в Библии.
Вид: Yersinia pestis (чумная палочка)
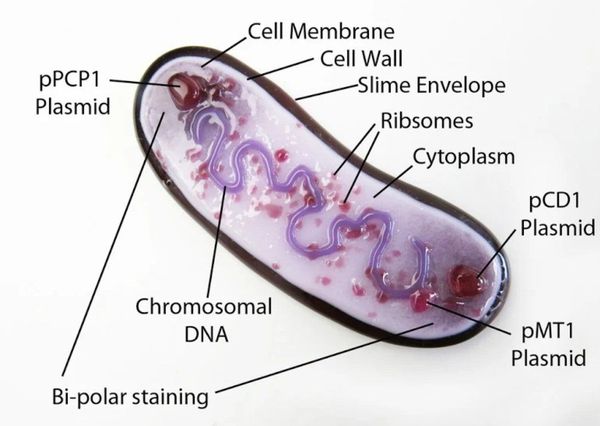
Y. pestis — неподвижная грамотрицательная палочка размером 0,3-0,6 × 1-2 мкм, округлой, нитевидной или удлинённой формы. Покрыта капсулой из слизистого вещества, окрашивается биполярно: интенсивно на концах и бледнее в центре. Не имеет жгутиков и не образует спор. Факультативный внутриклеточный анаэроб — способна развиваться как в клетках, так и за их пределами.
Факторы патогенности (вещества, определяющие способность бактерии вызывать инфекционный процесс):
Y. pestis умеет расщеплять углеводы и вырабатывает ферменты, помогающие заселять организм: гиалуронидазу, коагулазу, гемолизин, фибринолизин, пестицин. Существует несколько подвидов возбудителя чумы, различных по способности заражать организм.
Бактерии растут на обычных питательных средах с добавлением гемолизированной крови или сульфита натрия для стимуляции роста при температуре 28-30°С, рН среды 7,0-7,2 с видимым результатом через 12-14 ч.
Содержит более 30 антигенов, V- и W-антигены подавляют иммунные реакции, в частности фагоцитоз. Капсула защищает микроорганизм от растворения полиморфно-ядерными лейкоцитами, контролирующими различные стадии воспаления.
Чумная палочка сохраняется в выделениях больных людей и на объектах внешней среды:
Выдерживает низкие температуры: при 0 °С сохраняется шесть месяцев, в замороженных трупах — год и более. Не переносит:
Эпидемиология
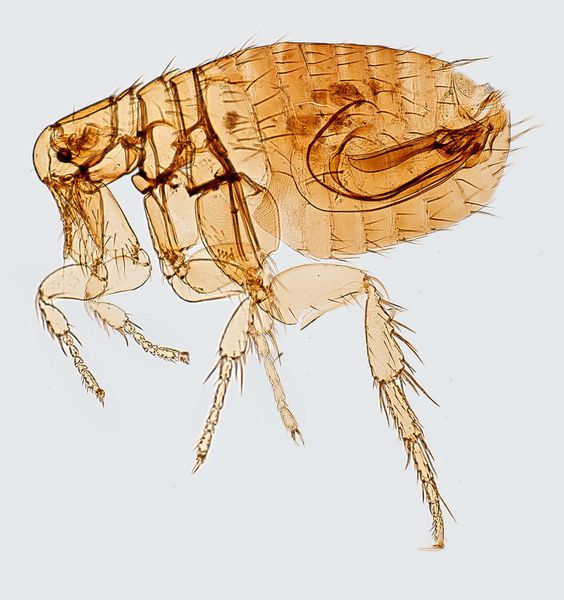
Резервуар и основной источник инфекции — грызуны. Реже болеют зайцы, кролики, лисы и верблюды. Ранее эпидемии чумы вызывали миграции крыс, заражающихся в природных очагах. Переносчики чумы — крысиные блохи (Xenopsylla cheopis).
Распространённость чумы
В XXI веке эпидемии чумы не возникают, выявляют лишь единичные случаи:
Основные природные очаги в РФ:
Механизмы передачи:
Человеческая форма чумы редко поражает животных. Заболевание, как правило, проходит в лёгкой форме. Подозреваться заражение можно, если появился кашель с кровью и в скором времени животное погибло.
Симптомы чумы
Инкубационный период при заражении от укуса блохи и контакта с инфицированным материалом длится от 3 до 6 дней. При аэрогенном заражении лёгочной формой — 1-2 дня. У привитых пациентов этот период растягивается до 12 дней. Прививка действует около года, обеспечивая относительную защиту. Затем, в течение непродолжительного времени, болезнь развивается в более лёгкой форме, по окончанию периода — как у непривитых.
Чума часто протекает в среднетяжёлой и тяжёлой форме. Болезнь начинается остро, внезапно. Симптомы заболевания:
С развитием болезни возбуждение сменяется апатией и адинамией, появляется сыпь на коже, выраженная тахикардия, нарушение ритма сердца, прогрессирующее падение артериального давления. Развивается учащённое поверхностное дыхание (тахипноэ), снижается количество отделяемой мочи вплоть до анурии.
Выделяют четыре клинические формы чумы: кожную, бубонную, первично-септическую, лёгочную.
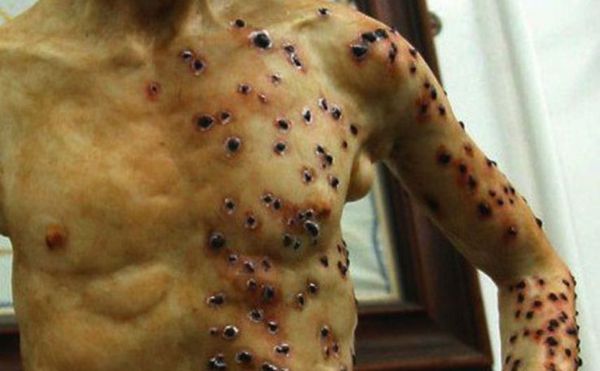
Кожная форма чумы
На коже последовательно формируются: пятно, папула, пузырёк, гнойный пузырёк (пустула) с конечным превращением в язву. Пустула болезненна, наполнена гнойно-кровавым содержимым, окружена зоной воспаления и находится посреди плотного багрово-красного основания. При разрыве возникает язва с дном тёмного цвета. После выздоровления в этой области формируется рубец. При своевременной антибиотикотерапии смертность не превышает 1 %.
Бубонная чума
Для бубонной формы чумы характерно появление и развитие бубона — болезненного лимфоузла (или группы лимфоузлов), расположенного в любой зоне, чаще в паху. Бубон плотный на ощупь с нечёткими неровными контурами, спаян с подкожной жировой клетчаткой и ограничивает движение конечностей. Кожа в этой области сухая, горячая на ощупь, с течением болезни приобретает багрово-синюшный оттенок. При развитии заболевания бубоны размягчаются, нагнаиваются, появляются гнойные свищи. Возможно распространение инфекции и возникновение вторичных бубонов в других областях. Вокруг поражённых лимфоузлов развиваются вторичные пузырьки с кровянистой жидкостью (фликтены чумы). При своевременном лечении смертность не более 5 %. При отсутствии терапии летальность — 90 %.
Первично-септическая форма
Лёгочная форма
Чума при беременности
Патогенез чумы
Иммунная система человека практически неспособна противостоять натиску чумной палочки. Это связано со стремительным размножением возбудителя, выработкой им факторов патогенности и антифагинов, подавляющих фагоцитоз (поглощение бактерий клетками иммунной системы) на начальных этапах, и слабым образованием антител.
Входные ворота при кожно-бубонной форме — кожа в месте укуса или втирания фекалий блох в повреждённую кожу, конъюнктивы, слизистые оболочки ротоглотки. При лёгочной форме чумы — слизистые оболочки респираторного тракта.
Этапы развития заболевания:
При попадании возбудителя в ткань лёгких (20 % случаев) возникает вторично-лёгочная форма заболевания. Стремительно развивается гангренозно-геморрагическая пневмония, увеличиваются и воспаляются трахеобронхиальные лимфоузлы, в плевральной полости скапливается жидкость (плевральный выпот).
Классификация и стадии развития чумы
Классификация и стадии развития
2. По клинической форме:
3. По степени тяжести:
Без лечения болезнь часто протекает в тяжёлой форме и заканчивается смертью.
Осложнения чумы
Диагностика чумы
Все действия с потенциально инфицированными материалами при подозрении на чуму проводятся в специализированной лаборатории особо опасных инфекций, работающей с патогенами I класса биологической опасности (в западных странах IV класса).
Лабораторная диагностика:
Дифференциальная диагностика:
2. Лёгочная чума (в т.ч. септическое течение):
3. Кожная форма чумы:
Лечение чумы
Независимо от формы болезни, необходима строгая изоляция пациента в инфекционном отделении больницы или ОРИТ (отделение реанимации и интенсивной терапии) боксового типа.
Режим — палатный, постельный или полупостельный. Диета — №2 или №7 по Певзнеру с ограничением поступления ионов натрия и контролем уровня потребляемой жидкости.
Антибиотикотерапию необходимо начать сразу, не дожидаясь лабораторного подтверждения диагноза. Даже при лёгочной форме чумы в первые 12-15 часов болезни есть шансы на выздоровление. Назначаются препараты:
Длительность введения антибиотиков — не менее 10 дней или до двух дней после исчезновения лихорадки.
Параллельно проводится применяют сорбенты и противоаллергические препараты. Для улучшения состояния ЖКТ принимают пищеварительные ферменты и пробиотики.
Критерии выздоровления при чуме:
Прогноз. Профилактика
Прогноз благоприятный, если начать лечение лёгкой и среднетяжёлой формы чумы своевременно. При развитии тяжёлой формы, особенно лёгочной чумы, пациент часто погибают.
Меры профилактики:
Оловянная чума
О́лово / Stannum (Sn)
серебристо-белый мягкий, пластичный металл (β-олово) или серый порошок (α-олово)
[Kr] 4d 10 5s 2 5p 2
О́лово (лат. Stannum ) — химический элемент, расположенный в пятом периоде в IVА группе периодической системы Менделеева; атомный номер 50, атомная масса 118,69; белый блестящий металл, тяжёлый, мягкий и пластичный (в аллотропной модификации β-олово).
Содержание
История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, так как изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисеевой. Олово является (наряду с медью) одним из компонентов бронзы (см. История меди и бронзы), изобретённой в конце или середине III тысячелетия до н. э.. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: 35—11 века до н. э.).
Происхождение названия
Нахождение в природе
Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10 −4 до 8·10 −3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Распространённость в природе
Распространённость в природе отражается в таблице [2] :
| Геол. объект | Камен. метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Гранитоиды | Глины и др. | Вода океанов | Живое вещество (% на живой вес) | Почва | Зола растений |
|---|---|---|---|---|---|---|---|---|---|---|
| Содержание, вес. % | 00 1·10 −4 | 0 5·10 −5 | 0 1,5·10 −4 | 0000 − | 000 3·10 −4 | 1·10 −3 | 0 7·10 −7 | 0000 5·10 −5 | 1·10 −3 | 00 5·10 −4 |
В незагрязнённых поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на дм³, увеличиваясь в районе оловорудных месторождений, оно попадает в воды за счёт разрушения в первую очередь сульфидных минералов, неустойчивых в зоне окисления. ПДКSn = 2 мг/дм³.
Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особености его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Твёрдая фаза. Минералы
В общем можно выделить следующие формы нахождения олова в природе:
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях [5] :
Окисные соединения олова
Касситерит
Касситерит (от греч. kassiteros — олово) — главный рудный минерал для получения олова. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зерна минерала достигают в размере 3 — 4 мм и даже больше.
Плотность 6040-7120 кг/м³ (наиболее низкая у светлоокрашенных касситеритов). Твердость 6½. Блеск — матовый, на гранях — алмазный. Спайность несовершенная. Излом раковистый.
Основные формы выделения касситерита:
Гидроокисные соединения
Второстепенное место занимают гидроокисные соединения олова, которые можно рассматривать как соли полиоловянных кислот. К ним можно отнести минерал сукулаит Ta2Sn2 +2 O [7] ; твёрдый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3 (Бретштейн Ю. С., 1974;Воронина Л. Б. 1979); «варламовит» — продукт окисления станнина; считается, что он представляет собой смесь аморфных и полуаморфных соединений Sn, метаоловянной кислоты, поликонденсированной фазы и гидрокасситеритовой фазы. Известны также гидратированные продукты окисления — гидромартит 3SnOxH2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6 и др.
Силикаты
Шпинелиды
Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16О32 (Peterson E.U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождения халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде местрождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.
Независимые исследования выявили аномально высокую растворимость SnO2 в хлор-кремниевых растворах. Максимальная растворимость достигается при отношении 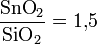
Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2SnkO2k+1, SnkO2k−1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову (1928—1992) [3]
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
Добыча
Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Китае, Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Боливии, Перу, Бразилии) и Австралии. В России запасы оловянных руд расположены в Чукотском автономном округе (рудник/посёлок Валькумей, разработка месторождения закрыта в начале 90-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем
10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационном методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановления древесного угля, слои которого укладываются поочередно со слоями руды.
Физические и химические свойства
Оловянная чума
«Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 г. Она осталась без горючего из-за того, что оно просочилось через запаянные оловом баки, поражённые «оловянной чумой», названной так в 1911 г. Г. Коэном. Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 г. — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок. «Оловянная чума» погубила многие ценнейшие коллекции оловянных солдатиков. Например, в запасниках питерского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например висмута.
Применение
Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
Цены на металлическое олово в 2006 году составили в среднем 12—18 долл/кг, двуокись олова высокой чистоты около 25 долл/кг, монокристаллическое олово особой чистоты около 210 долл/кг.
Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Изотопы
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 Sn (5,94 %). Этот элемент обладает наибольшим числом стабильных изотопов, что связано с фактом, что 50 (число протонов в ядрах олова) является магическим числом — оно составлет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра.
Изотопы олова 117 Sn и 119 Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Физиологическое действие
Металлическое олово не токсично, что позволяет применять его в пищевой промышленности. Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 ºС, не выделяются в воздух рабочей зоны в объёмах, превышающих предельно допустимую концентрацию в соответствии с ГОСТ. Длительное (в течение 15—20 лет) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.