Октет химия что такое
Правило октетов
Правило октета (октетная теория) — предложено Г.Н. Льюисом для объяснения причин образования ковалентных химических связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов. По своей важности это фундаментальное открытие Льюиса стоит в одном ряду с такими открытиями, как Периодический закон элементов и теория строения органических соединений. Широко распространенное мнение, что правило октета выполняется лишь в ограниченном числе случаев также ошибочно, как и утверждение того, что Периодический закон элементов не имеет всеобщего характера. Все примеры «невыполнения» правила октетов можно подразделить на следующие три группы:
2. Молекула образуется за счет трехцентровых связей, например KI3. В этой молекуле анион иода связан с молекулой иода трехцентровой четырехэлектронной связью. Молекула B2H6 построена за счет образования трехцентровых двухэлектронных связей Н-В-Н.
3. В образовании химических связей принимают участие d-орбитали. В этом случае правило октетов (в пределе, т.е. в случае участия всех пяти d-орбиталей) преобразуется в правило 18-электронов. Поскольку в целом ряде случаев участие d-орбиталей в образовании химических связей у некоторых элементов остается спорным вопросом, возникает иллюзия невыполнения правила октетов. Классическими примерами выполнения правила 18-электронов являются молекулы Fe(CO)5, Ni(CO)4, Co2(C)8, Fe(C5H5)2 (ферроцен).
История
В конце XIX века стало известно, что координационные структуры формируются атомами или молекулами таким образом, чтобы максимально удовлетворить валентность задействованных атомов. В 1893 Альфред Вернер показал, что число атомов или их групп, ассоциированных с центральным, часто равно 4 или 6, реже 8. В 1904 году Ричард Абегг сформулировал правило (известное как правило Абегга), утверждавшее, что максимальная разница между положительной и отрицательной валентностью элемента часто равна 8. Используя его Гилберт Ньютон Льюис в 1916 году записал правило октета для своей теории кубического атома.
Обзор
Валентная оболочка элемента полна и наиболее устойчива, если содержит 8 электронов (что является причиной низкой химической активности благородных газов).
Объясните языком даунов, что такое правило Октета (химия)
Правило октета (октетная теория) — предложено Г. Н. Льюисом для объяснения причин образования ковалентных химических связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов. По своей важности это фундаментальное открытие Льюиса стоит в одном ряду с такими открытиями, как Периодический закон элементов и теория строения органических соединений. Широко распространенное мнение, что правило октета выполняется лишь в ограниченном числе случаев также ошибочно, как и утверждение того, что Периодический закон элементов не имеет всеобщего характера. Все примеры «невыполнения» правила октетов можно подразделить на следующие три группы:
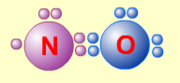
1. Сумма валентных электронов атомов, образующих молекулу, нечётна. Пример — молекула оксида азота NO.
Nitrogen oxide.png
В данном случае сумма валентных электронов атома азота (5) и кислорода (6) равна 11, поэтому в этой молекуле атом кислорода достигает восьмиэлектронной оболочки, а атом азота — нет. В данном случае изначально невозможно достижение обоими атомами восьмиэлектронной оболочки. Стремление атома азота заполнить свою электронную оболочку объясняет химическую реакционную способность этой молекулы.
2. Молекула образуется за счет трехцентровых связей, например KI3. В этой молекуле анион иода связан с молекулой иода трехцентровой четырехэлектронной связью. Аналогичные трехцентровые, но двухэлектронные связи присутствуют в молекуле B2H6.
3. В образовании химических связей принимают участие d-орбитали. В этом случае правило октетов (в пределе, то есть в случае участия всех пяти d-орбиталей) преобразуется в правило 18-электронов. Поскольку в целом ряде случаев участие d-орбиталей в образовании химических связей у некоторых элементов остается спорным вопросом, возникает иллюзия невыполнения правила октетов. Классическими примерами выполнения правила 18-электронов являются молекулы Fe(CO)5, Ni(CO)4, Co2(СО) 8, Fe(C5H5)2 (ферроцен) и многие другие.
Таким образом, главным в правиле октетов Льюиса является не цифра 8 (или 18), а обобществление электронов как основа образования ковалентной химической связи, и приближение за счет этого к электронной конфигурации инертного газа — восьмиэлектронной или восемнадцатиэлектронной.
«Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов. «
Правило октета
Атомы стремятся отдавать или принимать электроны до тех пор, пока в их внешнем слое не станет 8 электронов.
Расположение химических элементов в периодической системе Менделеева объясняется тем, как электроны заполняют доступные энергетические уровни, или слои, в атоме. Например, благородные газы, такие как неон, ксенон и аргон, имеют во внешнем слое по 8 электронов (то есть слой заполнен) — и поэтому они неохотно вступают в химические реакции. Самое низкое энергетическое состояние (и, следовательно, самое устойчивое) в большинстве случаев имеют атомы с заполненным внешним электронным слоем. На этом и построено правила октета.
Правило октета объясняет, как атомы образуют ионы. Рассмотрим в качестве примера натрий. В его атоме 11 электронов: два во внутреннем слое, восемь в следующем и один во внешнем слое. Этот внешний электрон очень подвижен, поэтому, если атому натрия передается энергия (например, в результате столкновения с другим атомом), он легко образует ион натрия с единичным положительным зарядом. Чтобы удалить электрон с внутреннего слоя, энергии потребуется в десять раз больше, поэтому ион натрия с двойным положительным зарядом — большая редкость. Точно так же кальций, имеющий 2 электрона во внешнем слое и 8 в следующем, более низком слое, образует ион, теряя 2 электрона. То есть, когда атомы превращаются в ионы, они по строению становятся похожи на атомы благородных газов.
Правило октета помогает нам понять, как устроены химические связи. Но оно работает далеко не для всех элементов. Например, олово имеет во внешнем незаполненном слое 14 электронов, но может отдавать только 2 или 4 электрона: отрыв большего количества электронов потребовал бы непомерных затрат энергии. Поэтому олово образует ионы с положительным зарядом 2 или 4.
Правило октета — одно из тех правил, которые отражают на первый взгляд случайные закономерности, выведенные химиками из опыта и наблюдений. Однако эти закономерности легко могут быть объяснены в терминах атомной теории строения вещества.
В Правило октета это химический практическое правило это отражает наблюдение, что элементы основной группы как правило связь таким образом, чтобы каждый атом имеет восемь электроны в его валентной оболочки, давая ему то же самое электронная конфигурация как благородный газ. Правило особенно применимо к углерод, азот, кислород, а галогены, но также и с такими металлами, как натрий или же магний.
Валентные электроны можно подсчитать с помощью Электронная точечная диаграмма Льюиса как показано справа для двуокиси углерода. Электроны, разделяемые двумя атомами в Ковалентная связь подсчитываются дважды, по одному разу на каждый атом. В двуокиси углерода каждый кислород делит четыре электрона с центральным углеродом, два (показаны красным) от самого кислорода и два (показаны черным) от углерода. Все четыре этих электрона подсчитываются как в октете углерода, так и в октете кислорода, так что считается, что оба атома подчиняются правилу октета.
Содержание
Пример: хлорид натрия (NaCl)
Ионная связь является общим между парами атомов, где одна из пары является металл низкого электроотрицательность (Такие как натрий) а второй неметалл с высокой электроотрицательностью (например, хлор).
Атом натрия имеет один электрон во внешней электронной оболочке, первая и вторая оболочки снова заполнены двумя и восемью электронами соответственно. Чтобы удалить этот внешний электрон, требуется только первый энергия ионизации, что составляет +495,8 кДж на крот атомов натрия, небольшое количество энергии. Напротив, второй электрон находится в более глубокой второй электронной оболочке, и вторая энергия ионизации, необходимая для его удаления, намного больше: +4562 кДж на моль. [2] Таким образом, натрий в большинстве случаев образует соединение, в котором он потерял один электрон и имеет полную внешнюю оболочку из восьми электронов, или октета.
История
В 1864 г. английский химик Джон Ньюлендс разделил шестьдесят два известных элемента на восемь групп на основе их физических свойств. [4] [5] [6] [7]
В конце 19 века было известно, что координационные соединения (ранее называвшиеся «молекулярными соединениями») образовывались комбинацией атомов или молекул таким образом, что, по-видимому, выполнялись валентности задействованных атомов. В 1893 г. Альфред Вернер показали, что количество атомов или групп, связанных с центральным атомом («координационный номер”) Часто бывает 4 или 6; другие координационные числа до максимум 8 были известны, но реже. [8] В 1904 г. Ричард Абегг был одним из первых, кто расширил концепцию координационный номер к концепции валентность в котором он различал атомы как доноры или акцепторы электронов, приводя к положительным и отрицательным валентным состояниям, которые очень напоминают современную концепцию состояния окисления. Абегг отметил, что разница между максимальным положительным и отрицательным валентности из элемент по его модели часто бывает восемь. [9] В 1916 г. Гилберт Н. Льюис назвал это понимание как Правило Абегга и использовал его, чтобы сформулировать кубический атом модель и «правило восьми», которое начало различать валентность и валентные электроны. [10] В 1919 г. Ирвинг Ленгмюр доработал эти концепции и переименовал их в «кубический атом октета» и «теорию октета». [11] «Теория октетов» превратилась в то, что сейчас известно как «правило октетов».
Вальтер Коссель [12] и Гилберт Н. Льюис увидел, что благородные газы не имеют тенденции принимать участие в химических реакциях в обычных условиях. На основании этого наблюдения они пришли к выводу, что атомы из благородные газы устойчивы, и на основе этого вывода они предложили теорию валентность известная как «электронная теория валентности» в 1916 году:
Во время образования химической связи атомы объединяются, приобретая, теряя или разделяя электроны таким образом, что они приобретают ближайшую конфигурацию благородного газа. [13]
Объяснение в квантовой теории
В аргон атом имеет аналогичные 3s 2 3p 6 конфигурация. Также есть пустой 3d-уровень, но он со значительно большей энергией, чем 3s и 3p (в отличие от атома водорода), так что 3s 2 3p 6 до сих пор считается закрытой оболочкой для химических целей. Атомы непосредственно до и после аргона стремятся достичь этой конфигурации в соединениях. Однако есть некоторые гипервалентные молекулы в котором 3d уровень может играть определенную роль в связывании, хотя это спорно (см. ниже)
За гелий согласно квантовой теории не существует уровня 1p, так что 1s 2 представляет собой замкнутую оболочку без p-электронов. Атомы до и после гелия (H и Li) подчиняются правилу дуэта и имеют тенденцию иметь одинаковые единицы. 2 конфигурация как гелий.
Исключения
Хотя обычно считается, что стабильные молекулы с нечетными электронами и гипервалентные молекулы нарушают правило октетов, ab initio расчеты молекулярных орбиталей показывают, что они в значительной степени подчиняются правилу октетов (см. трехэлектронные связи и гипервалентные молекулы разделы ниже).
Трехэлектронные связи
Некоторые стабильные молекулярные радикалы (например, оксид азота, NO) получить конфигурации октетов с помощью трехэлектронная связь который вносит один общий и один неподеленный электрон в октет каждого связанного атома. [14] В NO октет каждого атома дополняется четырьмя электронами от двух двухэлектронных связей, плюс один одинокая пара несвязывающих электронов только на этом атоме. Порядок связи равен 2,5, поскольку каждая двухэлектронная связь считается одной связью, тогда как трехэлектронная связь имеет только один общий электрон и, следовательно, соответствует полусвязи.
Диоксид иногда представляется как подчиняющееся правилу октетов с двойной связью (O = O), содержащей две пары общих электронов. [15] Однако основное состояние этой молекулы парамагнитный, что указывает на наличие неспаренных электронов. Полинг предположил, что эта молекула фактически содержит две трехэлектронные связи и одну нормальную ковалентную (двухэлектронную) связь. [16] Тогда октет каждого атома состоит из двух электронов от каждой трехэлектронной связи, плюс два электрона ковалентной связи, плюс одна неподеленная пара несвязывающих электронов. Порядок облигаций равен 1 + 0,5 + 0,5 = 2.
Правило октета
Сумма валентных электронов атомов, образующих молекулу, нечётна. Пример — молекула оксида азота NO.
В данном случае сумма валентных электронов атома азота (5) и кислорода (6) равна 11, поэтому в этой молекуле атом кислорода достигает восьмиэлектронной оболочки, а атом азота — нет. В данном случае изначально невозможно достижение обоими атомами восьмиэлектронной оболочки. Стремление атома азота заполнить свою электронную оболочку объясняет химическую реакционную способность этой молекулы.
Молекула образуется за счет трехцентровых связей, например KI3. В этой молекуле анион иода связан с молекулой иода трехцентровой четырехэлектронной связью. Аналогичные трехцентровые, но двухэлектронные связи присутствуют в молекуле B2H6.
В образовании химических связей принимают участие d-орбитали. В этом случае правило октетов (в пределе, то есть в случае участия всех пяти d-орбиталей) преобразуется в правило 18-электронов. Поскольку в целом ряде случаев участие d-орбиталей в образовании химических связей у некоторых элементов остается спорным вопросом, возникает иллюзия невыполнения правила октетов. Классическими примерами выполнения правила 18-электронов являются молекулы Fe(CO)5, Ni(CO)4, Co2(СО)8, Fe(C5H5)2 (ферроцен)и многие другие.Таким образом, главным в правиле октетов Льюиса является не число 8 (или 18), а обобщение электронов как основа образования ковалентной химической связи, и приближение за счет этого к электронной конфигурации инертного газа — восьмиэлектронной или восемнадцатиэлектронной.
Связанные понятия
В химии валентными электронами называют электроны, находящиеся на внешней (валентной) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических.