Оксикамы что это такое
Нестероидные противовоспалительные препараты
Поделиться:
Нестероидные противовоспалительные препараты, или НПВП, — анальгетики, проявляющие сразу три эффекта: обезболивающий, жаропонижающий и противовоспалительный. При этом дурная слава о плохом влиянии этих лекарств на желудок буквально преследует их.
Разбираться в особенностях принципа действия, показаниях и, конечно же, безопасности НПВП мы будем во второй статье из цикла о препаратах анальгетиках.
Ацетилсалициловая кислота: анальгетик с опытом
Мало кто знает, что самый первый НПВП, ацетилсалициловая кислота, имеет растительное происхождение — ее предшественник был получен из лабазника, или таволги вязолистной. Препарат создали фармацевты Байера в конце XIX века и назвали его в честь латинского наименования лабазника Spiraea ulmariа аспирином.
Принцип действия аспирина, как и всех других НПВП, состоит в блокировании фермента циклооксигеназы (ЦОГ). В организме существуют два типа ЦОГ. Первый, ЦОГ-1, — это нужный, «добрый» фермент: он выполняет множество важных функций, в том числе и защищает слизистую желудка. Второй, ЦОГ-2, отвечает за выработку простагландинов, запуская механизм боли и воспаления.
Ацетилсалициловая кислота блокирует оба вида ЦОГ, причем первый тип фермента в большей степени, чем второй. Поэтому список ее побочных эффектов немал, и лидером в нем является повреждение слизистой желудка, чреватое развитием гастрита и даже язвенной болезни. Аспирин категорически противопоказан детям младше 15 лет из-за опасности развития синдрома Рейе — тяжелого поражения мозга и печени.
Взрослые могут принимать препарат как жаропонижающее и легкое обезболивающее. Однако в последние годы ацетилсалициловая кислота на этом поприще уступила место более безопасным НПВП и перешла в разряд кардиологических препаратов благодаря свойству препятствовать агрегации тромбоцитов и «разжижать» таким образом кровь.
Сомнительный анальгин?
Метамизол натрия, или анальгин, — достаточно активный обезболивающий и очень слабый противовоспалительный препарат. К желудку он относится лояльно, направляя все свое негативное влияние на кровь. Серьезный побочный эффект анальгина — способность изменять картину крови и приводить к развитию апластической анемии, агранулоцитоза и других гематологических неприятностей.
Во многих странах мира, в том числе США, анальгин запрещен к продаже. А вот в Германии, к примеру, он широко применяется и даже считается препаратом выбора для лечения послеоперационной боли. В России анальгин знают, любят и пьют, и, признаться, в этом нет ничего страшного — главное не потреблять его регулярно (т. е. изо дня в день) и не превышать рекомендуемые дозы.
Диклофенак сотоварищи
Группа производных кислот поражает выбором даже специалистов, но каждый препарат, входящий в нее, все-таки имеет свое «лицо». Производные органических кислот отличаются выраженными противовоспалительными свойствами, нередко затмевающими обезболивающий и жаропонижающий эффект. Исключение составляет ибупрофен, который все-таки чаще всего применяется для борьбы с болью и лихорадкой, а не воспалением.
Одними из самых мощных противовоспалительных препаратов этой подгруппы считаются индометацин и диклофенак. Первый оказывает неблагоприятное действие на желудок и кровь, и применяется сегодня редко. Диклофенак гораздо более безопасен, что вкупе с высокой активностью и экономичностью обеспечивает крайне высокую популярность при ревматических заболеваниях.
Однако по анальгетическому эффекту диклофенак значительно уступает многим препаратам, в частности напроксену, который успешно применяют для борьбы с различными видами интенсивной боли, в том числе зубной, головной, периодической и т. д. Напроксен продается без рецепта врача и пользуется спросом как довольно безопасный, доступный и при этом мощный анальгетик.
Еще один НПВП, который используют для обезболивания, — кеторолак, известный под торговым названием Кетанов. Он отличается быстротой, силой и длительностью анальгетического действия в комплексе с традиционными для НПВП желудочно-кишечными побочными эффектами. Поэтому кеторолак применяют только по рецепту врача для купирования послеоперационной боли, боли при онкологических заболеваниях и в других непростых случаях.
Мефенаминовая кислота гораздо «невинней» кеторолака, однако и не столь результативна. Ее слава эффективного жаропонижающего средства несколько преувеличена: препарат чуть более активен, чем ацетилсалициловая кислота.
И еще один представитель НПВС, который нельзя обойти вниманием, — мелоксикам, совмещающий довольно щадящее действие на желудок с мощным противовоспалительным эффектом, благодаря чему он часто применяется в ревматологии.
Коксибы: последнее слово фармакологии
Коксибы — самая молодая группа НПВП, первый представитель которой, целекоксиб, появился в продаже в конце 1990-х годов. Коксибы почти не влияют на ЦОГ-1, а, значит, практически не оказывают традиционных для этой группы желудочно-кишечных побочных эффектов. Они достойно борются с болью и воспалением при артритах и других ревматоидных заболеваниях, однако первоначальных ожиданий, которыми были полны специалисты при появлении первого коксиба, не оправдали.
Препараты этой группы все-таки не лишены побочных эффектов (в частности, специалисты до сих пор обсуждают возможное влияние коксибов на повышение риска инфаркта и инсульта) и к тому же отличаются немаленькой ценой, способной вышибать почву из-под и без того нездоровых ног. Решение об их назначении должен принимать только врач, и самолечением коксибами, как, впрочем, и большинством других НПВП, заниматься не стоит.
Читателям, которых все-таки терзают муки выбора, хотелось бы сказать: не терзайтесь. Избавьтесь от этого камня на своей душе, водрузив его на плечи лечащего врача. Доверьте ему вашу боль и воспаление и не испытывайте желудок на прочность в попытках попасть пальцем в небо и отыскать из десятков лекарств самый «лучший» НПВП.
Товары по теме: [product](ацетилсалициловая кислота), [product](анальгин), [product](ибупрофен), [product](напроксен), [product](кетопрофен), [product](индометацин), [product](кеторолак), [product](ацеклофенак), [product](диклофенак), [product](пироксикам), [product](мелоксикам), [product](аркоксиа), [product](целекоксиб), [product](эторикоксиб), [product](акьюлар), [product](кетанов), [product](кеторол), [product](кетокам), [product](кетофрил), [product](долак), [product](аленталь), [product](аэртал), [product](наклофен), [product](мовалис), [product](либерум), [product](артрозан), [product](мирлокс), [product](амелотекс), [product](брутан), [product](ибуклин), [product](некст), [product](нурофен), [product](налгезин), [product](кетонал), [product](метиндол ретард), [product](коплавикс), [product](агренокс), [product](экседрин), [product](кардиомагнил), [product](кардиаск), [product](аспирин), [product](цитрамон), [product](тромбо АСС), [product](ацекардол), [product](аскофен-П), [product](аспикор), [product](тромбопол)
Теноксикам
Теноксикам – эффективный, надежный, проверенный временем представитель группы нестероидных противовоспалительных препаратов (НПВП), который активно используется в мировой медицинской практике уже более 35 лет. С момента своего появления на фармакологическом рынке теноксикам прошел жесткую проверку в многочисленных сравнительных клинических исследованиях, выполненных по всем требованиям медицины, основанной на доказательствах, а также оценку длительного применения в реальной клинической практике в ходе серии национальных наблюдательных исследований. Его лечебный потенциал доказан при широком спектре ревматических заболеваний – остеоартрите, ревматоидном артрите, анкилозирующем спондилите, подагре, неспецифической боли в спине. Он также с успехом используется в хирургической практике для контроля послеоперационной боли и как компонент мультимодальной периоперационной анальгезии. Удобство применения (один раз в день), наличие различных лекарственных форм и хорошая переносимость (по сравнению с другими традиционными НПВП) делают теноксикам удачным инструментом обезболивающей терапии в самых разных отраслях медицины.
Нестероидные противовоспалительные препараты (НПВП) были и остаются незаменимым инструментом анальгетической и противовоспалительной терапии, востребованным в самых разных областях медицины. Лечение заболеваний суставов и позвоночника, купирование головной боли напряжения и мигрени, острой висцеральной боли («колики»), контроль болевого синдрома после травм и оперативных вмешательств, комплексная симптоматическая терапия онкологических больных и многое другое – области успешного использования этого класса фармакологических средств [1,3]. Это одна из наиболее обширных фармакологических групп: сегодня спектр НПВП, доступных российскому врачу, насчитывает более 20 международных непатентованных наименований, а число коммерческих препаратов (за счет генериков) превышает две сотни.
Такое разнообразие ставит врача перед непростым выбором – какой препарат назначить конкретному пациенту в той или иной клинической ситуации?
Формально, все НПВП обладают сходным обезболивающим и противовоспалительным потенциалом, разумеется, при условии, что они используются в максимальных терапевтических дозах в течение достаточно длительного времени. Это положение подтверждается обширным опытом «правильно организованных» с точки зрения медицины, основанной на доказательствах, рандомизированных контролируемых исследований (РКИ) [1,2]. Однако в реальной клинической практике на результат применения лекарства влияет множество факторов, связанных с характером заболевания, индивидуальной чувствительностью пациента и наличием коморбидной патологии. И, конечно, огромное значение имеют фармакологические особенности препарата, определяющие его быстродействие, стойкость эффекта и риск развития нежелательных реакций (НР) [3].
Одним из наиболее интересных биохимических семейств НПВП являются оксикамы. Они представляют собой производные эноликовой кислоты, которые, в отличие от большинства других НПВП, не содержат в своей структуре карбоксильную группу [4].
Общеизвестно, что главной фармакологической мишенью всех НПВП, независимо от химической структуры, является индуцируемый (т.е. появляющийся под воздействием провоспалительных цитокинов) фермент циклооксигеназа (ЦОГ)-2. Подавление активности этого фермента блокирует синтез простагландина (ПГ) Н2, который представляет собой субстрат для образования ПГЕ2, одного из наиболее важных медиаторов боли и воспаления [5,6]. ЦОГ – это последовательный гомодимер, белковая структура, объединяющая две взаимосвязанные зеркальные субъединицы, образующие при соприкосновении тонкий извитой гидрофобный канал, по которому происходит перемещение субстрата (полиненасыщенных жирных кислот, ПЖК) и где проходит его биохимическая трансформация. Оба мономера ЦОГ содержат N-терминальную зону (фактор роста подобную зону) – четырехспиральный участок, связанный с клеточной мембраной, и энзимный участок. В данной области ЦОГ имеются два участка: циклооксигеназный, где осуществляется окисление ПЖК и «замыкание» типичного для простаноидов циклопентанового кольца, и область пероксидазы, которая катализирует присоединение дополнительной OH- группы. Действие всех НПВП – от аспирина до коксибов, заключается в связывании циклооксигеназной области активной зоны ЦОГ, что нарушает ее взаимодействие с субстратом. Но пероксидазная активность фермента при этом не меняется [6,7].
Хотя все НПВП имеют общий механизм действия, разная биохимическая структура этих препаратов определяет важные отличия в их взаимодействии с ЦОГ. От этого зависит длительность их фармакологического эффекта и селективность в отношении ЦОГ-1/ЦОГ-2. Последнее имеет принципиальное значение: ведь именно с подавлением активности ЦОГ-2 связано анальгетическое, противовоспалительное и жаропонижающее действие НПВП. А неизбирательная блокада биохимического «двойника» этого фермента – ЦОГ-1, который постоянно присутствует в тканях организма и отвечает за синтез цитопротективных ПГ, приводит к развитию многих НР, таких как повреждение слизистой желудочно-кишечного тракта (ЖКТ) [4].
В чем особенность действия оксикамов? Они связываются с активной зоной ферментативного канала ЦОГ, образуя множественные гидрофобные связи и единственную непосредственную водородную связь между 4-гидроксильной группой молекулы препарата и аминокислотой Ser-530 ЦОГ. Фиксация двух молекул Н2О в активной зоне фермента обеспечивает дополнительные полярные связи между действующим веществом и структурами ЦОГ в каталитической вершине и области сужения ферментативного канала. Связь боковой цепи оксикама с аминокислотой Leu-531 ЦОГ формирует особую пространственную конформацию комплекса и появление гидрофобного «кармана», представленного 8 аминокислотными остатками фермента: Met-113, Val116, Leu-117, Ile-345, Val-349, Leu-531, Leu-534 и Me535. Согласно компьютерной модели взаимодействия оксикамов и ЦОГ, именно образование данной структуры определяет большую селективность в отношении ЦОГ-2 и более длительный противовоспалительный эффект этих препаратов [4].
Ценным свойством оксикамов представляется их способность влиять не только на активность ЦОГ-2, но и на матриксную ПГЕ2-синтетазу – фермент, благодаря которому происходит конечный синтез основного медиатора воспаления – ПГЕ2. Матриксная ПГЕ2-синтетаза является очень перспективной «мишенью» для противовоспалительной терапии, однако разработать пригодный для клинического применения ингибитор этого фермента («супер-НПВП») пока не удалось. В то же время оксикамы обладают структурным сходством с бензотиопиран S-диоксидами, а эти соединения могут связывать матриксную ПГЕ2-синтетазу и стали основой для создания экспериментального препарата PF-9184, показавшего свойство селективного ингибитора фермента [4].
Теноксикам – это надежный, проверенный временем лекарственный препарат, который широко используется во многих странах мира [8]. Впервые на фармакологическом рынке он появился в 1982 г. во Франции под торговым наименованием Тилкотил. В настоящее время, по данным сайта www.drugs.com, на глобальном фармакологическом рынке, кроме оригинального препарата, представлены еще 83 генерика теноксикама [9]. На 2016 г. теноксикам зарегистрирован и используется в 14 странах Евросоюза, таких как Бельгия, Болгария, Великобритания, Греция, Дания, Исландия, Испания, Италия, Кипр, Люксембург, Португалия, Румыния, Франция и Швеция [10].
Теноксикам относится к «традиционным» НПВП – неселективным ингибиторам ЦОГ-2. Соотношение ингибирующих концентраций ЦОГ-2/ЦОГ-1 для него составляет 1,34 (для примера, для индометацина – более 10) [11]. Имеются данные, что теноксикам, помимо своего основного фармакологического действия (блокада ЦОГ-2), способен проявлять свойства антиоксиданта, подавляя образование реактивных форм кислорода, супероксид-анионов, а также снижать синтез окиси азота 14.
Теноксикам обладает устойчивой стабильной фармакодинамикой. Он практически полностью всасывается из ЖКТ (биодоступность составляет 99%) и обнаруживается в крови уже через 30 мин после перорального приема. Достаточно быстро – в среднем через 1,9 ч (1,0-5,0 ч) после приема 20 мг теноксикама достигается пиковая концентрация препарата в плазме – 2,7 мг/л (2,3-3,0 мг/л). Теноксикам практически полностью связывается белками плазмы (на 99%), при этом, за счет низкой липофильности и высокой ионизации, его проникновение в ткани происходит плавно и постепенно: пиковая концентрация в синовиальной жидкости составляет 1/3 от содержания в плазме и достигается примерно через 20 ч. Препарат метаболизируется в печени с образованием 5′-гидрокси- и 6-O-глюкуронированной формы, которые выводятся с мочой и желчью. Особенностью теноксикама является линейная фармакодинамика (которая отмечается при использовании в дозах от 10 до 100 мг) и весьма медленная элиминация. Период полувыведения этого лекарства составляет 67 ч (49-81 ч) [8].
Теноксикам при хронических заболеваниях суставов и позвоночника
С момента появления на фармакологическом рынке теноксикам проходил жесткую проверку, прежде всего, как препарат, предназначенный для длительного использования у больных с хроническими ревматическими заболеваниями, такими как остеоартрит (ОА), ревматоидный артрит (РА) и анкилозирующий спондилит.
С целью изучения эффективности и безопасности теноксикама была проведена серия масштабных и хорошо организованных РКИ. Так, в 12-недельной работе британских ученых теноксикам 20 мг/сут сравнивали с пироксикамом 20 мг/сут у 1328 больных ОА и РА [15]. Параллельно в Швейцарии было проведено РКИ, в котором оценивали действие теноксикама 20 мг/сут, пироксикама 20 мг/сут и диклофенака 100 мг/сут у пациентов с ОА и ревматической патологией околосуставных мягких тканей [16]. Третьей работой со сходным планом было 12-недельное РКИ датских исследователей, которые сопоставляли эффект теноксикама 20 мг/сут и кетопрофена 200 мг/сут у 307 больных ОА [17]. Во всех трех исследованиях был получен сходный результат: анальгетическое и противовоспалительное действие теноксикама не уступало препаратам контроля, но при этом суммарная частота НР, особенно со стороны ЖКТ, была ниже. Например, при сравнении теноксикама с кетопрофеном суммарная частота НР составила 29,0% и 47,3%, соответственно (p 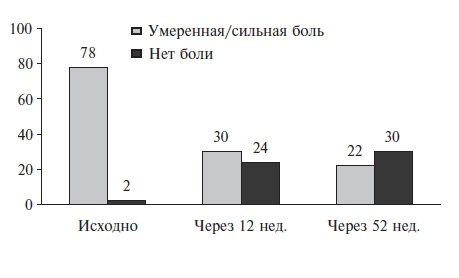
Канадские ученые G. Kraag и соавт. провели масштабное наблюдательное исследование, в котором оценивали результаты использования теноксикама у 1809 амбулаторных больных с заболеваниями суставов и позвоночника, из которых большинство (84,3%) страдали ОА. Средний курс терапии составил 4 недели. Теноксикам оказался эффективным и относительно безопасным лекарством. Так, 81,1% пациентов сообщили о существенном улучшении состояния после курса терапии, при этом лишь у 12,6% были отмечены те или иные НР [21].
Итальянские ученые R. Marcolongo и A. Fioravanti оценили результаты применения теноксикама 20 мг/сут, диклофенака 100 мг/сут и пироксикама 20 мг/сут у 625 больных с ОА и ревматической патологией околосуставных мягких тканей. Теноксикам не уступал препаратам контроля по эффективности, но превосходил по переносимости – частота НР при его применении оказалось самой низкой (7,4%) [22].
K. Ibrahima и соавт. изучали эффективность теноксикама 20 мг/сут (от 15 до 30 дней) у 736 африканских пациентов с ревматическими заболеваниями. Пода вляющее большинство больных (более 90%) оценили результат лечения как хороший или отличный [23].
Эффективность, хорошая переносимость и удобство применения сделали теноксикам удачным средством для длительного лечения больных с ревматическими заболеваниями. Это подтверждает опыт нескольких исследований, в которых лечебное действие теноксикама оценивали в течение продолжительного периода времени. В частности, О. Nived и соавт. сравнивали теноксикам с напроксеном в течение 6 месяцев [24], а В. Lund и соавт. применяли теноксикам и пироксикам у больных ОА в течение 12 месяцев [25]. А в небольшом исследовании J. Lalos и соавт. успешно использовали теноксикам в течение 4 лет (!) у 20 больных РА. При этом переносимость препарата была оценена как хорошая или отличная [26].
В плане оценки безопасности теноксикама очень важны результаты его сравнения с ацеклофенаком, который характеризуется хорошей переносимостью и низким риском серьезных НР. Испанские ученые провели два таких исследования. В работе F. Perez-Ruiz и соавт. 292 больных РА получали теноксикам 20 мг/сут или ацеклофенак 200 мг/сут в течение 3 мес. Эффективность препаратов через 2 недели и в конце исследования не различалась. Частота НР также была практически равной: 4,1% – в группе ацеклофенака и 6,2% – в группе теноксикама. Число осложнений со стороны ЖКТ также достоверно не отличалось [27]. L. Villa Alcаzar и соавт. оценивали эффективность этих препаратов в аналогичных дозах при анкилозирующем спондилите (n=273). Через 3 мес лечения эффект препаратов не отличался ни в отношении боли, ни в отношении улучшения функции позвоночника. При этом частота НР при лечении ацеклофенаком была несколько выше, чем при приеме теноксикама: они развились у 42 и 37 больных, соответственно. Частота отмены двух препаратов из-за НР составила 2,2% и 1,4%, соответственно. Таким образом, в обоих исследованиях теноксикам не уступал по переносимости ацеклофенаку [28].
Эффективность теноксикама для купирования острой боли
Теноксикам представляет собой эффективное и удобное средство для длительного контроля основных симптомов при наиболее распространенных хронических заболеваниях суставов и позвоночника. Однако он может использоваться не только в этой ситуации. Теноксикам оказался весьма удачным препаратом и для купирования острой боли при самой различной ургентной патологии.
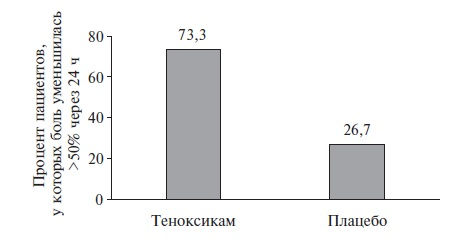
Так, имеется успешный опыт применения теноксикама для лечения острого подагрического артрита [29,30]. Любопытно отметить, что теноксикам, согласно анализу Cochrane Collaboration, стал единственным НПВП, который сравнивали с плацебо для купирования острого приступа подагры (de la Torre G., 1987). В этом РКИ 30 больных (по 15 в каждой группе) получали теноксикам 40 мг/сут или плацебо. По эффективности теноксикам значительно превосходил плацебо (рис.2). Очень важно, что в группе теноксикама не было зафиксировано ни одной НР, в то время как в группе плацебо было 2 осложнения [31].
Теноксикам показал себя действенным средством для лечения острой неспецифической боли в спине. В работе бельгийских ученых М. Szpalski и J. Hayez 2-недельный курс лечения теноксикамом в дозе 20 мг у 78 пациентов с этой патологией привел к существенному уменьшению боли и улучшению функции позвоночника [32].
Классической моделью для проверки терапевтического потенциала анальгетиков в ургентных ситуациях служит купирование острой боли после удаления зуба. Такую проверку прошел и теноксикам, причем очень успешно. Была проведена серия исследований, показавших его эффективность в данной клинической ситуации 35. При этом по уровню обезболивающего действия он не уступал большим дозам глюкокортикоидов [36] и превосходил мягкие опиоидные препараты (в частности, комбинацию парацетамола 500 мг и кодеина 8 мг) [37].
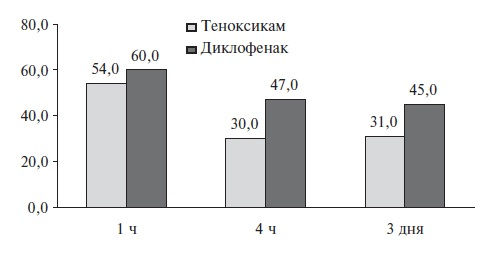
В качестве примера удачного использования теноксикама в стоматологической практике можно привести РКИ J. Roelofse и соавт., в которое были включены 35 пациентов, перенесших удаление 3-го моляра. Теноксикам сравнивали с диклофенаком: оба препарата вводили непосредственно перед операцией (теноксикам 40 мг внутривенно, диклофенак 75 мг внутримышечно), а затем назначали внутрь (теноксикам 20 мг один раз в день, диклофенак 50 мг три раза в день) на 7 дней. Эффективность теноксикама оказалась достоверно выше как в первые послеоперационные часы, так и через 3 дня (рис. 3) [38].
Эффективность теноксикама для купирования боли после экстракции зуба подтверждает также недавнее исследование V. Kaplan и соавт. у 90 больных, перенесших удаление зуба мудрости. В качестве анальгетика они в течение 7 дней получали теноксикам 20 мг, флурбипрофен 200 мг или диклофенак 100 мг, причем первую доза каждого препарата назначали за 2 ч до операции. Теноксикам оказывал более выраженное обезболивающее действие по сравнению с препаратами сравнения как в первые послеоперационные часы, так и последующие дни наблюдения [39].
Важнейшая область ургентного применения НПВП – купирование острой почечной и билиарной колики. Здесь теноксикам также показал себя эффективным препаратом: внутривенное или внутримышечное введение препарата быстро и существенно снижало выраженность болевых ощущений и частоту осложнений, связанных с этой патологией 42.
Теноксикам применяется в анестезиологической практике как элемент мультимодального обезболивания при «больших» хирургических операциях. Его эффективность была подтверждена результатами серии РКИ. Так, в работе W. Chang и соавт. предоперационное введение этого препарата обеспечивало снижение потребности в применении опиоидов в послеоперационном периоде у больных, перенесших хирургическое вмешательство на позвоночнике [45]. Очень важные данные были получены I. Gunusen и соавт., которые сравнили выраженность боли и потребность в морфине у 120 больных, которые после абдоминальной гистерэктомии получали внутривенно теноксикам 20 мг, парацетамол 1 г или плацебо. В группе теноксикама послеоперационная боль была достоверно менее выражена, а суммарная потребность в морфине в трех группах составила 44,8±17,4 мг, 64,6±19,6 мг и 69,2±22,1 мг, соответственно (p
Безопасность
Как было отмечено выше, теноксикам относится к «традиционным» НПВП, т.е. неселективным ингибиторам ЦОГ-2, поэтому на фоне приема этого препарата могут отмечаться НР, свойственные всем другим представителям этой лекарственной группы. Прежде всего, речь идет о возможности развития осложнений со стороны ЖКТ [61]. Тем не менее, согласно данным многочисленных РКИ и наблюдательных исследований, приведенных выше, по переносимости он в целом превосходит многие другие популярные НПВП [19].
Было проведено несколько исследований, в которых изучалось действие теноксикама на слизистую оболочку верхних отделов ЖКТ. Так, Р. Müller и соавт. сравнили частоту эндоскопических изменений после 14-дневного приема теноксикама 20 мг/сут и диклофенака 100 мг/сут у 36 здоровых добровольцев. Теноксикам достоверно реже вызывал повреждения слизистой оболочки. Так, счет Lanza, отражающий выраженность изменений, составил 1,3±0,7 и 2,2±1,1 в двух группах, соответственно (р=0,014) [62]. А. al-Quorain и соавт. сравнивали частоту изменений слизистой оболочки желудка у 36 больных, получавших теноксикам 20 мг и диклофенак 100 мг в течение 4 недель. Повреждение слизистой оболочки было отмечено у 21% и 41% больных, соответственно. При этом множественные геморрагии и эрозии (>10) были выявлены лишь у 5% больных, получавших теноксикам, и 18% пациентов группы диклофенака [63].
G. Perpignano и соавт. оценили частоту и характер эндоскопических изменений ЖКТ у 60 больных ОА, которые в течение 8 недель получали теноксикам 20 мг/сут или умеренно селективный НПВП с хорошей переносимостью этодолак 600 мг/сут. Частота минимальных изменений слизистой желудка оказалась выше в группе теноксикама, однако язвы желудка встречались с одинаковой частотой (по 2 в каждой группе) [64].
Важные данные о сравнительной частоте НР при использовании теноксикама в реальной клинической практике были получены специалистами французской системы фармаконадзора, которые оценили 42389 спонтанных сообщений о серьезных НР, зарегистрированных за период с 2002 по 2006, и построили «рейтинг» для наиболее популярных НПВП в зависимости от частоты лекарственных осложнений. При лечении теноксимамом частота НР была низкой (0,42 случая на 1 млн принятых доз), сопоставимой с таковой при применении мелоксикама (0,41) и существенно ниже, чем при лечении диклофенаком (0,58) и особенно кетопрофеном (0,78) [65].
Данные по осложнениям со стороны сердечнососудистой системы при применении теноксикама ограничены, однако другие представители семейства оксикамов (мелоксикам и пироксикам) характеризуются средним риском их развития [66,67]. Недавно А. Arfе и соавт. провели анализ взаимосвязи между приемом НПВП и развитием сердечной недостаточности у 92163 больных, госпитализированных в связи с этой патологией в Нидерландах, Германии, Велико британии и Италии за период с 2000 по 2010 гг. Соответствующую по полу и возрасту контрольную группу составили 8 246 403 пациента без сердечной недостаточности. В среднем, прием НПВП ассоциировался с умеренным нарастанием риска сердечной недостаточности: показатель относительного риска (ОР) составил 1,19 (95% доверительный интервал [ДИ] 1,17-1,22). Теноксикам практически не повышал риск развития сердечной недостаточности (ОР 1,06; 95% ДИ 0,80-1,41). Для диклофенака этот показатель составил 1,19 (95% ДИ 1,151,24) [67].
Разумеется, при использовании теноксикама следует учитывать все противопоказания и тщательно оценивать наличие факторов риска класс-специфических осложнений, свойственных НПВП.
Заключение
Теноксикам – универсальный НПВП, который может использоваться как для купирования острой боли (в том числе в хирургической практике), так и и для длительного контроля болевых ощущений при хронических заболеваниях суставов и позвоночника. Имеется обширная доказательная база, основанная на данных хорошо организованных клинических испытаний и многолетнем опыте реальной практической работы, подтверждающая эффективность и хорошую переносимость этого препарата. Он удобен в применении (назначают один раз в день) и имеет различные лекарственные формы, в том числе для парентерального введения. Эти достоинства определяют целесообразность активного использования теноксикама в российской медицинской практике.

