Оксид углерода что это такое
Оксид углерода(IV)
| Оксид углерода (IV) | |
|---|---|
_   | |
| Другие названия | углекислый газ, двуокись углерода, сухой лёд(твердый) |
| Формула | CO2 |
| Молярная масса | 44,0095(14) г/моль |
| В твердом виде | сухой лёд |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1,9769 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1,45 кг/м³ |
| Удельная теплоемкость | 0,846 кДж/(кг*С) при 27 °C |
| Удельная теплота плавления | 25,13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6,35 и 10,33 |
| Вязкость | 0,07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | молекулярная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | |
| R-phrases | R: As, Fb [источник не указан 1315 дней] |
| S-phrases | S9, S23, S36 (ж) [источник не указан 1315 дней] |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO C3O2 стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references |
Оксид углерода(IV) (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом.
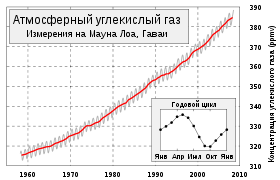
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,0395 %. [1]
Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Содержание
Свойства
Физические
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом ) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя. Смесь полученных газов, промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната, чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его, таким образом, отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
Жидкая углекислота широко применяется в системах пожаротушения, в огнетушителях и для производства газированной воды и лимонада.
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Когда углекислота применяется в газовой фазе, то для хранения она используется под давлением, как сжиженный газ, в виде жидкой фазы. Хранение углекислоты в баллоне в сжиженном состоянии намного выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру 31°С. Когда в 40-литровый баллон с нормальным давлением 100 кгс/сm² залито 30 кг сжиженного углекислого газа, то при температуре 31°С в баллоне будет только жидкая фаза с давлением 100 кгс/сm². Если температура будет выше, то следует уменьшить заполнение баллона или использовать баллоны с более высоким рабочим давлением. Если углекислота будет охлаждаться, то при температуре 21°С при нормальном заполнении в баллоне появиться газовая фаза.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле и т.д.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Углекислый газ в природе
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Токсичность
ОКСИД УГЛЕРОДА
ОКСИД УГЛЕРОДА (окись углерода, угарный газ — CO) — газ без цвета и запаха; почти не поглощается активированным углем; горит синим пламенем с образованием CO2 и выделением тепла; концентрационные пределы взрываемости (КПВ) в смеси с воздухом 12,5—74,2%; смесь CO : O2 = 2 : 1 (по объему) взрывается при зажигании. CO образуется при сгорании органических видов топлива (древесина, уголь, бумага, масла, бензины, газы, взрывчатые вещества и др.) в условиях недостатка О2; при взаимодействии CO2 с раскаленным углем, при конверсии метана в присутствии различных катализаторов.
Естественный уровень CO в атмосфере 0,01—0,9 мг/м 3 (в северном полушарии в 3 раза выше); 90% атмосферного CO образуется в результате естественных процессов (вулканические и болотные газы, лесные и степные пожары, жизнедеятельность наземной и океанической флоры и фауны, окисление метана в тропосфере). Сотни миллионов тонн CO поступают в атмосферу ежегодно в результате деятельности человека: автотранспорт, железнодорожный и морской транспорт; неисправность газопроводов и газоаппаратуры; металлургия, химическая индустрия (крекинг-процесс, производство формалина, углеводородов, аммиака, соды, фосгена, метилового спирта, муравьиной и щавелевой кислот, метана и др., производство и переработка синтетических волокон), угледобывающая промышленность (добыча угля и углеподающие трассы, поверхностное окисление угля в шахтах, тление терриконов); производство табака, хлеба; светокопирование; переработка отходов; сжигание топлива в быту.
В промышленности CO получают путем неполного окисления природного газа или газификацией угля и кокса. CO является одним из исходных соединений в органическом синтезе, используется как восстановитель в металлургии, производстве карбонилов, ароматических альдегидов, формамида, гексагидроксибензола, хлорида алюминия, метанола, синтетического бензина, синтола.
В основе биологического действия CO лежит образование карбоксигемоглобина (HbCO), при этом CO занимает место кислорода. В результате синтезируется HbCO вместо оксигемоглобина (HbO2). Сродство гемоглобина (Hb) человека к CO приблизительно в 240 раз выше, чем к О2. HbCO затрудняет подачу кислорода к тканям и высвобождение кислорода, доставленного молекулами Hb в ткани. CO связывается также с мышечным гемоглобином (миоглобином), что приводит к образованию карбоксимиоглобина и существенно влияет на обмен веществ в мышцах (особенно сердечной мышцы). В обычных условиях в организме человека образуется небольшое количество CO и уровень эндогенного HbCO составляет 0—0,7%. Нормой для разных категорий населения принято считать следующие уровни HbCO: беременные женщины — 0,4—2,6%, здоровые дети — 0,5—4,7%, взрослые — 1—5%, пациенты с гемолитической анемией — до 6%, курильщики (1 пачка в день) — 3—7%.
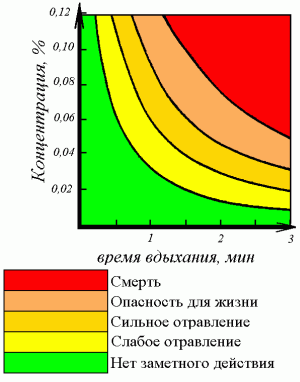
Тяжесть отравления зависит от концентрации и длительности воздействия CO, наличия сопутствующих хронических заболеваний и особенностей состояния здоровья человека, интенсивности дыхания. К группам риска при отравлении угарным газом относятся: беременные женщины, курильщики, лица с повышенной легочной вентиляцией (дети и подростки, лица, связанные с тяжелым физическим трудом или работающие в условиях нагревающего микроклимата, с высокой температурой тела), лица, страдающие заболеваниями сердечно-сосудистой системы (напр., ишемической болезнью сердца, церебральным или общим атеросклерозом), системной гипоксией, анемией, гипертиреозом. Мужчины более чувствительны к отравлению CO, чем женщины.
Концентрация карбоксигемоглобина HbCO в крови
и симптомы отравления угарным газом
Основные клинические симптомы
острого отравления
Содержание
в воздухе, мг/м 3
Снижение скорости психомоторных реакций, иногда — компенсаторное увеличение кровотока к жизненно важным органам. У лиц с выраженной сердечно-сосудистой недостаточностью — боль в груди при физической нагрузке, одышка
Незначительная головная боль, снижение умственной и физической работоспособности, одышка при средней физической нагрузке. Нарушения зрительного восприятия. Может быть смертельно для плода, лиц с тяжелой сердечной недостаточностью
Пульсирующая головная боль, головокружение, раздражительность, эмоциональная нестабильность, расстройство памяти, тошнота, нарушение координации мелких движений рук
Сильная головная боль, слабость, насморк, тошнота, рвота, нарушение зрения, спутанность сознания
Галлюцинации, тяжелая атаксия, тахипноэ
Обмороки или кома, конвульсии, тахикардия, слабый пульс, дыхание типа Чейна-Стокса
Кома, конвульсии, угнетение дыхания и сердечной деятельности. Возможен летальный исход
Глубокая кома со снижением или отсутствием рефлексов, нитевидный пульс, аритмия. Возможен летальный исход
Легкие отравления протекают без потери сознания или с кратковременным обмороком, могут сопровождаться сонливостью, тошнотой, рвотой. Отравления средней тяжести характеризуются потерей сознания различной длительности, после чего сохраняется общая слабость; могут быть провалы памяти, двигательные расстройства, судороги. При тяжелых отравлениях потеря сознания длится более 2 ч, происходят клонические и тонические судороги, непроизвольное мочеиспускание и дефекация.
Первые признаки типичной картины отравления при вдыхании угарного газа в концентрациях до 1000 мг/м 3 появляются уже через 5—10 мин: тяжесть и ощущение сдавливания головы, боль в лобных и височных областях, головокружение, затем присоединяются слабость, чувство страха и жажды, ощущение недостатка воздуха, пульсация височных артерий, тошнота, рвота. В дальнейшем, при сохранении сознания — мышечная слабость, оцепенелость и безучастность (или даже ощущение приятной истомы), из-за чего человек вскоре не может покинуть опасную зону; сонливость, спутанность и потеря сознания. В редких случаях наблюдаются атипические формы отравления — внезапная потеря сознания без предварительных симптомов либо острые психические расстройства во время или через 2—3 недели после воздействия высоких концентраций CO.
Последствиями острого отравления могут быть: продолжительные головные боли и головокружения, обмороки, энцефалопатии, психозы (редко), паркинсонизм; стойкие нарушения функции кишечника и мочевого пузыря; расстройства периферической нервной системы (двигательные, чувствительные и трофические); снижение остроты зрения и слуха, нарушение функции вестибулярного аппарата; трофические расстройства кожи, ногтей, волос; поражение органов дыхания, мышц, суставов; нарушение работы сердца (гипотония, тахикардия, экстрасистолия, стенокардия, инфаркт миокарда); гипертиреоз; поражение печени, надпочечников, почек; снижение иммунитета. Кроме того, у молодых пострадавших — хореоидные гиперкинезы, у пожилых — депрессия, деменция, амнезия, прогрессирующая кахексия.
Повторное воздействие. CO не накапливается в организме. Существует определенная адаптация к хроническому воздействию CO (увеличение концентрации гемоглобина и гематокрита). Хроническое отравление диагностируют по профессиональному анамнезу, клинической картине, содержанию HbCO в крови. Жалобы и симптомы интоксикации многообразны и неспецифичны: физическая и психическая астения, нарушения со стороны кардиореспираторной системы (одышка, сердцебиение, боли в области сердца, аритмия, экстрасистолия, стенокардия, гипотония), нервной системы (красный дермографизм, тремор, вялость рефлексов, невриты, расстройства речи, парезы, энцефалопатии и др.); эритроцитоз и ретикулоцитоз крови позже переходят в анемию; нарушаются все виды обмена. Признаки нарушения др. органов и систем в целом сходны с признаками острого отравления CO.
Профилактика. Локализация источников выделения CO путем герметизации оборудования, организации эффективного воздухообмена. Применение средств индивидуальной защиты — фильтрующих противогазов марки CO или М (время защитного действия при концентрации CO в воздухе 6200 мг/м 3 — 150 или 90 мин соответственно) — допускается лишь при наличии в воздухе 18% кислорода и не более 0,5% углекислого газа. Следует применять также кислородные изолирующие противогазы.
ПДК О. у. в воздухе рабочей зоны — 20 мг/м 3 ; пары; 4-й класс опасности (ГН 2.2.5.686—98); CAS [630-08-0].
О. у. — основной загрязнитель воздуха жилых помещений, опасный фактор пожара. Особенно высокая концентрация CO наблюдается в жилых помещениях с печным отоплением с использованием твердого топлива при нарушении правил эксплуатации печей. Для предохранения образования и проникновения CO в помещение вьюшечную задвижку можно полностью закрывать только тогда, когда дрова целиком прогорят, угли начинают темнеть и над ними уже не появляются голубые огоньки. Если печь топится углем, то для предохранения образования CO окончание топки производят так: убедившись, что стенки печи прогрелись в достаточной степени, полностью очищают топливник от остатков топлива, а затем закрывают вьюшечную задвижку. Остатки топлива дожигают во время следующей топки. У детей, живущих в домах с газовыми плитами, отмечено сокращение объема легких и увеличение числа респираторных заболеваний по сравнению с детьми, живущими в домах с электрическими плитами. Если нет возможности заменить газовую плиту на электрическую, то, по крайней мере, необходимо тщательно следить за исправностью конфорок у плиты, правильно регулировать доступ воздуха, не включать на полную мощность газовую плиту, желательно избегать ставить низко на конфорку кастрюли и сковородки больших размеров. Но в любом случае необходимо использовать кухонные воздухоочистители. Средства защиты: фильтрующие противогазы марки CO, самоспасатели СПИ-20, ПДУ-3 и др.
Окись углерода
Окись углерода
| Монооксид углерода | |
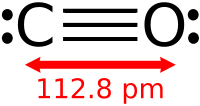 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Монооксид углерода |
| Химическая формула | CO |
| Отн. молек. масса | 28.0101 а. е. м. |
| Молярная масса | 28.0101 г/моль |
| Физические свойства | |
| Плотность вещества | 0,00125 (при 0°C) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −205 °C |
| Температура кипения | −191,5 °C |
| Энтальпия (ст. усл.) | −110,52 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0.0026 г/100 мл |
| Классификация | |
| номер CAS | [630-08-0] |
Монооксид углерода (лат. Carbon monoxide ; другие названия — уга́рный газ, окись углерода, моноокись углерода, оксид углерода (II)) — бесцветный газ без вкуса и запаха. Химическая формула CO.
Содержание
Строение молекулы
Молекула CO, так же, как и изоэлектронная ей молекула азота, имеет тройную связь. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой :C≡O:, причём третья связь образована по донорно-акцепторному механизму, где углерод является акцептором электронной пары, а кислород — донором.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ 2 Oσ 2 zπ 4 x, yσ 2 C. Тройная связь образована σ—связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум σ—связям. Электроны на несвязывающих σC—орбитали и σO—орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
История открытия
Монооксид углерода был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем. То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крукшэнк. Моноксид углерода вне атмосферы Земли впервые был обнаружен бельгийским ученым М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК спектре Солнца.
Монооксид углерода в атмосфере Земли
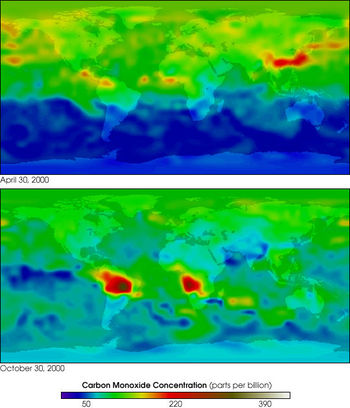
Различают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Монооксид углерода образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение монооксида углерода за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв монооксид углерода выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % монооксида углерода. В настоящее время в коммунальной сфере этот газ вытеснен гораздо менее токсичным природным газом (низшие представители гомологического ряда алканов — пропан и др.)
Поступление CO от природных и антропогенных источников примерно одинаково.
Монооксид углерода в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года, окисляясь гидроксилом до диоксида углерода.
Получение
Промышленный способ
1. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2. или при восстановлении диоксида углерода раскалённым углём:
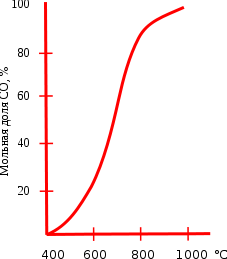
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400°C равновесие практически полностью сдвинуто влево, а при температуре выше 1000°C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому монооксид углерода при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
3. Смеси монооксида углерода с другими веществами получают при пропускании воздуха, водяного пара и т. п. сквозь слой раскалённого кокса, каменного или бурого угля и т. п. (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
Лабораторный способ
1. Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5. Схема реакции:
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
2. Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
Выделяющийся совместно с CO диоксид углерода можно удалить, пропустив смесь через баритовую воду.
3. Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:
Физиологическое действие, токсичность
Опытами на молодых крысах выяснено, что 0,02-процентная концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
Помощь при отравлении монооксидом углерода: пострадавшего следует вынести на свежий воздух, полезно также кратковременное вдыхание паров нашатырного спирта.
TLV (предельная пороговая концентрация, США): 25 ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³
Защита от монооксида углерода
Свойства
Монооксид углерода представляет собой бесцветный газ без вкуса и запаха. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
| Стандартная энергия Гиббса образования ΔG | −137,14 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 197,54 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 29,11 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 0,838 кДж/моль |
| Энтальпия кипения ΔHкип | 6,04 кДж/моль |
| Критическая температура tкрит | −140,23°C |
| Критическое давление Pкрит | 3,499 МПа |
| Критическая плотность ρкрит | 0,301 г/см 3 |
Основными типами химических реакций, в которых участвует монооксид углерода, являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830°C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
до 830°С смещено вправо, выше 830°C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Монооксид углерода горит синим пламенем (температура начала реакции 700°C) на воздухе:
Температура горения CO может достигать 2100°C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42°C, кипения +16°C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200°C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
C переходными металлами образует очень летучие, горючие и ядовитые соединения — карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Как указано выше, монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
Определение монооксида углерода
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
Эта реакция очень чувствительная. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Количественное определение монооксида углерода основано на иодометрической реакции:
Применение
См. также
Литература
Ссылки
Полезное
Смотреть что такое «Окись углерода» в других словарях:
Окись углерода — см. Оксид углерода … Российская энциклопедия по охране труда
ОКИСЬ УГЛЕРОДА — (carbon monoxide) бесцветный, практически без запаха, очень ядовитый газ. При попадании в организм он связывается с гемоглобином, содержащимся в эритроцитах крови, с образованием карбоксигемоглобина, имеющего ярко красную окраску. Это соединение… … Толковый словарь по медицине
окись углерода — anglies monoksidas statusas T sritis apsauga nuo naikinimo priemonių apibrėžtis Bespalvės, bekvapės nuodingosios dujos, kurios susidaro trūkstant deguonies degimo metu. Virimo temperatūra 192 °C. Apsinuodijimo požymiai: lengvai apsinuodijus –… … Apsaugos nuo naikinimo priemonių enciklopedinis žodynas
окись углерода — anglies monoksidas statusas T sritis ekologija ir aplinkotyra apibrėžtis Nevisiško degimo produktas – bespalvės, beskonės, bekvapės nuodingos dujos (CO). Į atmosferą patenka su kūryklų dujomis, automobilių deginiais (juose anglies monoksido yra… … Ekologijos terminų aiškinamasis žodynas
окись углерода — (син. угарный газ) газ без цвета и запаха, образующийся при неполном сгорании органических соединений; обладает сильным токсическим действием, обусловленным способностью вытеснять кислород из оксигемоглобина, образуя карбоксигемоглобин … Большой медицинский словарь
Окись углерода — (угарный газ) см. Углерод … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окись углерода — – газ без цвета, запаха образуется при неполном сгорании органических соединений; вытесняет кислород из оксигемоглобина, образуя карбоксигемоглобин; угарный газ … Словарь терминов по физиологии сельскохозяйственных животных
окись углерода — угарный газ … Cловарь химических синонимов I
Окись Углерода (Carbon Monoxide) — бесцветный, практически без запаха, очень ядовитый газ. При попадании в организм он связывается с гемоглобином, содержащимся в эритроцитах крови, с образованием карбоксигемоглобина, имеющего ярко красную окраску. Это соединение является химически … Медицинские термины
ОКИСЬ — ОКИСЬ, окиси, жен. (хим.). Промежуточная степень окисления вещества в отличие от закиси низшей, и перекиси высшей степени окисления. Окись углерода (угарный чад). Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова