Оксид циркония что это
Оксид циркония: история открытия и тонкости производства
Оксид циркония появился на стоматологическом рынке в 2004 году. Он завоевал доверие стоматологов благодаря механизму трансформационного упрочнения и высокой прочности. Его стали активно использовать для каркасов протезов, корневых штифтов, замковых креплений, штифто-культевых вкладок, несъемных шин, а также супраструктур дентальных имплантов. Со временем стало понятно, что материал достаточно сложен в обработке и требует дальнейшего изучения.
История открытия оксида циркония
Двести лет назад оксид циркония выделили из его минерала. Более трех тысячелетий назад минерал использовали на острове Цейлон как несовершенный алмаз – для изготовления украшений. Есть несколько версия появления названия. К примеру, по версии одного источника, в 1776 г. немецкий ученый Брюкнер назвал его «заркун», то есть «минерал». Первым, кто выделил из минерала циркон оксид циркония, стал немецкий химик Мартин Генрих Клапрон, – в 1789 г.
Циркон и цирконий
Минерал циркон – это силикат циркония с примесями меди, железа, кальция, цинка, урана, тория, гафния и титана. Он встречается в природе в виде призматических кристаллов, агрегатов, зерен, отличается по цвету и прозрачности. Чистый оксид циркония тугоплавкий, имеет низкую удельную теплопроводность, малорастворим в воде, устойчив к химическим реагентам.
Цирконий – это элемент IV группы таблицы Менделеева с атомной массой 91,224. Он существует в двух формах – кристаллической и аморфной. Максимально высокая концентрация вещества – в щелочных породах. В природе встречается в соединении с оксидом силиката – минерал циркон или как свободный оксид циркония – минерал бадделеит.
Производство и получение оксида циркония

Оксид циркония существует в виде моноклинной, тетрагональной и кубической кристаллических фаз. При нагревании он преобразуется из одной фазы в другую с уменьшением объема. Для стабилизации состояния в него добавляют стабилизирующие оксиды кальция, магния, церия, иттрия.
Исключительные физические и механические свойства наблюдаются у керамики на основе оксида циркония, стабилизированного частично оксидом иттрия. Такой материал имеет рекордные показатели прочности на изгиб и отменную трещиностойкость.
Для промышленного изготовления коронок на зубы из циркония в ортопедической стоматологии применяют порошок частично стабилизированного оксида циркония высокой степени очистки. Возможны два варианта его обработки.
Итог – подобные мелу, необожженные керамические блоки высокой плотности (95 % от теоретической). Их можно снова термически обработать в атмосфере кислорода в специальной печи без давления, чтобы получить блоки в предварительно спеченном состоянии («мягкий» циркон). Для полностью спеченного состояния, или «твердого» циркона, температура обработки должна быть не 1000, а 1500 °С.
Результат после спекания – керамические блоки с плотностью 100 %. Удаление остаточной пористости происходит при давлении 1000 бар и температуре, которая на 50 °С ниже, чем температура спекания. Блоки имеют серовато-черный цвет, поэтому проводят дополнительное окисление для восстановления белизны. Такие блоки отличаются более высокой прочностью.
Механизм трансформационного упрочнения керамики
Высокая прочность керамики объясняется механизмом трансформационного упрочнения. Частицы тетрагонального оксида циркония трансформируются в моноклинную фазу при появлении в металле трещин из-за сжимающих напряжений. На переднем конце трещины объем увеличивается на 3-5 % – это провоцирует сжимающие напряжения в противоположном направлении и подавляет распространение трещины. Этот принцип можно сравнить с принципом действия подушки безопасности в автомобиле.
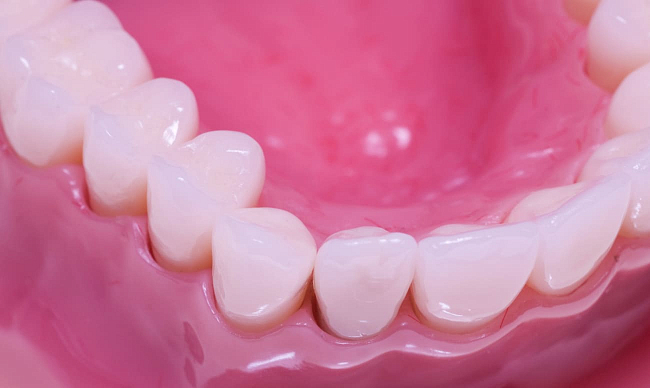
Коронки из диоксида циркония
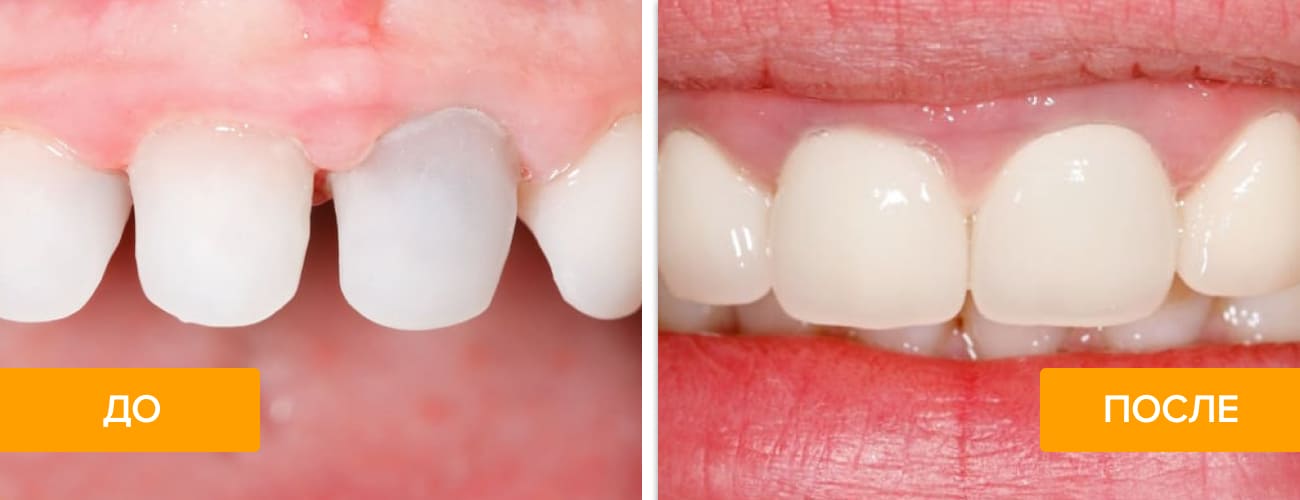
Восстановление сильно разрушенных зубов отнимает много времени и сил, поэтому хочется решить проблему раз и навсегда. Сейчас стоматологи имеют возможность пользоваться новейшими методиками реставрационной техники с применением современных материалов, в том числе и диоксида циркония, из которого получаются красивые и прочные ортопедические конструкции. Подробнее об этом уникальном материале рассказывает Startsmile.
Содержание статьи
Что такое оксид, или диоксид, циркония?
Оксид или диоксид циркония используют для изготовления коронок, виниров и абатментов на имплантаты. И хотя формально цирконий — это металл, конструкции из ZrO2 принято относить к безметалловым: они лишены недостатков традиционной металлокерамики, в том числе визуальных — диоксид циркония белого цвета.
У этого материала есть несколько неоспоримых преимуществ.
Всегда ли нужно выбирать виниры и коронки из диоксида циркония?
Из диоксида циркония можно изготовить любой протез: коронку, в том числе и на зубной имплантат, вкладку или винир. И все они будут обладать определенными преимуществами перед аналогичными конструкциями из других материалов.
✔ Чаще всего диоксид циркония используют при восстановлении жевательных зубов. Благодаря своей прочной структуре он легко выдерживает нагрузку, которая приходится на моляры, не скалывается и не разрушается даже по прошествии длительного времени. В то же время циркониевые коронки на боковые зубы не будут выглядеть искусственно.
✔ Для протезирования передних зубов, как правило, применяют протезы из цельной керамики, поскольку диоксид циркония при всех своих плюсах хуже пропускает свет, а потому выглядит менее естественно. Однако если мы говорим о протезировании на имплантатах, для зоны улыбки идеально подойдет керамическая коронка на циркониевом каркасе и циркониевый абатмент.
✔ Виниры из диоксида циркония очень прочные и служат, как правило, дольше цельнокерамических и композитных. Если вы хотите поставить циркониевые виниры, не стоит гнаться за низкой ценой: для хорошего результата важно, чтобы заготовки были высокого качества и обладали определенной степенью прозрачности.
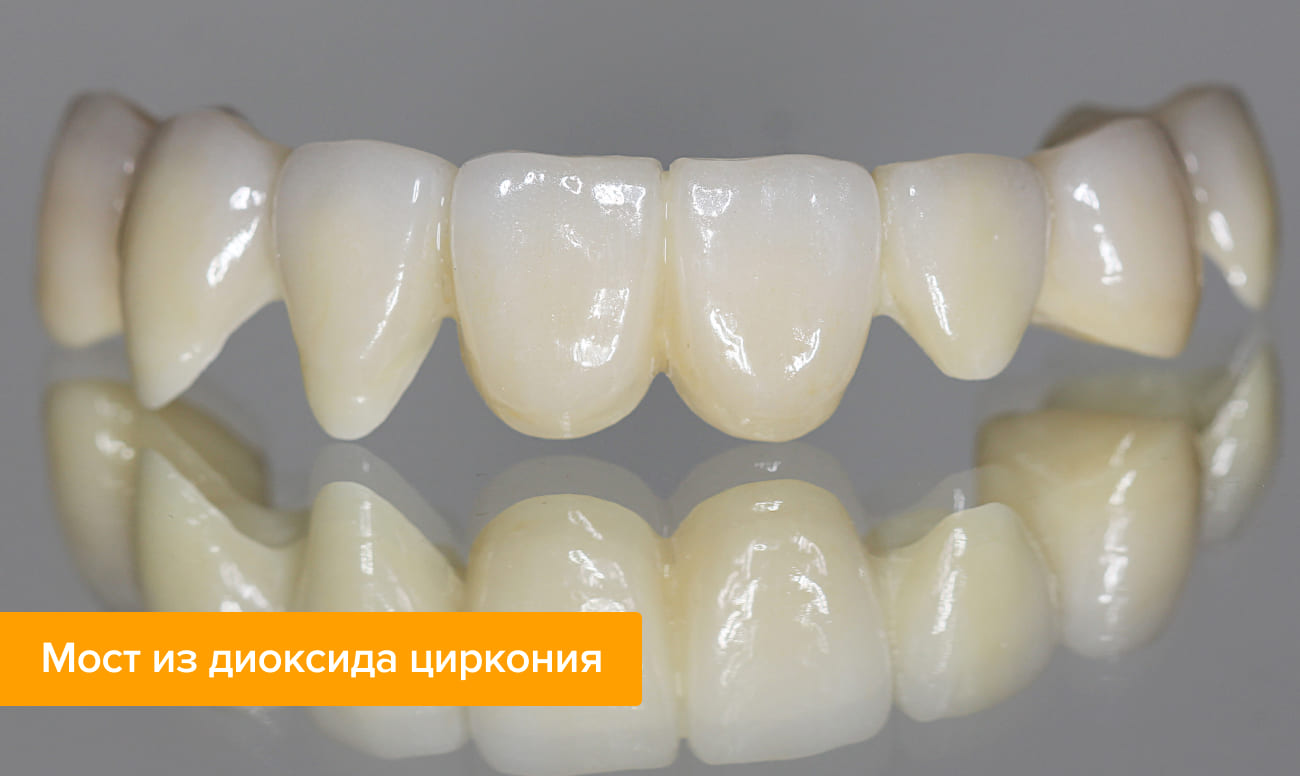
Какие бывают коронки из диоксида циркония и как они изготавливаются?
Есть два типа циркониевых протезов.
Какой бы вариант вы ни выбрали, для изготовления ортопедической конструкции из диоксида циркония нужно специальное оборудование. Каркас или сам протез, если мы говорим о монолитном решении, вытачивается на фрезеровальном станке с программным управлением. Станок напрямую управляется компьютером, поэтому результат будет точным, без влияния человеческого фактора.
Чтобы придать будущей коронке эстетичный вид, каркас покрывается несколькими слоями керамики. После нанесения каждого слоя он обжигается в печи для прочности. В конце зубной техник придает коронке нужный оттенок.
В случае с монолитной конструкцией этап нанесения керамической массы отсутствует.
Какие плюсы имеют абатменты и коронки из диоксида циркония с опорой на имплантаты?
Циркониевые коронки идеально подходят для протезирования зубов на имплантатах: они легче, чем конструкции на любом другом металле, и не выделяются на фоне естественных зубов. Что касается абатментов из диоксида циркония, то благодаря высокой эстетике они используются для протезирования в зоне улыбки. Подходят и для жевательных зубов с силу своей прочности.
Какова цена коронки из диоксида циркония в Москве?
Цена на коронки из диоксида циркония в Москве зависит от многих факторов. Поэтому точную стоимость лечения можно определить только после консультации с врачом. В целом же можно сказать, что цены начинаются от 30 000 рублей за обычную коронку и 37 000 рублей — за коронку на имплантат. Для сравнения: цена металлокерамического протеза на зуб начинается от 10 000 рублей. Однако качество и эстетика диоксида циркония превосходят металлокерамику во много раз.
Оксид циркония: история открытия и тонкости производства
Что такое цирконий
Цирконием называют элемент zirconium (Zr). В таблице Менделеева указан его атомный вес 91,22 и номер 40. Входит в состав продуктов питания, камней, руд.
Соединение циркония с кислородом – это металл серебристо-серого цвета. Напоминает нержавеющую сталь, белое золото. До очистки нередко содержит радиоактивные примеси. После удаления должен соответствовать ГОСТу 21907-76. Он непрозрачный, ковкий, вязкий, устойчив к коррозии, не намагничивается, но притягивается сильным полем.
Цирконий в украшениях используется в виде металлических вставок и оправ, для изготовления сережек.
Его также применяют для синтеза фианитов. Это прозрачные камни с бриллиантовой чистотой и сиянием. Темно-серые, графитовые или черные искусственные самоцветы называют черным цирконием.
Фианиты также бывают:
Циркон отличается от металла тем, что это природный драгоценный камень группы силикатов. В его составе есть элемент Zr, отчего минерал используется для извлечения циркония. По окрасу бывает бесцветным (матарский алмаз), золотистым (сиамский), голубым (старлит) и бурым (малакон).
В дополнение смотрите видеообзор в продолжение описания металла:
Подробнее об отличиях циркона, циркония и фианита читайте в статье.


Производство
Как уже говорилось ранее, цирконий изготавливается исключительно лабораторным путем. В качестве основного компонента применяется минерал циркон.
Получить синтетический камень можно несколькими способами:
В ходе всех вышеперечисленных методов образуется химическое соединение, из которого отделяется цирконий методом кристаллизации.
История происхождения циркония
Похожие на название циркония натуральные самоцветы цирконы используются давно. Их называли несовершенными алмазами, а темно-красные – гиацинтами. По легенде, это отвердевшие капли крови Гиацинта, убитого богом Зефиром. В русской сказке аленьким цветочком назван цветок, выточенный из бордового циркона.
В Средневековье их называли самоцветами-убийцами. Было подмечено: владелец начинал болеть при носке темно окрашенных крупных камней, затем умирал. Это случалось из-за использования радиоактивных минералов. Такие цирконы и сейчас нельзя применять.
История синтеза циркониевого металла:
Исследователи причисляют диоксид циркония к металлу с усовершенствованными свойствами. Он подходит для изготовления пластин для костей, коронок, других медицинских конструкций. Изделия безопасны, не противопоказаны для прохождения МРТ.
Смотрите видео о циркониевом металле:
Основные отличия циркониевых коронок от металлокерамических
Чтобы понять, диоксид циркония или металлокерамика – что лучше, приводим сравнительные характеристики для следующих аспектов:
Свойства и применение циркония
Циркониевые сплавы используются в химическом, машиностроительном и других производствах, в медицине. Порошок применяют для пиротехники, снарядов. Соединение с сульфатом используют для дубления кожи.
В ювелирном деле из циркониевого сплава или окиси делают оправы, вставки и самоцветы. Но это – не драгоценные камни или металл, а их имитация.
Физико-химические свойства
Чистый металл тверже стали, гибкий. Выдерживает давление в 65 кгс на 1 мм2. Чем больше газовых примесей, тем ниже прочность.
Формула записывается как ZrO2 (диоксид циркония). Он выдерживает до 750 °С, затем начинает рекристаллизовываться. Плавиться будет при + 1855 °С, а кипеть – при температуре более 4000 °С.
В основе циркона лежит силикат циркония (ZrSiO4). Поэтому различаются химико-физические характеристики минерала и металла.
При естественной температуре циркониевый металл устойчив к коррозии:
У металла структура решетки похожа на шестиугольник с равными сторонами (гексагональная). Радиус атома равен 160 пикометра (10-12 м). В центре есть ядро с 51 нейтроном и 40 протонами. Вокруг него расположены пять орбит с 40 электронами.
У фианитов строение решетки напоминает равносторонний куб. Окрас зависит от примесей. Желтую и красную гамму дает соединение с церием. Благодаря титану получается золотистый самородок. В розовый окрашивает эрбий, а в пурпурный – неодим. Добавление хрома дает зеленый колер.
Лечебные свойства циркония
В медицине используют только циркониевые сплавы:
Циркониевые изделия биологически совместимы с тканями, не отторгаются, не окисляются, не вызывают нагноения или аллергии. Они ускоряют регенерацию поврежденных структур.
Циркониевые сережки рекомендуют носить после прокола ушей. Они быстрее заживут, не будут гноиться.
Подмечено, что браслет или пояс с металлическими вставками ускоряет выздоровление у пациентов с патологиями опорно-двигательного аппарата. Около 10 % людей отзываются об улучшении кожи при псориазе или других дерматологических болезнях.
Каркасы из стоматологических металлических сплавов
Каркас для металлокерамической конструкции делается из сплавов кобальта и хрома, никеля и хрома, используются и драгоценные металлы – золото, платина, палладий. Толщина основы составляет от 0,3 до 0,5 мм, вместе со слоем керамики толщина протеза составляет около 1,5-2 мм.
В отличие от композитных материалов, которые также применяются для реставрации коронок, и намного дешевле, керамика воспроизводит цвет и структуру натуральной зубной ткани, при этом она не тускнеет и не впитывает красящие вещества.
Металлокерамическая зубная коронка – хороший вариант, если необходимо восстанавливать жевательные зубы эстетично и надежно и у вас нет аллергии на металлы. Металлокерамические протезы имеет следующие преимущества:
Но металлокерамические зубные протезы имеют некоторые недостатки:
Лечебные свойства камня
Циркониевый материал является биологически инертным и никак не влияет на здоровье людей. Благодаря такому показателю специалисты ценят этот металл больше, чем титан. Примерно 20 лет назад активно рекламировали циркониевый браслет. Но ученые доказали, что состояние здоровья от их ношения не меняется. Были единичные случаи, когда украшение помогало справиться с мигренями. Спустя некоторое время, выяснилось, что самочувствие улучшалось благодаря эффекту плацебо.
Свойство металла нагреваться помогает ему взаимодействовать с серными кислотами. Многих интересует, сколько элементов могут реагировать с циркониевым металлом. Как показывает практика, есть два основных: кислород и галоген.
Физико-химические свойства
Цирконий — блестящий серебристо-серый металл. Существует в двух кристаллических модификациях: α-Zr с гексагональной решёткой типа магния (а = 3,231 Å; с = 5,146 Å; z = 2; пространственная группа P63/mmc
Плотность α-циркония (20 °C) 6,5107 г/см³; Tпл — 1855 °C; Tкип — 4409 °C; удельная теплоёмкость (25-100 °C) 0,291 кДж/(кг×К) [0,0693 кал/(г×°C)], коэффициент теплопроводности (50 °C) 20,96 вт/(м×К) [0,050 кал/(см×сек×°C)]; температурный коэффициент линейного расширения (20-400 °C) 6,9×10−6; удельное электрическое сопротивление циркония высокой степени чистоты (20 °C) 44,1 мкОм×см. температура перехода в состояние сверхпроводимости 0,7 К.
Внешняя электронная конфигурация атома циркония 4d25s2. Для циркония характерна степень окисления +4. Более низкие степени окисления +2 и +3 известны для циркония только в его соединениях с хлором, бромом и иодом.
Компактный цирконий медленно начинает окисляться в пределах 200—400 °C, покрываясь плёнкой циркония двуокиси ZrO2; выше 800 °C энергично взаимодействует с кислородом воздуха. Порошкообразный металл пирофорен — может воспламеняться на воздухе при обычной температуре. Цирконий активно поглощает водород уже при 300 °C, образуя твёрдый раствор и гидриды ZrH и ZrH2; при 1200—1300 °C в вакууме гидриды диссоциируют и весь водород может быть удалён из металла. С азотом цирконий образует при 700—800 °C нитрид ZrN. Цирконий взаимодействует с углеродом при температуре выше 900 °C с образованием карбида ZrC. Карбид и нитрид циркония
— твёрдые тугоплавкие соединения;
карбид циркония
— полупродукт для получения хлорида ZrCl4. Цирконий вступает в реакцию со фтором при обычной температуре, а с хлором, бромом и иодом при температуре выше 200 °C, образуя высшие галогениды ZrHal4 (где Hal — галоген). Цирконий устойчив в воде и водяных парах до 300 °C, не реагирует с соляной и серной (до 50 %) кислотами, а также с растворами щелочей (цирконий — единственный металл, стойкий в щелочах, содержащих аммиак). С азотной кислотой и царской водкой он взаимодействует при температуре выше 100 °C. Растворяется в плавиковой и горячей концентрированной (выше 50 %) серной кислотах. Из кислых растворов могут быть выделены соли соответствующих кислот разного состава, зависящего от концентрации кислоты. Так, из концентрированных сернокислых растворов циркония осаждается кристаллогидрат Zr(SO4)2•4H2O; из разбавленных растворов — основные сульфаты общей формулы xZrO2 • ySO3 • zH2O (где х : y > 1). Сульфаты циркония при 800—900 °C полностью разлагаются с образованием двуокиси циркония. Из азотнокислых растворов кристаллизуется Zr(NO3)4 • 5H2O или ZrO(NO3)2 • xH2O (где х = 2-6), из солянокислых растворов — ZrOCl2 • 8H2O, который обезвоживается при 180—200 °C.
Нахождение в природе
Соединения циркония широко распространены в литосфере. В природе распространены главным образом циркон (ZrSiO4), бадделеит (ZrO2) и различные сложные минералы. Во всех земных месторождениях цирконию сопутствует Hf, который входит в минералы циркона благодаря изоморфному замещению атома Zr.
Циркон является самым распространенным циркониевым минералом. Он встречается во всех типах пород, но главным образом в гранитах и сиенитах. В графстве Гиндерсон (шт. Сев. Каролина) в пегматитах были найдены кристаллы циркона длиной в несколько сантиметров, а на Мадагаскаре были обнаружены кристаллы, вес которых исчисляется килограммами.
Бадделеит был найден Юссаком в 1892 г в Бразилии. Основное месторождение находится в районе Посус-ди-Калдас (Бразилия). Там была найдена глыба бадделеита весом около 30 т, а в водных потоках и вдоль обрыва бадделеит встречается в виде аллювиальной гальки диаметром до 7,5 мм, известной под названием фавас (от португальского fava
— боб). Фавас обычно содержит свыше 90 % двуокиси циркония.
Отзывы
Ольга, 32 года «Три года назад купила себе серьги из циркона. Покорила цена – всего 2 тысячи рублей. Достоинства – они красивы, долговечны, не ржавеют. Недостаток – немного шершавая поверхность»
Валентина, 53 года «Дочка подарила мне на 8 марта циркониевый браслет. Я долго её ругала, так как все эти медицинские «штучки» считала ерундой и приманкой от шарлатанов. Однако, решила попробовать его в действии и удивилась, давление действительно в течение длительного времени было нормальным, несмотря на то, что я гипертоник»
Екатерина, 28 лет «Кулон, с камнем цирконом мне подарил молодой человек. Я заметила, что с его появлением меня меньше стали мучать приступы аллергии. Теперь, это мой талисман»
Стоимость за грамм
Австралийский Союз и Южно-Африканская Республика уже давно являются основными поставщиками циркония на мировой рынок. Спрос на металл постоянно увеличивается. А количество поставляемого материала остается примерно на одном уровне. Поэтому его стоимость постоянно увеличивается.
На данный момент цена грамма киновари составляет около 100-200 рублей.
Цирконий знаком человеческому обществу уже столетие, но он до сих пор не открыл людям все свои тайны. Неясно, почему химический элемент получил свое имя, каково полное влияние металла на живой организм. Наверно известны не все серы, в которых можно применять удивительный металл серебряного цвета.
Удельный вес циркония, его свойства, применение, таблица значений
| Цирконий | |
| Атомный номер | 40 |
| Внешний вид простого вещества | |
| Свойства атома | |
| Атомная масса (молярная масса) | 91,224 а. е. м. (г/моль) |
| Радиус атома | 160 пм |
| Энергия ионизации (первый электрон) | 659,7 (6,84) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d2 5s2 |
| Химические свойства | |
| Ковалентный радиус | 145 пм |
| Радиус иона | (+4e)79 пм |
| Электроотрицательность (по Полингу) | 1,33 |
| Электродный потенциал | 0 |
| Степени окисления | 0, +1, +2, +3, +4 |
| Термодинамические свойства простого вещества | |
| Плотность | 6,506 /см³ |
| Молярная теплоёмкость | 25,3 Дж/(K·моль) |
| Теплопроводность | 22,7 /(·) |
| Температура плавления | 2125 |
| Теплота плавления | 19,2 кДж/моль |
| Температура кипения | 4650 |
| Теплота испарения | 567 кДж/моль |
| Молярный объём | 14,1 ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,231 c=5,148 |
| Отношение c/a | 1,593 |
| Температура Дебая | 291 |
| Zr | 40 |
| 91,224 | |
| [Kr]4d25s2 | |
| Цирконий | |
— элемент побочной подгруппы четвёртой группы пятого периода периодической системы химических элементов, атомный номер 40. Обозначается символом
Zr
(лат.
Zirconium
). Простое вещество
цирконий
(CAS-номер: 7440-67-7) — блестящий металл серебристо-серого цвета. Обладает высокой пластичностью, устойчив к коррозии. Существует в двух кристаллических модификациях: α-Zr с гексагональной решёткой типа магния, β-Zr с кубической объёмноцентрированной решёткой типа α-Fe, температура перехода α↔β 863 °C.
Нахождение в природе
Соединения циркония широко распространены в литосфере. В природе распространены главным образом циркон (ZrSiO4), бадделеит (ZrO2) и различные сложные минералы. Во всех земных месторождениях цирконию сопутствует Hf, который входит в минералы циркона благодаря изоморфному замещению атома Zr.
Циркон является самым распространенным циркониевым минералом. Он встречается во всех типах пород, но главным образом в гранитах и сиенитах. В графстве Гиндерсон (шт. Сев. Каролина) в пегматитах были найдены кристаллы циркона длиной в несколько сантиметров, а на Мадагаскаре были обнаружены кристаллы, вес которых исчисляется килограммами.
Бадделеит был найден Юссаком в 1892 г в Бразилии. Основное месторождение находится в районе Посус-ди-Калдас (Бразилия). Там была найдена глыба бадделеита весом около 30 т, а в водных потоках и вдоль обрыва бадделеит встречается в виде аллювиальной гальки диаметром до 7,5 мм, известной под названием фавас (от португальского fava
— боб). Фавас обычно содержит свыше 90 % двуокиси циркония.
Что такое цирконий
Цирконием называют элемент zirconium (Zr). В таблице Менделеева указан его атомный вес 91,22 и номер 40. Входит в состав продуктов питания, камней, руд.
Соединение циркония с кислородом – это металл серебристо-серого цвета. Напоминает нержавеющую сталь, белое золото. До очистки нередко содержит радиоактивные примеси. После удаления должен соответствовать ГОСТу 21907-76. Он непрозрачный, ковкий, вязкий, устойчив к коррозии, не намагничивается, но притягивается сильным полем.
Цирконий в украшениях используется в виде металлических вставок и оправ, для изготовления сережек.
Его также применяют для синтеза фианитов. Это прозрачные камни с бриллиантовой чистотой и сиянием. Темно-серые, графитовые или черные искусственные самоцветы называют черным цирконием.
Фианиты также бывают:
Циркон отличается от металла тем, что это природный драгоценный камень группы силикатов. В его составе есть элемент Zr, отчего минерал используется для извлечения циркония. По окрасу бывает бесцветным (матарский алмаз), золотистым (сиамский), голубым (старлит) и бурым (малакон).
В дополнение смотрите видеообзор в продолжение описания металла:
Подробнее об отличиях циркона, циркония и фианита читайте в статье.
Физико-химические свойства
Цирконий — блестящий серебристо-серый металл. Существует в двух кристаллических модификациях: α-Zr с гексагональной решёткой типа магния (а = 3,231 Å; с = 5,146 Å; z = 2; пространственная группа P63/mmc
Плотность α-циркония (20 °C) 6,5107 г/см³; Tпл — 1855 °C; Tкип — 4409 °C; удельная теплоёмкость (25-100 °C) 0,291 кДж/(кг×К) [0,0693 кал/(г×°C)], коэффициент теплопроводности (50 °C) 20,96 вт/(м×К) [0,050 кал/(см×сек×°C)]; температурный коэффициент линейного расширения (20-400 °C) 6,9×10−6; удельное электрическое сопротивление циркония высокой степени чистоты (20 °C) 44,1 мкОм×см. температура перехода в состояние сверхпроводимости 0,7 К.
Внешняя электронная конфигурация атома циркония 4d25s2. Для циркония характерна степень окисления +4. Более низкие степени окисления +2 и +3 известны для циркония только в его соединениях с хлором, бромом и иодом.
Компактный цирконий медленно начинает окисляться в пределах 200—400 °C, покрываясь плёнкой циркония двуокиси ZrO2; выше 800 °C энергично взаимодействует с кислородом воздуха. Порошкообразный металл пирофорен — может воспламеняться на воздухе при обычной температуре. Цирконий активно поглощает водород уже при 300 °C, образуя твёрдый раствор и гидриды ZrH и ZrH2; при 1200—1300 °C в вакууме гидриды диссоциируют и весь водород может быть удалён из металла. С азотом цирконий образует при 700—800 °C нитрид ZrN. Цирконий взаимодействует с углеродом при температуре выше 900 °C с образованием карбида ZrC. Карбид и нитрид циркония
— твёрдые тугоплавкие соединения;
карбид циркония
— полупродукт для получения хлорида ZrCl4. Цирконий вступает в реакцию со фтором при обычной температуре, а с хлором, бромом и иодом при температуре выше 200 °C, образуя высшие галогениды ZrHal4 (где Hal — галоген). Цирконий устойчив в воде и водяных парах до 300 °C, не реагирует с соляной и серной (до 50 %) кислотами, а также с растворами щелочей (цирконий — единственный металл, стойкий в щелочах, содержащих аммиак). С азотной кислотой и царской водкой он взаимодействует при температуре выше 100 °C. Растворяется в плавиковой и горячей концентрированной (выше 50 %) серной кислотах. Из кислых растворов могут быть выделены соли соответствующих кислот разного состава, зависящего от концентрации кислоты. Так, из концентрированных сернокислых растворов циркония осаждается кристаллогидрат Zr(SO4)2•4H2O; из разбавленных растворов — основные сульфаты общей формулы xZrO2 • ySO3 • zH2O (где х : y > 1). Сульфаты циркония при 800—900 °C полностью разлагаются с образованием двуокиси циркония. Из азотнокислых растворов кристаллизуется Zr(NO3)4 • 5H2O или ZrO(NO3)2 • xH2O (где х = 2-6), из солянокислых растворов — ZrOCl2 • 8H2O, который обезвоживается при 180—200 °C.
История и происхождение названия[ | ]
Цирконий в виде диоксида впервые был выделен в 1789 году немецким химиком М. Г. Клапротом в результате анализа минерала циркона (природного силиката циркония).
В свободном виде цирконий впервые был выделен шведским химиком Берцелиусом в 1824 году[4]. Свободный от примесей чистый цирконий удалось получить лишь более чем через 100 лет (А. ван Аркель, 1925 год).[2]
Происхождение самого слова циркон
неясно. Возможно, оно происходит от арабского
zarkûn
(киноварь) или от персидского
zargun
(золотистый цвет).
Применение циркония и его соединений
В промышленности цирконий стал применяться с 30-х годов XX века. Из-за высокой стоимости его применение ограничено. Единственным предприятием, специализирующемся на производстве циркония в России (и на территории бывшего СССР), является Чепецкий механический завод (Глазов, Удмуртия).
Металлический цирконий и его сплавы
Ядерная энергетика
Цирконий имеет очень малое сечение захвата тепловых нейтронов. Поэтому металлический цирконий, не содержащий гафния, и его сплавы применяются в атомной энергетике для изготовления тепловыделяющих элементов, теплообменников и других конструкций ядерных реакторов.
Легирование
Пиротехника
Цирконий обладает замечательной способностью сгорать в кислороде воздуха (температура самовоспламенения — 250 °C) практически без выделения дыма, с высокой скоростью и развивая наиболее высокую температуру из всех металлических горючих (4650 °C). За счет высокой температуры образующаяся двуокись циркония излучает значительное количество света, что используется очень широко в пиротехнике (производство салютов и фейерверков), производстве химических источников света применяемых в различных областях деятельности человека (факелы, осветительные ракеты, осветительные бомбы, ФОТАБ — фотоавиабомбы). В этой сфере повышеный интерес имеет не только металлический цирконий, но и его сплавы с церием (значительно больший световой поток). Порошкообразный цирконий применяют в смеси с окислителями (бертолетова соль) как бездымное средство в сигнальных огнях пиротехники и в запалах, заменяя гремучую ртуть и азид свинца.
Сверхпроводник
Сверхпроводящий сплав 75 % и 25 % Zr (сверхпроводимость при 4,2 ) выдерживает нагрузку до 100 000 А/см².
Конструкционный материал
В виде конструкционного материала идет на изготовление кислотостойких химических реакторов, арматуры, насосов. Цирконий применяют как заменитель благородных металлов.
применяется в виде различных огнеупоров для футеровки стекловаренных и металлургических печей. Он также применяется в производстве строительной керамики, эмалей и глазурей для сантехнических изделий.
Медицина
Цирконий обладает высокой стойкостью к воздействию биологических сред, даже более высокой, чем титан, и отличной биосовместимостью, благодаря чему применяется для создания костных, суставных и зубных протезов, а также хирургического инструмента.
Цирконий применяется для изготовления разнообразной посуды, обладающей отличными гигиеническими свойствами благодаря высокой химической стойкости.
Соединения
(т. пл. 2700 °C). Область применения — производство огнеупоров-бакоров (бакор — бадделеит-корундовая керамика). Применяется в качестве заменителя шамота, так как в 3—4 раза увеличивает кампанию в печах для варки стекла и алюминия. Огнеупоры на основе стабилизированной двуокиси применяются в металлургической промышленности для желобов, стаканов при непрерывной разливке сталей, тиглей для плавки редкоземельных элементов. Также применяется в керметах — керамикометаллических покрытиях, которые обладают высокой твёрдостью и устойчивостью ко многим химическим реагентам, выдерживают кратковременные нагревания до 2750 °C. Двуокись — глушитель эмалей, придает им белый и непрозрачный цвет. На основе кубической модификации двуокиси циркония, стабилизированной скандием, иттрием, редкими землями, получают материал — фианит (от ФИАНа где он был впервые получен), фианит применяется в качестве оптического материала с большим коэффициентом преломления (линзы плоские), в медицине (хирургический инструмент), в качестве синтетического ювелирного камня (дисперсия, показатель преломления и игра цвета больше, чем у бриллианта), при получении синтетических волокон, и производстве некоторых видов проволоки (волочение). При нагревании диоксид циркония проводит ток, что иногда используется для получения нагревательных элементов устойчивых на воздухе при очень высокой температуре. Нагретый цирконий способен проводить ионы кислорода как твердый электролит. Это свойство используется в промышленных анализаторах кислорода.
ZrB2 — кермет. В различных смесях с нитридом тантала и карбидом кремния материал для производства резцов. Цены на металлический цирконий в 2006 году составили в среднем 120 долларов США за килограмм.
(т. пл. 3530 °C) важнейший конструкционный материал для твердофазных ядерных реактивных двигателей[
источник не указан 232 дня
].
чрезвычайно твёрд и устойчив к окислению на воздухе до 1650 °C, применяется в авиакосмической технике (двигатели, сопла, реакторы, радиоизотопные электрогенераторы)[
источник не указан 232 дня
].
Гидрид циркония применяется в качестве компонента ракетного топлива, в атомной технике как весьма эффективный замедлитель нейтронов. Также гидрид циркония служит для покрытия цирконием в виде тонких плёнок с помощью термического разложения его на различных поверхностях.





Каркасы из стоматологических металлических сплавов
Каркас для металлокерамической конструкции делается из сплавов кобальта и хрома, никеля и хрома, используются и драгоценные металлы – золото, платина, палладий. Толщина основы составляет от 0,3 до 0,5 мм, вместе со слоем керамики толщина протеза составляет около 1,5-2 мм.
В отличие от композитных материалов, которые также применяются для реставрации коронок, и намного дешевле, керамика воспроизводит цвет и структуру натуральной зубной ткани, при этом она не тускнеет и не впитывает красящие вещества.
Металлокерамическая зубная коронка – хороший вариант, если необходимо восстанавливать жевательные зубы эстетично и надежно и у вас нет аллергии на металлы. Металлокерамические протезы имеет следующие преимущества:
Но металлокерамические зубные протезы имеют некоторые недостатки:
Избыток циркония в организме
Медики до сих пор не имеют данных о летальной дозе данного элемента для человеческого организма, хотя его передозировка может вызвать негативные последствия. Избыток вызывается при работе на соответствующих производствах, использовании средств индивидуальной гигиены или при проживании около источников, которые загрязняют окружающую среду.
Нужно отметить, что проявлениями передозировки являются следующие симптомы: фиброз легких, пневмония и раздражение покровов кожи. Цирконий – металл, который может накапливаться в органах, при этом оседая на тканях. Из продуктов получить такую большую дозу нереально.
Лечебные свойства камня
Циркониевый материал является биологически инертным и никак не влияет на здоровье людей. Благодаря такому показателю специалисты ценят этот металл больше, чем титан. Примерно 20 лет назад активно рекламировали циркониевый браслет. Но ученые доказали, что состояние здоровья от их ношения не меняется. Были единичные случаи, когда украшение помогало справиться с мигренями. Спустя некоторое время, выяснилось, что самочувствие улучшалось благодаря эффекту плацебо.
Свойство металла нагреваться помогает ему взаимодействовать с серными кислотами. Многих интересует, сколько элементов могут реагировать с циркониевым металлом. Как показывает практика, есть два основных: кислород и галоген.
Получение[ | ]
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 31 августа 2021 года
В промышленности исходным сырьём для производства циркония являются циркониевые концентраты с массовым содержанием диоксида циркония не менее 60—65 %, получаемые обогащением циркониевых руд.
Основные методы получения металлического циркония из концентратов — хлоридный, фторидный и щелочной процессы.
Хлоридный процесс основан на переводе циркония в летучий тетрахлорид ZrCl4 (T
Образовавшийся гексафторцирконат калия выщелачивают горячей водой и очищают фракционной перекристаллизацией от примеси гексафторгафната K2HfF6, после чего металлический цирконий получают электролизом расплава смеси гексафторцирконата калия и хлоридов калия и натрия.
Щелочной процесс является методом получения технически чистого диоксида циркония ZrO2, из которого металлический цирконий получают хлоридным или фторидным методом. В этом процессе цирконий переводится в растворимую форму спеканием концентрата с гидроксидом натрия при 600—650 °С, карбонатом натрия при 900—1100 °С либо со смесью карбоната и хлорида кальция при 1000—1300 °С, после чего образовавшиеся цирконаты натрия Na2ZrO3 или кальция CaZrO3 выщелачиваются соляной либо серной кислотами:
Водные растворы хлорида или сульфата цирконила далее очищаются и гидролизуются, осадок ZrO(OH)2 прокаливают и получают технический диоксид циркония ZrO2.