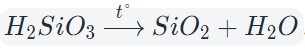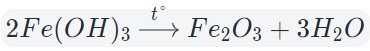Оксид это что простыми словами
Оксид
Окси́д (о́кисел, о́кись) — соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Оксиды — весьма распространенный тип соединений, содержащихся в земной коре и во вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Окислами называется класс минералов, представляющих собой соединения металла с кислородом (см. Категория:Окислы).
Соединения, содержащие атомы кислорода, соединённые между собой, называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов.
Содержание
Классификация
В зависимости от химических свойств различают:
Номенклатура
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент образует несколько оксидов, то в их названиях указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, моноокисью или закисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распостранены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
Химические свойства: Основные оксиды.
Примечание:кислота ортофосфорная или сильная.
2. Сильноосновный оксид + вода = щелочь
3. Сильноосновный оксид + кислотный оксид = соль
4. Основный оксид + водород = металл + вода
Примечание: металл менее активный, чем алюминий.
Химические свойства: Кислотные оксиды.
Некоторые оксиды, например SiO2, с водой не реагируют, поэтому их кислоты получают косвенным.
2. Кислотный оксид + основной оксид = соль
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
4. Нелетучий оксид + соль1 = соль2 + летучий оксид
Химические свойства: Амфотерные оксиды.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H2O = K2[Zn(OH)4)] (в водном растворе)
ZnO + CaO = CaZnO2 (при сплавлении)
Получение оксидов
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
2. Обжиг или горение бинарных соединений в кислороде:
3. Термическое разложение солей:
4. Термическое разложение оснований или кислот:
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
6. Взаимодействие некоторых металлов с водой при высокой температуре:
7. Взаимодействие солей с кислотными оксидами при нагревании с выделением летучего оксида:
9. При действии водоотнимающих веществ на кислоты и соли:
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
Ссылки
Полезное
Смотреть что такое «Оксид» в других словарях:
оксид — окисел, глинозем Словарь русских синонимов. оксид сущ., кол во синонимов: 3 • глинозем (8) • окисел … Словарь синонимов
ОКСИД — ОКСИД, а, муж. (спец.). То же, что окисел. | прил. оксидный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Оксид — – соединение химического элемента с кислородом. Оксиды – весьма распространенный тип соединений, содержащихся в земной коре и во вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд… … Нефтегазовая микроэнциклопедия
оксид — В полупроводниковой технологии так обычно обозначается двуокись кремния (SiO2). [http://www.cscleansystems.com/glossary.html] Тематики полупроводниковые приборы EN oxide … Справочник технического переводчика
оксид — ОКСИД, а, м Соединение химического элемента с кислородом; окислы. Оксид цинка применяют как белый пигмент, активатор … Толковый словарь русских существительных
оксид — oksidas statusas T sritis chemija apibrėžtis Elemento junginys su deguonimi. atitikmenys: angl. oxide rus. окисел; окись; оксид … Chemijos terminų aiškinamasis žodynas
оксид — (2 м); мн. окси/ды, Р. окси/дов … Орфографический словарь русского языка
оксид — Химик элементның кислород белән кушылмасы … Татар теленең аңлатмалы сүзлеге
оксид — у, ч. Те саме, що окисень … Український тлумачний словник
оксид — [окси/д] ду, м. (на) д і, мн. дие, д іў … Орфоепічний словник української мови
Оксиды
Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом (см. Окислы).
Соединения, которые содержат атомы кислорода, соединённые между собой, называются пероксидами (перекисями; содержат цепочку −O−O−), супероксидами (содержат группу О − 2 ) и озонидами (содержат группу О − 3 ). Они не относятся к категории оксидов.
Содержание
Классификация
В зависимости от химических свойств различают:
Номенклатура
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом или моноокисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
В начале XIX века и ранее тугоплавкие, практически не растворимые в воде оксиды химики называли «землями».
Оксиды с низшими степенями окисления (субоксиды) иногда по старой русской номенклатуре называют [1] закись (англ. аналог — protoxide) и недокись (например, оксид углерода(II), CO — закись углерода; диоксид триуглерода, C2O3 — недокись углерода [2] ; оксид азота(I), N2O — закись азота; оксид меди(I), Cu2O — закись меди). Высшие степени окисления (оксид железа(III), Fe2O3) называют в соответствии с этой номенклатурой окись, а сложные оксиды — закись-окись (Fe3O4 = FeO·Fe2O3 — закись-окись железа, оксид урана(VI)-диурана(V), U3O8 — закись-окись урана). Эта номенклатура, однако, не отличается последовательностью, поэтому такие названия следует рассматривать скорее как традиционные.
Химические свойства
Основные оксиды
1. Основный оксид + cильная кислота → соль + вода
2. Сильноосновный оксид + вода → щелочь
3. Сильноосновный оксид + кислотный оксид → соль

4. Основный оксид + водород → металл + вода
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:

4. Нелетучий оксид + соль1 → соль2 + летучий оксид
5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1
Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:


Получение
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:




3. Термическое разложение солей:

4. Термическое разложение оснований или кислот:

5. Окисление низших оксидов в высшие и восстановление высших в низшие:
6. Взаимодействие некоторых металлов с водой при высокой температуре:
7. Взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:
9. При действии водоотнимающих веществ на кислоты и соли:
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
Ссылки
Примечания
Полезное
Смотреть что такое «Оксиды» в других словарях:
ОКСИДЫ — новолатинск., от греч. oxys, кислый. Кислородо двухлористые соединения. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. ОКСИДЫ окислы, соединение простых тел (элементов) с… … Словарь иностранных слов русского языка
ОКСИДЫ — ОКСИДЫ, соединения химических элементов (кроме фтора) с кислородом. При взаимодействии с водой образуют основания (основные оксиды) или кислоты (кислые оксиды), многие оксиды амфотерны. Большинство оксидов при обычных условиях твёрдые вещества,… … Современная энциклопедия
ОКСИДЫ — ОКСИДЫ, неорганические соединения, в которых КИСЛОРОД связан с другим элементом. Оксиды часто образуются при горении элемента на воздухе или в присутствии кислорода. Так, магний (Mg) при горении образует оксид магния (MgO). Оксиды бывают… … Научно-технический энциклопедический словарь
оксиды — Соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (наприме, Na2О, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды подразделяют на… … Справочник технического переводчика
Оксиды — ОКСИДЫ, соединения химических элементов (кроме фтора) с кислородом. При взаимодействии с водой образуют основания (основные оксиды) или кислоты (кислые оксиды), многие оксиды амфотерны. Большинство оксидов при обычных условиях твёрдые вещества,… … Иллюстрированный энциклопедический словарь
Оксиды — (окислы) – химическое соединение металлов с кислородом. [Блюм Э. Э. Словарь основных металловедческих терминов. Екатеринбург, 2002 г.] Оксиды – класс химических соединений элементов с кислородом. [Ушеров Маршак А. В. Бетоноведение:… … Энциклопедия терминов, определений и пояснений строительных материалов
ОКСИДЫ — соединения химических элементов с кислородом. Делятся на солеобразующие и несолеобразующие (напр., NO). Солеобразующие бывают основными (CaO), кислотными (SO3) и амфотерными (ZnO) их гидраты являются соответствующими основаниями, кислотами или… … Большой Энциклопедический словарь
оксиды — ов, м. oxide m., нем. Oxyden <гр. oxys кислый. хим. Окисел. По химическому разложению, сделанному аптекарем Швенсоном, дознано, что они <воды> содержат в себе большую часть угольной кислоты, углекислой извести и железного оксида. Муханов … Исторический словарь галлицизмов русского языка
ОКСИДЫ — хим. соединения элементов с кислородом (устаревшее название окислы); один из важнейших классов хим. веществ. О. образуются чаще всего при непосредственном окислении простых и сложных веществ. Напр. при окислении углеводородов образуются О.… … Большая политехническая энциклопедия
Оксиды — [oxides] соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (например, Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды… … Энциклопедический словарь по металлургии
Оксиды
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
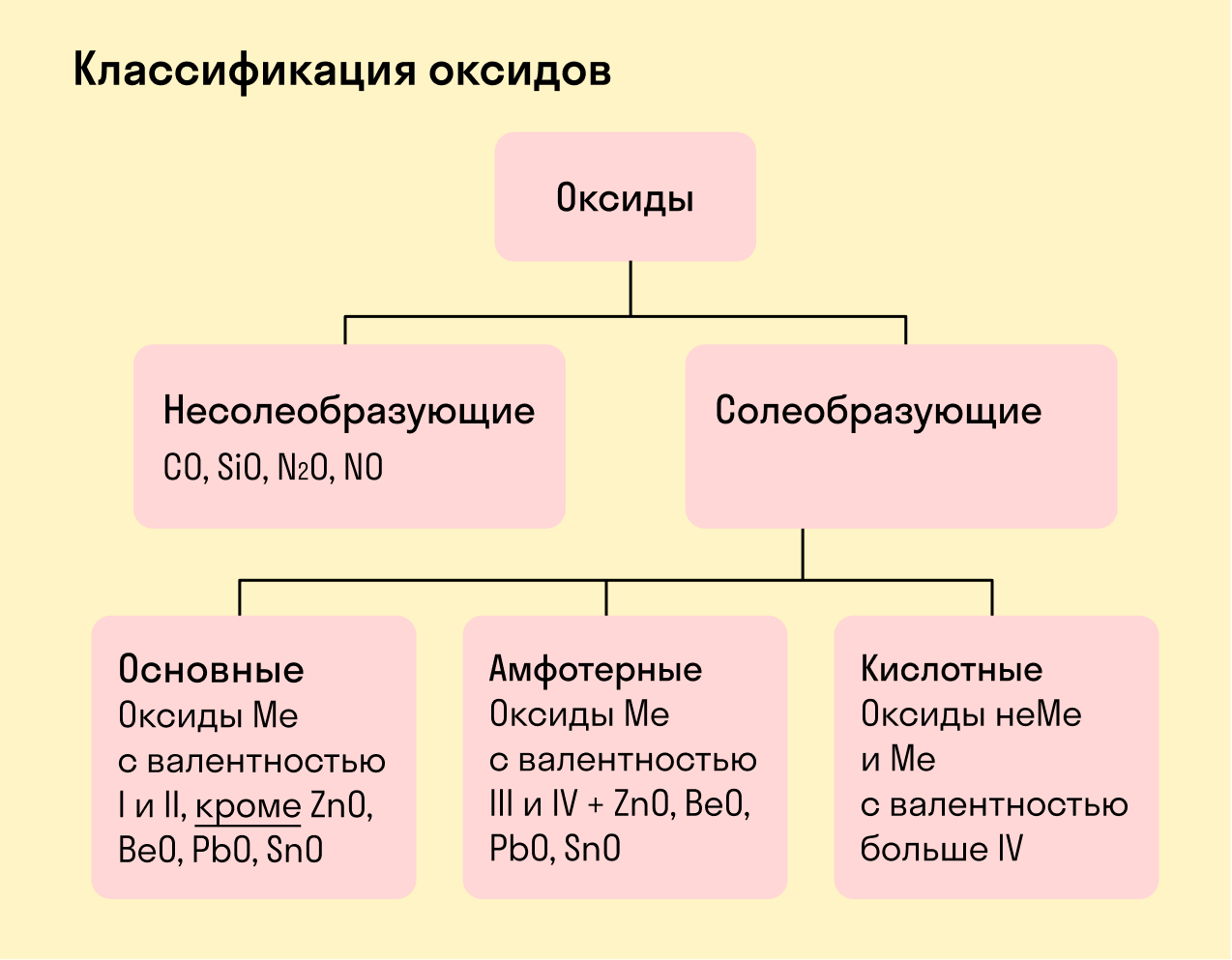
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
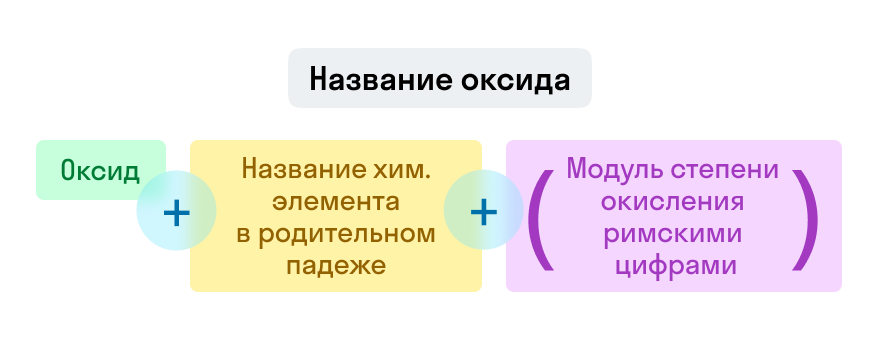
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!