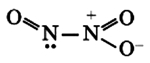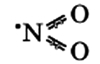Оксид азота что это за оксид
Окислы азота
Оксиды азота — соединения азота с кислородом.
Содержание
Список оксидов
Азот образует несколько соединений с кислородом:
Оксид азота N2O — бесцветный газ со слабым запахом, растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
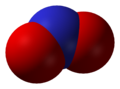
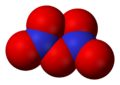
Оксид азота NO — бесветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционноспособное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
N2O3(III)
Оксид N2O3 (азотистый ангидрид) неустойчив при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NО2, N2O4
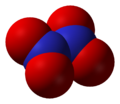
Оксид азота NО2 — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NО2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NО2. Этот оксид окисляет SО2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N2O5(V)
Оксид N2O5 (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NО2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
Воздействие на организм
Применение
Оксиды азота зарегистрированы в качестве пищевой добавки E918.
См.также
Полезное
Смотреть что такое «Окислы азота» в других словарях:
Окислы азота — Смесь различных окислов азота, кроме закиси NO2, образовавшихся в цилиндре дизеля в процессе сгорания Источник: ГОСТ 24585 81: Дизел … Словарь-справочник терминов нормативно-технической документации
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота (NOх) — 5. Окислы азота (NOх) Смесь окиси и двуокиси азота, содержащихся в пробе газа Примечание. В расчетах условно предполагается, что окись азота находится в виде двуокиси азота Источник … Словарь-справочник терминов нормативно-технической документации
Окислы азота и азотная кислота — 4.6. Окислы азота и азотная кислота оказывают в основном вредное влияние на активную массу отрицательных электродов, окисляя свинец в окись. Окись свинца, в свою очередь, вступая в реакцию с оставшейся неиспользованной кислотой, образует… … Словарь-справочник терминов нормативно-технической документации
ОКИСЛЫ — ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности элемента … Большая медицинская энциклопедия
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
Окислы — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окислы — О. называются соединения простых тел с кислородом. Если придерживаться деления простых тел на две группы, на металлы и металлоиды (см.), то вообще в характере их О. можно заметить довольно ясную разницу. Тогда как типические представители первой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — химический состав см. Окислы азота. В медицине З. азота получила название веселящего газа: вдыхаемая в смеси с атмосферным воздухом или кислородом при обыкновенной температуре и давлении она вызывает особое состояние опьянения, уничтожающего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — веселящий газ, один из окислов азота (см. Азота окислы); в медицине применяют в смеси с кислородом как средство для ингаляционного Наркоза при хирургических операциях, родах, иногда при инфаркте миокарда. Назван веселящим газом английским … Большая советская энциклопедия
Оксид азота
Считаю необходимым периодически рассматривать некоторые рабочие или не рабочие, по моему мнению, спортивные добавки. Маркетинг – штука тонкая и может заставить неосведомлённых людей купить даже муку в красивой банке за баснословные деньги. Сегодня мы разберёмся с оксидом азота. Поехали, друзья!
Привет, друзья! Оксид азота – довольно интересное вещество. Это газ, который образуется в нашем организме и участвует во множестве, очень важных для качка, физиологических процессов. Сейчас особенно распространена реклама в спортивной индустрии, где огромные накачанные атлеты глотают черпаки предтренировочных комплексов из чёрных, красных и других пластиковых банок, при этом уверяя, что это даст людям невероятную мышечную массу. Что же, нужно разобраться, так ли это.
Что такое оксид азота (NO)?
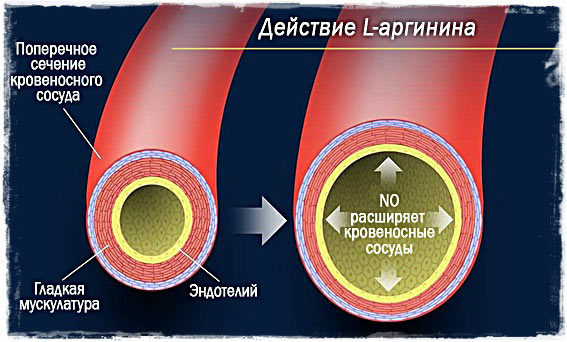
Как я упоминал выше, оксид азота – это газ, который расширяет сосуды артериального русла и регулирует артериальное давление.
Из-за расширения сосудов усиливается приток крови к мышцам, а это облегчает поступление и усвоение питательных веществ, а так же способствует синтезу белка после тренировки.
Как образуется NO в нашем организме?
Оксид азота образуется благодаря донаторам (от англ. «даритель») азота, в число которых входит условно незаменимая аминокислота – АРГИНИН. Практически все остальные донаторы азота содержат в себе аргинин.
Всё проще, чем кажется. Аргинин доставляет азот (N) в систему ферментов (энзимов), а они, в свою очередь, производят оксид азота (NO).
Как оксид азота влияет на рост мышц?
На рост мышц он влияет напрямую. При недостаточном количестве аргинина (донатора азота) будет наблюдаться низкая активность ферментов (энзимов). Это приведёт к повышению артериального давления, которое снизит синтез белка! Т.е. по сути NO является АНАБОЛИЧЕСКИМ ФАКТОРОМ РОСТА МЫШЕЧНОЙ ТКАНИ.
Скажу ещё пару слов по этому поводу. Как мы все знаем анаболические гормоны (тестостерон, соматотропин, инсулин и др.) играют ключевую роль в наборе мышечной массы. Так же есть такая штука, как инсулиноподобный фактор роста (IGF-1) – это основной посредник действия гормона роста (соматотропина).
Фишка в том, что было установлено, что хоть силовые тренировки и способствуют выработке IGF-1, но без должного количества оксида азота эффект от гормона роста минимален!
Я вас там не запутал? Ок. Давайте объясню ещё раз, для сутулых.
МАЛО АРГИНИНА —> Низкая активность ферментов —> Повышается артериальное давление —> СИНТЕЗ БЕЛКА СНИЖАЕТСЯ (а соответственно и мышечный рост)
МАЛО ОКСИДА АЗОТА —> IGF-1 почти не вырабатывается —> ГОРМОН РОСТА ПЛОХО РАБОТАЕТ (без IGF-1)
Как видите, всё не так сложно.
ВНИМАНИЕ: Замечено, что чем больше вы тренируете ваши мышцы, тем больше они производят оксида азота (NO). Больше бездельничаете, меньше NO в ваших мышцах.
Причины снижения уровня NO (оксида азота)
Думаю, что теперь понятно, что для хорошего роста мышечной массы нужна достаточная для роста концентрация NO. А что влияет на понижение уровня оксида азота в организме?
На самом деле причин гораздо больше! Но я, на мой взгляд, перечислил основные. Вот почему я советую тренироваться «натуралу» (тренирующемуся без фарм. поддержки) не более 45-60 минут, об этом я писал здесь. Для того, чтобы снизить уровень кортизола, который препятствует выработке NO.
Повышение уровня NO
Ок, а как повысить концентрацию NO? Тут всё очевидно, НУЖНЫ ДОНАТОРЫ АЗОТА. И сразу же на ум приходит АРГИНИН, ведь в большинстве донаторов встречается именно он.
Так же считается, что аргинин способствует увеличению мышечной массы и сокращению жировых отложений при оптимальной нагрузке.
Т.е. всё вроде бы понятно. Хочешь увеличить концентрацию оксида азота – кушай аргинин! Не торопитесь, друзья. Тут как раз мы с вами наблюдаем маркетинг во всей своей красе.
Почему аргинин?
Ребят, дело в том, что в Соединённых штатах учёные искали вещество, которое отвечает за поддержание работы кровеносных сосудов и кровеносной системы человека.
Через какое-то время они нашли это вещество и поскольку решили, что это обычная молекула белка назвали его EDRF (фактор расслабляющий эндотелий). Но через небольшой промежуток времени они были очень удивлены, что найденная молекула оказалась ОЧЕНЬ ХИМИЧЕСКИ-АКТИВНЫМ ГАЗОМ или донатором азота.
В течение 10 лет было опубликовано более 60000 статей на эту тему, а учёные, сделавшие это открытие были удостоены Нобелевской премии в 1998 г. Как вы поняли, эта молекула оказалась аргинином.
Позже, это открытие помогло многим больным гипертонией (т.к. аргинин расслабляет сосуды), а так же тем, кто имел проблемы с желудочно-кишечным трактом в качестве вещества, которое стимулирует (поддерживает) иммунитет.
Но медицина медициной друзья. Что насчёт бодибилдинга? Несколько исследований показали, что аргинин вызывает КРАТКОВРЕМЕННОЕ расширение сосудов! Т.е. аргинин даже если и увеличивает выработку оксида азота, то на небольшой промежуток времени! Поэтому его польза в бодибилдинге весьма сомнительна.
Дак что же донаторы азота, увеличивающие содержание NO в крови – это всё один глобальный обман? Не спешите с выводами, друзья. Просто нужны БОЛЕЕ МОЩНЫЕ ДОНАТОРЫ АЗОТА!
Мощные донаторы азота
Нужно сказать, что на данный момент во всех спортивных добавках и на всех цветастых баночках спортивного питания, где вы найдёте заветные буквы «NO» используются малоэффективные компоненты.
Решение нужно искать в медицине, где давно уже используются препараты, которые по сравнению с аргинином гораздо сильнее способствуют выработке оксида азота в крови.
Эти препараты относятся к классу НИТРАТЫ и самые известные из них:
Изосорбид или, если быть точным, ИЗОСОРБИДА ДИНИТРАТ имеет более длительный период действия, однако дозировка должна быть снижена как минимум в 1,5-2 раза из-за того, что при употреблении рекомендованной терапевтической дозировки могут быть побочные эффекты: учащённое сердцебиение, головная боль, артериальная гипотензия (снижение артериального давления), пульсация сосудов и т.д. Правда переживать не стоит. Все эти побочные эффекты связаны с увеличением концентрации оксида азота в крови, поэтому стоит просто уменьшить дозировку.
Практика применения
Думаю, что многих заинтересует именно практическая сторона вопроса. Как закидывать? Сколько шарашить? И другие важные вопросы.
Ощущения от применения
Так же есть и такие моменты, которые часто заявлены производителями, но я ИХ НЕ ОЩУТИЛ:
Так же есть те, кому эту добавку я бы НЕ СОВЕТОВАЛ применять вообще:
Что использовал
Мне удалось попробовать несколько довольно не плохих предтренировочных комплексов, способствующих выработке NO.
Выводы
В статье было много информации, а так же не очень простых терминов, поэтому вместо того, чтобы размазывать сопли по подушке, я думаю, что стоит подытожить всё вышесказанное:
Надо понимать, что добавки повышающие уровень оксида азота в крови не панацея накачки мышечной массы. И если стоит выбор между покупкой банки предтреника, который по словам производителя просто переполнит вас NO или обычной пищи на неделю, то я бы лучше прикупил творожка, орехов, рыбы, мяса, гречки, сыра, молока, кефира и т.д. Так как они так же являются донаторами азота. Как всегда, правда, где-то посередине.
На сегодня у меня всё, друзья.
С уважением и наилучшими пожеланиями, Никита Волков!
Оксиды азота
Азот образует несколько оксидов:
Все оксиды азота, за исключением N2O, являются ядовитыми веществами.
Оксид азота N2O (I)
Строение молекулы линейное:
Оксид азота NO(II)
Молекула имеет вид:
Оксид азота NO(II) димеризуется (образуется новое вещество путём соединения двух структурных элементов) только при низких температурах.
В природе NO(II) образуется во время грозы в результате взаимодействия азота с кислородом при высокой температуре:
N2+O2=2NO.
Монооксид азота используют для получения азотной кислоты.
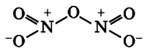
Оксид азота N2O3(III)
Оксид азота N2O3(III) является кислотным оксидом, в значительной степени диссоциирует и реагирует со щелочами:
N2O3 ↔ NO2+NO
N2O3+2NaOH = 2NaNO2+H2O
Оксид азота N2O3(III) взаимодействует с водой с образованием азотистой кислоты:
N2O3+H2O = 2HNO2
Азотистая кислота является слабой кислотой, и существует только в водном растворе.
Оксид азота NO2(IV)
Связи N-O располагаются под углом друг к другу, при этом они носят промежуточный «полуторный» характер, при этом имеется еще и один неспаренный электрон, как и у NO (см. выше).
При н.у. оксид азота NO2(IV) является ядовитым газом (хорошо растворимым в воде) бурого цвета, с характерным запахом.
При нагревании до 50°C неустойчивая азотистая кислота не образуется:
3NO2+H2O = 2HNO3+NO
В промышленных условиях оксид азота NO2(IV) получают путем окисления NO кислородом:
2NO+O2=2NO2
В лабораторных условиях оксид азота NO2(IV) получают окислением меди азотной кислотой (концентрированной), либо разложением нитрата свинца (меди):
Cu+4HNO3(конц) = Cu(NO3)2+2NO2↑+2H2O
2Pb(NO3)2 = 2PbO+4NO2↑+O2↑
Оксид азота NO2(IV) применяют в производстве азотной кислоты.
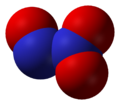
Оксид азота N2O5(V)
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:
2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Оксиды азота
Содержание
Список оксидов
Известны девять соединений азота с кислородом. Кроме пяти классических оксидов азота:
обнаружены ещё димер диоксида азота (NO2)2 и три малостабильных соединения: нитрозилазид N4O, тринитрамид N(NO2)3 и нитратный радикал NO3.
Несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
Оксид азота NO (монооксид азота) — бесцветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
N2O3(III)
Оксид N2O3 (триоксид диазота, азотистый ангидрид) — темно-синяя жидкость, неустойчивая при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NO2, N2O4(IV)
Оксид азота NO2 (диоксид азота) — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NO2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
и растворами щелочей:
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NO2. Этот оксид окисляет SO2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N2O5(V)
Оксид азота N2O5 (пентаоксид диазота, азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NO2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
N(NO2)3
Тринитрамид открыт в 2010 году. Является перспективным кандидатом на роль высокоэффективного ракетного топлива, однако на данный момент неизвестно, является ли устойчивой твёрдая фаза вещества.
Существует при температуре ниже −50 °C как бледно-жёлтое твёрдое вещество, выше этой температуры разлагается на N2O и N2.
Воздействие на организм
Все оксиды азота физиологически активны, относятся к третьему классу опасности.
Применение
Закись азота используется в медицине для наркоза, в пищевой промышленности в качестве пропеллента и упаковочного газа (зарегистрирована в качестве пищевой добавки E942).
См. также
Полезное
Смотреть что такое «Оксиды азота» в других словарях:
оксиды азота — оксиды азота: Смесь различных оксидов азота, образовавшихся в процессе горения топлива в цилиндре дизеля, обозначаемая символом NOx. Источник … Словарь-справочник терминов нормативно-технической документации
оксиды азота — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN nitrogen oxides Oxides formed and released in all common types of combustion; they are formed by the oxidation of atmospheric nitrogen at high temperatures. Introduced into the … Справочник технического переводчика
оксиды азота NOx — 3.6 оксиды азота NOx %: Смесь различных оксидов азота, образующихся в процессе горения топлива в цилиндре дизеля. Источник … Словарь-справочник терминов нормативно-технической документации
быстрые оксиды азота — Образуются в небольшом количестве в процессе окисления молекулярного азота во фронте горения. [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN promt nitrogen oxidations … Справочник технического переводчика
термические оксиды азота — Образуются при высокой температуре горения в результате окисления молекулярного азота, содержащегося в воздухе, по механизму Я.Б. Зельдовича, в зависимости от времени пребывания в зоне горения и концентрации кислорода. [А.С.Гольдберг. Англо… … Справочник технического переводчика
топливные оксиды азота — Образуются в процессе горения в результате окисления содержащегося в топливе азота. [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN fuel nitrogen oxidations … Справочник технического переводчика
АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы) сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO несолеобразующие оксиды, N2O3 с … Большой Энциклопедический словарь
АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO несолеобразующие оксиды, N2O3… … Энциклопедический словарь
Азота оксиды — N0, Оксиды азота NO, N02 в сумме в пересчете на NOj, относящиеся к классу опасности III Источник: ГОСТ Р 51206 98: Автотранспортные средства. Содержание вредных веществ в воздух … Словарь-справочник терминов нормативно-технической документации
АЗОТА ФОСФОРА СЕМЕЙСТВО — ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА ФОСФОРА Тенденция изменения свойств от неметаллических до металлических, которая выявлена в подгруппах IIIA и IVA, характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий) начинается с мышьяка, у… … Энциклопедия Кольера
Окись азота
Окись азота
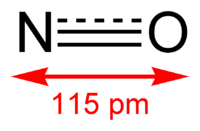
| Оксид азота(II) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(II) |
| Химическая формула | NO |
| Отн. молек. масса | 30.0061 а. е. м. |
| Молярная масса | 30.0061 г/моль |
| Физические свойства | |
| Плотность вещества | 0.00134 (газ) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −163.6 °C |
| Температура кипения | −151.7 °C |
| Энтальпия (ст. усл.) | 81 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,01 г/100 мл |
| Классификация | |
| номер CAS | [10102-43-9] |
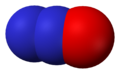
Окси́д азо́та (II) NO (моноксид азота, окись азота, нитрозил-радикал) — несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации = 17 кДж. Жидкий оксид азота (II) на 25% состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Содержание
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
и тотчас же реагирует с кислородом:
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
Химические свойства
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит мгновенно:
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Физиологическое действие
Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO, являясь одним из мессенджеров, участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение(вазодилатацию), предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как ассенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
Клиренс NO (скорость очищения крови от NO в процессе его химических превращений) происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. В клиренс могут быть вовлечены промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита. Оксид азота может быть восстановлен NO-редуктазой – ферментом, тесно связанным с NO-синтазой.
Применение
Полезное
Смотреть что такое «Окись азота» в других словарях:
ОКИСЬ АЗОТА — ОКИСЬ АЗОТА, см. монооксид АЗОТА … Научно-технический энциклопедический словарь
окись азота — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN nitric oxide … Справочник технического переводчика
окись азота — azoto oksidas statusas T sritis ekologija ir aplinkotyra apibrėžtis Azoto junginys su deguonimi: N₂O, NO, NO₂, N₂O₃, N₂O₄, N₂O₅. atitikmenys: angl. nitric oxide; nitrogen monoxide vok. Stickoxid, n; Stickstoffmonoxid, n rus. окись азота, f … Ekologijos terminų aiškinamasis žodynas
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
азота окись — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
азота(II) оксид — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
Окись этилена — Окись этилена … Википедия
Окись — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окись углерода — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона