Окраска на слизь по крейбергу положительная что это значит
Окраска на слизь по крейбергу положительная что это значит
ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого» МЗ РФ, г. Красноярск
Арутюнян Вильям Рузвелдович ― заочный аспирант кафедры и клиники хирургических болезней им. проф. А.М. Дыхно с курсом эндоскопии и эндохирургии ПО ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого»
660130, г. Красноярск, ул. Гусарова, д. 62, кв. 11, тел. +7-913-512-73-50, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Реферат. Проведен комплексный клинико-лабораторный, патоморфологический и морфометрический анализ результатов влияния интраоперационного лаважа просвета толстой кишки на ее стенку у экспериментальных животных с декомпенсированной обтурационной толстокишечной непроходимостью.
Ключевые слова: экспериментальная острая толстокишечная непроходимость, лаваж толстой кишки, первичный межкишечный анастомоз толстой кишки.
Актуальность
Острая толстокишечная непроходимость (ОТКН) остается одним из наиболее тяжелых осложнений целого ряда заболеваний прямой и ободочной кишки, составляя до 80% всех ургентных состояний с вовлечением толстой кишки [4, 6]. Летальность при этой нозологии в условиях экстренной хирургии достигает 7-50% 3. Высок процент пациентов, которым на первом этапе хирургического лечения накладывается колостома (40-72%) 6. Одномоментные радикальные операции на толстой кишке в условиях ОТКН с восстановлением ее просвета составляют незначительное количество. Разработка новых технологий, позволяющих избежать наложения колостом при первичных операциях на толстой кишке, в ургентной хирургии является сложной задачей. Важным моментом в проблеме является оценка состояния стенки толстой кишки в условиях развития ОТКН и лаважа ее просвета.
Цель исследования ― изучить патоморфологические изменения в стенке толстой кишки и провести их морфометрический анализ в динамике развития экспериментальной толстокишечной непроходимости и в условиях ее внутрипросветного лаважа растворами разной осмотической активности.
Материалы и методы
В эксперименте на кроликах создавалась модель ОТКН. В контрольные сроки после моделирования (24, 48, 72 часа) проводили забор толстой кишки для оценки ее морфологического состояния, определялся микробный пейзаж в ее содержимом. В исследуемых группах животных интраоперационно проводили лаваж толстой кишки стерильными солевыми растворами заданной осмолярности (от 300 до 540 мосм/л). Оценивали реакцию стенки толстой кишки на ее декомпрессию в комбинации с лаважом (непосредственный эффект).
У всех животных с моделью ОТКН в установленные сроки проводился забор материала ― толстая кишка, для морфологического исследования с окраской гематоксилин-эозином и окраской по Крейбергу на слизь. Для детализации морфологических данных у контрольных животных и во всех сериях эксперимента изучалась морфометрическая характеристика толстой кишки в динамике эксперимента. Оценивались такие параметры, как толщина слизистой оболочки, толщина всех слоев стенки кишки и соотношение ее с толщиной слизистой оболочкой, степень отека слизистой оболочки в баллах и численная плотность инфильтрации слизистой оболочки.
Дополнительно содержимое толстой кишки брали для бактериологического исследования. У кроликов исследуемых групп, после ликвидации ОТКН, просвет толстой кишки промывали стерильными полиионными растворами с фиксированной осмолярностью в объеме 250 мл на 1 кг массы. В исходных и заключительных (после промывания) порциях кишечного содержимого определялось количество и качество микрофлоры. Для бактериологического исследования содержимое толстой кишки брали: 1 ― у здоровых животных в стерильную емкость (до моделирования ОТКН) из прямой кишки (трансанально); 2 ― после моделирования ОТКН через 24 и 48 часов (при декомпрессии толстой кишки ― из первой порции толстокишечного содержимого); 3 ― после моделирования и устранения непроходимости (при проведении санации просвета толстой кишки растворами разной осмотической активности из расчета 250,0 мл раствора на 1 кг массы животного в течение 30 минут до прозрачных промывных вод ― из последней порции отработанного раствора). Материал в бактериологическую лабораторию доставлялся в течение двух часов. В бактериологической лаборатории с культур, выросших на средах, делались мазки со всех колоний и окрашивались по Грамму, затем исследовались в световом микроскопе.
Статистическая обработка данных проводилась с указанием числа наблюдений с расчетом средних величин (М), определением среднеквадратического отклонения (b), средней ошибки (m). Вычислялся критерий Стьюдента (t). При проведении межгруппового сравнительного анализа использовалась методика Фишера.
Анализ полученных результатов
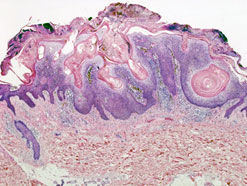
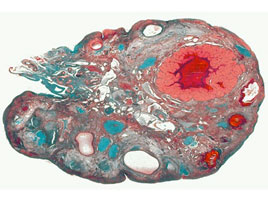
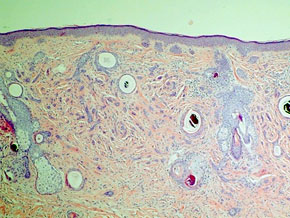
При гистологическом исследовании стенки толстой кишки после моделирования 24 часовой ОТКН в собственной пластинке слизистой оболочки отмечали: слабо выраженный отек, умеренную и равномерную воспалительную клеточную инфильтрацию нейтрофилами, с примесью плазматических клеток и лимфоцитов при окраске гематоксилин-эозином, а при окраске по Крейбергу на слизь ― выявлялось резко положительное окрашивание апикальных концов эпителиоцитов. При этом со стороны поверхностных отделов эпителиального покрова положительно окрашивались лишь единичные клетки. Сосуды слизистой оболочки кишки были полнокровными, с явлениями краевого стояния сегментоядерных лейкоцитов. Сосуды микроциркуляторного русла подслизистого, мышечного и серозного слоев были с умеренным кровенаполнением, явлениями стаза эритроцитов. Подслизистая оболочка была умеренно отечная, слабо и равномерно инфильтрирована сегментоядерными лейкоцитами и плазматическими клетками (рис. 1).
В мышечной оболочке кишки миоциты были расположены достаточно компактно, с типичным формированием двух слоев ― поперечного и продольного. В серозной оболочке отмечали признаки умеренно выраженного отека.
Через 48 часов с момента моделирования ОТКН, в слизистой оболочке отмечали выраженный отек внеклеточного матрикса наряду с выраженной диффузной инфильтрацией сегментоядерными лейкоцитами, лимфоцитами и плазматическими клетками. При окраске на слизь отмечалось неравномерное окрашивание эпителиоцитов крипт и слабое окрашивание эпителиоцитов поверхностного эпителия. Подслизистая оболочка была с выраженным воспалительным отеком, слабо и неравномерно инфильтрирована сегментоядерными лейкоцитами и плазматическими клетками. Кровеносные сосуды всех оболочек кишки были с признаками умеренного кровенаполнения. Определялся выраженный отек серозной оболочки (рис. 2).
Через 72 часа после моделирования ОТКН в слизистой оболочке отмечался выраженный отек внеклеточного матрикса, наряду со значительно выраженной диффузной инфильтрацией сегментоядерными лейкоцитами, лимфоцитами и плазматическими клетками, с формированием микроабсцессов (рис. 3). При окраске на слизь отмечается неравномерное и малочисленное окрашивание эпителиоцитов крипт в поверхностных слоях эпителиальной выстилки. Подслизистая оболочка была с признаками выраженного воспалительного отека, со слабо выраженной диффузной инфильтрацией сегментоядерными лейкоцитами и плазматическими клетками. Миоциты располагались достаточно компактно, с четкими границами между поперечным и продольным слоями, однако определялся выраженный отек внеклеточного матрикса мышечной оболочки. Кровеносные сосуды всех оболочек были с морфологической картиной выраженного полнокровия, с явлениями стаза эритроцитов и тромбоза отдельных сосудов микроциркуляторного русла. В серозной оболочке наблюдалась картина выраженного отека.
Динамика морфометрических параметров толстой кишки отражена в таблице 1.
Изменения морфометрических показателей в динамике эксперимента (табл. 1) указывают на значительное увеличение степени выраженности воспалительного отека слизистой оболочки толстой кишки, увеличение численной плотности воспалительного клеточного инфильтрата, и, как следствие ― увеличение общей толщины стенки толстой кишки. Показатели таблицы 1, также статистически достоверно отражают прогрессирующее нарастание воспалительной клеточной реакции в стенке толстой кишки в зависимости от увеличения длительности ОТКН.
При сроках эксперимента 48 и 72 часа после создания обтурационной толстокишечной непроходимости, общее значение плотности воспалительного клеточного инфильтрата в слизистой оболочке достоверно возрастало в несколько раз: от 40±13,2 (в контроле) до 1021,0±197,2 и 1126,1±209,6 (соответственно 48 и 72 часовой ОТКН: P Опубликовано в Экспериментальная онкология
Окраска на слизь по крейбергу положительная что это значит
В настоящее время эндоскопическое исследование желудочно-кишечного тракта у больных с язвенной болезнью желудка и ДПК, как правило, дополняется взятием биопсии с последующим морфологическим исследованием ткани, поскольку при наличии любого язвенного или инфильтративного поражения необходима гистологическая и цитологическая верификация эндоскопических данных.
Язва представляет собой дефект тканей стенки желудка или ДПК с перифокальными изменениями воспалительного или дегенеративного характера. В 85,3 % случаев язвы желудка являются одиночными и в 14,7 % – множественными. В ДПК одиночные язвы встречаются в 94,5 %. В 2,9 % случаев отмечается сочетание язвы желудка и ДПК.
Цель исследования – изучение особенностей морфологической структуры слизистой желудка у пациентов с язвенной болезнью желудка и ДПК в стадии обострения и ремиссии заболевания.
Материалы и методы исследования
На основании эндоскопического определения локализации язвенного дефекта, данных анамнеза, учета клинических проявлений заболевания все больные (пациенты отделения хирургии) были разделены на четыре группы. Первую группу составили 64 больных с ЯБ ДПК; вторую группу – 33 пациента с ЯБ желудка; в третьей группе было 13 больных с сочетанием ЯБ желудка и ДПК. К четвертой группе нами были отнесены пациенты с осложненным течением заболевания – 26 человек (в анамнезе у этой категории больных имеются ссылки на осложненное течение ЯБ – перфорации, кровотечения). Все группы были сопоставимы по возрасту, факторам риска, сопутствующей патологии и характеру течения заболевания.
Больным выполняли эндоскопическое исследование верхних отделов желудочно-кишечного тракта, которое дополняли взятием материала для гистологического анализа, в том числе для изучения клеточного состава инфильтрата в стадию обострения и ремиссии.
Брали не менее 5 биоптатов: по два из антрального и фундального отделов и один из области угла желудка.
Результаты исследования и их обсуждение
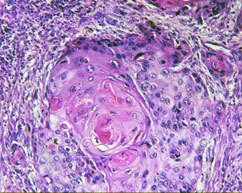
В результате исследования установлено, что характер микроскопических изменений язвы зависит от стадии заболевания. При обострении дно язвы состоит из четырех слоев. Первый, самый верхний слой представлен бесструктурными некротическими массами, слизью, фибрином, десквамированными эпителиальными клетками, лейкоцитами и эритроцитами. Второй слой – зона фибриноидного некроза. Толщина его прерывиста и составляет 1–1,5 мм. При быстро прогрессирующем процессе альтерации слой фибриноидного некроза резко утолщен, так как образование этого слоя связано с пропитыванием коллагеновых волокон фибриногеном плазмы, а выраженность экссудации зависит от интенсивности и длительности обострения. Третий слой дна язвы определяется не всегда. Он представлен грануляционной тканью и большим числом сосудов. Здесь отмечается выраженная в различной степени плазмолимфоцитарная инфильтрация и склероз. При прогрессировании альтерации этот слой подвергается фибриноидному некрозу, а при заживлении язвы – рубцеванию. Четвертый слой представлен соединительной тканью различной степени зрелости, которая распространяется далеко за пределы макроскопически определяемого края язвенного дефекта. Значительным изменениям подвергаются кровеносные сосуды (чаще артерии), расположенные в области язвы. Отмечается воспалительная инфильтрация и фибриноидный некроз стенок, тромбоз.
Морфологические изменения могут быть различными в зависимости от стадии развития язвенного процесса. При прогрессировании язвы дефект увеличивается в размерах в ширину и в глубину. Это увеличение размеров происходит за счёт разрушения краев язвы. Кроме того, в окружности язвы могут образовываться новые острые язвы и эрозии, которые, сливаясь, могут увеличивать размеры первичного язвенного дефекта. Процесс заживления язвы начинается с отторжения некротических масс дна язвы. Вслед за этим начинается процесс эпителизации. Активный рост эпителия с проникновением его под слой некротизированных тканей способствует более быстрому и окончательному отторжению некроза. Постепенно при заживлении язвы эпителий становится более высоким, клетки его начинают продуцировать слизь. В дальнейшем начинают формироваться желудочные ямки, а затем и железы. В отличие от нормального строения слизистой оболочки они имеют более примитивное строение.
Регенерировать могут и элементы мышечной пластинки слизистой оболочки. При этом образуются крупные гладкомышечные клетки, формирующие неравномерные утолщения. В регенерировавших участках отсутствуют эластические волокна, что даже при полном восстановлении слизистой оболочки маркирует зону имевшегося ранее изъязвления. Грануляционная ткань замещается волоконной соединительной тканью, и рубец становится белесоватым (стадия белого рубца), признаки воспаления в биопсийном материале отсутствуют. Мышечная оболочка стенки желудка или ДПК в области язвы не восстанавливается. Она замещается фиброзной тканью, в которой можно обнаружить отдельные мышечные клетки.
Слизистая оболочка регенерирует без образования рубца. Макроскопически вначале сформированный рубец характеризуется образованием на месте язвы участка покрытого палисадообразным эпителием с выраженной гиперплазией капилляров (стадия красного рубца). В этой стадии наблюдается появление в регенерировавшей слизистой оболочке незрелых псевдопилорических желез. В дальнейшем новообразованная слизистая оболочка приобретает более бледную окраску за счёт уменьшения количества капилляров и их запустения (стадия белого рубца).
При язве ДПК слизистая оболочка желудка отличается гиперплазированными желудочными железами с увеличением числа главных и париетальных клеток. Наряду с увеличением их числа происходит ускоренная дифференциация этих клеток. При дуоденальных язвах отмечается также гиперплазия клеток, продуцирующих гастрин. У больных с язвами ДПК в области дна желудка, как правило, наблюдаются морфологические признаки хронического гастрита.
При локализации язвы в желудке в зоне язвенного дефекта и в антральном отделе обнаруживается лимфоидно-клеточная инфильтрация собственной пластинки. Увеличено число клеток, продуцирующих иммуноглобулины, преимущественно класса G. Эти изменения являются свидетельством активации иммунной системы, связанной с антигенными свойствами продуктов распада тканей в зоне некроза, вирусов и микроорганизмов и образованием аутоантител. Морфологические изменения при гастродуоденальных язвах лежат в основе развития осложнений. Эти осложнения могут быть связаны с процессами деструкции тканей и носить язвенно-дегенеративный характер: пенетрация, перфорация, кровотечение. С сопутствующим воспалением связаны перигастрит, перидуоденит.
Результаты собственных исследований показали, что наиболее выраженные изменения в клеточном составе инфильтрата слизистой желудка по сравнению с данными контрольной группы отмечаются при язвенной болезни ДПК и сочетанной локализации язвенных дефектов в желудке и ДПК. Обострение язвенной болезни приводит к значительному увеличению числа клеток в инфильтрате слизистой.
Во всех группах наблюдения были установлены достоверные отличия с высоким уровнем значимости (p
Памятка при выборе гистологического исследования от сети ветеринарных лабораторий «Шанс Био»
Приём гистологического материала в «ШАНС БИО»
С февраля наша лаборатория ввела новые требования к приёму гистологического материала, прежде всего это связанно и обоснованно с различными задачами по постановке диагноза и ведения онкопациента.
❶ Код 803 Гистологическое исследование (1 образец), включает одно заключение по материалу, помещаемому в гистологическую кассету. 30×25×6 мм – это максимальный размер того, что можно поместить в кассету и собственно размер самой гистологической кассеты.
Выглядит это следующим образом:
| Макро: | Микро: |
 | 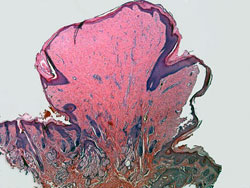 |
Фото 1. ×4. ГЭ. Папиллома. Весь объем патологически изменённых тканей исследован. Границы удаления оценить легко.
| Макро: | Микро: |
 | 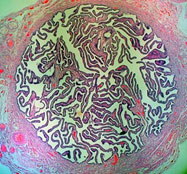 |
Фото 2. ×4. ГЭ. Мягкие ткани живота. Локализованное разрастание, предположительно аденома МЖ.
Ткани молочной железы в присланном материале не представлены.
Видна соединительно-тканная капсула.
❷ Код 814 Гистологическое исследование среднего операционного материала (1-2 фрагмента) включает одно и/или два заключения по материалу, в зависимости от случая и допобработку на два фрагмента исследуемой ткани.
Например: прислан крупный образец кожи, размером более 6 см с язвенным поражением поверхности. Отобрано два фрагмента тканей; поверхность и толща.
| Макро: | Макро: |
 |  |
Для выявления отдалённых фокусов неоплазии лаборант отдела патоморфологии производит полную ревизию образца тканей.
Фото 3. ×10. ГЭ. Ороговевающий
плоскоклеточный рак кожи, высокая степень
Слева книзу расположен фокус вертикального
роста или фокус инвазии.
Фото 4. ×40. ГЭ. Отдалённый метастатический фокус опухолевой ткани. Макроскопически, был расположен в 5 см от первоначального инфильтративно-язвенного поражения, обнаружен «случайно».
А ведь от этого зависит….
Клиническая классификация по стадиям (по системе TNM) информация приведена для данного случая неоплазии (ППК)
❸ Код 817 Гистологическое исследование большого операционного материала (2-3 фрагмента), включает одно и/или два и/или три заключения по материалу, в зависимости от случая и допобработку на несколько фрагментов исследуемых тканей.
При выборе данного кода можно направлять обширные области или даже целые органы и особо крупные фрагменты.
Напоминаем из анатомии…
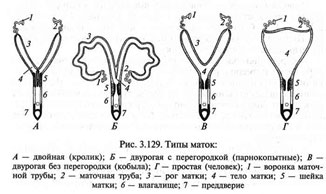
Например: тело матки и оба яичника. Яичник, врастающий в сальник и рог матки. Яичник, сальник и лимфатический узел тазовой полости. Тело матки, шейка матки и лимфатический узел тазовой полости и т.д. в различных комбинациях.
Фото 5. Х 4. Окраска по Маллори. Матка. Концентрические разрастания лейомиосаркомы виде «глаз». Выраженный эндометриоз и кровенаполненные сосуды «дополняют» картину.
Например: гряда молочной железы. При этом происходит полная ревизия тканей, отбирается образец опухолевой ткани (первичный очаг), фокальный образец (вторичное разрастание) и лимфатический узел. Или же образец опухолевой ткани (первичный очаг) и оба лимфатических узла. При гистологическом исследовании РМЖ приоритет отдаётся в пользу регионарных лимфатических узлов (рекомендации ВОЗ).
Ревизия крупных разрастаний….
Поиск лимфатических узлов…..
Фото 6. Х 4. ГЭ. Лимфатический узел. Реактивные изменения (I88.9).
Фото 7. Х 4. Вторичный (метастатический) очаг опухолевой ткани (М-8211\6).
Фото 8. Х 10. ГЭ. Тубулярная аденокарцинома молочной железы, умеренно дифференцированная (М-8211\3 | G2).
Мы не принимаем материал, которые не соответствует требованиям лаборатории!

Несоответствие тары… и размеров. Бутылка с узким горлом….

«Утрамбованные» образцы «страдают» от отсутствия фиксирующей жидкости! Фактически исследуем некроз. «Тёмное месиво» чаще оказывается множеством фрагментов….

Код 803 используется для исследования образца тканей с верификацией патпроцесса, т.е. просто информирует врача о диагнозе пациента. И если размер неоплазии позволяет, то описываются границы резекции. Это происходит в случае своевременного обращения за профессиональной помощью владельцев, т.к. условно любая неоплазия изначально это одна клетка, которая начала патологически делиться, и в большинстве случаев размер соответствует требованиям лаборатории.
Кратко код 803 – DS + границы резекции при соблюдении размерности.
Код 814 используется для исследования образца тканей не соответствующего требованиям, (3×3×3 см.) и ориентирует врача на дальнейшее ведение онкобольного. Заключение одно или два в зависимости от конкретных тканей и патпроцесса.
Кратко код 814 – применяем, если визуально это орган и если размер явно больше чем 3×3×3 см; врачу нужен DS и границы.
Множество вопросов поступило по поводу семенников. Всё-таки это отдельный полноценный орган и для адекватного ведения больного необходима оценка придатка и/или соединительных тканей придатка или капсулы органа (при инвазии). Не всегда неоплазия расположена вблизи выводных каналов придатка, а размеры органа сильно вариабельны…. Иногда приходиться делать несколько образцов тканей.
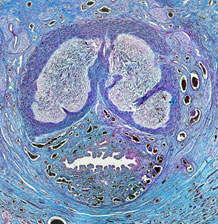
Фото 9. ×10. ГЭ. Семенник и придаток. Строение в пределах нормы.
Кратко код 817 – применяем, если визуально это орган или обширная область, а врачу нужен не только DS, но и понимание патпроцесса. Границы, регионарные л.у. Может быть врач хочет проверить множественные очаги поражения для понимания стадийности заболевания при диссеминации мастоцитомы или лимфом кожи, посмотреть наличие инфильтративного роста в подлежащие и близлежащие структуры. Например, инвазия в кость при плоскоклеточном раке ногтевого ложа и т.д.
ДОПОЛНЕНИЕ:
❹ Код 805 Дополнительное окрашивание (3 красителя)., добавляется по желанию заказчика к 803 или эндоскопическому материалу (1 локализация, любой отдел) 882.
Фото 10. ×4. Окраска по Крейбергу. Эндоскопический материал. Назальный полип. Положительное окрашивание альциановым синим, при этом виден муцин, скапливающийся в виде «озёр».
Кратко: требуется для верификации диагноза при ряде случаев, включающих «сложные» неоплазии, аутоиммунные заболевания и дерматозы и т.д.
С Уважением, ветеринарный врач-патоморфолог лаборатории «ШАНС БИО»,
к.в.н. Заболотная Алена Михайловна
Применение дополнительных гистологических методов окраски в доклинических исследованиях
Я.А. Гущин, руководитель отдела гистологии и патоморфологии, ORCID 0000-0002-7656-991Х
188663, Россия, Ленинградская обл., Всеволожский р-н, г.п. Кузьмоловский, ул. Заводская, д. 3, корп. 245
Резюме
В клинической практике и при фармакологических исследованиях микроскопический анализ является неотъемлемой частью изучения, как нормального строения тканей, так и патологически измененных органов. Один из основных этапов подготовки материала к гистологическому исследованию – визуализация, которая достигается окрашиванием структур тканей красителями. Чаще применяют обзорную окраску гематоксилином и эозином, которой недостаточно для раскрытия полной картины процесса. Поэтому необходимо использовать ряд дополнительных окрасок. Часть из них можно применять как обзорные и заменить ими классические гематоксилин и эозин, например окраски по Ван Гизону или трихром по Маллори. Большая часть окрасок более специфична, и они служат для выявления конкретных структур или химических соединений в клетках и тканях. Это позволяет получить значительный объем информации, что облегчает понимание течения как нормальных, так и патологических процессов. Методики выявления мукополисахаридов альциановым синим применяются при исследовании желудочно-кишечного тракта и дыхательной системы. ШИК-реакция необходима в диагностике болезней накопления, ряда онкологических процессов и грибковых инфекций. «Жировые красители», прежде всего судан III и шарлах красный, используются повсеместно при исследовании дистрофических заболеваний и атеросклероза. Краситель Oil Red O применим для макроскопической оценки площади атеросклеротического поражения аорты. Конго красный незаменим для обнаружения амилоида. Рассмриваются специализированные окраски, направленные на диагностику повреждений миокарда (ГОФП-методика и применение солей тетразолия) для визуализации площади поражения сердечной мышцы и головного мозга.
В данном обзоре рассматривается ряд гистологических окрасок, некоторые особенности их применения, а также механизмы взаимодействия краситель–субстрат в тканях. Данные методы можно, а часто и необходимо использовать при гистологической работе. Исследователям при планировании следует учитывать возможность их применения, что поможет выявлять, а также всесторонне изучать патологические процессы, моделируемые в доклинических исследованиях.
Введение
Неотъемлемая часть доклинических исследований – патоморфологическое изучение экспериментальных животных, сначала макроскопическое – органов и систем органов, а в последующем микроскопическое – отдельных органов и тканей. Именно гистологическое исследование позволяет более точно определить патологические процессы, выявить ткани-мишени, механизм и степень их повреждения. Основным этапом подготовки материала к гистологическому исследованию является визуализация, которая достигается окрашиванием структур тканей красителями. Цель окрашивания – более четкое выделение различных компонентов клеток и тканей [2].
Общие механизмы окрашивания тканей и клеточных структур
Существует много классификаций красителей; их делят в зависимости от их химической природы [3], в зависимости от реакции с субстратом на субстантивные (прямые) и адъективные (непрямые) [4, 5]. Однако чаще применяют деление на основные или базофильные (ядерные), кислые или ацидофильные (цитоплазматические), нейтральные и флюорохромы [2, 3]. По механизму действия красителя со структурами тканей и клеток выделяют ионное взаимодействие, слабые электрические взаимодействия, ковалентное связывание, взаимодействие с металлами и др.
Ионное взаимодействие – самое распространенное и сильное, но оно чувствительно к pH среды и концентрации солей. Так, например, катионные красители при pH 5 будут окрашивать почти все структуры, поскольку карбоксильные группы белков хорошо ионизированы, при pH 4 окрашиванию подвергаются ядра клеток и хрящевая ткань, а при pH 1 слабые фосфорно-кислые группы ДНК не ионизируются, и ядра будут плохо визуализированы. При увеличении концентрации солей в растворе, наблюдается конкуренция между ионами солей и ионами красителя за субстрат и окрашивание будет менее эффективно. Также при высоких концентрациях солей в растворе наблюдается агрегация частиц красителя в коллоидные частицы, что затрудняет их диффузию к субстрату и окрашивание также будет менее эффективно. Электронное взаимодействие слабее ионного, поэтому можно рассматривать 2 основных механизма – водородные связи, силы Ван дер Ваальса и гидрофобное связывание [6, 7].
Водородные связи обеспечивают прикрепление анионов красителей к незаряженным субстратам в тканях (например, целлюлоза с множеством ОН-групп и коллаген, богатый NH и NH2-групп). В водных растворах большая часть молекул кислорода и азота уже связаны с молекулами воды, и в данном случае взаимодействие обусловлено силами Ван дер Ваальса [6].
Гидрофобное окрашивание является следствием взаимодействия водородных связей молекул воды и агрегации гидрофобных участков молекул силами дисперсионного взаимодействия (силами Лондона), которые из области высокой концентрации (краситель) поступают в область низкой концентрации (клетки), где удерживаются слабыми силами Ван дер Ваальса [6, 7].
Хорошим примером ковалентных связей является реактив Шифа в реакциях PAS (Periodic acid – Schiff reaction), который взаимодействует с альдегидными группами, образуя окрашенный продукт [7]. Другой пример – образование ковалентных связей между органическими группировками и ионами металлов. Так, ализариновый красный образует в тканях хелатные комплексы с ионами кальция, а гематоксилин, являясь комплексом гематина с ионами алюминия, взаимодействует, вероятно, с амино- и гуанидино-группами ДНК в ядре, что и придает ему синий цвет [7].
Как видно существует много вариантов взаимодействия красителя с субстратом; они различаются специфичностью и условиями использования и служат для достижения своих, подчас узкоспециализированных, задач. Однако в рутинной гистологии главной и основной окраской остается методика с применением гематоксилина и эозина. Это простой, дешевый и повсеместно используемый метод, который имеет много модификаций и может применяться в большинстве случаев. Именно поэтому его еще называют обзорной окраской. Но подчас этого недостаточно и тогда необходимы дополнительные методы [8, 9], которые в значительной мере улучшат качество не только диагностики заболеваний, но и качество исследовательских работ с привлечением гистологических методов.
Рассмотрим ряд гистологических окрасок, некоторые особенности их применения, а также механизмы взаимодействия краситель-субстрат в тканях. Данные методики можно, а часто и необходимо, использовать при гистологической работе, а исследователям при планировании следует учитывать возможность их применения, что поможет выявлять, а также всесторонне изучать патологические процессы, моделируемые в доклинических исследованиях.
Окраска соединительной ткани. Окраска соединительной и мышечной тканей гематоксилин-пикрофуксином по методу Ван Гизона (рис. 1). Это второй наиболее часто используемый в гистологической практике метод. Им можно заменить окраску гематоксилин-эозином и применять как основной для получения обзорных препаратов, но все же чаще он дополняет исследование [10]. Этот метод имеет ряд преимуществ по сравнению с окраской гематоксилин-эозином, так как по-разному окрашивает различные ткани: соединительная ткань после окраски пикрофуксином имеет ярко-красный цвет, а все остальные ткани – буровато-желтый или желто-зеленый. Механизм действия основан на большем сродстве кислого фуксина к коллагену, что, с одной стороны, объясняется параллельной волокнистой организацией белка, открывающей большое количество пептидных групп, содержащих карбоксильные аминокислоты (аспарагиновую и глутаминовую), легко образовывающих водородные связи с красителем, а, с другой стороны, наличием ионных связей, которые могут быть нарушены обработкой ткани кислотами, т.е. дезаминированием белков. Цитоплазматическое окрашивание более характерно для пикриновой кислоты, поскольку она, за счет меньшего размера, имеет более высокую скорость диффузии в клетки, а также, являясь выраженным анионным красителем, проявляет более сильное ионное взаимодействие с положительно заряженными аминогруппами цитоплазматических белков [11] (рис. 2).
В качестве ядерной окраски можно использовать гематоксилин Майера, Эрлиха, но железный гематоксилин Вейгерта дает лучшую черную или буро-черную окраску ядер. Данный метод необходим при дифференцировке соединительной ткани от мышечной в случаях, когда их трудно различить на препаратах, окрашенных другими методами (например, при исследовании хронических заболеваний с развитием фиброза или при опухолевых процессах).
Некоторые особенности не позволили данному методу стать основным, например, необходимость контроля под микроскопом, поскольку пикрофуксин как дифференцирующее соединение, ослабляет интенсивность окраски гематоксилином, и если ядра приобретают бурый, а не черный цвет, то следует использовать более длительную экспозицию срезов в гематоксилине или меньшую в пикрофуксине [2]. Но более существенным недостатком является выцветание препаратов за счет потери окраски фуксинофильных коллагеновых волокон, а это значит, что препараты нельзя хранить длительное время [12].
Окраска эластических волокон фуксин-резорцином по Вейгерту. Окраска (рис. 3) позволяет выявить эластические волокна в тканях, что полезно при изучении заболеваний и патологических процессов, поражающих сосуды или, например кожу. Взаимодействие между эластином и красителем осуществляется за счет сложных эфирных групп, а также путем образования водородных связей между фенольными гидроксильными группами красителя и эластином [14] (рис. 4). При этом хлорид железа, используемый при окраске, с одной стороны, взаимодействуя с резорцином, дает насыщенный синий цвет, а, с другой, увеличивая насыщенность раствора солями, препятствует окрашиванию таких базофильных структур, как хроматин и рибосомы цитоплазмы, а значит повышает селективность метода [15]. Но специфичность метода все равно остается низкой, причем возможно окрашивание и других структур коллагена, а также базальных мембран. Поэтому для лучшей визуализации эластических волокон необходимо проводить тщательное дифференцирование под микроскопом в процессе окраски [13].
Есть возможность использовать данный метод в комбинации с окраской по Ван Гизону, что позволяет одновременно выявить также коллаген и окрашивать ядра. Тогда результатом будет следующая картина: ядра – черные, эластические волокна – от темно-синих до черного, коллагеновые волокна – оттенки красного, цитоплазма, гладкая и поперечнополосатая мышечная ткань, ороговевающий эпителий, нейроглия и эритроциты – желтые [2, 13].
Орсеин – еще один распространенный краситель, позволяющий выявить эластические волокна в тканях, прежде всего в сосудах (рис. 5, 6). Результат – эластические волокна – от темно-красных до коричневых [10, 11]. За счет окрашивания белков, связанных с медью, данная методика применяется для диагностики заболеваний накопления меди (болезнь Вильсона). Кроме того, связываясь с поверхностными антигенами вируса гепатита В, позволяет использовать краситель для визуализации пораженных клеток [16].
Механизм окрашивания до конца неясен. Возможно, краситель взаимодействует с эластином за счет образования в кислой среде водородных связей между фенольными группами орсеина, заряженными положительно, и отрицательно заряженными боковыми цепями белка, который отличается от коллагеновых волокон меньшим содержанием аргинина, гистидина и лизина и большим количеством нейтральных лейцина и валина. Кроме того, повышенное (до 90%) содержание неполярных аминокислот делает эластические волокна, в отличие от коллагеновых, малорастворимыми в большинстве органических и неорганических растворителей, что может быть применено для выделения компонентов ткани [17].
Трихром по Маллори. Дифференцировка коллагеновых волокон хорошо достигается при окраске по Ван Гизону, но другие компоненты ткани (фибрин, хрящевая и мышечная ткань, форменные элементы крови) окрашиваются хуже и не столь специфично, поэтому для более детальной одновременной визуализации можно использовать трихромные окраски, которые окрашивают компоненты тканей в 3 цвета (красный, желтый и синий) с их вариантами. Например, метод окрашивания по Маллори, включает в себя несколько компонентов: анилинового синего, фосфомолибденовую кислоту, пикриновую кислоту и фуксин [12] (рис. 7). Специфичность действия трихрома объясняется различной степенью сродства между его компонентами и макромолекулами соединительной ткани, которая из-за наличия большого числа основных групп ацидофильна и обладает высоким сродством к кислым красителям (пикриновая кислота и оранжевый G), но низким по отношению к слабым основным и амфотерным красителям (кислый фуксин и пунцовый фуксин). Фосфомолибденовая кислота как крупный гетерополианион легко и прочно связывается с катионными группами тканевых структур (волокна коллагена, клеточные мембраны), блокируя таким образом воздействие на них анилинового синего (основный краситель с частичными амфотерными свойствами) [10, 13, 16, 18] (рис. 8). Результат следующий: ядра – темно-коричневые; коллагеновые волокна – темно-синие; хрящ, кость, мукополисахариды, амилоид – оттенки синего; фиброглия, нейроглия, фибрин – красные; мышечная ткань, миелин и эритроциты – желтые; эластические волокна – розовые.
Данная окраска дает более яркие и выраженные результаты, если использовать для фиксации материала жидкость Ценкера, и перед окраской обработать срезы 3% раствором бихромата калия примерно в течение 20 мин [12].
Окраска мукоплисахаридов. Мукополисахариды – это полимерные углеводно-белковые комплексы, содержащиеся в соединительной ткани (хрящевой ткани, роговице) и в жидкостях (слизь, гепарин, синовиальная жидкость, стекловидное тело). В гистологии окраски на мукополисахариды применяются при изучении, прежде всего структур, выделяющих слизь – кишечника, бронхов, муцинозные опухоли, а также заболеваний хрящевой ткани.
Альциановый синий (рис. 9) по химической структуре является медьсодержащим фталоцианином, который образует прочную связь с полианионами мукополисахаридов, избирательно взаимодействуя с их карбоксильными группами и сульфогруппами [пирс]. Краситель под воздействием тетрабората натрия становится плохо растворимым синим пигментом, который хорошо визуализируется. На реакцию значительно влияет кислотность раствора, так альциановый синий рН 1,0 образует связи с мукополисахаридами с большим содержанием сульфо-групп, а альциановый синий рН 2,5 способен к окрашиванию всех кислых мукополисахаридов [2,13,16] (рис. 10). Это позволяет добиться селективного окрашивания кислых сиаломуцинов и сульфомуцинов бокаловидных клеток толстой кишки, в то время как нейтральный муцин желудка или желез Бруннера не реагируют с альциановым синим при рН 2,5 [16].
Результат окрашивания будет следующим – кислые мукополисахариды – бирюзово-голубые, хрящевая ткань – от пурпурного до темно синего.
Для выявления гликогена в нормальных и патологически измененных тканях используют ШИК-реакцию (Шифф-йодная кислота) (рис. 11). В данном случае йодная кислота окисляет и разрывает связи в соединениях, содержащих 2 смежные гликолевые группы, образуя диальдегид. Последний образует с серосодержащим фуксином из реактива Шиффа нерастворимое окрашенное соединение, сходное с основным фуксином [13, 17] (рис. 12).
В результате гликоген окрашивается в красные цвета. Таким образом, этот метод широко используется при изучении болезней накопления гликогена, ряда опухолевых заболеваний при которых происходит накопление муцина, грибковых поражений для визуализации клеточной стенки, а также для изучения лимфопролиферативных заболеваний для детализации патологических клеток крови.
Окраска жиров. Обнаружение липидов в клетках и тканях осуществляется группой жировых красителей под общим названием «Суданы» (Судан черный, Судан III, Судан IV и др.), а также нильблаусульфатом и осмиевой кислотой. Эти жирорастворимые вещества легко проникают в липидсодержащие структуры, и не взаимодействует с гидротированными белками (рис. 13, 14). Таким образом, процесс окрашивания липидов представляет собой не гидрофобное взаимодействие, а имеет чисто физический характер, что не позволяет проводить избирательное окрашивание отдельных липидов разного химического состава. Для этой цели перед проведением гистохимической реакции необходимо использовать методы экстракции отдельных групп липидов разными системами растворителей [7, 19,].
Наиболее часто применяют Судан III и шарлах красный. Они выявляют все жиры, липоиды и нейтральные жиры, интенсивно окрашивая их в оранжево-красный цвет. При этом следует помнить о существенных особенностях обработки материала. Прежде всего формалиновая фиксация не должна быть более 48 ч. После чего на замораживающем микротоме сразу изготавливают срезы, поскольку при обычной проводке эфир, ксилол и крепкие спирты растворяют и извлекают жиры из клеток в растворы, именно поэтому после окраски срезы нельзя обезвоживать и заключать обычным способом. Препараты заключают в глицерин или глицерин-желатин, которые не растворяют жиры и хорошо просветляют необезвоженный препарат, но при длительном хранении препаратов наблюдается выпадение Судана в осадок в виде красных кристаллов. Лучше использовать специальные монтирующие среды на водной основе [13, 20]. Несмотря на используемый метод заключения, краситель все равно быстро выцветает, поэтому желательно исследовать препараты вскоре после их изготовления [10, 20].
Стоит отметить метод окраски макропрепаратов при помощи Sudan Red 5B или масляный красный (Oil Red O), которые применяются для визуализации атеросклеротического повреждения сосудов. Oil Red O – это лизохромный диазокраситель, используемый для окрашивания нейтральных триглицеридов и липидов. Он окрашивает липиды в красный цвет с максимальным поглощением при 500–600 нм. На интиме аорты, после обработки красителем, можно обнаружить даже ранние стадии патологического процесса, поскольку жировые включения окрашиваются красным и хорошо визуализируются глазом [20] (рис. 15).
Окраска на амилоид. Для выявления скопления амилоида (патологический белково-полисахаридный комплекс, образующийся при хронических заболеваниях) в тканях наиболее простой и широко используемый краситель – конго красный (рис. 16). Данный краситель окрашивает белок в красный цвет. Кроме того, возможно изучение препаратов в поляризационном свете, при этом массы амилоида дают желто-зеленое свечение, однако рекомендуется заключение срезов в гуммиарабик для исключения свечения коллагеновых волокон [2, 21]. Прочное связывание амилоида с красителем не до конца изучено. Оно происходит таким образом: за счет водородных связей гидроксильных групп, с помощью положительно заряженных аминокислот и посредством полярных контактов [22] (рис. 17).
Специальные методы
Выявление повреждений миокарда по Ли (ГОФП-метод: гематоксилин – основной фуксин – пикриновая кислота). Liе и соавт. (1971) описали и дали название этому методу – «фуксиноррагический». Основной фуксин как катионный краситель взаимодействует с продуктами распада, высвобождаемых из саркоплазмы кардиомиоцитов (в частности с гликогеном), тем самым окрашивая их в красно- коричневый цвет. При этом интактные ткани остаются желто-коричневыми или бледно-зелеными, поскольку, как указано выше, хорошо воспринимают пикриновую кислоту (рис. 18, 19), тем самых создавая хороший контраст с поврежденными участками. ГОФП-метод эффективен для объективного выявления ишемизированных участков миокарда, причем при повреждении как коронарогенного, так и некоронарогенного генеза. Кроме того, опосредованно можно визуализировать соединительную ткань (например, рубцовая ткань после перенесенного инфаркта миокарда окрашивается в сиреневые оттенки, а эластические волокна становятся красными). Особенно эффективна методика на ранних этапах поражения сердечной мышцы, поскольку в поражённых кардиомиоцитах фуксинофильный субстрат появляется вначале вблизи ядра, затем распространяется по всей цитоплазме, а в дальнейшем и на большую часть мышечного волокна [12, 23]. Но впоследствии, когда мышечные волокна начинают разрушаться и рассасываться, фуксинофильный субстрат полностью исчезает, и окраска утрачивает свое значение [24].
Для макроскопической оценки площади ишемического повреждения тканей, а особенно миокарда и головного мозга, можно использовать соли тетразолия, в частности трифенилтетразолия хлорид (ТТХ) (рис. 20). Соли тетразолия, реагируя с дегидрогеназами (группы ферментов катализирующих окислительно-восстановительные реакции) восстанавливаются до окрашенных соединений – формазанов. Таким образом, в очаге повреждения высвобождается большое количество дегидрогеназ, которые при взаимодействии с тетразолием дают хорошо видимый глазом красный цвет (рис. 21). Реакция позволяет выявить ишемические повреждения на ранних донекротических стадиях патологического процесса [25, 26].
Заключение
В клинической практике и при фармакологических исследованиях микроскопический анализ – неотъемлемая часть изучения нормального строения тканей, а также патологически измененных органов. Приготовление гистологических препаратов включает в себя 5 этапов, каждый из которых важен и может повлиять на полученные результаты. Последний этап является – окрашивание, который обычно ограничен применением стандартной – обзорной окраски гематоксилином и эозином. Но для раскрытия более полной картины процесса необходимы дополнительные окраски; их можно применять как обзорные и заменить ими классические гематоксилин и эозин, например окраски по Ван Гизону или трихром по Маллори. Однако эти методы имеют ряд ограничений или трудоемки в исполнении, поэтому не получили широкого распространения и используются как дополнительные окраски для более детального анализа, в частности для изучения соединительной ткани и патологических процессов, связанных с фиброзом.
Большая часть окрасок более специфична, и их применение служит для выявления конкретных структур или химических соединений в клетках и тканях. Это позволяет получить значительный объем информации, что облегчает как понимание течения нормальных, так и патологических процессов. Так методики выявления мукополисахаридов альциановым синим широко применимы при исследовании желудочно-кишечного тракта и дыхательной системы, а ШИК-реакция незаменима в диагностике болезней накопления, ряда онкологических процессов и грибковых инфекций. Жировые красители, прежде всего Судан III и шарлах красный, используются повсеместно при исследовании дистрофических заболеваний и не в последнюю очередь атеросклероза, а методика применения красителя Oil Red O применима для макроскопической оценки площади атеросклеротического поражения аорты. Конго красный незаменим для обнаружения патологического белка амилоида, который образуется в тканях при аутоимунных и хронических заболеваниях – ревматоидном артрите, туберкулезе или нефропатии.
Кроме того, применяются специализированные окраски, направленные на диагностику повреждений миокарда. Выявить наиболее ранние признаки повреждения кардиомиоцитов позволяет ГОФП-методика. А при помощи солей тетразолия легко макроскопически визуализировать площадь поражения в тканях (не только в сердечной мышце, но и, например, в головном мозге).
В данном обзоре была рассмотрена только незначительная часть гистологических окрасок, их механизмы действия, химические реакции, позволяющие визуализировать микроскопические структуры тканей. Многие из этих методик нашли свое применение в практической деятельности лабораторий, при изучении эффективности и токсичности лекарственных средств. Конечно, существует еще множество красителей, методов, а также их сочетания. Все они могут быть использованы сами по себе, но скорее необходимо применять целый комплекс окрасок. Данный материал будет полезен как специалистам по планированию и проведению доклинических исследований на этапе подготовки к экспериментам, так и врачам-гистологам для понимания процессов, происходящих в тканях в момент окрашивания структур, что позволит выявлять ошибки и получать более объективный конечный результат.