Окклюзия коронарной артерии что это
Окклюзия коронарной артерии что это
Атеросклероз является причиной ишемической болезни сердца. Наиболее частой причиной уменьшения коронарного кровотока является атеросклероз. Развитие атеросклеротического процесса — специфическое нарушение липидного обмена. Суть этого процесса заключается в следующем.
У людей с генетической предрасположенностью к атеросклерозу, а также у людей, потребляющих большое количество холестерола с пищей и ведущих малоподвижный образ жизни, избыток холестерола постепенно откладывается в артериях под эндотелиальным слоем. Постепенно эти отложения прорастают фиброзной тканью и часто кальцинируются. В результате формируются атеросклеротические бляшки, которые выступают в просвет сосуда и приводят к полному или частичному перекрытию кровотока. Типичное место расположения атеросклеротических бляшек — первые несколько сантиметров крупных коронарных артерий.
Острая коронарная окклюзия
Острая коронарная окклюзия (закупорка сосуда) чаще развивается у людей с атеросклерозом коронарных артерий и почти никогда — у людей с нормальным коронарным кровообращением. Острая окклюзия может быть вызвана одной из следующих причин. 1. Атеросклеротическая бляшка приводит к местному свертыванию крови и образованию тромба, который перекрывает просвет артерии. Тромб возникает, если атеросклеротическая бляшка повреждает эндотелий и вступает в прямой контакт с протекающей кровью.
Поскольку бляшка имеет неровную поверхность, происходит адгезия тромбоцитов к поверхности бляшки, откладывается фибрин, образуется красный тромб, который продолжает расти, пока полностью не перекроет просвет сосуда. Нередко тромб отрывается от атеросклеротической бляшки и с током крови попадает в периферическую ветвь коронарной артерии, блокируя кровоток в этом участке. Тромбы, которые закупоривают сосуд, попадая в него с кровью, называют эмболами. 2. Многие клиницисты полагают, что местный спазм коронарной артерии тоже может вызвать нарушение кровообращения. Причиной спазма может быть непосредственное раздражение гладкомышечной стенки артерии краями атеросклеротической бляшки или же местное рефлекторное сосудосуживающее влияние. Спазм артерии приводит к вторичному тромбообразованию.
Жизненно важное значение коллатерального кровообращения в сердце. Тяжесть повреждения сердечной мышцы как при медленном развитии атеросклеротического процесса, так и при внезапной окклюзии коронарных артерий в большой степени зависит от состояния коллатерального кровообращения сердца. Имеет значение и уже существующая коллатеральная сеть, и коллатерали, которые открываются в первые минуты окклюзии.
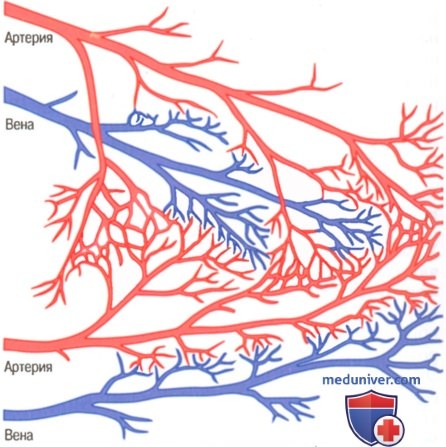
В здоровом сердце практически нет коллатералей между крупными коронарными артериями, однако существуют множество коллатеральных анастомозов между мелкими артериями диаметром от 20 до 250 мкм (рисунок выше).
При внезапной окклюзии одной из основных коронарных артерий мелкие анастомозы начинают расширяться уже через несколько секунд. Однако кровоток через мелкие коллатеральные сосуды обычно бывает в 2 раза меньше, чем требуется для выживания сердечных клеток.
В течение следующих 8-24 ч диаметр коллатеральных анастомозов существенно не увеличивается. Затем коллатеральный кровоток начинает расти. На второй или третий день его интенсивность увеличивается в 2 раза, а к концу первого месяца коронарный кровоток достигает нормального уровня. Благодаря развитию коллатеральных сосудов многие больные практически полностью выздоравливают после перенесенной коронарной окклюзии, если только зона повреждения миокарда не была слишком большой.
Если атеросклеротическое сужение коронарных артерий прогрессирует медленно, в течение многих лет, коллатеральное кровообращение развивается по мере того, как атеросклеротическое поражение становится все тяжелее. Поэтому у такого рода больных никогда не бывает острых нарушений сердечной деятельности. Однако коллатеральный кровоток не может компенсировать все большее развитие склеротического процесса, тем более что атеросклероз нередко поражает и сами коллатеральные сосуды. Если это происходит, производительность сердца резко ограничивается, оно оказывается не в состоянии перекачивать необходимый объем крови даже в состоянии покоя. Это является самой распространенной причиной развития сердечной недостаточности у большого числа пожилых людей.
Видео этиология, патогенез инфаркта миокарда
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Врачи ФГБУ «НМИЦ ТПМ» Минздрава России успешно лечат хронические окклюзии коронарной артерии
Хроническая окклюзия коронарной артерии (ХОКА) — это полное закрытие сосуда, снабжающего кровью сердечную мышцу. Сердце не получает достаточного количества кислорода, что приводит к тяжелым последствиям. Чтобы компенсировать кровоток, организму приходится искать “обходные пути”. Их может быть достаточно для кровоснабжения, но они слабее, чем основные, поэтому рано или поздно у пациента развивается сердечная недостаточность или инфаркт миокарда.
Причиной окклюзии могут быть тромб или атеросклеротическая бляшка.
ХОКА диагностируется у каждого пятого пациента с ишемической болезнью сердца. По статистике, ХОКА чаще встречается у мужчин, и ассоциирована с такими факторами риска, как сахарный диабет, артериальная гипертония, дислипидемия, курение и ранее перенесенный инфаркт миокарда. Несмотря на то, что многие кардиологи до сих пор выбирают медикаментозную терапию, в центре внимания врачей хирургические способы лечения – малоинвазивное чрескожное коронарное вмешательство. Данный вариант лечения отличается высокой эффективностью, малой травматичностью и быстрым восстановительным периодом.
Например, выписка из стационара возможна в течение нескольких дней после процедуры. А значит, благодаря таким операциям пациент в короткие сроки возвращается работе и активной жизни.
Важно понимать! Хроническая окклюзия — серьезная патология, требующая незамедлительного лечения в профильном кардиологическом стационаре!
Специалисты ФГБУ “НМИЦ ТПМ” Минздрава России успешно занимаются проблемой хронических окклюзий и добились в этом вопросе хороших результатов. В последнее время было разработано множество техник для хирургического лечения ХОКА и практически полностью поменялось техническое обеспечение:
• стенты последнего поколения,
• специальная линейка проводников для реканализации ХОКА,
• рентгеновские томографы нового поколения, позволяющие существенно снизить дозу рентгеновского облучения.
Накопленный опыт, улучшенная техническая база и профессионализм хирургов центра позволяют достичь 90-95% успеха чрескожных коронарных вмешательств при ХОКА и снизить количество осложнений.
Опыт эндоваскулярного лечения ишемической болезни сердца у пациентов с хронически окклюзированными коронарными артериями
Хронически окклюзированные коронарные артерии составляют значительную часть коронарных поражений, выявляемых у пациентов с ишемической болезнью сердца (ИБС) при проведении диагностической коронароангиографии (КАГ) и, в определенной клинической ситуации,
Хронически окклюзированные коронарные артерии составляют значительную часть коронарных поражений, выявляемых у пациентов с ишемической болезнью сердца (ИБС) при проведении диагностической коронароангиографии (КАГ) и, в определенной клинической ситуации, требующих проведения реваскуляризации миокарда.
Так, окклюзированные коронарные артерии выявляются примерно у 40% пациентов, а коронарная ангиопластика на хронически окклюзированных коронарных артериях составляет 10—20% всех интервенционных процедур [1].
Многие авторы ссылаются на то, что при ангиопластике хронических окклюзий коронарных артерий процент успешных вмешательств ниже, тогда как время облучения больше и стоимость процедуры выше, чем при ангиопластике у больных со стенотическими поражениями [10].
В Научно-практическом центре интервенционной кардиоангиологии (НПЦИК) при проведении плановой диагностической КАГ также довольно часто обнаруживаются полные хронические окклюзии 1-2 или более коронарных артерий. В связи с чем нами было проведено исследование, целью которого явилась оценка эффективности эндоваскулярного лечения хронически окклюзированных коронарных артерий.
В НПЦИК в период с октября 1997 по декабрь 2002 гг. были осуществлены 380 попыток механической реканализации хронически окклюзированных коронарных артерий у 375 больных. При этом успешными процедуры были признаны у 253 больных (67,5%), которым реканализировали 258 сегментов. В 122 случаях (32,5%) процедура реканализации оказалась неэффективной.
Проводниковая реканализация и коронарная ангиопластика окклюзированной артерии выполнялись 107 больным на 107 сегментах; реканализация, транслюминальная баллонная ангиопластика (ТЛАП) и стентирование — 146 больным, которым был реканализирован 151 сегмент.
В нашем исследовании в 2 случаях (0,53%) имелись осложнения — разрыв коронарной артерии передней межжелудочковой ветви левой коронарной артерии (ПМЖВ) и правой коронарной артерии (ПКА), потребовавшие хирургического вмешательства — эмболизации и ушивания артерии соответственно. Оба пациента живы и выписаны из клиники.
В настоящем исследовании представлены результаты обследования и лечения 185 человек ИБС, которым была выполнена процедура реканализации хронически окклюзированной коронарной артерии и которые прошли контрольное обследование, включающее коронароангиографию.
Пациенты были разделены на 2 группы: у 146 человек проводилось стентирование 151 сегмента после реканализации хронически окклюзированной коронарной артерии, у 107 больных — проведена ТЛАП. В исследование не включались больные, у которых процедура осуществлялась в острой стадии инфаркта миокарда (ИМ), а также пациенты, перенесшие ранее процедуры на венечных сосудах.
Диагностику ИБС и ее форм проводили на основании тщательного сбора анамнеза, данных электрокардиографии (ЭКГ), холтеровского мониторирования ЭКГ, эхокардиографического исследования (ЭхоКГ), велоэргометрической пробы (ВЭМ), клинического и биохимического анализа крови (КФК, КФК-МБ, АСТ, ЛДГ, холестерина и липидного спектра крови). Для оценки состояния и степени поражения коронарных артерий, сократительной и функциональной способности миокарда левого желудочка (ЛЖ) всем пациентам выполняли селективную коронароангиографию и левую вентрикулографию (ВГ).
Показаниями для проведения эндоваскулярной процедуры являлись приступы стенокардии, признаки ишемии миокарда, по данным суточного мониторирования ЭКГ, а также положительные результаты нагрузочных проб.
Клиническая характеристика пациентов представлена в таблице. В подавляющем большинстве случаев наблюдался III функциональный класс (ФК) стенокардии напряжения — 60,0 и 72,0% в 2 группах соответственно. Стенокардия напряжения I ФК в обеих группах больных в исследовании не встречалась. У 3 (4%) пациентов из группы ТЛАП была выявлена безболевая ишемия миокарда.
Инфаркт миокарда ранее перенесли 80% человек из первой группы и 86,7% пациентов второй группы, гипертоническая болезнь различной стадии и длительности была выявлена соответственно у 60,9 и 69,3% больных.
Сахарным диабетом 2 типа страдали 7,3% пациентов в группе стентирования и 5,3% больных в группе ТЛАП. Во всех случаях имела место средняя тяжесть течения заболевания. Сахарный диабет 1 типа не встречался в нашем исследовании ни в одном случае.
Предполагаемая длительность («возраст») окклюзии определялась как период времени от перенесенного инфаркта миокарда в области, кровоснабжаемой окклюзированной артерией, либо от эпизода стенокардии большей, чем обычно, интенсивности. Длительность окклюзии до 3 мес. наблюдалась у 46,4% пациентов из первой группы и у 46,7% — из второй группы. «Возраст» окклюзии от 3 до 6 мес. был выявлен у 30,9% больных первой группы и у 25,3% больных второй группы, от 6 до 12 мес. — 14,5 и 17,3% соответственно, свыше 12 мес. — 8,2 и 10,7% больных соответственно.
Для уточнения характера поражения коронарного русла и оценки функции ЛЖ всем больным выполнялись селективная КАГ и левая ВГ. Гемодинамически значимыми считались поражения, стенозирующие просвет коронарной артерии более чем на 50%.
Общее количество гемодинамически значимых атеросклеротических поражений (больше 50% просвета артерии) составило 248 у 110 больных в группе стентирования и 152 у 75 больных в группе ТЛАП. Основное количество поражений было локализовано в ПМЖВ и ПКА.
Наиболее часто процедура выполнялась на ПМЖВ — 50,45 и 56,0%, в первой и второй группах соответственно. На ПКА было выполнено 25,67% процедур в группе стентирования и 21,30% в группе ТЛАП. На огибающей ветви левой коронарной артерии (ОВ ЛКА) — 19,47 и 17,30% процедур соответственно.
Все больные получали симптоматическую терапию, заключавшуюся в назначении нитратов (нитросорбид, кардикет, моно мак), β-блокаторов (атенолол, конкор, эгилок, беталок-ЗОК, дилатренд), антагонистов Са (амловас, норваск, нормодипин, лацидипин), ингибиторов АПФ (эналаприл, престариум, фозиноприл) и статинов (зокор, липримар, симгал).
Непосредственный ангиографический успех процедуры у больных после проведения стентирования и баллонной ангиопластики был довольно высоким, остаточный стеноз не превышал 30%, а антеградный кровоток у всех пациентов определялся как TIMI III. В подавляющем большинстве случаев диаметр стентированного сегмента практически не отличался от прилегающих интактных сегментов коронарной артерии.
Для имплантации применялись различные стенты, однако наиболее часто использовались следующие стенты: BX Velocity (Cordis, Johnson&Johnson) — 26 (23,0%), BX Sonic (Cordis, Johnson&Johnson) — 15 (13,3%), CrossFlex (Cordis, Johnson&Johnson) — 14 (12,4%), Biodivysio (Biocompatible) — 12 (10,6%), Angiostent (Angio Dynamics, NJ) — 10 (8,9%), Multilink (Guidant, Santa Clara, CA) — 7 (6,2%). Средняя длина стента составила 17,96±4,79 мм, средний диаметр стента — 2,98±0,27 мм.
У 9 (8,2%) больных в основную артерию были установлены по 2 коронарных стента. У 1 (0,9%) больного в основную артерию имплантировано 3 стента.
При проведении стентирования ни в одном случае не отмечалось острого или подострого тромбоза стента. Спазм коронарной артерии после стентирования определяли в 2 (1,8%) случаях, что потребовало только медикаментозной коррекции. У 3 (2,7%) пациентов была отмечена окклюзия боковой ветви, ни в одном случае не сопровождавшаяся существенной клинической симптоматикой или развитием инфаркта миокарда.
Одновременно с основной процедурой 31 больному проводилась эндоваскулярная процедура на другом поражении коронарного русла. При этом у 24 (21,8%) больных была выполнена одна дополнительная процедура, у 7 (6,4%) пациентов — 2 процедуры.
В результате проведенного эндоваскулярного лечения полная реваскуляризация миокарда, т. е. устранение всех гемодинамически значимых стенозов, оказалась выполнена более чем у 60% больных в обеих группах.
На госпитальном этапе отсутствие обострений после вмешательства отмечали у 100% больных в группе стентирования и у 98,7% в группе ТЛАП, т. е. у всех больных проведение эндоваскулярных процедур обусловило стабилизацию состояния и купирование приступов стенокардии. Развития острого инфаркта миокарда, необходимости в оперативном лечении ни в одном случае отмечено не было. Госпитальной летальности в нашем исследовании также не наблюдалось.
Полученные в настоящее время данные рандомизированных исследований свидетельствуют о том, что позднее открытие окклюзированных венечных артерий оказывает положительное влияние на частоту неблагоприятных кардиальных событий в отдаленном периоде (снижение смертности, частоты повторных ИМ), улучшает функцию ЛЖ, влияет на его ремоделирование после перенесенного ИМ.
Отмечено, что выживаемость пациентов через 2 года после коронарной ангиопластики составляет 98%, а отсутствие инфарктов за тот же период отмечалось у 94% больных [2, 12].
По данным исследования, проведенного P. A. Sirnes, у пациентов после реканализации, ТЛАП и стентирования хронически окклюзированных коронарных артерий в отдаленном периоде наблюдалось значительное улучшение клинического состояния по сравнению с исходным. До ТЛАП 83% пациентов принимали b-блокаторы и 55% — нитраты. В отдаленном периоде соответствующие цифры составили 53 и 9% (p Рисунок 1. Ангиограмма пациента Ф. (68 лет), с хронической окклюзией ПКА
Частота рестеноза ТЛАП, согласно многочисленным исследованиям, выполненным в различных странах, колеблется в пределах от 17 до 50% [3, 4, 5, 7, 8, 9, 13].
По данным P. A. Sirnes и соавт., после баллонной ангиопластики хронически окклюзированных коронарных артерий частота отдаленного рестеноза составляет 53%, после стентирования коронарных артерий — 40% [11].
Анализ наших собственных данных (НПЦИК) показывает, что в отдаленные сроки после стентирования хороший ангиографический результат процедуры сохранялся в 68 (60,2%) артериях (рис. 1—3). Рестеноз стента был выявлен в 28,3%, реокклюзия — в 11,5% случаев.
 |  |
| Рисунок 2. Ангиограмма пациента Ф. (68 лет) после проведения механической реканализации, ТЛАП и стентирования ПКА | Рисунок 3. Отдаленный результат механической реканализации, ТЛАП и стентирования хронически окклюзированной ПКА (через 7 месяцев) |
Менее утешительные результаты получены после коронарной ангиопластики в аналогичных ситуациях: хороший результат процедуры выявлен лишь в 41,3% случаев, рестеноз в месте проведения ангиопластики наблюдали в 38,7% случаев, а реокклюзию — у 20% больных.
Таким образом, в отношении сохранения хороших результатов проведения ангиопластики стентирование хронически окклюзированных венечных артерий обладает достоверными преимуществами по сравнению с баллонной ангиопластикой.
Мы считаем, что по мере развития материально-технической базы медицинских учреждений, накопления опыта проведения интервенционных вмешательств, а также более точного отбора больных доля успешно выполненных процедур будет расти.
На основании всего вышеизложенного можно сделать следующие выводы.
По вопросам литературы обращайтесь в редакцию.
Д. Г. Иоселиани, доктор медицинских наук, профессор
М. В. Яницкая, кандидат медицинских наук
А. В. Кононов, О. В. Захарова, П. Ю. Лопотовский
Научно-практический центр интервенционной кардиоангиологии, Москва
Коронарная ангиопластика и стентирование коронарных артерий
(Ангиопластика сердца, стентирование, коронарная ангиопластика, стентирование сосудов сердца)
Правильное название процедуры: Коронарная ангиопластика со стентированием или чрескожное коронарное вмешательство.
Для простоты иногда говорят просто «стентирование».
Что такое стентирование коронарных артерий
Кому показано стентирование сосудов сердца?
Стентирование сосудов сердца показано пациентам с тяжелой стенокардией, после инфаркта миокарда и предынфарктным состоянием, больным с доказанной ишемией (нехваткой крови сердцу) по результатам нагрузочных проб. При этом решение о стентировании принимается только по результатам коронарографии – контрастного исследования сосудов сердца. Коронарография, как и стентирование, выполняется в рентгеноперационной. Часто коронарография «переходит» в стентирование сосудов т.к. выполняется через один и тот же прокол в артерии.
Какие альтернативные стентированию методы существуют?
Как выбрать между стентированием, шунтированием и медикаментозной терапией?
Это задача вашего кардиолога, который учитывает следующие данные:
Методика стентирования коронарных артерий (с профессиональным жаргоном)
Первый инструмент, который попадает к месту сужения артерии – коронарный баллон диаметром чаще всего от 1 до 3.5 мм длиной 10-20 мм. Баллон надевается на проводник и движется по нему до места максимального сужения где он раздувается. Давление внутри баллона при этом достигает 15-20 атмосфер.
Внутрь имплантированного стента заводится жесткий баллон и раздувается большим давлением (до 25 атмосфер). Чаще всего после этого стент расправляется и хорошо прилегает к стенкам артерии.
Контрольная коронарография
Гемостаз
Что делать с отверстием в артерии?
Если вмешательство проводилось через лучевую артерию (на руке) – на запястье надевается специальный браслет с валиком (гемостатическая манжета), который будет давить на место вкола и не допустит кровотечения. В зависимости от ситуации манжета останется на руке от 3 до 12 часов.
В случае бедренного доступа возможны 2 основных варианта:
Коронарная ангиопластика и стентирование
Риск серьезных осложнений очень зависит от степени поражения артерий, локализации бляшек, извитости артерий, наличия кальциноза и, конечно, опыта оператора.
В среднем риск серьезного осложнения не превышает 1%. Этими осложнениями могут быть:
«Малые осложнения» стентирования:
Окклюзия коронарной артерии что это
Общеизвестно, что из всех морфологических форм атеросклеротического поражения коронарных артерий одной из наиболее технически сложных для реваскуляризации являются хронические окклюзии [7]. Хронические тотальные окклюзии коронарных артерий (ХОКА) выявляются при ангиографическом исследовании примерно у 20-30 % пациентов [1,13]. Наличие ХОКА является наиболее частым критерием в пользу выбора коронарного шунтирования [2,3], поскольку у пациентов с многососудистым поражением коронарного русла, ввиду невысокой частоты успешных реканализаций, процедура сводится к неполной анатомической реваскуляризации. Несмотря на значительный прогресс интервенционных технологий в последние годы, успешность чрескожных реканализаций ХОКА составляет от 47 до 80 % (в среднем 67 %) [11]. Наиболее частой причиной неудач при реканализации ХОКА является непроведение проводника интралюминально в дистальное русло. Дополнительную проблему создает неоптимальная антеградная визуализация дистального русла. Гистологические исследования выявили, что концентрация богатой коллагеном фиброзной ткани особенно высока в проксимальной части окклюзии и более низка в дистальной [6,9,10]. Кроме того, дистальная культя чаще, чем проксимальная, имеет сужающуюся (tapered) форму, более благоприятную для проводниковой пенетрации. С учетом вышеизложенного, с 2003-2004 годов усилиями главным образом японских операторов стали активно развиваться различные методики ретроградной (билатеральной) реканализации ХОКА [7]. Технология была усовершенствована, появились разнообразные стратегии на основе билатерального доступа, такие как: киссинг-проводник, проводник-ориентир, прямая и обратная CART методика, «ретроградное проведение в истинный просвет проксимальной культи» [8].
Целью настоящего исследования явился анализ ангиографических и клинических результатов реканализации ХОКА билатеральным способом.
Материалы и методы
В Саратовском НИИ кардиологии билатеральные вмешательства при ХОКА были выполнены 27 пациентам. Мужчин 21, женщин 6. Средний возраст 56±5 лет.
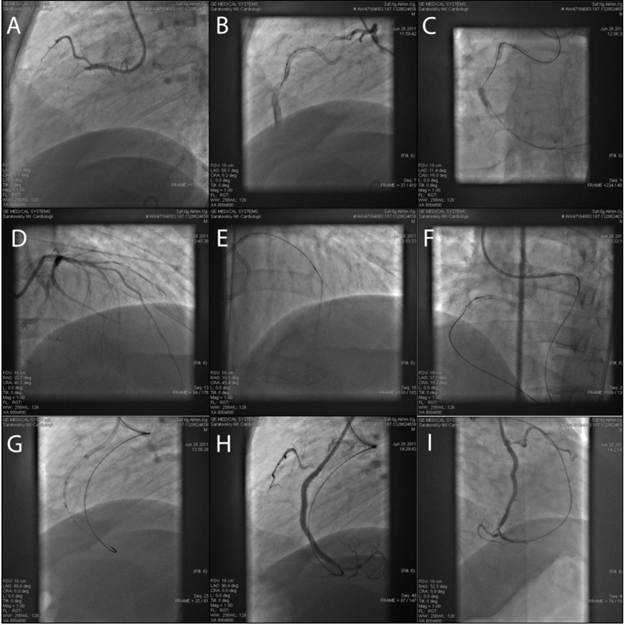
Показания к ретроградному вмешательству у всех больных определялись на основе ангиографических характеристик хронической окклюзии, неблагоприятных для проведения антеградной реканализации, таких как: протяженная окклюзия (более 20 мм) с плохой антеградной визуализацией дистального русла, наличие неоптимальных условий в области проксимальной части окклюзии (извитость сосуда, развитая боковая ветвь, отсутствие благоприятной культи окклюзированного сосуда, наличие мостовидных коллатералей), а также невозможность создания достаточного упора для пенетрации проксимально расположенной окклюзии. Обязательным условием являлось наличие хорошо развитой системы коллатералей из контра- ипсилатеральной артерии, одна или несколько из которых непрерывно прослеживались до дистального русла закрытой артерии и имели достаточный диаметр. Нескольким пациентам предварительно было выполнено стентирование стенозированной донорской артерии с целью минимизации вероятности ее тромбоза и ишемических осложнений. Баллонная дилатация коллатералей не применялась. При планировании вмешательства первичную попытку антеградной реканализации было решено провести у 18 пациентов. Из них 10 пациентам после неудачи антеградной попытки в дальнейшем единовременно проводилась попытка ретроградной реканализации (рисунок 1). У 8 пациентов вторичная попытка была отсрочена на 20-30 суток по причине высокого или предельного расхода контрастного вещества и/или высокой или предельной лучевой нагрузки. 12 пациентам были выставлены показания к первично ретроградному вмешательству.
Все пациенты получали стандартную антикоагулянтную и дезагрегантную терапию.
Локализация хронической окклюзии: правая коронарная артерия (17 пациентов), передняя нисходящая артерия (9), огибающая артерия (1). Во всех случаях поражение располагалось в проксимальном и среднем сегментах, протяженность его составляла от 15 до 30 мм. Артерией-донором коллатералей являлась:
Таблица 1. Локализация ХОКА и пути коллатерализации
Передняя межжелудочковая артерия
Правая коронарная артерия
Передняя межжелудочковая артерия
Правая коронарная артерия
Для ретроградного доступа наиболее часто использовались септальные коллатерали (24). Также использовались апикальные (2), задне-боковые эпикардиальные коллатерали (1) (табл. 2).
Таблица 2. Выбор коллатералей при выполнении реканализации ХОКА билатеральным способом
Количество процедур (N=27)
Результаты
Провести ретроградный проводник в дистальное русло удалось в 19 наблюдениях. Далее применялись различные стратегии (табл. 3). Прямая и обратная CART-методика выполнялась наиболее часто (9). В 6 наблюдениях было возможно выполнить технику киссинг-проводников. У 4 больных при наличии развитой боковой ветви в проксимальной части бляшки, невозможности создания адекватного упора для проведения антеградного баллона, выполнено ретроградное проведение проводника в истинный просвет проксимальной культи. В дальнейшем для проведения антеградного баллона применялась техника анкерного баллона (3), у 2 пациентов при невозможности заведения антеградного проводника выполнен захват и выведение ретроградного проводника 300 см через антеградный проводниковый катетер.
Таблица 3. Выбор методики реканализации из билатерального доступа
Количество процедур (N=19)
Прямая и обратная CART-методика
Ретроградное проведение проводника в истинный просвет проксимальной культи
Процедуру завершали баллонной ангиопластикой окклюзии и имплантацией стента с лекарственным покрытием. Ангиографический и клинический успех достигнут у всех 19 пациентов. При этом у 16 пациентов полностью отсутствовали клинические и объективные признаки стенокардии. У 3 больных отмечено снижение стенокардии на 2 функциональных класса, сохранялись объективные признаки ишемии миокарда.
У 8 пациентов проведение ретроградного проводника оказалось неуспешным (табл. 4). Всем им ранее выполнялись попытки антеградной реканализации. Процедура была прекращена у 4 больных по причине выраженного спазма коллатерального русла, сопровождавшегося ишемическими изменениями на ЭКГ, нарушениями ритма. Изменения были обратимы и после удаления проводника и микрокатетера купировались полностью. У 1 пациента произошла перфорация септальной артерии с формированием интрамуральной гематомы. У 3 пациентов процедура была прекращена за длительностью, с учетом количества израсходованного контрастного вещества, при явлениях спазма коллатералей, препятствующего проведению проводника, ригидного к селективному введению нитропрепаратов. Таким образом, сосудистый спазм стал причиной 7 неудач.
Таблица 4. Причины завершения вмешательства при неудачной попытке реканализации окклюзии билатеральным способом
Перфорация септальной коллатерали
Высокий или предельный расход контрастного вещества и/или высокая или предельная лучевая нагрузка
Обсуждение
Остается открытым вопрос, следует ли проводить попытку эндоваскулярного лечения пациентам с хроническими окклюзиями, не поддающимися антеградной реканализации, или безопаснее рекомендовать операцию коронарного шунтирования. С одной стороны, эндоваскулярные технологии претерпели значительную эволюцию за последние годы, и их возможности вплотную приблизились к возможностям открытого хирургического лечения. В связи с этим в поле зрения эндоваскулярных хирургов попадают все более сложные в лечении коронарные окклюзии. Вместе с тем более агрессивные методики ассоциированы с более высоким риском фатальных осложнений. Ретроградные вмешательства при хронических коронарных окклюзиях потенциально опасны не только для целевой окклюзированной артерии с точки зрения перфорации, опасных диссекций, но и для артерии-донора коллатералей. Нарушение коллатерального кровотока может привести к ишемическим осложнениям [4]. Не стоит забывать о длительности процедуры, повышенном расходе контрастного вещества, лучевой нагрузке [5,8]. Поэтому авторы часто говорят о необходимости большого опыта эндоваскулярных вмешательств для выполнения таких процедур. Кроме того, для полноты оценки эффективности методики не хватает исследований на больших группах пациентов, существующие источники ограничены лишь ретроспективными обзорами на малых группах больных [8].
Вместе с тем существует и логичное обоснование для попытки ретроградной реканализации. Прежде всего, не всякая хроническая коронарная окклюзия при однососудистом поражении подлежит коронарному шунтированию (редко предлагается оперативное лечение при изолированной окклюзии правой коронарной артерии). Однако, по данным нерандомизированных исследований, реканализация любой хронической окклюзии, даже при наличии крупноочагового инфаркта, повышает качество жизни пациентов (снижение функционального класса стенокардии, повышение толерантности к физическим нагрузкам, повышение фракции выброса и улучшение локальной сократимости при эхокардиографии), а также улучшает показатели выживаемости в отдаленном периоде [5,12]. Кроме того, существует неподтвержденная гипотеза, согласно которой реканализованная коронарная артерия может в дальнейшем сама стать донором коллатералей при прогрессировании атеросклеротического процесса в бассейне другой артерии. Сопутствующая патология, препятствующая проведению коронарного шунтирования, возраст, отказ пациента от кардиохирургического лечения также позволяют сделать выбор в пользу малоинвазивного лечения.
Наш опыт проведения ретроградных вмешательств позволил выделить несколько методологических закономерностей. Антеградная попытка реканализации предпринималась при малейшей вероятности ее успеха. Ретроградный способ избирался при исчерпании всех других методик. Вместе с тем 12 пациентам была первично избрана методика ретроградной реканализации из-за сочетания ряда неблагоприятных ангиографических условий (проксимальная, неоптимальной формы культя или ее отсутствие, развитая боковая ветвь в месте проксимальной культи окклюзии), делающих невозможной антеградную попытку.
При проведении проводника в большинстве случаев использовались септальные коллатерали, что было связано с меньшим риском кровотечения в полость перикарда и развития тампонады сердца в случае перфорации коллатерали. При повреждении септальной коллатерали у одного пациента образовался небольших размеров экстравазат (интрамуральная гематома), не повлекший никаких ишемических последствий. Кроме того, эпикардиальные коллатерали часто были недостаточно развиты, что делало их непригодными для проведения инструментов. В сравнении с апикальными коллатералями, септальный доступ был связан с лучшей визуализацией и управляемостью инструментария. При планировании вмешательства предпочтение отдавалось лишь крупным, визуализируемым коллатералям СС2, что было обусловлено меньшей вероятностью спазма, ведущего к невозможности проведения проводника по коллатерали.
Выбор методики ретроградной реканализации зависел в основном от ангиографической характеристики окклюзии. Предпочтение отдавалось методике ретроградного проведения проводника в истинный просвет проксимального сосудистого русла с дальнейшим проведением в антеградный проводниковый катетер и созданием петли, как наиболее безопасной. При невозможности проведения проводника в истинное русло применяли прямую и обратную CART-методику. Также в таких случаях, особенно при выраженной извитости сосуда, применяли технику киссинг-проводников.
Что касается осложнений, то наиболее частым препятствием для проведения процедуры был спазм коллатералей, ригидный к селективному введению нитропрепаратов.
Выводы
1. Билатеральный способ реканализации ХОКА позволяет добиться более высокой ангиографической и клинической эффективности эндоваскулярных вмешательств за счет расширения показаний к последним.
2. Реканализации хронических коронарных окклюзий билатеральным способом являются технически сложными вмешательствами, сопряженными с повышенным риском осложнений. Однако применение данной методики вполне оправдано при невозможности антеградного доступа, высоком анестезиологическом риске коронарного шунтирования, а также при категорическом отказе пациента от кардиохирургического лечения.
3. Для минимизации количества и тяжести осложнений необходим тщательный отбор пациентов, правильный выбор стратегии и достаточный хирургический опыт.
4. Для развития метода необходимо дальнейшее пополнение методологической базы, проведение рандомизированных исследований по оценке эффективности ретроградных вмешательств на коронарных артериях.
Рецензенты:
Агапов Валерий Владимирович, доктор медицинских наук, главный врач ГУЗ «Областной кардиохирургический центр» Министерства здравоохранения Саратовской области, г. Саратов.
Прелатов Вадим Алексеевич, доктор медицинских наук, профессор, профессор кафедры хирургии ФПК и ППС ГБОУ ВПО «Саратовский государственный медицинский университет им. В. И. Разумовского» Министерства здравоохранения России, г. Саратов.