Окислительные свойства у фтора сильнее выражены чем у хлора
Химия, Биология, подготовка к ГИА и ЕГЭ
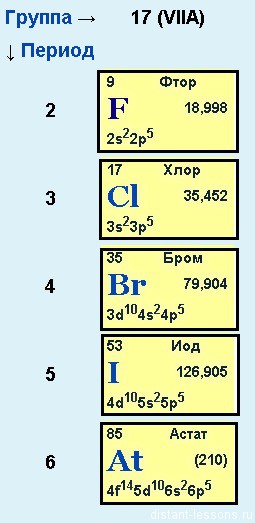
Химические свойства галогенов
или подгруппа фтора
Фтор, хлор, бром, йод и астат
Общее электронное строение:
nS 2 np 5
И, как всегда, все не так просто, как хотелось бы…
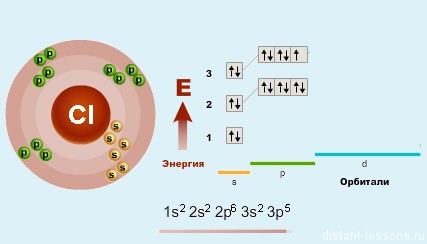
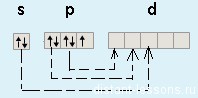
Как уже было замечено в предыдущих лекциях (подгруппа кислорода) у первого элемента — F (фтора) все соответствует общей формуле — на внешнем уровне 7 электронов. А вот у хлора (Cl) — элемента 3-го периода появляется свободная d-орбиталь и возможность распаривать на нее электроны.
Благодаря этой возможности — распаривать электроны p-подуровня на d-подуровень, для всех элементов кроме фтора (. ) возможны степени окисления +1, +3, +5 и +7.
Физические свойства галогенов
Химические свойства галогенов
Фтор — самый активный неметалл, нет веществ, с которыми он не вступал бы в реакции, он НИКОГДА не проявляет положительные степени окисления. Это КОРОЛЬ неметаллов.
1. Взаимодействие с водородом :
F2 + H2 = 2HF — плавиковая кислота
2. Взаимодействие с металлами:
F2 + 2Li = 2LiF — фторид лития (галогениды )
3. Взаимодействие с неметаллами:
F2 + O2 = OF2 (кислород здесь проявляет с.о. +2)
4.Окислительный свойства:
5. Взаимодействие с водой:
раствор HF — плавиковая кислота
Cl2 + H2O ↔ HCl + HClO — оксокислоты хлора
Не смотря на то, что эти реакции написаны для фтора и хлора, естественно, они применимы и к брому, и к йоду (кроме взаимодействия с кислородом — там придется элементы поменять местами).
Как и во всех других группах, химические свойства соединений галогенов подчиняются законам периодичности:
Отдельно мы разберем Кислоты хлора — их немало, и их названия, а тем более называния солей, желательно знать наизусть
Обсуждение: «Химические свойства галогенов»
8. В соединении OF2 степень окисления кислорода:
+2
-2
0
-1
я ответила «1», а он правильным ответом выдал «2»
разве это правильно?
Сверху вниз ослабевают окислительные свойства, а сила кислот в ряду HF – HCl – HBr – HI возрастает, что объясняется уменьшением в этом же направлении энергии связи и увеличением межъядерного расстояния. Или я чего-то не понимаю? Вопрос о силе кислот встречается давольно часто, кто-то может не правильно истолковать ваши слова.
Да, все правильно. Сила кислот — это «легкость » отдачи водорода, те. величина диссоциации — разрыва связи H-Элемент. Чем радиус больше, тем легче связь рвется, поэтому в группе сверху вниз сила кислот HЭ возрастает
Извините, но тогда я не понимаю, почему у вас выделен текст «сила кислот сверху вниз ослабевает»
Опечатка. Спасибо, что обратили внимание. Исправили
Тест с ответами: “Галогены”
1. Среди галогенов, простых веществ, жидким является:
а) бром
б) фтор
в) хлор
2. Электронную формулу внешнего энергетического уровня, общую для всех атомов галогенов, можно записать в виде:
а) ns2np3
б) ns2np5 +
в) ns2np2
3. Наиболее ярко выражены окислительные свойства у:
а) брома
б) хлора
в) фтора +
4. С какими из перечисленных веществ хлор не взаимодействует:
а) раствором хлорида натрия +
б) раствором щелочи
в) раствором бромида натрия
5. Наиболее сильной из кислот является:
а) НСlО3
б) НСlО
в) НСlО4 +
6. Раствор фтора в воде получить нельзя, так как:
а) фтор не растворяется в воде
б) фтор разлагает воду +
в) фтор частично растворяется в воде
7. При сливании растворов иодида натрия и нитрата серебра образуется осадок:
а) желтоватого цвета
б) оранжевого цвета
в) желтого цвета +
8. В раствор, полученный при пропускании 11,2 л газообразного хлороводорода в 100 см3 воды, поместили 13 г цинка. Объем выделившегося газа равен (при н. у.):
а) 4,48 л +
б) 22,4 л
в) 11,2 л
9. О фторе нельзя сказать, что он:
а) самый электроотрицательный
б) самый активный
в) самый легкий элемент +
10. Наиболее ярко выражены восстановительные свойства у:
а) фтора
б) иода +
в) хлора
11. Из галогенов как отравляющее вещество в боевых действиях был применен впервые:
а) хлор +
б) бром
в) фтор
12. Степень окисления хлора в соединении Са(ОСl)2:
а) +3
б) +1 +
в) +2
13. Сила галогеноводородных кислот возрастает в этом ряду:
а) НСl, НВr, НI +
б) НI, НСl, НВr
в) НI, НВr, НСl
14. При сливании растворов бромида калия и нитрата серебра образуется осадок:
а) белого цвета
б) оранжевого цвета
в) желтоватого цвета +
15. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна:
а) 16,8 г +
б) 33,6 г
в) 48,8 г
16. Какая из кислот является более сильным электролитом:
а) HF
б) HJ +
в) HCl
17. В какой из газообразных молекул прочность связи выше:
а) HCl
б) HBr
в) (HF)2 +
18. Какой из ионов проявляет только восстановительные свойства:
а) JO3-
б) J- +
в) JO2-
19. Какая из приведенных реакций может протекать в водном растворе:
а) KBr + J2→
б) KCl + Br2→
в) KJ + Br2→ +
20. Какая из кислот более сильный окислитель:
а) HClO2
б) HClO +
в) HClO4
21. Какой из катионов является противоионом для галогенид-ионов при качественном обнаружении хлоридов, бромидов, иодидов:
а) Ag+ +
б) Ba2+
в) Pb2+
22. Плотность по водороду галогеноводорода 40,5. Найдите галоген:
а) NaCl
б) KCl +
в) CaOCl2
23. Галогены реагируют почти со всеми простыми веществами, кроме некоторых:
а) щелочей
б) металлов
в) неметаллов +
24. К галогенам относится:
а) S
б) F +
в) H
25. К галогенам относится:
а) S
б) He
в) Br +
26. К галогенам относится:
а) P
б) At +
в) S
27. Все галогены – неметаллы являются сильными:
а) окислителями +
б) растворителями
в) конденсаторами
28. Галогены имеют такую реакционную способность:
а) среднюю
б) низкую
в) высокую +
29. Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к:
а) иоду +
б) хлору
в) брому
30. В природе эти элементы встречаются в основном в виде:
а) генидов
б) галогенидов +
в) галогеновидов
Галогены окислители
Почему галогены сильные окислители

Общую характеристику галогенов мы обычно начинаем с положения их в периодической системе и со схем строения их атомов:
F 0 • + 9 )—2 )—7 Сl 0 • + 17 )—2 )—8 )—7 Вr 0 • + 35 )—2 )—8 )—18 )—7 J 0 • + 53 )—2 )—8 )—18 )—18 )—7
На основе этих схем делается ряд важных выводов:
1. До устойчивого положения во внешнем слое атомам галогенов не хватает только 1-го электрона. Поэтому в реакциях атомы этих элементов обычно присоединяют по одному электрону — восстанавливаются. Следовательно, группа галогенов в целом является по сравнению с элементами других групп одного и того же периода окислительной группой.
2. Но окислительные свойства у галогенов выражены неодинаково: наиболее энергично присоединяется электрон к атому фтора, потому что расстояние между ядром и внешним слоем электронов, куда принимается восьмой электрон, меньше, чем у атомов остальных галогенов. За фтором в этой последовательности идёт хлор и т. д.
3. Из предшествующего положения становится ясным вывод, что галогены окислители с меньшим атомным весом и порядковым номером вытесняет всех остальных галогенов с большими атомными весами из их соединений с водородом и металлами.