Окисленный липопротеин низкой плотности что это
Холестерин липопротеинов низкой плотности в сыворотке крови
Краткое описание
Подробное описание
Липопротеины низкой плотности образуются из липопротеинов очень низкой плотности в процессе гидролиза последних под действием сначала липопротеинлипазы, а затем печеночной липазы. При этом относительное содержание триглицеридов в частице заметно падает, а холестерина растет. Таким образом, ЛПНП являются завершающим этапом обмена эндогенных (синтезированных в печени) липидов в организме. Они переносят в организме холестерин, а также триглицериды, каротиноиды, витамин Е и некоторые другие липофильные компоненты.
Исследование ЛПНП-ХС осуществляют с целью фенотипирования гиперлипопротеинемии или дислипопротеинемий.
Возможные причины повышения уровня ХС ЛПНП:
Пониженный уровень ХС ЛПНП не используется в диагностике из-за низкой специфичности. Тем не менее его причинами могут быть:
-наследственная гипохолестеролемия,
-тяжелое заболевание печени,
-онкологические заболевания костного мозга,
-повышение функции щитовидной железы (гипертиреоз),
-воспалительные заболевания суставов,
-B12- или фолиеводефицитная анемия,
-распространенные ожоги,
-острые заболевания, острые инфекции,
-хроническая обструктивная болезнь легких.
Важные замечания:
-Липидограмму необходимо сдавать, когда человек относительно здоров. После острого заболевания, инфаркта, хирургической операции следует подождать перед измерением холестерола как минимум 6 недель.
-ЛПНП, как правило, рассчитывают по следующей формуле: ХС ЛПНП = общий ХС – (ХС ЛПВП – ТГ (триглицериды)/2,2).
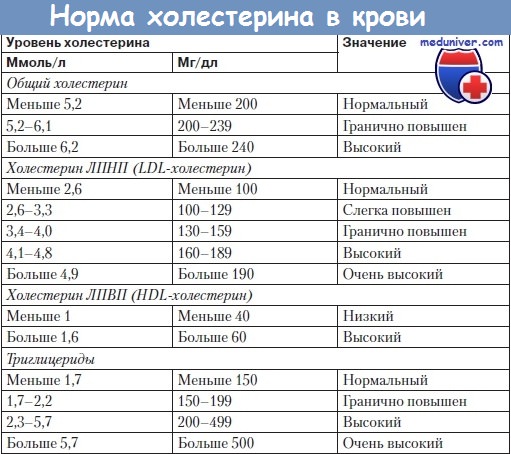
-В США липиды измеряются в миллиграммах на децилитр, в России и в Европе – в миллимолях на литр. Пересчет осуществляется по формуле ХС (мг/дл) = ХС (ммоль/л) × 38,5 или ХС (ммоль/л) = ХС (мг/дл) х 0,0259.
-ХС ЛПНП обычно рассчитывают, исходя из результатов других анализов, входящих в липидограмму: общего холестерола, ХС ЛПВП и триглицеридов – еще одного вида липидов, входящих в состав липопротеинов. Чаще достигается достаточно точный показатель, однако если уровень триглицеридов значительно повышен (> 10 ммоль/л) или перед сдачей анализа человек употребил много жирной пищи, результат может быть не вполне корректным. В этом случае ЛПНП измеряют напрямую.
Концентрация холестерола время от времени может изменяться, это нормально. Единичное измерение не всегда отражает обычный уровень, поэтому иногда может потребоваться пересдать анализ через 1-3 месяца.
Повышают уровень ХС ЛПОНП:
-беременность (липидограмму следует делать по меньшей мере через 6 недель после рождения ребенка),
-длительное голодание,
-сдача крови стоя,
-анаболические стероиды, андрогены, кортикостероиды,
-курение,
-прием пищи, содержащей животные жиры.
Снижают уровень ХС ЛПОНП:
-нахождение в положении лежа,
-аллопуринол, клофибрат, колхицин, противогрибковые препараты, статины, холестирамин, эритромицин, эстрогены,
-интенсивная физическая нагрузка,
-диета с низким содержанием холестерола и насыщенных жирных кислот и, напротив, высоким содержанием полиненасыщенных жирных кислот.
Окисленный липопротеин низкой плотности что это
Нормальное значение этого коэффициента не должно превышать 3, в противном случае риск развития сердечно-сосудистой патологии значительно увеличивается. Из этой же формулы следует, что при значительном увеличении фракции липопротеидов с низкой плотностью относительно высокой повышается вероятность развития атеросклероза.
Показатели нормы холестрина крови
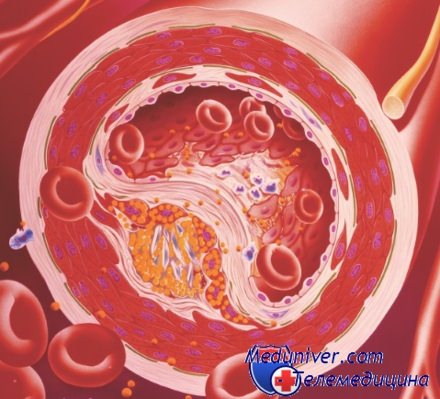
Другой немаловажной причиной повышения уровня ЛПНП выступает нарушение транспортных систем липидов. При различных обменных заболеваниях или наследственной предрасположенности может уменьшаться количество рецепторов к ЛПНП (которые служат для липопротеидов «посадочной площадкой») и за счет этого липопротеиды низкой плотности не могут проникнуть из крови в ткани. Накапливаясь в крови, их концентрация достигает того критического значения, когда они начинают пропитывать стенку кровеносного сосуда с развитием атеросклеротической бляшки.
При биохимическом анализе крови и выяснении липидного профиля человека всегда важно определять соотношения различных фракций липопротеидов между собой. Например, даже значительное повышение общего холестерина или жиров крови, но образованное за счет липопротеидов высокой плотности не представляет угрозы здоровью, но может быть признаком различных заболеваний печени (цирроз, гепатит), почек (гломерулонефрит), поджелудочной железы, эндокринной системы. С другой стороны даже при нормальном общем содержании липидов крови, но нарушенном балансе липопротеидных фракций и высоком коэффициенте атерогенности повышается вероятность развития атеросклероза, гипертонии и других заболеваний сердечно-сосудистой системы.
Учебное видео расшифровки биохимического анализа крови
— Рекомендуем посетить наш раздел с интересными материалами на аналогичные тематики «Профилактика заболеваний»
Окисленный липопротеин низкой плотности что это
Окисленные липопротеины низкой плотности (окЛНП) играют одну из ведущих ролей в атерогенезе. ОкЛНП являются аутоантигенами, индуцирующими локальный иммунный ответ в артериальной стенке и обладающими выраженными проатерогенными свойствами. Согласно современным представлениям, окислительная модификация преобразует ЛНП в форму, захватываемую макрофагами в десятки раз быстрее, чем нативные липопротеины низкой плотности (ЛНП), что способствует прогрессированию атеросклеротического процесса. Уровни окисленных ЛНП могут обладать прогностическим значением в отношении риска сердечно-сосудистых событий.
Риск сердечно-сосудистых заболеваний, атеросклероз.
Oxidized low-density lipoprotein (Ox-LDL).
Твердофазный иммуноферментный анализ.
МЕ/л (международная единица на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
В последние годы было получено достаточно данных в пользу того, что аутоиммунный механизм является первичным патогенетическим процессом, вовлеченным в развитие атеросклероза. Преимущественной мишенью аутоиммунных реакций рассматриваются окисленные липопротеины низкой плотности (oLDL), которые, как полагают, играют критическую роль в развитии и прогрессировании атеросклероза. Ведущий путь химической трансформации липопротеинов – избыточное перекисное окисление липидов, входящих в их состав. В наибольшей степени перекисной модификации подвержены липиды «атерогенной» фракции липопротеинов – ЛПНП.
На сегодняшний день приоритетной считается воспалительная теория атерогенеза, где пусковым механизмом является повреждение эндотелия, сопровождающееся повышением адгезивности и проницаемости и повышением продукции сосудосуживающих и прокоагулянтных факторов. К дисфункции может приводить наличие в организме инфекционных агентов, например вируса герпеса, различных токсических веществ. Высокий уровень инсулина и артериальная гипертензия тоже могут служить причиной развития эндотелиальной дисфункции. Основным фактором, ведущим к повреждению эндотелия, является гиперхолестеринемия. Она приводит к изменениям в структуре эндотелия, что сопровождается увеличением содержания холестерина и соотношения холестерин/фосфолипиды в эндотелиоцитах. В результате нарушается барьерная функция эндотелия и проницаемость его для липопротеинов низкой плотности, что сводится к избыточной инфильтрации интимы этими частицами. Проходя через эндотелий, липопротеины низкой плотности подвергаются окислению, таким образом, в саму интиму проникают в основном окисленные формы липопротеиновых частиц, которые самостоятельно обладают повреждающим воздействием на структурные элементы и эндотелия, и интимы. На следующем этапе формирования атеросклеротического очага происходит инфильтрация интимы циркулирующими моноцит/макрофагами, осуществляющими захват окисленных липопротеинов низкой плотности, с последующей деструкцией. Это способствует накоплению в макрофагах эфиров холестерина и образованию так называемых пенистых клеток, дающих начало липидным полоскам, которые являются первой морфологической стадией атеросклеротического очага. Макрофагами секретируется достаточно большое количество биологически активных веществ, таких как факторы роста (стимулируют миграцию ГМК и фибробластов, пролиферацию этих клеток, синтез соединительной ткани), хемотаксины, митогены. Таким образом, для атеросклеротического процесса характерны фундаментальные закономерности, которые свойственны любому воспалению: действие повреждающего фактора, в качестве которого выступают окисленные липопротеиновые частицы, клеточная инфильтрация, фагоцитоз и формирование соединительной ткани.
Перекисномодифицированные ЛПНП, с одной стороны, подвергаются нерегулируемому захвату макрофагами и гладкомышечными клетками артериальной стенки, который приводит к массивному накоплению в них эфиров холестерина и трансформации таких клеток в «пенистые». Последние быстро погибают, освобождая в межклеточные пространства значительные количества эфиров холестерина и его моногидрата, что инициирует образование атеросклеротических бляшек. С другой стороны, перекисная модификация ЛПНП сопровождается существенным повышением их иммуногенности. Секреция макрофагами и пенистыми клетками факторов роста приводит к пролиферации ГМК и металлопротеиназ, вызывающих деградацию матрикса. По-видимому, это обусловливает прогрессирование атеросклеротического процесса. Образование антител к окисленным ЛПНП, захватываемым клетками артериальной стенки, является дополнительным фактором повреждения артерий. Повышенные уровни окЛНП были обнаружены в циркулирующей крови у пациентов с ишемической болезнью сердца. Кроме того, исследования показали корреляцию между окЛНП и прогрессированием каротидного атеросклероза.
На фоне стабильной стенокардии, фибрилляции предсердий также наблюдается увеличение уровня окисленных липопротеинов. В формировании нестабильных атеросклеротических очагов липидного и воспалительно-эрозивного типа ключевое значение имеет воспаление, активность которого проявляется в повышении содержания воспалительных цитокинов, окисленных липопротеинов и белков. Таким образом, определение уровня окисленных ЛПНП является показательным и информативным, их повышение коррелирует с тяжестью заболевания.
Для чего используется исследование?
Для оценки риска сердечно-сосудистых событий.
Что означают результаты?
Причины повышения уровня окПНП:
Окисленный липопротеин низкой плотности (ox-LDL)
Описание
Существует множество экспериментальных и клинических данных, свидетельствующих о том, что нарушения метаболизма липидов играют важную роль в патогенезе атеросклероза. На сегодняшний день было проведено много исследований, посвященных изучению механизмов, с помощью которых высокие уровни ЛПНП-холестерина влияют на биологию сосудов и вызывают образование атеросклеротического поражения. За последнее десятилетие стало совершенно ясно, что окислительно-модифицированная форма ЛПНП (ox-LDL) более важна, чем нативный ЛПНП при атерогенезе.
Окисленные ЛПНП обнаружены в макрофагах, происходящих из моноцитов, при атеросклеротических поражениях. Окисление ЛПНП является естественным процессом в организме, а окисленный ЛПНП — важным инструментом в изучении эндоцитоза, а также образовании пенистых клеток. В результате многочисленных исследований было доказано, что ЛПНП, главные переносчики холестерина в крови, первыми превращаются в окисленные ЛПНП, так они могут быть дифференцированы рецепторами окисленных ЛПНП на макрофагах. Связывание окисленных ЛПНП с макрофагами — стадия, с помощью которой окисленные ЛПНП вызывают аккумуляцию холестерина в макрофаги, и, таким образом, превращают макрофаги в нагруженные липидами пенистые клетки.
Окисленные ЛПНП активируют клетки эндотелия, продуцирующие MCP-1 (моноцитарный хемотоксический протеин), который привлекает моноциты из просвета сосуда в субэндотелиальное пространство; ускоряют дифференциацию моноцитов в макрофаги; вызывают выделение макрофагами противовоспалительных цитокинов (ИЛ-1, ИЛ-8, ФНО-a), способствующих проникновению моноцитов в субэндотелиальное пространство.
Хороший, плохой, злой холестерин
Хороший, плохой, злой холестерин
Нарушение жирового обмена является основным фактором развития атеросклероза и связанных с ним осложнений (ишемическая болезнь сердца, инфаркт, инсульт, облитерация сосудов нижних конечностей и пр.). При этом наиболее важным фактором повышенного риска атеросклероза является повышение содержания в крови атерогенных липопротеинов.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Довольно подробно о роли холестерина в работе биомембран рассказывается в статье «Липидный фундамент жизни» [12]. — Ред.
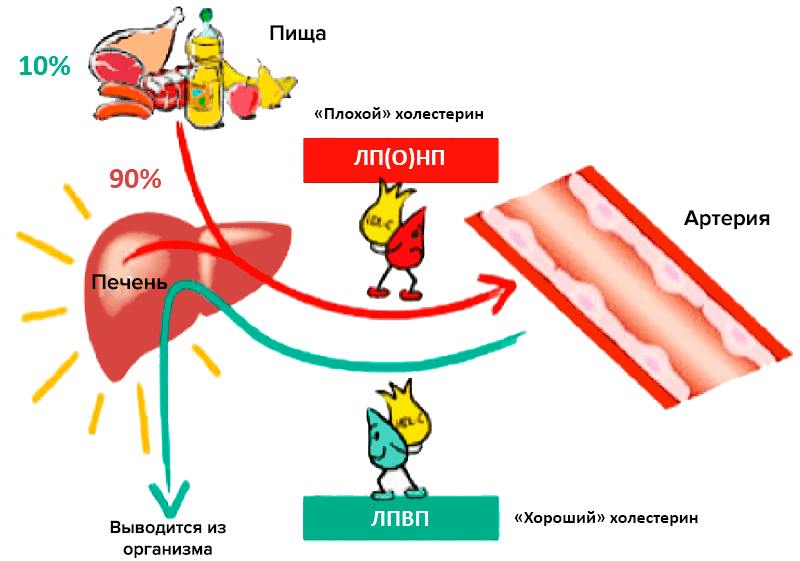
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
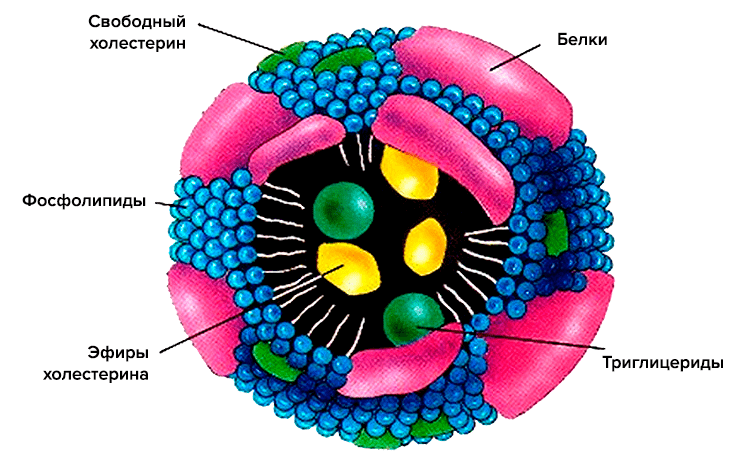
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1–5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2–6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4–14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20–22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25–35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30–80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75–1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
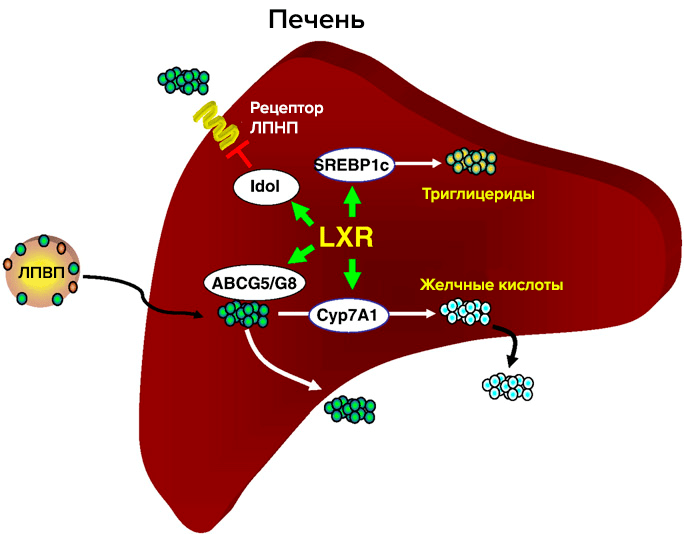
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
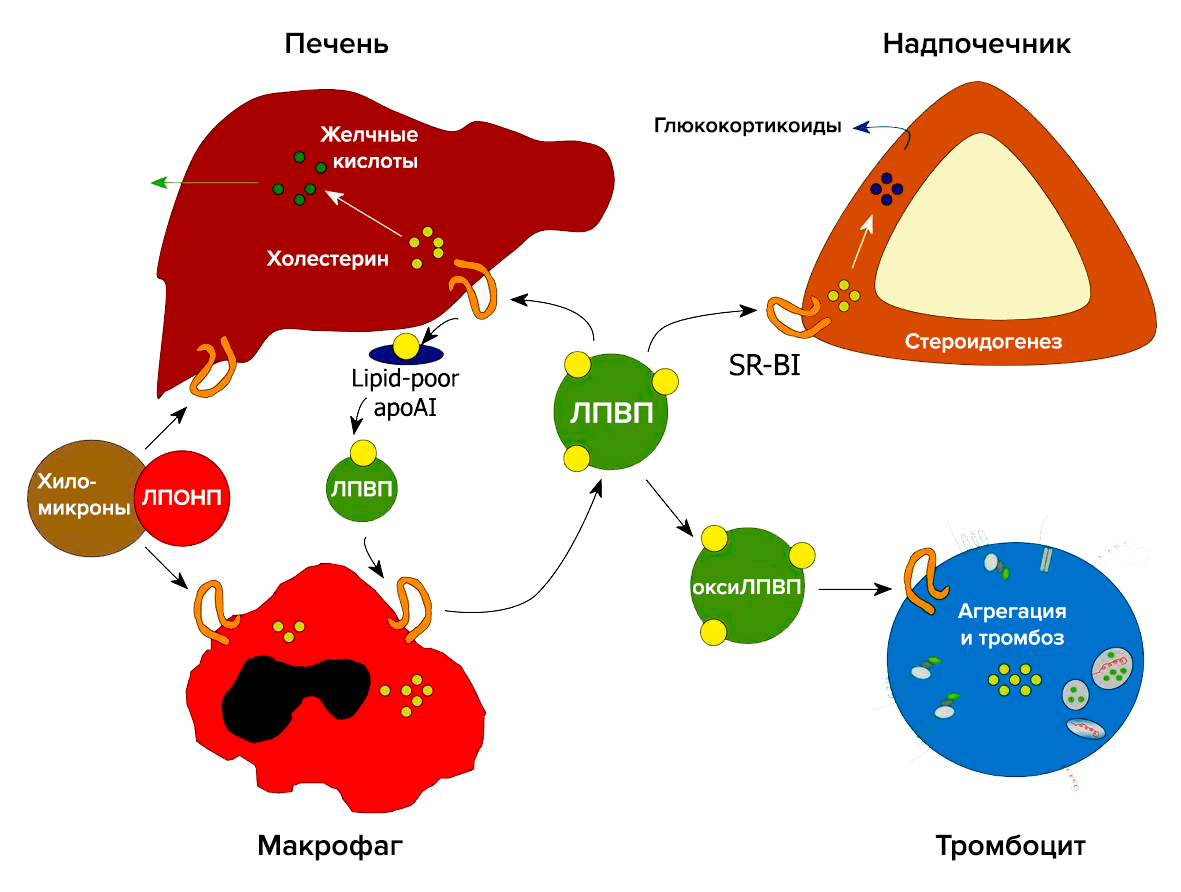
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Восстановление этого баланса искусственным путем (например, на молекулярном уровне с использованием наночастиц) когда-нибудь станет основным способом лечения атеросклероза (см. «Наночастицами — по „плохому“ холестерину!» [13]). — Ред.