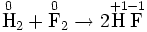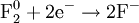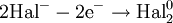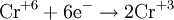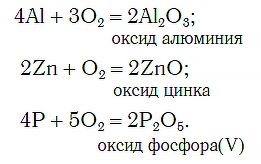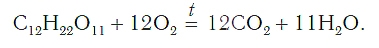Окисление в химии что это
Окисление
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Содержание
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e − ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
Виды окислительно-восстановительных реакций
Примеры
Окислительно-востановительная реакция между водородом и фтором
Разделяется на две полуреакции:Ы
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
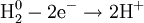

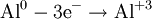
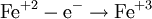
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
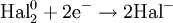
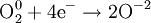

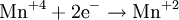
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Мнемонические правила
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
См. также
Ссылки
Полезное
Смотреть что такое «Окисление» в других словарях:
Окисление — Окисление. В области научной терминологии широко и наглядно сказалась огромная словообразующая роль словарного фонда. Из слов, принадлежащих к основному словарному фонду и выражающих очень конкретные бытовые значения, создавались новые… … История слов
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, химическая реакция присоединения кислорода или отнятия водорода. Для ионных процессов общепринята более расширенная формулировка: О. есть увеличение положительной валентности (заряда> или уменьшение отрицательной валентности… … Большая медицинская энциклопедия
окисление — – окисление масла – в работающем двигателе горячее масло постоянно циркулирует и контактирует с воздухом, продуктами полного и неполного сгорания топлива. Кислород воздуха ускоряет окисление масла. EdwART. Словарь автомобильного жаргона, 2009 … Автомобильный словарь
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, химическая реакция, включающая потерю атомом или молекулой одного или более ЭЛЕКТРОНОВ (всегда является частью реакции ОКИСЛЕНИЯ ВОССТАНОВЛЕНИЯ, при которой эти электроны приобретаются другим атомом или молекулой). Раньше этот термин… … Научно-технический энциклопедический словарь
окисление — оксидировка, оксидация, окисание, оксидирование, фотолиз Словарь русских синонимов. окисление сущ., кол во синонимов: 9 • автоокисление (2) • … Словарь синонимов
ОКИСЛЕНИЕ — в химии см. Окислительно восстановительные реакции … Большой Энциклопедический словарь
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, окисления, мн. нет, ср. (хим.). Химический процесс, при котором происходит соединение какого нибудь тела с кислородом. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, я, ср. (спец.). Химическая реакция соединения вещества с кислородом или с другим веществом, способным принимать электроны. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
окисление — Ндп. пережог рубашка Дефект в виде окисленного слоя металла с поверхности отливки, получившийся после отжига отливок из белого чугуна на ковкий чугун. [ГОСТ 19200 80] Недопустимые, нерекомендуемые пережогрубашка Тематики отливки из чугуна и стали … Справочник технического переводчика
окисление — Одна из разновидностей химического выветривания, особенно в горных породах, содержащих железо, в результате которого скальная поверхность приобретает коричневатый или желтоватый цвет и соответственно разрушается … Словарь по географии
окисление — – 1. Процесс взаимодействия с кислородом. 2. Процесс передачи электронов восстановителем в ходе окислительно восстановительной реакции. Словарь по аналитической химии [3] … Химические термины
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
Типичные восстановители – это, как правило:
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители :
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
C 0 + 4H N +5 O3(конц) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
KMnO4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
Схема восстановления хроматов/бихроматов
Соединения хрома VI окисляют:
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании до 150 о С под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Взаимодействие металлов с серной кислотой
Например :
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Cu 0 + 2H2 S +6 O4(конц) = Cu +2 SO4 + S +4 O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S 2- (в зависимости от температуры, степени измельчения и активности металла).
Пероксид водорода
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например :
Урок 20. Окислительные процессы
В уроке 20 «Окислительные процессы» из курса «Химия для чайников» узнаем о процессах с участием кислорода; дадим определения топливу и окислению, а также выясним как эти самые процессы влияют на атмосферу.
Вы хорошо знаете, что человеку и животным необходим воздух (а следовательно, и кислород) для дыхания. Какую же роль играет кислород в организме человека и животных?
Процессы с участием кислорода
В живом организме протекают процессы, в которых сложные вещества пищи — белки, жиры и углеводы — вступают в химические реакции с кислородом. При этом выделяется необходимая для жизнедеятельности энергия. Кислород, необходимый для протекания этих реакций, поступает в организм благодаря процессу дыхания.
Еще одной разновидностью взаимодействия кислорода и сложных веществ является процесс гниения. Вы, наверное, видели, как над кучами гниющей лист вы или каких-либо отходов, особенно по утрам, поднимается пар (рис. 86). Это сложные вещества вступают в реакцию с кислородом воздуха. В результате этой реакции образуется вода и выделяется теплота, благодаря которой вода превращается в пар.
Можно сказать, что гниение и дыхание — это «медленное горение». Эти процессы широко распространены в природе.
Присоединение кислорода как окислительный процесс
Общим для всех рассмотренных процессов с участием кислорода O2 является то, что продуктами реакции в них являются сложные вещества, которые образуются путем присоединения атомов кислорода к атомам других элементов. Например:
Такие реакции называют реакциями окисления.
Окисление — химическая реакция, в результате которой происходит присоединение атомов кислорода к атомам других элементов.
При сгорании сложного вещества сахарозы (это обычный сахар) C12H22O11 в кислороде также протекает окисление. В этом процессе происходит соединение атомов кислорода с атомами углерода и водорода. При этом образуются углекислый газ и вода:
Окисление может протекать с выделением большого количества теплоты и света — тогда это реакция горения, а также в виде «медленного горения» — дыхания и гниения. Во всех этих случаях происходит присоединение атомов кислорода к атомам других химических элементов, которые входили в состав сложного вещества. В результате процессов горения, гниения и дыхания образуются новые сложные вещества (обычно оксиды).
Понятие о топливе
Процессы горения издавна используются для удовлетворения нужд человека в энергии и тепле.
Топливо — это вещество, которое горит с выделением тепловой энергии.
По агрегатному состоянию топливо бывает твердое, жидкое и газообразное.
Запасы топлива могут быть восполнимыми (древесина, древесный уголь) и невосполнимыми (уголь, торф, нефть).
Каменные и бурые угли. Уголь (рис. 87) является древнейшим источником энергии, с которым знакомо человечество. Он представляет собой полезное ископаемое, которое образовалось из растительного материала на протяжении многих миллионов лет. Например, древесина без доступа воздуха превращается в каменный уголь. Основная масса угля состоит из углерода и органических соединений.
Торф. В Беларуси важное значение для бытового отопления и работы небольших предприятий имеет торф (рис. 88). Это топливо, которое образуется без доступа воздуха на низинных болотах из мха сфагнума и другой растительности. В последнее время его спрессовывают с угольной крошкой и получают торфоугольные брикеты, которые также используются как топливо.

Древесина. Как топливо древесина используется преимущественно на бытовом уровне. Основная масса ее применяется как строительный материал, а также идет на химическую переработку.
Нефть. Источник самых разнообразных жидких видов топлива на Земле — нефть (рис. 89). При ее переработке получают такие важные виды горючего, как бензин, керосин, лигроин, мазут. Эти виды топлива используются в автомобилях и тракторах, реактивных авиационных двигателях, а также на тепловых электростанциях и в системах теплообеспечения жилья и предприятий.
Природный газ. Примерно на 90 % состоит из метана CH4. Использовать его в качестве топлива стали только в XX в. Сегодня наша жизнь немыслима без газопроводов (рис. 90), доставляющих «голубое топливо» в наши квартиры, на ТЭС, ТЭЦ, промышленные предприятия.
Охрана атмосферы
В результате деятельности человека происходит загрязнение атмосферы самыми различными веществами, многие из которых ядовиты для человека, животных и растений. Изменение состава атмосферы приводит к ослаблению здоровья населения, снижению продолжительности жизни, распространению болезней. Это особенно заметно в больших городах, где атмосфера загрязняется газовыми выбросами промышленных предприятий и автомобильного транспорта.
В состав почти всех известных традиционных видов топлива входят вещества, при сгорании которых образуются не только СО2 и Н2О. При неполном сгорании топлива может образовываться весьма ядовитый угарный газ (СО). Также очень неблагоприятны для человека продукты сгорания соединений, содержащих атомы серы и азота, которыми являются оксиды серы (SO2) и азота (NO, NO2).
Для улучшения качества бензина в него добавляют соединения свинца. При сгорании такого бензина в окружающую среду выбрасывается большое количество ядовитых для человека веществ, содержащих свинец.
На сжигание различных видов топлива потребляется огромное количество кислорода. Так, в течение 1 ч. полета реактивный самолет (рис. 91) потребляет количество кислорода, вырабатываемое лесом площадью 1 га. за месяц.
Смог (рис. 92) — это туман, смешанный с пылью и сажей и содержащий продукты взаимодействия оксидов серы и азота с водой.
Кислотные дожди. Дождевая вода более кислая, чем обычная, так как в ней содержатся вещества, называемые кислотами. Они образуются при взаимодействии оксидов серы и азота с парами воды.
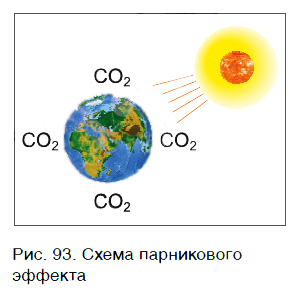
Парниковый эффект (рис. 93) возникает в результате повышения температуры воздуха за счет накопления в атмосфере некоторых газов, называемых парниковыми. Основным парниковым газом является углекислый газ. В результате парникового эффекта повышается температура воздуха в нижних слоях атмосферы, происходит изменение климата, возможны таяния ледников, наводнения.
Поскольку атмосфера у всех народов Земли общая, разные государства предпринимают совместные меры по ее защите от вредных выбросов. Для этого на заводах устанавливаются очистительные установки, совершенствуются системы очистки выхлопных газов автотранспорта, разрабатываются новые экологически чистые производства и виды транспорта.
Уменьшить влияние химических веществ на природу, здоровье людей возможно, только сделав самые тщательные исследования источников и состава ядовитых соединений. Химия как наука позволяет человеку найти пути решения указанных выше проблем охраны атмосферы.
Краткие выводы урока:
Надеюсь урок 20 «Окислительные процессы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.