Окись углерода что это
ОКСИД УГЛЕРОДА
ОКСИД УГЛЕРОДА (окись углерода, угарный газ — CO) — газ без цвета и запаха; почти не поглощается активированным углем; горит синим пламенем с образованием CO2 и выделением тепла; концентрационные пределы взрываемости (КПВ) в смеси с воздухом 12,5—74,2%; смесь CO : O2 = 2 : 1 (по объему) взрывается при зажигании. CO образуется при сгорании органических видов топлива (древесина, уголь, бумага, масла, бензины, газы, взрывчатые вещества и др.) в условиях недостатка О2; при взаимодействии CO2 с раскаленным углем, при конверсии метана в присутствии различных катализаторов.
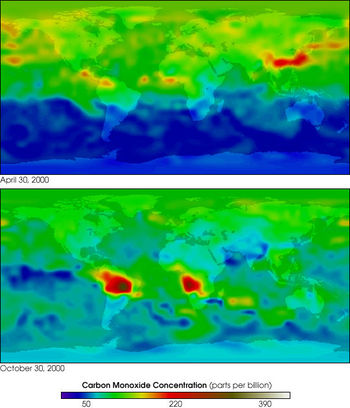
Естественный уровень CO в атмосфере 0,01—0,9 мг/м 3 (в северном полушарии в 3 раза выше); 90% атмосферного CO образуется в результате естественных процессов (вулканические и болотные газы, лесные и степные пожары, жизнедеятельность наземной и океанической флоры и фауны, окисление метана в тропосфере). Сотни миллионов тонн CO поступают в атмосферу ежегодно в результате деятельности человека: автотранспорт, железнодорожный и морской транспорт; неисправность газопроводов и газоаппаратуры; металлургия, химическая индустрия (крекинг-процесс, производство формалина, углеводородов, аммиака, соды, фосгена, метилового спирта, муравьиной и щавелевой кислот, метана и др., производство и переработка синтетических волокон), угледобывающая промышленность (добыча угля и углеподающие трассы, поверхностное окисление угля в шахтах, тление терриконов); производство табака, хлеба; светокопирование; переработка отходов; сжигание топлива в быту.
В промышленности CO получают путем неполного окисления природного газа или газификацией угля и кокса. CO является одним из исходных соединений в органическом синтезе, используется как восстановитель в металлургии, производстве карбонилов, ароматических альдегидов, формамида, гексагидроксибензола, хлорида алюминия, метанола, синтетического бензина, синтола.
В основе биологического действия CO лежит образование карбоксигемоглобина (HbCO), при этом CO занимает место кислорода. В результате синтезируется HbCO вместо оксигемоглобина (HbO2). Сродство гемоглобина (Hb) человека к CO приблизительно в 240 раз выше, чем к О2. HbCO затрудняет подачу кислорода к тканям и высвобождение кислорода, доставленного молекулами Hb в ткани. CO связывается также с мышечным гемоглобином (миоглобином), что приводит к образованию карбоксимиоглобина и существенно влияет на обмен веществ в мышцах (особенно сердечной мышцы). В обычных условиях в организме человека образуется небольшое количество CO и уровень эндогенного HbCO составляет 0—0,7%. Нормой для разных категорий населения принято считать следующие уровни HbCO: беременные женщины — 0,4—2,6%, здоровые дети — 0,5—4,7%, взрослые — 1—5%, пациенты с гемолитической анемией — до 6%, курильщики (1 пачка в день) — 3—7%.
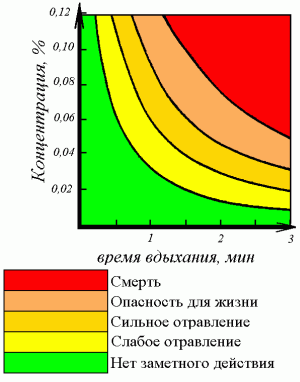
Тяжесть отравления зависит от концентрации и длительности воздействия CO, наличия сопутствующих хронических заболеваний и особенностей состояния здоровья человека, интенсивности дыхания. К группам риска при отравлении угарным газом относятся: беременные женщины, курильщики, лица с повышенной легочной вентиляцией (дети и подростки, лица, связанные с тяжелым физическим трудом или работающие в условиях нагревающего микроклимата, с высокой температурой тела), лица, страдающие заболеваниями сердечно-сосудистой системы (напр., ишемической болезнью сердца, церебральным или общим атеросклерозом), системной гипоксией, анемией, гипертиреозом. Мужчины более чувствительны к отравлению CO, чем женщины.
Концентрация карбоксигемоглобина HbCO в крови
и симптомы отравления угарным газом
Основные клинические симптомы
острого отравления
Содержание
в воздухе, мг/м 3
Снижение скорости психомоторных реакций, иногда — компенсаторное увеличение кровотока к жизненно важным органам. У лиц с выраженной сердечно-сосудистой недостаточностью — боль в груди при физической нагрузке, одышка
Незначительная головная боль, снижение умственной и физической работоспособности, одышка при средней физической нагрузке. Нарушения зрительного восприятия. Может быть смертельно для плода, лиц с тяжелой сердечной недостаточностью
Пульсирующая головная боль, головокружение, раздражительность, эмоциональная нестабильность, расстройство памяти, тошнота, нарушение координации мелких движений рук
Сильная головная боль, слабость, насморк, тошнота, рвота, нарушение зрения, спутанность сознания
Галлюцинации, тяжелая атаксия, тахипноэ
Обмороки или кома, конвульсии, тахикардия, слабый пульс, дыхание типа Чейна-Стокса
Кома, конвульсии, угнетение дыхания и сердечной деятельности. Возможен летальный исход
Глубокая кома со снижением или отсутствием рефлексов, нитевидный пульс, аритмия. Возможен летальный исход
Легкие отравления протекают без потери сознания или с кратковременным обмороком, могут сопровождаться сонливостью, тошнотой, рвотой. Отравления средней тяжести характеризуются потерей сознания различной длительности, после чего сохраняется общая слабость; могут быть провалы памяти, двигательные расстройства, судороги. При тяжелых отравлениях потеря сознания длится более 2 ч, происходят клонические и тонические судороги, непроизвольное мочеиспускание и дефекация.
Первые признаки типичной картины отравления при вдыхании угарного газа в концентрациях до 1000 мг/м 3 появляются уже через 5—10 мин: тяжесть и ощущение сдавливания головы, боль в лобных и височных областях, головокружение, затем присоединяются слабость, чувство страха и жажды, ощущение недостатка воздуха, пульсация височных артерий, тошнота, рвота. В дальнейшем, при сохранении сознания — мышечная слабость, оцепенелость и безучастность (или даже ощущение приятной истомы), из-за чего человек вскоре не может покинуть опасную зону; сонливость, спутанность и потеря сознания. В редких случаях наблюдаются атипические формы отравления — внезапная потеря сознания без предварительных симптомов либо острые психические расстройства во время или через 2—3 недели после воздействия высоких концентраций CO.
Последствиями острого отравления могут быть: продолжительные головные боли и головокружения, обмороки, энцефалопатии, психозы (редко), паркинсонизм; стойкие нарушения функции кишечника и мочевого пузыря; расстройства периферической нервной системы (двигательные, чувствительные и трофические); снижение остроты зрения и слуха, нарушение функции вестибулярного аппарата; трофические расстройства кожи, ногтей, волос; поражение органов дыхания, мышц, суставов; нарушение работы сердца (гипотония, тахикардия, экстрасистолия, стенокардия, инфаркт миокарда); гипертиреоз; поражение печени, надпочечников, почек; снижение иммунитета. Кроме того, у молодых пострадавших — хореоидные гиперкинезы, у пожилых — депрессия, деменция, амнезия, прогрессирующая кахексия.
Повторное воздействие. CO не накапливается в организме. Существует определенная адаптация к хроническому воздействию CO (увеличение концентрации гемоглобина и гематокрита). Хроническое отравление диагностируют по профессиональному анамнезу, клинической картине, содержанию HbCO в крови. Жалобы и симптомы интоксикации многообразны и неспецифичны: физическая и психическая астения, нарушения со стороны кардиореспираторной системы (одышка, сердцебиение, боли в области сердца, аритмия, экстрасистолия, стенокардия, гипотония), нервной системы (красный дермографизм, тремор, вялость рефлексов, невриты, расстройства речи, парезы, энцефалопатии и др.); эритроцитоз и ретикулоцитоз крови позже переходят в анемию; нарушаются все виды обмена. Признаки нарушения др. органов и систем в целом сходны с признаками острого отравления CO.
Профилактика. Локализация источников выделения CO путем герметизации оборудования, организации эффективного воздухообмена. Применение средств индивидуальной защиты — фильтрующих противогазов марки CO или М (время защитного действия при концентрации CO в воздухе 6200 мг/м 3 — 150 или 90 мин соответственно) — допускается лишь при наличии в воздухе 18% кислорода и не более 0,5% углекислого газа. Следует применять также кислородные изолирующие противогазы.
ПДК О. у. в воздухе рабочей зоны — 20 мг/м 3 ; пары; 4-й класс опасности (ГН 2.2.5.686—98); CAS [630-08-0].
О. у. — основной загрязнитель воздуха жилых помещений, опасный фактор пожара. Особенно высокая концентрация CO наблюдается в жилых помещениях с печным отоплением с использованием твердого топлива при нарушении правил эксплуатации печей. Для предохранения образования и проникновения CO в помещение вьюшечную задвижку можно полностью закрывать только тогда, когда дрова целиком прогорят, угли начинают темнеть и над ними уже не появляются голубые огоньки. Если печь топится углем, то для предохранения образования CO окончание топки производят так: убедившись, что стенки печи прогрелись в достаточной степени, полностью очищают топливник от остатков топлива, а затем закрывают вьюшечную задвижку. Остатки топлива дожигают во время следующей топки. У детей, живущих в домах с газовыми плитами, отмечено сокращение объема легких и увеличение числа респираторных заболеваний по сравнению с детьми, живущими в домах с электрическими плитами. Если нет возможности заменить газовую плиту на электрическую, то, по крайней мере, необходимо тщательно следить за исправностью конфорок у плиты, правильно регулировать доступ воздуха, не включать на полную мощность газовую плиту, желательно избегать ставить низко на конфорку кастрюли и сковородки больших размеров. Но в любом случае необходимо использовать кухонные воздухоочистители. Средства защиты: фильтрующие противогазы марки CO, самоспасатели СПИ-20, ПДУ-3 и др.
Углерода окись
Углерода окись
| Монооксид углерода | |
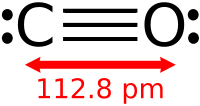 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Монооксид углерода |
| Химическая формула | CO |
| Отн. молек. масса | 28.0101 а. е. м. |
| Молярная масса | 28.0101 г/моль |
| Физические свойства | |
| Плотность вещества | 0,00125 (при 0°C) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −205 °C |
| Температура кипения | −191,5 °C |
| Энтальпия (ст. усл.) | −110,52 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0.0026 г/100 мл |
| Классификация | |
| номер CAS | [630-08-0] |
Монооксид углерода (лат. Carbon monoxide ; другие названия — уга́рный газ, окись углерода, моноокись углерода, оксид углерода (II)) — бесцветный газ без вкуса и запаха. Химическая формула CO.
Содержание
Строение молекулы
Молекула CO, так же, как и изоэлектронная ей молекула азота, имеет тройную связь. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой :C≡O:, причём третья связь образована по донорно-акцепторному механизму, где углерод является акцептором электронной пары, а кислород — донором.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ 2 Oσ 2 zπ 4 x, yσ 2 C. Тройная связь образована σ—связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум σ—связям. Электроны на несвязывающих σC—орбитали и σO—орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
История открытия
Монооксид углерода был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем. То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крукшэнк. Моноксид углерода вне атмосферы Земли впервые был обнаружен бельгийским ученым М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК спектре Солнца.
Монооксид углерода в атмосфере Земли
Различают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Монооксид углерода образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение монооксида углерода за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв монооксид углерода выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % монооксида углерода. В настоящее время в коммунальной сфере этот газ вытеснен гораздо менее токсичным природным газом (низшие представители гомологического ряда алканов — пропан и др.)
Поступление CO от природных и антропогенных источников примерно одинаково.
Монооксид углерода в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года, окисляясь гидроксилом до диоксида углерода.
Получение
Промышленный способ
1. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2. или при восстановлении диоксида углерода раскалённым углём:
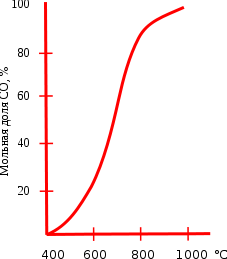
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400°C равновесие практически полностью сдвинуто влево, а при температуре выше 1000°C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому монооксид углерода при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
3. Смеси монооксида углерода с другими веществами получают при пропускании воздуха, водяного пара и т. п. сквозь слой раскалённого кокса, каменного или бурого угля и т. п. (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
Лабораторный способ
1. Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5. Схема реакции:
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
2. Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
Выделяющийся совместно с CO диоксид углерода можно удалить, пропустив смесь через баритовую воду.
3. Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:
Физиологическое действие, токсичность
Опытами на молодых крысах выяснено, что 0,02-процентная концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
Помощь при отравлении монооксидом углерода: пострадавшего следует вынести на свежий воздух, полезно также кратковременное вдыхание паров нашатырного спирта.
TLV (предельная пороговая концентрация, США): 25 ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³
Защита от монооксида углерода
Свойства
Монооксид углерода представляет собой бесцветный газ без вкуса и запаха. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
| Стандартная энергия Гиббса образования ΔG | −137,14 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 197,54 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 29,11 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 0,838 кДж/моль |
| Энтальпия кипения ΔHкип | 6,04 кДж/моль |
| Критическая температура tкрит | −140,23°C |
| Критическое давление Pкрит | 3,499 МПа |
| Критическая плотность ρкрит | 0,301 г/см 3 |
Основными типами химических реакций, в которых участвует монооксид углерода, являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830°C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
до 830°С смещено вправо, выше 830°C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Монооксид углерода горит синим пламенем (температура начала реакции 700°C) на воздухе:
Температура горения CO может достигать 2100°C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42°C, кипения +16°C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200°C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
C переходными металлами образует очень летучие, горючие и ядовитые соединения — карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Как указано выше, монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
Определение монооксида углерода
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
Эта реакция очень чувствительная. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Количественное определение монооксида углерода основано на иодометрической реакции:
Применение
См. также
Литература
Ссылки
Полезное
Смотреть что такое «Углерода окись» в других словарях:
углерода окись — anglies(II) oksidas statusas T sritis chemija formulė CO atitikmenys: angl. carbon monoxide; carbon(II) oxide rus. углерода моноксид; углерода окись; углерода(II) оксид ryšiai: sinonimas – anglies monoksidas … Chemijos terminų aiškinamasis žodynas
Углерода окись — угарный газ CO, оксид С (II), соединение углерода с кислородом; газ без цвета и запаха. У. о. впервые выделил французский врач Ж. де Лассон в 1776 при нагревании древесного угля с окисью цинка. Плотность У. о. 0,00125 г/см3 при 0 °С и… … Большая советская энциклопедия
углерода моноксид — anglies(II) oksidas statusas T sritis chemija formulė CO atitikmenys: angl. carbon monoxide; carbon(II) oxide rus. углерода моноксид; углерода окись; углерода(II) оксид ryšiai: sinonimas – anglies monoksidas … Chemijos terminų aiškinamasis žodynas
углерода(II) оксид — anglies(II) oksidas statusas T sritis chemija formulė CO atitikmenys: angl. carbon monoxide; carbon(II) oxide rus. углерода моноксид; углерода окись; углерода(II) оксид ryšiai: sinonimas – anglies monoksidas … Chemijos terminų aiškinamasis žodynas
Окись этилена — Окись этилена … Википедия
Окись углерода — см. Оксид углерода … Российская энциклопедия по охране труда
ОКИСЬ — ОКИСЬ, окиси, жен. (хим.). Промежуточная степень окисления вещества в отличие от закиси низшей, и перекиси высшей степени окисления. Окись углерода (угарный чад). Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ОКИСЬ ЭТИЛЕНА — Синонимы: оксиран, этиленоксид и др. Свойства. Бесцветный газ, пары огнеопасны. С водой и органическими растворителями смешиваются в любых количествах. В целях предотвращения воспламенения применяют смесь из 10 % окиси этилена и 90 % двуокиси уг … Отечественные ветеринарные препараты
Углерода оксид — (ОКИСЬ) см. Оксид углерода … Российская энциклопедия по охране труда
ОКИСЬ — ОКИСЬ, и, жен. (спец.). Соединение элементов средней степени окисления с кислородом. О. углерода (угарный газ.). О. цинка. | прил. окисный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова