Одиночный лимфоидный фолликул в кишечнике что это
Одиночный лимфоидный фолликул в кишечнике что это
Имеется вариабельность в строении лимфатических узлов из различных анатомических областей. Для лимфатических узлов шеи характерна типичная структура фолликулов, паракортикальной зоны, мозгового вещества и синусов. Подмышечные лимфатические узлы в состоянии покоя имеют вид ободка лимфоидной ткани вокруг жировой ткани в центре.
При злокачественных лимфомах и других лимфопролиферативных состояниях эта жировая ткань заселяется опухолевыми клетками и может полностью исчезнуть. Брыжеечные лимфатические узлы имеют более широкие синусы и обычно менее заметные фолликулы и паракортикальную зону.
Лимфоидные фолликулы отвечают за Т-зависимое образование антител. Они являются местом образования различных антител и переключения изотипов. Первичные фолликулы построены из малых В-клеток, несущих на поверхности IgM и IgD, и фолликулярных дендритных клеток. Если рассечь вторичный фолликул в области полюса, не затрагивая центр размножения, он будет выглядеть как первичный фолликул.
Вторичные фолликулы имеют центр размножения, состоящий из бластных клеток (центробласты) и их потомства (центроциты). Эти клетки проявляют полярность, выражающуюся в формировании темной зоны из бластных клеток (из-за выраженной базофилии цитоплазмы при окрашивании по Гимза) и светлой зоны из центроцитов. В клетках темной зоны выявляются многочисленные митозы и высокая степень пролиферации; во многих клетках могут определяться признаки апоптоза.
Обычно полярность фолликулов лучше видна в лимфоидных фолликулах слизистых оболочек (таких как слизистая миндалины) и лимфатических узлах.
В-клетки центра размножения не экспрессируют BCL-2 и, таким образом, подвержены апоптозу. Допускается, что только В-клетки, обеспечивающие хорошую аффинность антител, реэкспрессируют BCL-2 и выживают. Апоптозу подвергается значительная доля В-клеток фолликулярных центров, которые захватываются макрофагами центра (макрофаги «окрашенных телец»).
Центр размножения окружен мантийной зоной, состоящей из малых В-лимфоцитов с фенотипом, похожим на таковой клеток, обнаруживаемых в первичных фолликулах. В-клетки маргинальной зоны со светлой цитоплазмой могут обнаруживаться кнаружи от мантийной зоны. Часто такие клетки обнаруживаются в брыжеечных узлах, но обычно не заметны в других местах. Лимфоидные фолликулы содержат сеть фолликулярных дендритных клеток (ФДК).
ФДК захватывают и удерживают иммунные комплексы на своей поверхности для презентации В- и Т-клеткам. ФДК имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются в срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Эти отростки также выявляются окрашиванием на CD21 и CD23.
Центры размножения с обратным развитием часто содержат интерстициальное эозино-фильное протеиногеннос вещество. Иногда в центрах роста реактивных лимфатических узлов обнаруживаются плазматические клетки. Лимфоидные фолликулы содержат различное число малых Т-клеток, многие из которых экспрессируют CD3, CD4 и CD57.
Лимфома кишечника
1. Общие сведения
Лимфоциты – один из важнейших иммунных факторов, представляющий собой разновидность белых кровяных телец (лейкоцитов). Основная задача лимфоцитов заключается в запоминании (иммунная память) и уничтожении чужеродных, зараженных, мутировавших клеток, в том числе опухолевых. Повышенный уровень лимфоцитов в крови при отсутствии клинических проявлений инфекции, – или каких-либо иных симптомов, – рассматривается как возможный ранний признак начавшегося онкопроцесса. Однако в некоторых случаях злокачественно увеличивается концентрация самих лимфоцитов; размножаясь хаотично, неудержимо и неадекватно (по отношению к внутренней ситуации в организме), они накапливаются в лимфоузлах и иных органах, что приводит к развитию специфической клинической картины.
Такого рода патология лимфатической системы обозначается собирательным термином «лимфома» и включает группу редких гематологических болезней. Выделяют два гистологически и клинически разных типа лимфом: лимфогранулематоз Ходжкина (составляет не более одного процента в общем объеме регистрируемой онкопатологии) и т.н. неходжкинская лимфома, которая встречается значительно чаще первого типа (около 70% всех злокачественных лимфом).
Лимфома кишечника, таким образом, – одна из разновидностей лимфомы, которая характеризуется патологически быстрым, прогрессирующим накоплением лимфоцитов преимущественно в кишечнике. Со статистической точки зрения, лимфома кишечника встречается реже любых других вариантов локализации, и практически всегда относится к неходжкинскому типу.
2. Причины
Этиопатогенез лимфом, в том числе лимфомы кишечника, к настоящему времени изучен и прояснен недостаточно.
Считается, что предрасполагающим фактором является общая слабость иммунной системы, т.е. больные, например, с ВИЧ/СПИД однозначно попадают в группу риска. Есть также данные о том, что вероятность «запуска» лимфомы значимо повышается при длительном приеме гормонсодержащих препаратов, а также при наличии кишечного паразитоза (отсюда определенная эндемичность заболевания: в беднейших африканских странах его распространенность выше). Кроме того, установлены определенные возрастные и половые тенденции: пик заболеваемости приходится на категорию лиц старше 50 лет, большинство из которых составляют мужчины.
3. Симптомы и диагностика
Клиническая картина формируется многочисленными и, как правило, значительно выраженными симптомами, ни один из которых, однако, не является патогномоничным (однозначно указывающим на данное заболевание). Диагноз «лимфома кишечника» предполагается на основании специфического сочетания таких проявлений, как значительное увеличение и пальпаторная болезненность лимфатических узлов, болевой синдром (обычно усиливающийся в связи с дефекацией и/или приемом пищи), повышение температуры и общее недомогание, разнообразные диспептические явления, гипергидроз. Иногда отмечается примесь крови в каловых массах. Одна из особенностей лимфомы кишечника, отличающая ее от прочих онкозаболеваний, заключается в быстром появлении и нарастании клинически значимых симптомов, что оставляет шанс на раннюю правильную диагностику.
Следует отметить, что лимфомы кишечника широко варьируют в плане агрессивности, темпов роста, конкретной локализации (обычно это тонкий кишечник, реже толстый, очень редко встречается тотальное поражение всего кишечника), гистологических характеристик, а также стадийности в каждом конкретном случае обращения за помощью.
Решающим методом диагностики является биопсия. Некоторые клинические варианты лимфомы кишечника, особенно в запущенных формах, характеризуются крайне неблагоприятным прогнозом, другие (до 50%) считаются излечимыми.
4. Лечение
При установлении и подтверждении диагноза назначается стандартная схема онкологического лечения, как правило, с хирургическим удалением очагов злокачественного скопления лимфоцитов и обязательной последующей химиотерапией. В настоящее время интенсивно и результативно исследуются возможности инновационных методов лечения (иммунотерапия, HIFU-терапия и т.д.), что дает основания для разумного оптимизма в плане перспектив.
Необходимо подчеркнуть, что прогноз при лимфоме кишечника (как и при любых других онкозаболеваниях) критически зависит от своевременности выявления и идентификации патологии, – тем более, что в данном случае ранняя достоверная диагностика вполне возможна. Поэтому при любом сочетании описанных выше симптомов обратиться к врачу следует немедленно.
Одиночный лимфоидный фолликул в кишечнике что это
Риск развития первично-множественных злокачественных новообразований толстой кишки составляет 6% от всех злокачественных новообразований толстой кишки, при этом риск синхронных, как и метахронных составляет по 3% [8].
Доказано, что одной из причин развития злокачественных новообразований является недостаточность иммунной защиты организма, особенно ее Т-клеточного звена. Последняя осуществляет контроль за соматическими клетками, результатом чего является элиминация любых клеток, несущих чужеродную генетическую информацию [9].
Иммунная система толстой кишки представлена организованной лимфоидной тканью, расположенной вдоль поверхности кишки (в собственной пластинке), которая включает изолированные и сгруппированные лимфоидные фолликулы, лимфоидную ткань червеобразного отростка, мезентериальные (брыжеечные) лимфатические узлы. В лимфоидных фолликулах слизистой оболочки толстой кишки содержатся главным образом В-лимфоциты, с некоторым количеством Т-лимфоцитов-хелперов (CD4+) и цитотоксических лимфоцитов (CD8+). В собственной пластике слизистой оболочки толстой кишки, помимо плазматических клеток и Т-лимфоцитов, содержатся тканевые базофилы, макрофаги, В-лимфоциты, NК-клетки, эозинофилы и нейтрофилы [4; 6].
Наиболее активными участниками противоопухолевого иммунитета являются два типа клеток: Т- и NК- лимфоциты [2].
При изучении дифференцировки иммунокомпетентных клеток и механизмов межклеточного взаимодействия, формирующих клеточный и гуморальный иммунитет, была открыта большая группа медиаторов белковой природы, названных цитокинами. Их продукция рассматривается в качестве важнейшей характеристики функциональной активности мононуклеарных клеток (лимфоцитов и моноцитов) [6]. Важное место в осуществлении межклеточных взаимодействий и реализации противоопухолевого ответа иммунной системы принадлежит цитокиновой регуляции, в частности IL-2, IL-4, IL-12, IL-15, IL-23, IFN-g и др. [1].
В настоящее время известно, что многие цитокины (IL-1α, IL-6, IL-8, IL-10, ТNF-α., IL-23, IL-24) могут вырабатываться не только лимфоцитами, но и опухолевыми клетками, следовательно, способны проявлять себя как факторы усиления опухолевой прогрессии, активирующие ангиогинез и миграцию опухолевых клеток. ТNF-α, являясь индуктором апоптоза и неоангиогенеза, может вызывать усиление гибели, например, лимфоцитов, находящихся на данной территории, и распространение туда опухолевых клеток [1].
Исходя из вышеперечисленного можно сделать вывод, что содержание субпопуляций лимфоцитов и уровень цитокинов в периферической крови и тканях играет важную роль в процессах канцеропрогрессии.
Цель исследования. Изучить содержание субпопуляций лимфоцитов в периферической крови и тканях толстой кишки, а также уровень цитокинов в тканях толстой кишки при одиночном и первично-множественном синхронном раке толстой кишки (РТК).
Материалы и методы
Для изучения уровня субпопуляции лимфоцитов и цитокинов нами было проведено исследование периферической крови и ткани кишки у 46 больных одиночным раком толстой кишки и 17 больных первично-множественным синхронным раком толстой кишки (1-4 стадии).
Для изучения субпопуляции лимфоцитов периферической крови бралась кровь из локтевой вены натощак утром, в качестве антикоагулянта использовался гепарин. Для изучения внутритканевого уровня субпопуляций лимфоцитов были исследованы участки ткани кишки у 46 больных одиночным раком толстой кишки и 17 больных первично-множественным синхронным раком толстой кишки (1-4 стадии).
В ходе оперативных вмешательств проводилось удаление опухолевого очага с последующим исследованием ткани опухоли, а также визуально неизмененных участков кишки, отступя 1-3 см (перифокальная зона) и 10 см (линия резекции) от края опухоли. Последнюю считали нормой. Полученные образцы ex temporaе помещали в среду 199 для исследования в лаборатории проточной цитометрии. Аналогичные участки, взятые в формалине, направляли в патоморфологическую лабораторию РНИОИ для верификации диагноза.
Локальный уровень субпопуляций лимфоцитов, выделенных из образцов ткани кишки и периферической крови, определяли иммунофенотипированием на проточном цитометре BDFACSCantoll (USA). Результаты выражали в %.
Статистическую обработку результатов осуществляли с использованием статистических пакетов Statistica 6.0 и Microsoft Excel 2007.
Результаты исследования
Субпопуляционный состав лимфоцитов крови и исследованных образцов тканей больных одиночным и первично-множественным РТК представлен в таблицах 1 и 2.
Пробы крови
Субпопуляции лимфоцитов, %
Морфометрическая характеристика лимфоидных узелков (пейеровых бляшек) тонкой кишки в онтогенезе
АННОТАЦИЯ
Взаимосвязанность во времени и пространстве развития и становления структурно-функциональных единиц тонкой кишки, лимфоидных узелков перовой бляшки является морфологической отражением интеграции ее гидролитически-транспортной иммунной функций.
ABSTRACT
Time and space interconnectedness of development ormation of structurally functional units of the small intestine, lymphoid nodules plaque morphology is a reflection of the integration of its hydrolyticallytransport and immune function.
Ключевый слова: тонкая кишка, лимфоидных узелков, интеграция, морфология, пейровой бляшки,структура, функция, строения, онтогенез, иммунитет, фолликуллы, клетка.
Keywords: small, intestine, lymphoid, nodules, integration, morphology, peyrlovoy, plaque, function, structure, ontogenesis, immunity, follicles, cell.
В этот период лимфоциты и бластные клетки располагаются диффузно, узелки не определяются. Плазмоциды не определяются, макрофаги как светооптические, так и электронной-микроскопически встречаются в единичных случаях. Среди скопления бластных и стромальных клеток встречаются митотический делящиеся. Надо полагать, что в лимфатических узелках число клеток от срока к сроку увеличивается за счет деления диффузно расположенных клеток, а также их миграции из циркулирующей крови.
Таблица 1.
Динамика морфометрических характеристик лимфоидных узелков тонкой кишки белых крыс (М±m, n=6)
Возраст, сутки после рождения
Количество узелков вдоль тонкой кишки
Размеры узелков,
см х 10 1
Количество фолликулов в отдельных узелках
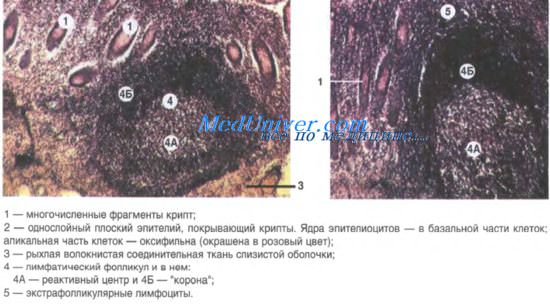
Рисунок 1. Куполообразно выбухающий лимфоидный узелок пейеровой бляшки тонкой кишки через 14 дней после рождения крыс. Окраска: гематоксилин-эозин. Ок. 10, об. 40
Через 14 дней после рождения вдоль тонкой кишки количество лимфоидных узелков доходит до 10,8±2,0. размер каждой из них увеличивается в среднем в 10 раз. Если в предыдущие сроки исследования скопления лимфоцитов представляли собой диффузную ткань, расположенную в собственной пластинке под развивающимися ворсинками и криптами и незначительно выступали в просвет кишки, то к концу второй недели после рождения крыс зона локализации лимфоидного узелка куполообразно начинает выбухать в просвет кишки, не содержит ворсинок и крипт (рис. 1). Выстилающий данный участок слизистой оболочки эпителий содержит единичные бокаловидные клетки, инфильтрирован относительно большим числом лимфоцитов (по сравнению с эпителием ворсинок или крипт). Следует отметить также, что при отсутствии зон, среди скопления лимфоидных клеток впервые появляются отдельные узелки. Они отчетливее различаются в проксимальной части тонкой кишки, хотя аналогичная тенденция проявляется и в дистальной (подвздошной) части тонкой кишки. Одновременно с увеличением лимфоидных бляшек границы между отдельными узелками и зонами не различаются. Однако при этом выявляется рост абсолютного числа лимфоцитов (110±3,0) при сохранении на единицу площади абсолютного количества бластных и ретикулярных клеток. Плазмоциды и макрофаги, по прежнему, единичны. Число митотический делящихся клеток возрастает в среднем в 2,5 раза и становится равно 2,0±0,3 (табл. 1).
Достойно внимания относительно резкое возрастание числа макрофагов в куполе каждого узелка.Плазмоциды во всех зонах единичны. В составе эпителия, ассоциированного с зоной купола, обнаруживаются многочисленные средние и малые лимфоциты. Они располагаются на разных уровнях эпителиального пласта. Базальная мембрана, отделяющая эпителий и купол фолликула тонкая, однако прерывистая. Через неё в обеих направлениях проходят лимфоциты.
Призматические эпителиоциты, выстилающие купол лимфатического узелка, на поверхности микроворсинок гликокаликса не имеют. Их ядра находятся на различных уровнях из-за межэпителиальных лимфоцитов, расположенных базальное или в средней части пласта Базальная мембрана около 100 мкм толщиной, отделяет эпителий от подлежащего купола лимфоидного узелка, однако прерывиста из-за миграции лимфоцитов в обеих направлениях.
Лимфатический узел, независимо от числа составляющего его фолликулов, располагается в основном в собственной пластинке и захватывает часть подслизистой основы, истончая мышечную оболочку, распространяется до серозной оболочки. В связи с этим они и различаются под серозной оболочкой по свободному краю тонкой кишки как самостоятельное мелкобугристое образование.
Независимо от числа фолликулов, которые составляют лимфатический узел, каждый из них имеет округлую или овальную форму, отделен от смежного парафолликулярной зоной. По периферии каждый лимфатический фолликул без резких границ переходит в окружающую рыхлую соединительную ткань собственной пластинки или подслизистой основы.
Лимфобласты крупные округлые клетки с относительно крупным округлым ядром. Реже ядро может иметь бухтообразное углубление. В цитоплазме комплекс Гольджи состоит из 1-2 коротких уплощенных цистерн, единичных везикул. Митохондрии мелкие, единичные. Рибосомы многочисленны, равномерно распределены по узкому ободку цитоплазмы Скапливаясь по 3-4, они образуют группы, отделенные длинноотростчатыми ретикулярными клетками.
В фолликулярной и парафолликулярной зонах малые и средние лимфоциты располагаются более плотно, группами по 5-8 клеток, окруженные теми же анастомозирующими ретикулярными клетками. Купол фолликула существенно отличается от других зон. В этой зоне крупных бластных клеток не видно, однако в этой зоне группами выявляются малые и средние лимфоциты, макрофаги, единичные плазмобласты, тканевые базофилы и эозинофилы.
Рисунок 4. Ретикулярные клетки лимфатического узелка пейеровой бляшки и послойное расположение лимфоидных клеток. Полутонкий срез. Окраска: основной фуксин-метиленовая синяя. Ок. 10, об.20.
Макрофаги в цитоплазме имеют различной величины и формы вторичные лизосомы, миелиноподобные образования.
По сравнению с другими зонами, купол содержит относительно больше лимфатических и кровеносных капилляров, выстланных уплощенным эндотелием.
Таким образом, лимфатические узелки и фолликулы, из которых они состоят, развиваются в основном после рождения и их становление, формирование зон происходит ко времени перехода на дефинитивное питание. Окончательное формирование каждой зон и совершенная интеграция составляющих каждую зону клеток происходит ко времени полового созревания.
Преимущественное поселение активированных В-лимфоцитов в слизистых оболочках и дифференцировка в JgA-продуценты происходит под влиянием Th-2 лимфоцитов, продуцирующих ИЛ-4, ИЛ-5 [10,11].
При условии полноценной активации в зоне купола Т-хелперы активируются и пролиферируют под влиянием выделяемого ими же ИЛ-4, а затем дифференцируются в Тh1 и Th2. Не сбалансированная активация этих клеток чревата развитием аутоиммунных процессов клеточного типа. Th2 выделяют ИЛ-4 и ИЛ-5, обуславливающие развитие гуморального ответа, а также антипаразитарной защиты с участием эозинофилов. Чрезмерное преобладание Тh2-зависимых процессов приводит к развитию аллергии.
Цитотоксические CD8 + Т-клетки мигрируют в собственную пластинку и межэпителиальные участки. Находясь между энтероцитами CD8 + клетки под влиянием бактериальных антигенов, проникающими здесь, они активируются и участвуют в презентации антигена, выработке цитокинов. Не исключается одновременно индукция ими апоптоза энтероцитов, пропускающих антигены
Таким образом, сгруппированные лимфоидные узелки являются важным инструментом диалога макроорганизма с антигенами микроорганизмов и компонентов пищи. Развиваясь и активируясь под их влиянием, они обеспечивают оптимальную взаимосвязь центральных и периферических органов иммунной системы, барьерную функцию на пути внедрения чужеродных антигенов путем активации гуморального и клеточного его звеньев, развития толерантности.
Нодулярная лимфоидная гиперплазия (НЛГ)
Нодулярная лимфоидная гиперплазия (НЛГ) ― довольно редкое доброкачественное заболевание, характеризующееся множественными узелками в слизистой оболочке различных отделов желудочно-кишечной трубки: тонкой и толстой кишки, а также желудка.
Распространенность этого заболевания до конца неизвестна, оно достаточно часто встречается у детей до 10 лет, однако иногда может наблюдаться и у взрослых лиц.
Классификация НЛГ
Выделяют две формы заболевания:
1) Фокальная НЛГ ― представлена отдельными очагами, локализованными чаще всего в терминальном отделе подвздошной кишки, прямой кишке и других участках желудочно-кишечного тракта
2) Диффузная НЛГ ― для этой формы характерно вовлечение больших участков желудочно-кишечной трубки (например, вся тонкая кишка).
Этиопатогенез НЛГ
Патогенетические механизмы развития НЛГ до сих пор остаются неясными. Однако существуют несколько теорий, которые отличаются друг от друга в зависимости от того, имеется ли у пациента ассоциированное иммунодефицитное состояние или нет.
Так, если у пациента подтвержден иммунодефицит, то образование узелков в слизистой оболочке может быть результатом скопления предшественников плазматических клеток (неспособных к полноценному созреванию В-лимфоцитов).
НЛГ при отсутствии нарушений иммунодефицита может быть связана с иммунной стимуляцией лимфоидной ткани кишечника. Эта гипотеза предполагает наличие постоянных раздражителей (триггеров) в просвете желудочно-кишечной трубки, чаще всего инфекционного происхождения. Повторяющаяся стимуляция иммунных клеток может привести к возможной гиперплазии лимфоидных фолликулов. Такой механизм может объяснить нередкую ассоциацию лямблиоза и Helicobacter pylori с НЛГ (см.ниже).
Клинические проявления НЛГ
Зачастую НЛГ не имеет никаких симптомов и является случайной находкой во время эндоскопического исследования желудка, толстой и тонкой кишки. Однако некоторые исследователи связывают НЛГ с желудочно-кишечными симптомами, такими как хроническая диарея, боль в животе, желудочно-кишечное кровотечение (оккультное или явное, из прямой кишки) и кишечная непроходимость (очень редко). У части пациентов может отмечаться потеря белка и снижение массы тела.
Насколько велик вклад НЛГ в возникновение симптомов, до сих пор остается неясным. Является ли это состояние первопричиной жалоб или НЛГ ― всего лишь случайная находка у пациента с желудочно-кишечной симптоматикой? Вопросов больше, чем ответов.
Ассоциированные с НЛГ заболевания и состояния
Достаточно часто по сравнению с другими лицами НЛГ выявляется у пациентов с иммунодефицитами. Так, 20% больных, страдающих общим вариабельным иммунодефицитом (ОВИД), имеют НЛГ. ОВИД ― заболевание, характеризующееся снижением уровней иммуноглобулинов различных субклассов (G, A, M), нарушенным иммунным ответом из-за снижения выработки антител. Пациенты часто страдают рецидивирующими бактериальными инфекциями дыхательных путей, аутоиммунными заболеваниями и имеют повышенный риск развития онкологических патологий. НЛГ при ОВИД обычно генерализованная, с вовлечением всей тонкой кишки.
НЛГ нередко ассоциирована с селективным дефицитом IgA, который выявляется у 1 из 300-700 лиц европеоидной расы. У таких людей отмечается снижение уровня IgA в крови ниже 0,7 г/л при нормальных или даже повышенных уровнях других иммуноглобулинов. Большинство лиц с селективным дефицитом IgA бессимптомны, однако у части из них встречаются рецидивирующие инфекции верхних дыхательных путей, аутоиммунные заболевания, аллергии и желудочно-кишечные патологии (целиакия, НЛГ).
НЛГ может быть ассоциирована с лямблиозом как у лиц с нормальным иммунным ответом, так и с иммунодефицитом. Триада НЛГ + лямблиоз + снижение уровня гамма-глобулинов известна как синдром Германа (англ. Herman’s syndrome).
Инфекция Helicobacter pylori может быть причиной развития НЛГ с вовлечением желудка и 12-перстной кишки.
НЛГ также нередко встречается у лиц с ВИЧ-инфекцией, может быть ассоциирована с семейным аденоматозом толстой кишки и синдромом Гарднера.
Существуют данные о возможной ассоциации синдрома раздраженного кишечника (СРК) с НЛГ. При этом рядом авторов НЛГ рассматривается как проявление малоактивного воспаления в слизистой оболочке толстой кишке у пациентов с СРК.
Осложнения НЛГ
НЛГ ― заболевание доброкачественное, и крайне редко приводит к развитию осложнений. Однако описаны случаи кишечной непроходимости у лиц с распространенным процессом в тонкой кишке, а также кишечных кровотечений..
Известно, что у лиц с НЛГ повышается риск лимфопролиферативных заболеваний (лимфомы), однако точный риск не установлен.
Диагностика НЛГ
Существует два основных метода диагностики НЛГ:
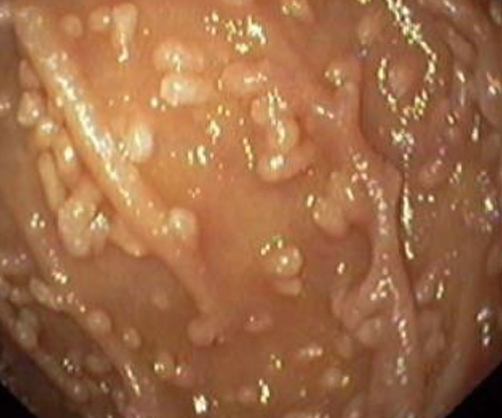
1) Эндоскопический ― выявление узелков различных размеров (2-10 мм, в среднем 5 мм) на слизистой оболочке желудка, тонкой кишки, толстой/прямой кишки. Такие узелки (чаще всего в виде выступающих папул) могут быть обнаружены при гастроскопии (ЭГДС), колоноскопии, энтероскопии или капсульной эндоскопии.
На фото ― НЛГ в 12-перстной кишке.
2) Гистологический метод ― выявление в слизистой оболочке и в поверхностной части подслизистого слоя увеличенных (гиперплазированных) лимфоидных фолликулов, которые обычно формируют группы, и могут практически сливаться между собой.
Дифференциальный диагноз
Дифференциальный диагноз ЛНГ проводится с лимфопролиферативными заболеваниями (лимфома тонкой кишки, желудка). При локализации НЛГ в толстой кишке ее элементы (узелки) могут напоминать аденоматозные полипы.
Важно помнить, что у некоторых пациентов при проведении илеоколоноскопии в подвздошной кишке могут также выявляться лимфоидные фолликулы. В этой зоне концентрация лимфоидных фолликулов максимальная по сравнению с другими отделами кишечной трубки. При этом в отличие от НЛГ узелки (те самые лимфоидные фолликулы) небольших размеров (1-3 мм, реже больше), они располагаются отдельно друг от друга, не сливаясь, между ними видны участки нормальной слизистой. Эти изменения не следует рассматривать как патологию, они ― вариант нормы.
Лечение НЛГ
Сама по себе ЛНГ не требует лечения. В случае, если имеются ассоциированные заболевания (лямблиоз, инфекция Helicobacter pylori), следует провести терапию, направленную на удалению возбудителя.
Прогноз НЛГ
Прогноз НЛГ в целом благоприятный, в большинстве случаев требуется лишь динамическое наблюдение за пациентом.
/Abdukarimova.files/image001.jpg)
/Abdukarimova.files/image004.jpg)