Объясните в чем сущность процесса растворения
Сущность процесса растворения. Термодинамика процесса растворения.



Растворение веществ часто происходит с выделением или поглощением теплоты, иногда с изменением объема. Основоположником теории растворов является Д.И. Менделеев. Сущность процесса растворения сводится к следующему:
· В растворах между компонентами раствора имеется взаимодействие, что приводит к образованию нестойких соединений переменного состава. Эти соединения растворенного вещества и растворителя называется сольватами, если растворитель – вода, то их называют гидратами.
· Раствор является динамической системой, в котором распадающиеся соединения находятся в подвижном равновесии с продуктами распада в соответствии с законом действующих масс.
Процесс растворения можно выразить схемой:
Тепловой эффект, сопровождающий процесс растворения, относящийся к 1 молю растворенного вещества называется молярной теплотой растворения ∆ Н раств.
∆Н раств. = ∆Н 1 + ∆Н 2
∆Н 1> 0 — количество теплоты, затраченной на распределение частиц растворяемого вещества среди молекул растворителя (процесс эндотермический).
∆Н 2 0 —энергия необходимая для разрушения кристаллической решетки и энергия необходимая для разрыва связей между молекулами растворителя (процесс эндотермический).
В зависимоссти от того преобладает первая или вторая составляющие, процесс растворения может быть экзотермический или эндотермический:
если │ ∆Н2 │> │∆ Н1│, процесс экзотермический и ∆Н 0.
Растворение как физико-химический процесс. Растворимость. Типы растворов
Урок 33. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Растворение как физико-химический процесс. Растворимость. Типы растворов»
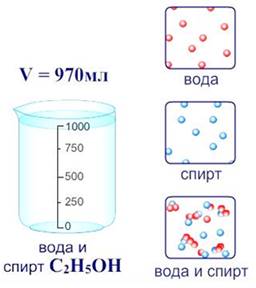
Растворы играют огромную роль в природе, науке и технике. Природная вода также являются раствором, ведь в ней содержатся растворенные вещества. В пресной воде солей мало, а в морской их содержится около 3,5 %. В первичном океане, из которого зародилась жизнь на Земле, содержание солей составляло около 1%. Как писал американский химик Лайнус Полинг: «Именно в этом растворе впервые развились живые организмы, и из этого раствора они получили ионы и молекулы, необходимые для их роста и жизни… С течением времени живые организмы изменялись и развивались, что позволило им покинуть водную среду и перейти на сушу и затем подняться в воздух. Они приобрели эту способность, сохранив в своих организмах водный раствор в виде жидкостей, содержащий необходимый запас ионов и молекул».
В каждой нашей клеточке напоминание о зарождении жизни. По нашим сосудам: артериям, венам и капиллярам тоже течет раствор, где содержание солей около 0,9%. Плазма крови, желудочный сок тоже являются растворами. Все физико-химические процессы, происходящие в живых организмах, протекают тоже в растворах. Природные водные растворы участвуют в почвообразовании и снабжают растения питательными веществами. Многие технологические процессы также протекают в растворах (получение бумаги, красок, металлов, удобрений, продуктов питания).
Растворы в организме человека
Растворы в промышленности
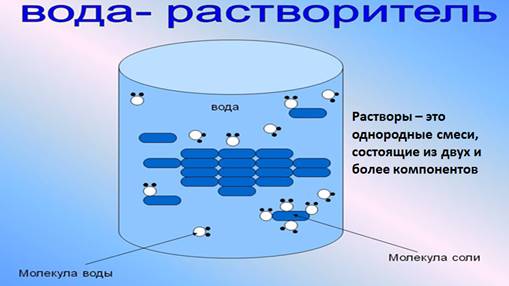
Растворы – это однородные смеси, состоящие из двух и более компонентов.
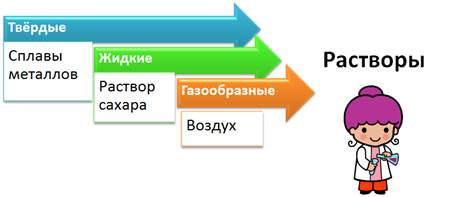
По агрегатному состоянию растворы делят на: твердые (например, сплавы металлов), жидкие (раствор сахара), газообразные (смесь газов – воздух). Наиболее распространены жидкие растворы.
Растворы состоят из растворителя и растворенного вещества (твердого, жидкого или газообразного). Растворителем может быть вода, тогда раствор является водным, а также бензин, эфир, спирт.
Как происходит растворение веществ?
Сторонники физической теории растворов, как Вант-Гофф, Аррениус, Оствальд, считали, что процесс растворения является результатом диффузии, т.е. проникновения молекул растворенного вещества между молекулами воды.
Сторонники химической теории растворов, одним из которых был Д. И. Менделеев, считали, что растворение является химическим взаимодействием растворенного вещества и воды.
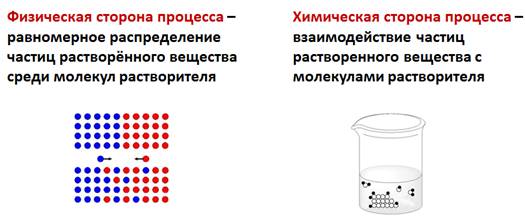
В настоящее время принята физико-химическая теория растворов, которую ещё в 1906 г. предсказывал Д. И. Менделеев. Поэтому растворение является физико-химическим процессом.
Физическая сторона процесса заключается в разрушении кристаллической решетки вещества и равномерном распределении, по принципу диффузии, частиц растворенного вещества среди молекул растворителя. Химическая сторона процесса проявляется во взаимодействии частиц растворенного вещества с молекулами растворителя.
В результате взаимодействия растворенного вещества и воды образуются гидраты. Растворение сопровождается тепловыми эффектами: при растворении серной кислоты воду добавляют к кислоте, из-за сильного разогревания раствора, т.е. теплота выделяется, а при растворении нитрата аммония, хлорида натрия, теплота, наоборот, поглощается.
Кроме гидратов есть еще кристаллогидраты, т.е. это кристаллические вещества, содержащие молекулы воды. Вода, входящая в их состав – кристаллизационная. Примером кристаллогидратов служит медный купорос – CuSO4 · 5H2O. Медный купорос является веществом голубого цвета, а безводный сульфат меди (II) – белый, при растворении в воде, раствор становится голубого цвета.
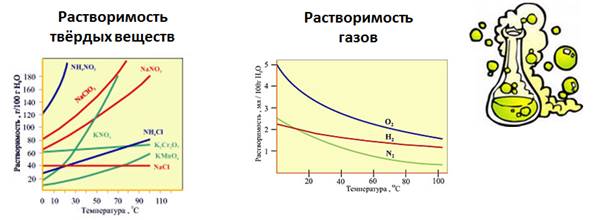
Растворимость веществ в воде зависит от температуры. Растворимость в воде твердых веществ при повышении температуры увеличивается, а газов, наоборот, уменьшается.
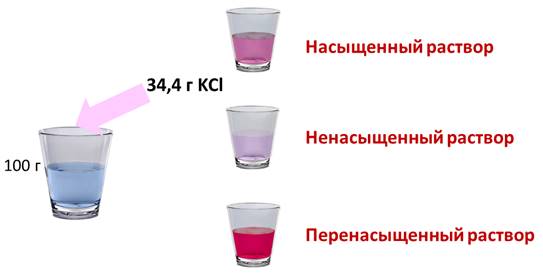
Если растворить в воде хлорид калия, то при комнатной температуре может раствориться только 34,4 г в 100 г воды. Если добавить больше соли, то сколько бы мы не перемешивали, соль не раствориться в воде, т.е. этот раствор уже насыщенный. Раствор, в котором при данной температуре вещество больше не растворяется является насыщенным. Если растворить не 34,4 г соли, а меньше, то раствор будет ненасыщенным. Т.е. раствор, в котором при данной температуре вещество ещё может раствориться, называют ненасыщенным.
При охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадает в осадок, то образуется перенасыщенный раствор. Перенасыщенным называют такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
Перенасыщенный раствор можно легко приготовить. Для этого нужно приготовить насыщенный раствор соли при высокой температуре, затем избыток соли отфильтровать, накрыть сосуд и охладить при комнатной температуре. Этот раствор может храниться довольно долго, но если в него внести стеклянную палочку, на которой будет несколько крупинок этой соли, то начнется ее кристаллизация из раствора. В мертвом море концентрация соли так велика, что помещенные сюда предметы, начинают покрываться кристаллами.
По растворимости вещества делятся на хорошо растворимые, если при комнатной температуре в 100 г воды растворяется более 1 г вещества, если меньше 1 г вещества, то такие вещества являются малорастворимыми, и если вещества растворяется меньше 0,01 г на 100 г воды, то такие вещества относятся к практически нерастворимым. Совершенно нерастворимых веществ нет. Даже атомы серебра чуть-чуть переходят в раствор из изделий, помещенных в воду.
Химическая реакция растворения
Растворение — что это за процесс
Растворы — однородные (гомогенные) системы, в состав которых входят: растворенные вещества, растворитель и (возможно) продукты химической реакции, протекающей между ними.
Особенностью растворенного вещества является равномерное распределение в объеме вещества, которое играет роль растворителя. Для раствора характерно содержание двух и более компонентов.
Растворитель представляет собой вещество, сохраняющее стабильность агрегатного состояния в процессе растворения.
Когда смешивают вещества с идентичными агрегатными состояниями, к примеру, жидкость с жидкостью, газ с газом, твердый материал с твердым, роль растворителя играет компонент с большим содержанием. Процесс, при котором образуется раствор, определяется особенностью взаимодействия частиц растворителя с частицами растворенного вещества и их природой.
Растворение является физико-химическим процессом, в котором можно наблюдать взаимодействие частиц между собой, что приводит к образованию раствора.
Растворение представляет собой результат взаимодействия молекул вещества, играющего роль растворителя, с частицами растворенного вещества. При растворении твердых веществ наблюдают увеличение энтропии. В процессе растворения газообразных веществ энтропия уменьшается. Растворение сопровождается исчезновением межфазной границы, изменением физических свойств раствора, в том числе плотности, вязкости, в некоторых случаях, окраски.
Когда растворитель и растворенное вещество участвуют в химическом взаимодействии, можно наблюдать изменение химических свойств раствора. В качестве примера можно привести растворение газа хлороводорода в воде, результатом которого является образование жидкой соляной кислоты.
Теплота растворения зависит от природы компонентов раствора.
Например: если растворяются кристаллические вещества с растворимостью, увеличивающейся при повышении температуры, то раствор охлаждается. Это объясняется тем, что раствор обладает большей внутренней энергией по сравнению с аналогичными характеристиками кристаллического вещества и растворителя, взятых по отдельности. Как пример, можно рассмотреть кипяток, в котором происходит растворение сахара. В результате раствор значительно охлаждается.
Основные этапы: физическая и химическая стадия
Этапы растворения кристаллических веществ в водной среде:
Классификация растворов в зависимости от механизма растворения:
Физическим растворением называют процесс разрыва и образования лишь межмолекулярных связей, в том числе, водородных.
Физическое растворение можно наблюдать только в случае определенных веществ, выполняющих роль растворителя и растворенного вещества, не вступающих в химические реакции между собой. К примеру, нафталин растворяется в спирте.
Химическое растворение является видом растворения, которое предполагает разрушение исходных химических связей в процессе химического превращения.
Например: химическое растворение протекает при электрической диссоциации растворяемого вещества.
При растворении имеет место следующая закономерность: подобное хорошо растворяется в подобном. Так, в неполярных растворителях хорошо растворяются неполярные вещества. Полярными растворителями целесообразно растворять полярные вещества. Благодаря исследованиям механизмов растворения, природы растворяемых веществ и растворителей, определяют степень растворимости одного вещества в другом.
Признаки химического взаимодействия при растворении
Физические признаки растворения выражаются в виде диффузии. Процесс заключается в распределении частиц растворенного вещества между молекулами вещества, которое является растворителем. В результате «качества» растворенного вещества проявляются в растворе.
Признаками химических явлений являются:
Когда концентрированная серная кислота растворяется в водной среде, температура раствора значительно повышается. Данное явление нашло практическое применение в «химических грелках».
Процесс растворения нитрата аммония в воде сопровождается сильным поглощением теплоты, что объясняет охлаждение раствора. На данном эффекте основан принцип действия гипотермического пакета, который входит в состав автомобильной аптечки для оказания первой медицинской помощи.
Безводный сульфат меди (II) обладает белой окраской. Когда вещество растворяют в воде, раствор окрашивается в голубой цвет.
В современной науке имеет место теория, объединяющая две точки зрения. Ее называют физико-химической теорией растворов. Предпосылки к данной теории были сформулированы еще в 1906 году Д.И. Менделеевым в учебнике «Основы химии».
Факторы растворимости веществ
Растворимость представляет собой свойство вещества растворяться в каком-либо растворителе.
Мера растворимости при заданных условиях определена содержанием данного вещества в насыщенном растворе. Существует условная классификация веществ в зависимости от их способности растворяться:
Когда вещество контактирует с водной средой, можно получить следующий результат:
Коэффициент растворимости определяется, как отношение массы растворенного вещества к массе растворителя (к примеру, 10 г соли на 100 г воды).
В зависимости от того, какой концентрацией обладает растворенное вещество, растворы условно разделяют на:
Ненасыщенные растворы — это те, в которых концентрация растворенного вещества меньше по сравнению с концентрацией в соответствующем насыщенном растворе. Особенность ненасыщенного раствора заключается в возможности при заданных условиях растворить в нем еще определенное количество растворенного вещества.
Насыщенные растворы представляют собой растворы с максимальной концентрацией растворенного вещества при заданных условиях.
В некоторых случаях нет необходимости создавать специальные условия для приготовления насыщенного раствора. Эксперимент можно поставить в домашних условиях.
При смешивании поваренной соли с водой образуется раствор. Когда смесь становится насыщенной, поваренная соль перестает растворяться в воде, так как достигнута ее максимальная концентрация.
Перенасыщенным раствором называют такой раствор, в котором растворенное вещество находится в концентрации, превышающей его концентрацию в насыщенном растворе.
Излишки растворенного вещества достаточно просто выпадают в виде осадка. Для получения перенасыщенного раствора можно, к примеру, охладить насыщенный раствор, компонентами которого являются поваренная соль и вода. В том случае, когда температура снижается, уменьшается растворимость поваренной соли. В результате получают перенасыщенный раствор.
В зависимости от концентрации растворенного вещества растворы бывают:
Концентрированные растворы являются растворами, для которых характерно относительно высокое содержание растворенного вещества.
Разбавленные растворы представляют собой растворы, в которых растворенное вещество характеризуется относительно низким содержанием.
Подобная классификация является условной и не зависит от деления раствора по насыщенности. Разбавленный раствор может являться насыщенным. Концентрированный раствор не во всех случаях можно отнести к насыщенным растворам.
где m р.в. определяет массу растворенного вещества, г;
m р-ля является массой растворителя, г.
Растворимость некоторых веществ в воде при температуре 20 °C:
Растворимость веществ зависит от нескольких факторов:
Абсолютно нерастворимых веществ не существует. Все вещества лишь условно классифицируют на растворимые, малорастворимые и нерастворимые. Даже такие материалы, как серебро и золото, частично растворяются в воде. С другой стороны, растворимость этих металлов столь мала, что ей допустимо пренебречь.
Растворимость, которой характеризуются твердые вещества, определяется структурой этих веществ, то есть типом кристаллической решетки. К примеру, вещества с металлическими кристаллическими решетками, в том числе железо и медь, отличаются малой растворимостью в воде. Вещества, для которых характерна ионная кристаллическая решетка, обычно хорошо растворяются в воде.
Подобное хорошо растворяется в подобном.
Согласно озвученному правилу, вещества, обладающие связями ионного или ковалентного полярного типа, хорошо растворяются в полярных растворителях. В качестве примера можно привести соли, которые характеризуются хорошей растворимостью в воде. С другой стороны, неполярные вещества в распространенных случаях способны хорошо растворяться в неполярных растворителях.
В большинстве своем соли щелочных металлов и аммония хорошо растворяются в водной среде. Высокой степенью растворимости характеризуются практически все нитраты, нитриты, многие галогениды, за исключением галогенидов серебра, ртути, свинца, таллия, и сульфаты, кроме сульфатов щелочноземельных металлов, серебра и свинца. Сульфиды, фосфаты, карбонаты, некоторые другие соли переходных металлов обладают небольшими показателями растворимости.
Растворимость газообразных веществ в жидких средах определяется их природой. К примеру, в 100 объемах воды при температуре 20 °C можно растворить 2 объема водорода, 3 объема кислорода. При аналогичных условиях в 1 доле воды можно растворить 700 объемов аммиака.
Процесс растворения газообразных веществ в воде, как результат гидратации молекул растворяемого газа, протекает с выделением теплоты. В связи с этим, когда температура повышается, растворимость газообразных веществ снижается.
Температурный режим неодинаково влияет на способность твердых веществ растворяться в воде. В распространенных случаях можно наблюдать повышение растворимости при нагреве твердых веществ.
Растворимость твердых и жидких веществ в жидких средах почти не меняется при перепадах давления. Это связано с незначительным изменением объема в процессе растворения. Когда в жидкости растворяют газы, объем системы уменьшается. В связи с этим, при повышении давления увеличивается растворимость газообразных веществ. Общий вид зависимости растворимости газов от давления описан законом У. Генри (Англия, 1803 г.).
Закон У. Генри: растворимость газа при стабильной температуре прямо пропорциональна его давлению над жидкостью.
Рассмотренная закономерность справедлива для небольших давлений в случае газообразных веществ со сравнительно небольшой растворимостью и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителя.
В том случае, когда вода содержит примеси других веществ, например, соли, кислоты и щелочи, газы хуже растворяются в такой среде. Газообразный хлор характеризуется растворимостью в насыщенном водном растворе поваренной соли, которая в 10 раз меньше по сравнению с аналогичным показателем в чистой воде.
Эффект, предполагающий снижение растворимости в присутствии солей, называют высаливанием. Ухудшение свойств растворимости связано с гидратацией солей, которая является причиной уменьшения количества свободных молекул воды. Молекулы воды, образовавшие связи с ионами электролита, не являются растворителем для каких-либо веществ.
Примеры растворения твердых веществ в воде
Данные о растворимости веществ необходимы для решения многих задач по химии, связанных с записью уравнений реакций. Таблица растворимости содержит информацию о зарядах веществ, которую используют для корректной записи реагентов и схем химического взаимодействия. По растворимости в воде определяют способность соли или основания диссоциировать.
Водные соединения, проводящие ток, являются сильными электролитами. Существует и другой тип веществ, которые отличаются тем, что плохо проводят ток. Такие соединения являются слабыми электролитами. Сильные электролиты представляет собой вещества, практически полностью ионизирующиеся в воде. В отличие от них, слабые электролиты проявляют это свойство лишь в малой степени.
Существует несколько видов уравнений:
Краткие ионные уравнения являются сокращенным вариантом полных ионных уравнений. В полном уравнении принято записывать все ионы из которых состоят реагенты и продукты реакции.
В виде отдельных ионов можно записывать только сильные электролиты.
Затем, сократив одинаковые ионы, присутствующие в обоих частях химического уравнения, получают уравнение в кратком виде.
В молекулярных уравнениях все, без исключения, вещества записаны в молекулярном виде.
Большая Энциклопедия Нефти и Газа
Сущность процесса растворения состоит в отделении молекул от поверхности твердого вещества под влиянием их собственного колебательного движения, а также притяжения со стороны молекул растворителя. [1]
Для того чтобы иметь ясное представление о термическом способе удаления растворенных в воде газов, необходимо вспомнить о сущности процесса растворения газов в воде. [5]
Взаимодействие окиси магния с водой приводит [51] к образованию гидроокиси, в этом случае скорость реакции возрастает при увеличении активности окиси и температуры гидратации. Сущность процесса растворения окиси магния в водяном паре окончательно не выяснена. [7]
Если к части полученного осадка прилить хлороводородной кислоты, то он легко переходит в раствор. При добавлении к другой части осадка гидроксида магния небольшого количества хлорида аммония осадок также растворяется. Сущность процессов растворения объясняют с помощью правила произведения растворимости. [9]
Если к части полученного осадка прилить соляной кислоты, то он легко переходит в раствор. При добавлении к другой части осадка гидроокиси магния небольшого количества хлорида аммония осадок также растворяется. Наконец, если к раствору хлорида магния сначала прибавить хлорид аммония, а затем едкое кали, то осадок гидроокиси магния вовсе не выпадет. Сущность процессов растворения объясняют с помощью правила произведения растворимости. [10]
Если к части полученного осадка прилить НС1, то он легко переходит в раствор. При добавлении к другой части Mg ( OH2 небольшого количества NH4CI осадок также растворяется. Сущность процессов растворения успешно объясняют с помощью правила произведения растворимости. [11]