Объясните чем отличается гемоглобин в крови матери и плода
Объясните чем отличается гемоглобин в крови матери и плода
Гемопоэз — процесс, который поддерживает продукцию гемопоэтических клеток крови на протяжении всей жизни. Основным местом гемопоэза у плода является печень, в то время как на протяжении всей постнатальной жизни — костный мозг.
Все гемопоэтические клетки образуются из полипотентных гемопоэтических стволовых клеток, которые являются ключевыми для нормального кровообразования; при их дефиците происходит недостаточность костного мозга, поскольку стволовые клетки требуются для продолжающегося замещения погибающих клеток.
Число полипотентных стволовых клеток остаётся относительно постоянным на протяжении всей жизни, поскольку пул стволовых клеток поддерживается балансом между пролиферацией стволовых клеток и дифференциацией в более зрелые гемопоэтические клетки всех гемопоэтических линий дифференцировки. Гемопоэтические стволовые клетки от здоровых доноров используются для лечения детей с недостаточностью костного мозга (трансплантация стволовых клеток).
Продукция гемоглобина у плода и новорождённого
Наиболее важное различие между гемопоэзом у плода по сравнению с постнатальной жизнью заключается в изменении принципа продукции Hb на каждой стадии развития. Первая формируемая глобиновая цепь — е-глобин, который практически немедленно дополняется а- и у-глобинами, которые экспрессируются с 4-5 нед гестации.
Фетальный Hb (HbF) состоит из 2а- и 2у-цепей (2а2у) и является основным Нb в течение внутриутробной жизни. У него более высокая аффинность к кислороду, чем у Hb взрослого человека (HbA), которая позволяет ему экстрагировать и удерживать кислород, что является преимуществом в относительно гипоксической окружающей среде плода.
Типы Hb у новорождённого, появившегося в срок: HbF, HbA и HbA2. HbF постепенно замещается HbA в течение первого года жизни. HbF и эмбриональный Hb в норме не определяются после периода младенчества, однако они продуцируются при врождённых нарушениях продукции Hb (гемоглобинопатиях) и определение их помогает в диагностике этих заболеваний.
Гематологические показатели при рождении и в первые несколько недель жизни:
• При рождении Hb у младенцев, рождённых в срок, высокий, 14-21,5 г/дл, для того чтобы компенсировать низкую концентрацию кислорода у плода. Hb падает в первые несколько недель в основном за счёт сниженного эритропоэза, уровень которого достигает самого низшего уровня вплоть до 10 г/дл в возрасте 2 мес. Нормальные гематологические показатели при рождении и в детстве представлены в приложении.
• У недоношенных младенцев отмечается более крутое снижение Hb — в среднем до 6,5-9,0 г/дл в первые 4-8 нед календарного возраста.
• Нормальный объём крови при рождении варьирует в зависимости от гестационного возраста. У здоровых младенцев средний объём крови — 80 мл/кг, у недоношенных — 100 мл/кг.
• Запасы железа, фолиевой кислоты и витамина В12 у доношенных и недоношенных младенцев достаточные при рождении. Однако у недоношенных младенцев запасы железа и фолиевой кислоты ниже и снижаются быстрее, что приводит к недостаточности после 2-4 мес, если не осуществляется рекомендованный ежедневный приём.
• Количество лейкоцитов у новорождённых выше, чем у старших детей (10-25х109/л).
• Количество тромбоцитов при рождении находится в пределах нормальных показателей взрослого возраста (150-400х109/л).
Гемоглобин при рождении:
• Концентрация Hb при рождении высокая (>14 г/дл), однако снижается до минимального уровня в возрасте 2 мес.
• HbF постепенно замещается НЬА в младенческом возрасте.
Примечание. Hb — гемоглобин; НbА — гемоглобин взрослого человека; HbF — фетальный гемоглобин.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Объясните чем отличается гемоглобин в крови матери и плода
Возникновение аутотрофных организмов в ходе эволюции жизни на Земле и, следовательно, такого «удобного» окислителя как кислород дало организмам-потребителям прекрасную возможность более эффективного извлечения энергии органических веществ, что привело к возникновению аэробных организмов. Преимуществом аэробного окисления является больший количественный энергетический выход на единицу массы органического субстрата. Появление многоклеточных организмов привело к возникновению проблемы доставки молекулярного кислорода во все структуры и клетки живых систем. Важнейшее приспособление для снабжения клеток кислородом, позволившее преодолеть ограничения, обусловленные низкой растворимостью кислорода в воде, – это появление в процессе эволюции специальных молекул – переносчиков кислорода. У позвоночных роль ключевого из таких транспортеров выполняет гемоглобин.Присутствие гемоглобина в 50 раз увеличивает способность крови переносить кислород. Кроме того, он играет жизненно важную роль в транспорте углекислого газа и ионов водорода [13, 21, 27].
Гемоглобин (от греч. haemo – кровь и лат. globus – шар), красный железосодержащий ферропротеин, являющийся дыхательным пигментом крови человека, позвоночных и некоторых беспозвоночных животных. Относится к сложным белкам – хромопротеидам [21].
Invivoгемоглобин выполняет следующие биологические функции:
• перенос молекулярного кислорода от альвеолярной ткани дыхательных органов к периферическим тканям;
• транспорт углекислого газа и катионов водорода от периферических тканей к легким для последующего выведения из организма.
2. Буферная функция – заключается в сохранении кислотно-основного баланса крови. Буферная система, создаваемая гемоглобином, способствует поддержанию рН крови в нормалном диапазоне.Гемоглобиновый буфер является самым мощным буфером крови (около 75 % от общей буферной емкости крови) [13, 21].
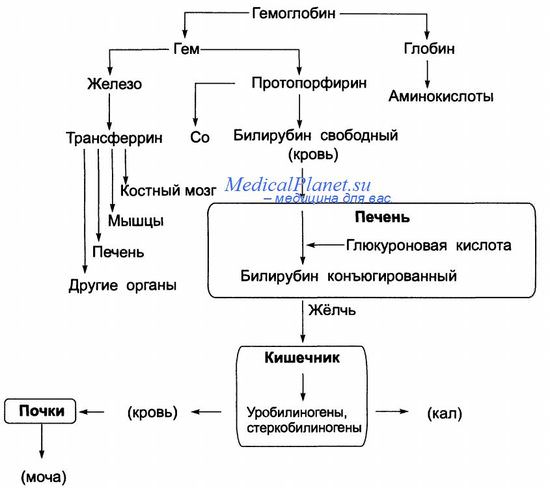
Молекула гемоглобина представлена белковой частью – глобином и небелковой – гемом.
Гем – тетрапиррольная ароматическая структура протопорфиринаIX, в состав которого обязательно входит ион Fe2+.Гем является простетической группойферропротеинов (гемоглобина, миоглобина,цитохромов, пероксидазы, каталазы и др.). Именно гем обеспечивает этим белкам их главные функции: связывание (миоглобин и гемоглобин) и транспорт кислорода (гемоглобин), участие в цепи переноса электронов (цитохромы), восстановление кислорода до воды (цитохромоксидаза), микросомальное окисление (цитохром P450), разложение перекисей (каталаза и пероксидаза) [18, 21].
Гемоглобины представляют собой мультимерные белки. Основные типы гемоглобина имеют значительное структурное сходство: все они – тетрамеры, состоящие из двух парпротомеров: пары идентичных субъединиц, представленных α-цепями, и характерной для каждого типа другой парой. Комплекс, составленный из одного гема и одной полипептидной глобиновой цепи, называется Сведберговой единицей. Следовательно, молекула гемоглобина состоит из четырех Сведберговых единиц [5, 18, 21].
В настоящее время известно более 300 генетически обусловленных типов гемоглобина. Их современная номенклатура принята на Х Международном гематологическом конгрессе в Стокгольме в 1964 году. Типы гемоглобина обозначают буквами латинского алфавита от А до G и S [6].
К наиболее значимым и изученным изотипам гемоглобина человека относятся:
Гемоглобин взрослого – HbA (от латинского adults – взрослый), включающий более сотни подтипов, основные из которых HbА1, HbА2.
Фетальный (или плодовый) гемоглобин – HbF (от латинского, fetus – плод).
Эмбриональный (или примитивный)– HbP (от греческого embryon – зародыш).
У человека и высших животных гемоглобин всех типов является тетрамером, молекула которого построена из 4 субъединиц-протомеров [6, 11].
Фетальный и эмбриональный гемоглобины являются типичными стадиоспецифическими белками, некоторые авторы объединяют их термином антенатальные гемоглобины [7, 17].
Примитивный гемоглобин P имеет синоним эмбриональный – HbE. Название HbP было предложено Allison в 1955 году. Этот тип гемоглобина обладает более высоким, чем HbA1, сродством к кислороду. Он также является тетрамером. Его синтез активируется в раннем эмбриогенезе и протекает в эмбриональном желточном мешке.HbP находится в эритроцитах эмбриона человека с 4-й по 18-ю неделю гестации, в основном между 5-й и 12-й неделями [6, 21].
HbPимеет несколько подтипов, главными из которых являются:Gower-I, Gower-II,Hb-Portland и другими.Все они являются тетрамерами, различающимися структурой только одной из двух пар полипептидных цепей: GowerI – ε4; ГоверII – α2ε2, Hb-Portlandz 2g2 [5, 11, 13, 20].
По физико-химическим свойствам эмбриональный гемоглобин сходен с фетальным гемоглобином, имеет близкие параметры по спектру поглощения, коэффициенту седиментации – 4,5 S, характеризуется высокой щелочной резистентностью, но имеет меньшую электрофоретическую подвижность [6, 18, 21].
Стадиоспецифическая смена различных типов гемоглобина в процессе онтогенеза обусловлена тем, что каждый изотипэтого белка обладает функциональными и физико-химическими особенностями, обеспечивающими адаптивную специфику молекул гемоглобина в разных микроусловиях организма. В результате этого транспорт дыхательных газов выполняет целое семейство системы гемоглобинов, количественное соотношение которых в норме адекватно возрастным особенностям организма. В первые недели эмбрионального развитияактивируется синтез гемоглобинов типа HbP. К концу 12-й недели продукция ε-цепи эмбрионального гемоглобина полностью репрессируется и с 12-й по 24-ю неделю практически весь гемоглобин плода представлен α- и γ-протомерами, т.е. фетальным гемоглобином. Стоит заметить, что HbF обнаруживается у эмбрионов на ранних сроках гестации, но его уровень в этот период значительно ниже, чем HbP [4, 10, 12].
Фетальный гемоглобин начинает активно синтезироваться с 12-й недели гестации, т.е. через 2 недели после формирования печени плода, и к 6 месяцам эмбрионального развития полностью замещает HbP, становясь основным гемоглобином плода. Он составляет 90–95 % общего количества Нb у плода вплоть до 34–36–недель гестации. После 6 месяца гестации постепенно появляется также обыкновенный гемоглобин человека (HbA1). Количество фетального гемоглобинаэкспоненциально снижается параллельно увеличению количества HbA1 и к моменту рождения составляет, по разным литературным источникам, 50–80 % от общего гемоглобина крови. Такое замещение происходит вследствие постепенного снижения синтеза β-цепей глобина и постепенного увеличения продукции β-цепей в ходе эритропоэза в красном костном мозге. В крови взрослого человека на долю HbF приходится не более 1,5 % от общего гемоглобина [8, 10, 12].
После рождения уровеньHbF в крови уменьшается примерно на 3 % в неделю и к шестому месяцу жизни составляет обычно менее 2–3 % общего количества гемоглобина, замещаясь на гемоглобин взрослого (HbA1). Следует отметить, что синтез HbP в постнатальном периоде у здорового человека ингибирована полностью [10, 12].
Изоэлектрическая точка фетального гемоглобина, по данным разныхавторов – 6,9–7,15 [13, 21].
HbF, как и HbP, устойчив к денатурирующему воздействию щелочей, что используется при его клиническом определении [5, 6, 21].
Благодаря большему сродству антенатальных гемоглобинов к кислороду, эритроциты эмбриона и плода могут поглощать и отдавать кислород при более низком парциальном давлении, чем эритроциты взрослого. Осмолярность кислорода в крови плода примерно в 2 раза ниже, чем у взрослого человека, тем, не менее, высокая тропностьHbF к кислороду позволяет обеспечить адекватнуюоксигенациютканей плода в условиях физиологтческой гипоксии. Кроме того, эритроциты, содержащие HbF, обладают повышенной устойчивостью к гемолизу [2, 23, 30].
Количественный анализ антенатальных гемоглобинов в крови имеет большое значение в клинической практике.
Многочисленные исследования свидетельствуют, что уровеньфетального гемоглобина значительно повышается в крови взрослых пациентовс гомозиготной формой β-талассемии, σ-, β-талассемии. У больныхсерповидноклеточной анемией уровень HbFпревышает норму на 30 %, а при наследственном персистированиифетального гемоглобинагемоглобин взрослого практически полностью представлен HbF. Значительное повышение уровня HbF выявлено также у недоношенных детей. Повышение концентрации этого белкарегистрируетсяу взрослых людей при гематологических заболеваниях, острых и хронических интоксикациях, эндокринных нарушениях, сердечно-сосудистой патологии, пароксизмальной ночной гемоглобинурии, наследственных сфероцитозах, аутоиммунных анемиях, несфероцитарных гемолитических и гипопластических анемиях [3, 9, 28].
Рост концентрации HbF в крови беременных женщин является тревожным признаком, указывающим на развитие осложнений – гестозов, угрозу прерывания беременности, преждевременную отслойку плаценты [1, 22].
В литературных источниках последних лет отмечено увеличение уровня фетального гемоглобина при хронических гипоксиях различной этиологии. Повышение уровня HbF в эритроцитах происходит за счет развития адаптивных реакций красной крови в условиях гипоксии и связана с частичной активацией гена g-цепи глобина на фоне напряженного эритропоэза. Установлено повышение концентрации HbF в крови при хронических гипоксиях (в частности, у больных ХИБС и ХОБЛ). Причем, увеличение концентрации этого протеина в кровотоке имеет прямую зависимость от степени декомпенсации кровообращения, возраста пациентов, наличия сочетанной патологии и длительности заболевания [14, 16, 26].
У людей, проживающих в экзогенных условиях хронической гипоксии, а именно: в условиях высокогорья, на Крайнем Севере, в Забайкалье, регистрируется компенсаторно-адаптивное повышение концентрации HbF. Причем, интенсивность его накопления в крови значительно превышает степень образования других изотипов гемоглобина [25, 26].
Литературные данные последних лет показали, что достоверное повышение уровня HbF в крови отмечается при ряде онкогематологической патологии, а именно: при миелопролиферативных заболеваниях (эритремия, сублейкемический миелоз, острый и хронический лимфолейкоз), что свидетельствует о высокой клинико-диагностической роли этого типа гемоглобина как канцероэмбрионального антигена [15, 19].
Достоверное снижение концентрации HbF наблюдается в крови больных с железодефицитной, В12 (фолиево)-дефицитной, гемолитической и постгеморрагической анемиями,при эритробластозах, развивающихся при несовместимости между матерью и плодом. Отмечается снижение содержания фетального гемоглобина у доношенных и недоношенных детей с гемолитической болезнью и у детей с задержкой внутриутробного развития [24, 29].
В крови взрослых пациентов снижение уровня HbF наблюдается при гематологической патологии: тромбоцитопенической пурпуре, лейкозе, сфероцитарной гемолитической анемии, лимфогранулематозе [3, 18].
Сведения о клинико-диагностическом значении эмбрионального гемоглобина в научной литературе крайне скудны. Это объясняется тем фактом, что, по мнению большинства клиницистов, данный белок не представляет прикладной (диагностическо-прогностической) ценности, т.к. активность его гена полностью репрессирована как у детей, так и у взрослых. Кроме того, широкому изучению HbP препятствует методологический фактор: получение препарата этого белка крайне затруднительно из-за сложностей получения биоматериала (HbP синтезируется только в раннем эмбриогенезе, с 5 по 18 гестации), экстрагирования и очистки белка [18, 21].
Тем не менее, в последние годы появились работы, свидетельствующие о несомненной роли этого протеина, как канцероэмбрионального антигена. Показано, что продукция эмбрионального гемоглобина активируется при ряде онкологических заболеваний красной крови, в первую очередь – при хронических миелопролиферативных заболеваниях (ХМПЗ): эритремии, сублейкемическом миелозе, а также острых и хроническихмиелолейкозах [15, 19].
Анемия при беременности – железные аргументы и развеивание мифов
Анемия – одно из самых частых осложнений, возникающих во время беременности. В России этот диагноз ставится каждой третьей беременной женщине. Однако не все, столкнувшись с этим диагнозом понимают, о чём идёт речь и что надо делать, чтобы лечение было максимально эффективным.
Анемия – заболевание, при котором снижается уровень гемоглобина крови, часто при одновременном снижении числа эритроцитов. Основной причиной развития анемии является несоответствие между поступлением железа в организм и его затратами.
Во время беременности затраты на нужды растущего плода обуславливают значительное возрастание потребности в железе. Кроме того, более редкой, но возможной причиной анемии может быть недостаточное поступление фолиевой кислоты или витамина В12.
К факторам риска по развитию железодефицитной анемии во время беременности относятся:
Поскольку главной задачей гемоглобина является доставка кислорода – жизненно важного элемента – ко всем тканям и клеткам женщины и плода, несложно представить какой вред наносит его снижение во время беременности. Однако и после родов вопрос нельзя считать закрытым. Доказано, что низкий уровень гемоглобина ассоциируется со снижением лактации, а так же с развитием анемии у ребенка.
Железодефицитная анемия проявляется слабостью, головокружением, патологической утомляемостью, извращенным восприятием вкусов и запахов, учащенным сердцебиением, отдышкой, головной болью, обмороками. Кожа становится сухой и бледной, а волосы и ногти ломкими.
Ставится диагноз анемии на основании оценки уровня гемоглобина в общем анализе крови. Нижняя граница нормы гемоглобина при беременности – 110 г/л. Однако, прежде чем снижается гемоглобин, происходит истощение запасов железа, что проявляется снижением уровня ферритина сыворотки крови. Это состояние носит название латентный дефицит железа и так же требует коррекции.
Лечение анемии и латентного дефицита железа проводят с помощью препаратов железа, которые чаще всего назначаются в виде таблеток или раствора для приёма внутрь, но иногда применяют растворы для внутривенного введения. Такая необходимость возникает, когда уровень гемоглобина очень низкий или в случае нарушения всасывания железа из желудочно-кишечного тракта.
При диагнозе анемия пациенту важно помнить, что потребление продуктов с высоким содержанием железа поможет лишь поддержать имеющийся уровень гемоглобина, но не сможет повысить его уровень и насытить запасы железа в достаточной степени.
Профилактикой железодефицитной анемии беременных является исследованием запасов железа и уровня гемоглобина на этапе планирования беременности, и при выявлении отклонений от нормы своевременная их коррекция, потребление продуктов с высоким содержанием железа, приём витаминно-минеральных комплексов, содержащих профилактические дозировки железа.
Врач акушер-гинеколог
женской консультации №14
Хиврич Е.Б.
Гемоглобин
Строение гемоглобина
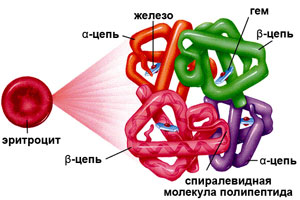
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
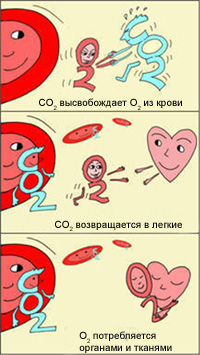
Эффект был описан датским физиологом Христианом Бором http://en.wikipedia.org/wiki/Christian_Bohr (отцом знаменитого физика Нильса Бора).
Христиан Бор заявил, что при большей кислотности (более низкое значение рН, например, в тканях) гемоглобин будет меньше связываться с кислородом, что позволит его отдать.
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.
Анемия у детей
Содержание статьи
Анемией в педиатрии называется состояние (как правило, симптом какой-либо болезни), при котором у детей в крови снижен уровень гемоглобина, по сравнению с нормальными показателями. Обычно эта патология сопровождается снижением эритроцитов – красных кровяных клеток, переносящих гемоглобин.
Гемоглобин – это важнейший железосодержащий белок, функция которого – доставка кислорода к тканям и органам. Поэтому анемия опасна в первую очередь тем, что у детей в таком состоянии весь организм подвергается кислородному голоданию. То, насколько снижен гемоглобин, определяет выраженность и тяжесть клинической картины.
Анемия имеет и другие названия – «малокровие», «болезнь усталой крови».
Второе название связано с тем, что главный симптом патологии – это постоянное ощущение усталости и упадка сил.
Распространенность в мире
Во всем мире анемии подвержено почти 25% населения, наибольшая распространенность – среди детей дошкольного возраста (47,4% или 293 млн). У школьников это состояние выявляется в 25,4% случаев (305 млн). У 9 из 10 детей дошкольного возраста анемия обуславливается дефицитом железа в организме, а у одного (или в 10% случаев) это симптом какой-либо патологии, например лейкемии. Источник:
WHO Global Database on Anaemia Geneva,
World Health Organization, 2008
Нормы содержания гемоглобина в крови для детей до 18 лет
| Возраст ребенка | Норма содержания гемоглобина на единицу крови, г/л |
|---|---|
| 0-2 недели | 125-220 |
| 0,5-1 месяц | 115-180 |
| 1-2 месяца | 90-130 |
| 2 месяца – 0,5 года | 95-140 |
| 0,5-1 год | 105-140 |
| От 1 до 5 лет | 100-140 |
| От 5 до 12 лет | 115-150 |
| Более 12 лет | 115-160 |
Причины появления анемии у детей
Данный диагноз может быть поставлен по различным причинам, среди которых:
Виды анемии у детей
Существует несколько классификаций этого заболевания.
По причине возникновения анемия бывает:
По типу заболевания выделяют следующие его виды:
Заболевание может быть связано с недостаточной выработкой эритроцитов костным мозгом. К этому виду патологии относятся следующие подвиды:
Анемии у детей также разделяются на степени тяжести по содержанию гемоглобина (Hb) в крови: у ребенка может быть легкая форма болезни (110-90 г/л), средняя (90-70 г/л), тяжелая (70-50 г/л), сверхтяжелая (до 50 г/л).
Также у ребенка может быть скрытая анемия, которая напоминает по проявлениям другие формы заболевания, но симптоматика при этом проявляется существенно реже.
Симптомы анемии у детей
Вне зависимости от типа анемии, у ребенка могут быть следующие признаки патологии, особенно при длительном ее течении:
Методы диагностики анемии у детей
Основной метод исследования при подозрении, что у ребенка присутствует анемия, – это лабораторные анализы. Так, в клиническом анализе крови сразу видно снижение уровня гемоглобина – менее 110 г/л, а также Er, ЦП сывороточного железа, концентрации ферритина, содержания витаминов, билирубина, насыщения трансферрина железом.
Иногда для установления точной причины симптоматики нужна биопсия костного мозга с последующим гистологическим исследованием.
Диагностика позволяет установить степень тяжести и форму анемии. По ее результатам ребенку могут потребоваться консультации у узкопрофильных врачей (нефролога, гастроэнтеролога, гинеколога и др.), обследования почек (УЗИ) и органов ЖКТ (УЗИ брюшной полости, ЭГДС).
Лечение анемии у детей
Когда анемия у детей является не самостоятельным заболеванием, а симптомом другой патологии, все меры направляются на лечение первичного очага. В других же случаях первое, что должны делать родители, если у ребенка анемия, – это скорректировать его рацион. Необходимо не только сбалансированное питание, но и правильный режим приема пищи.
Детям старшего возраста рекомендуется употреблять больше говядины, печени, морепродуктов, зелени, бобовых, зеленых овощей и фруктов, овощных и фруктовых соков (свежевыжатых, а не пакетированных).
Если анемией болеет грудной младенец, находящийся на вскармливании материнским молоком, то нужно в первую очередь скорректировать рацион матери – включить в него не только богатые железом продукты, но и препараты железа, поливитаминные комплексы. Не следует затягивать с введением прикорма – мясного пюре, яичного желтка, фруктовых и овощных соков, овощей. Когда ребенок – на искусственном вскармливании, то педиатр должен назначить специальную молочную смесь с повышенным содержанием железа.
Клинические рекомендации для детей при анемии также включают дополнительный сон, достаточные прогулки на свежем воздухе, УФО, массаж, ежедневную гимнастику.
При анемии также проводится медикаментозное лечение, включающее препараты железа, поливитаминные комплексы на срок в среднем 1,5-2,5 месяца или до нормализации у детей клинических показателей крови. Если случай тяжелый, врач может назначить гемотрансфузию (переливание эритроцитарной массы). Источник:
М.В. Эрман
Железодефицитные анемии у детей
// Здоровье – основа человеческого потенциала: проблемы и пути их решения, 2013
Осложнения заболевания
Если анемия у ребенка существует длительное время, то ее последствиями могут быть: выпадение волос, высокая ломкость ногтей. Тяжелая форма патологии может приводить к повышенной кровоточивости (геморрагический синдром), потерям сознания.
Профилактика анемии у детей раннего и старшего возраста
Профилактировать это заболевание можно еще на антенатальном этапе, то есть во время внутриутробного развития плода. Будущая мать должна полноценно питаться, достаточное время проводить на свежем воздухе, принимать витаминно-минеральные комплексы, обязательно содержащие железо.
Когда ребенок рождается, необходимо обеспечить ему грудное вскармливание примерно до 1 года, вовремя вводить прикормы, профилактировать болезни раннего возраста. Важен также правильный уход и режим дня. Если новорожденный относится к группе риска по какому-либо заболеванию, нужны специальные лечебно-профилактические курсы.
Для детей школьного возраста наиболее важен рацион. В нем должно быть как можно больше зеленых фруктов и овощей, содержащих фолиевую кислоту, зерновых продуктов (особенно гречневой крупы). Гречка рекомендуется еще и потому, что содержит много железа. Также для профилактики следует принимать поливитаминные комплексы, в которых содержится фолиевая кислота в сочетании со всеми витаминами группы В.
Источники: