Обструктивный тип мочеиспускания у мужчин что это
Обструктивная уропатия – когда нужно срочно обращаться к врачу
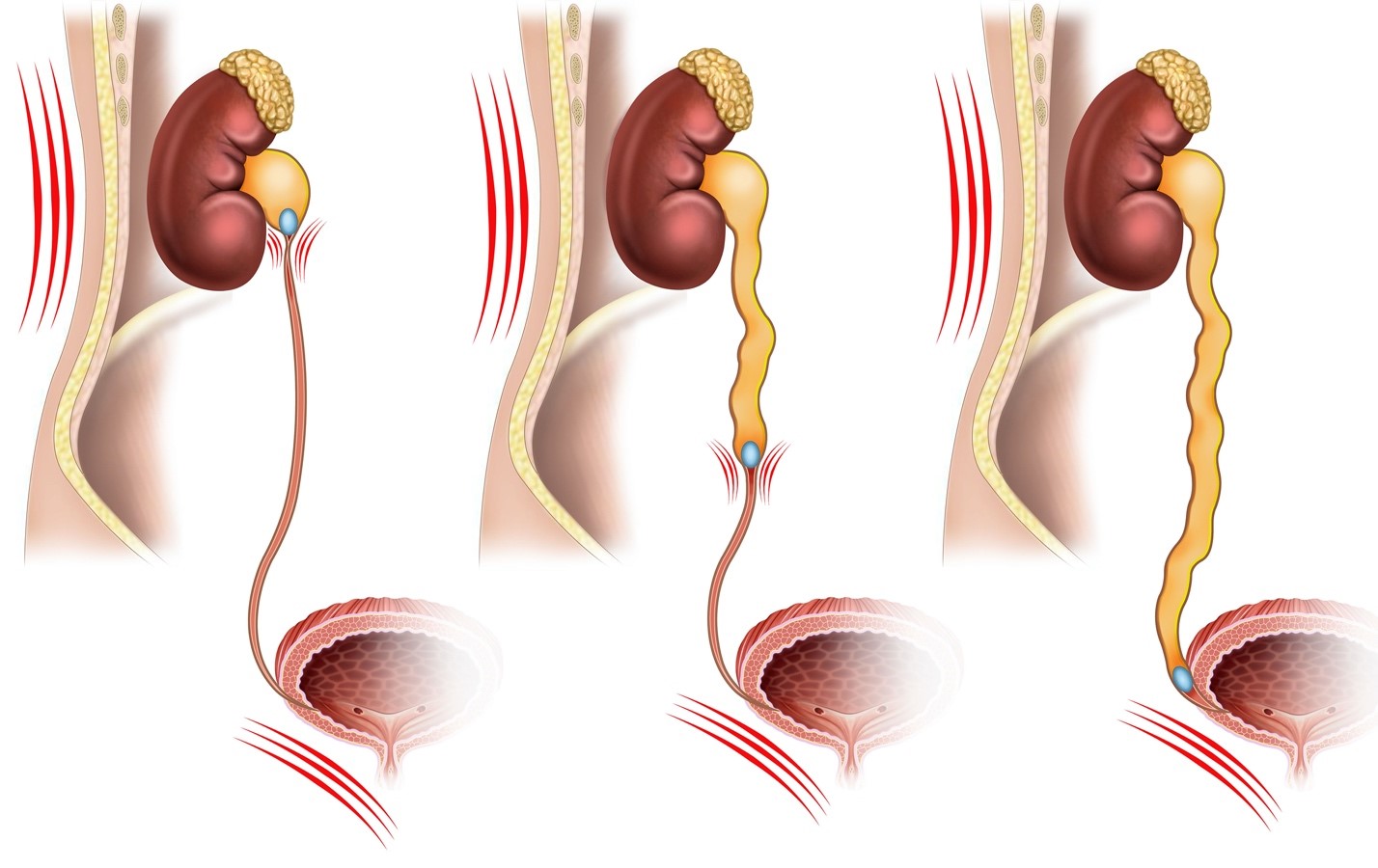
Обструктивная уропатия – состояние, при котором закупорка препятствует прохождению мочи по мочевыводящему каналу. Возникает в любом участке системы – от почек, где моча образуется, до канала, через который она покидает организм. Состояние повышает давление в мочевыделительном канале и угрожает осложнениями, если вовремя не будет диагностировано.
Причины
Причины развития обструктивной уропатии и рефлюкс-уропатии отличаются в разных возрастных группах:
Обструктивная уропатия у мужчин встречается чаще, у женщин же она часто встречается во время беременности. Это связано с давлением плода и матки на мочевыводящий канал.
Дополнительно причинами заболевания становятся:
Новообразования в простате у мужчин и в матке у женщин способны сужать просвет мочеточника, потому врач проводит дифференциальную диагностику с определением сопутствующих заболеваний и первопричин.
Непроходимость мочевыводящих путей – симптомы
Признаки уропатии зависят от локализации, продолжительности состояния. Пациентов беспокоят такие симптомы:
Если непроходимость возникает быстро, она причиняет боль и описанные состояния. При медленно прогрессирующей уропатии болезненность не отмечается на первых стадиях. В этом случае заболевание угрожает гидронефрозом.
Нарушение оттока мочи – повод немедленно обратиться к урологу! Патология может развиваться критически быстро, но своевременная диагностика и лечение предотвратят острые состояния и осложнения.
Диагностика
Для обнаружения обструктивной уропатии у мужчин и женщин назначаются лабораторные и инструментальные обследования:
В клинике урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова можно пройти диагностику и получить консультацию опытного уролога. Современные диагностические аппараты, врачи высшей категории помогут справиться с заболеванием на любой стадии в короткие сроки. Не откладывайте визит к врачу, позаботьтесь о здоровье сегодня!
Непроходимость мочевыводящих путей (обструктивная уропатия)
Непроходимость мочевыводящих путей — это закупорка, препятствующая прохождению мочи по мочевыводящих путям, включая почки, мочеточники, мочевой пузырь и мочеиспускательный канал. Непроходимость в любом месте мочевыводящих путей — от почек, где образуется моча, до мочеиспускательного канала, через который моча выходит из организма, может повысить давление внутри мочевыводящих путей и замедлить выделение мочи.
Непроходимость может возникнуть внезапно или развиваться постепенно в течение нескольких дней, недель или даже месяцев. При непроходимости мочевыводящие пути могут блокироваться полностью или только частично. В некоторых случаях поражается только одна почка, в других случаях — обе почки.
Причины
Симптомы
Непроходимость может остановить мочеиспускание или уменьшить объем выводимой при мочеиспускании мочи, если закупорка затронет мочеточники обеих почек или мочеиспускательный канал. Непроходимость мочеиспускательного канала или выходного отверстия мочевого пузыря может причинять боль, давление и растяжение мочевого пузыря.
У лиц с медленно прогрессирующей непроходимостью, которая вызывает гидронефроз, может не быть никаких симптомов, или же у них могут быть приступы тупой боли в боку на пораженной стороне. Иногда камень в почках временно блокирует мочеточник и причиняет периодически возникающую боль.
Непроходимость, которая приводит к гидронефрозу, может стать причиной общих симптомов со стороны пищеварительного тракта (тошнота, рвота и боль в животе). У лиц с инфекциями мочевыводящих путей (ИМП) может быть гной в моче, лихорадка и дискомфорт в области мочевого пузыря или почек.
Возможные осложнения
Диагностика
С учетом причины заболевания и имеющихся симптомов врач может назначить следующие виды обследования:
Лечение
Как правило, лечение направлено на снятие симптомов непроходимости и зависит от причины и симптомов болезни, тяжести течения, а также наличия сопутствующих заболеваний и медикаментозной терапии, получаемой по сопутствующей патологии. С учетом этого врач может назначить:
Императивные и обструктивные нарушения мочеиспускания у пациентов с хроническими воспалительными заболеваниями мочевыводящих путей
НИИ уронефрологии и репродуктивного здоровья человека (дир. – член-корр. РАМН, засл. деятель науки РФ, д-р мед. наук, проф. Ю. Г. Аляев); ГБОУ ВПО “Первый МГМУ им. И. М. Сеченова”, Москва
Проведена оценка показателей функционального состояния нижних мочевыводящих путей у 116 пациенток с хроническим циститом и 51 больной хроническим необструктивным пиелонефритом. У 53 (45,68%) пациенток с хроническим циститом (средний возраст – 40,72±14,45 года) выявлена нестабильность уретры, у 10 (8,62%; средний возраст – 45,55±13,45 года) – гиперактивность детрузора. Колебания детрузорного давления составили 22,16±15,8 см водн. ст. У 26 (22,4%) пациенток исследуемой группы (средний возраст – 65,16±10,49 года) диагностировано сочетание нестабильности уретры и гиперативности детрузора. Максимальное уретральное давление составило 75,5±21,44 см водн. ст., колебания уретрального давления — 37,45±17,44 см водн. ст. Снижение максимальной скорости потока мочи ниже 15 мл/с выявлено у 47 (40,5%) больных. Признаки детрузорно-сфинктерной диссинергии отмечены у 29 (25%) больных. После обработки данных уродинамических исследований пациенток с необструктивным пиелонефритом выявлены 20 (39,21%) больных с выраженной гипотонией детрузора, 18 (35,29%) – с гиперактивностью детрузора, 26 (50,98%) – с нестабильностью уретры. На основании полученных результатов исследования сделан следующий вывод: для женщин хронический воспалительный процесс в мочевом пузыре и почках может являться не причиной, а следствием функциональных нарушений нижних мочевыводящих путей, связанных с расстройством нервной регуляции этих органов. Развитие воспаления в стенке мочевого пузыря на фоне дисфункции нижних мочевыводящих путей в свою очередь может поддерживать нарушение функции мочевого пузыря и/ или уретры. Для устранения функциональных нарушений нижних мочевыводящих путей и улучшения деятельности этих органов возможно использование лекарственных препаратов, влияющих на функцию симпатических и парасимпатических элементов вегетативной нервной системы. Таким образом, патогенетическое лечение хронического цистита основывается на разрыве “замкнутого круга” дисфункция–воспаление. С учетом полученных нами данных и в связи с частым выявлением императивных, а также обструктивных функциональных расстройств мочеиспускания, кроме того, основываясь на нейрофизиологической концепции их возникновения, в лечебной тактике в отношении пациенток с хроническими рецидивирующими циститами и необструктивными пиелонефритами большое значение имеет использование α-адреноблокаторов и М-холиноблокаторов.
Введение. Проблема нарушений уродинамики занимает одно из центральных мест в урологии. Это
обусловлено большой распространенностью и многообразием причин, вызывающих эвакуаторную несостоятельность мочевыводящих путей, а также наличием прямо пропорциональной зависимости между степенью нарушений уродинамики, активностью пиелонефрита и сроками возникновения функциональной недостаточности почек [1]. В последние годы появилась масса работ, в которых указывается на увеличение числа женщин с расстройствами акта мочеиспускания в отсутствие патологических изменений в анализах мочи. Эта особенность для многих исследователей послужила поводом считать причиной возникновения дизурии нейроэндокринные нарушения в организме женщин, расстройства кровообращения в органах малого таза и различные изменения психики больных. Другие авторы рассматривали дизурию как проявление воспалительного процесса в мочевом
пузыре и уретре. Третьи объясняли возникновение дизурии функциональными нарушениями нижних
мочевыводящих путей [2]. В патогенезе пиелонефрита кроме нарушений гемодинамики важная роль принадлежит нарушениям уродинамики [3–7]. По данным отечественных исследователей, до 59% женщин, страдающих хроническим неспецифическим воспалением нижних мочевыводящих путей, имеют признаки инфравезикальной обструкции (ИВО), в большинстве наблюдений зона обструкции локализуется в шейке мочевого пузыря и проксимальной уретре [8, 9]. Пиелонефрит является одним из наиболее распространенных заболеваний почек и мочевыводящих путей, при котором воспалительный процесс развивается не только как первичное, но и как вторичное заболевание. В связи с этим большинство урологов считают, что в возникновении пиелонефрита кроме наличия инфекции немаловажную роль играют уро- и гемодинамические нарушения в почке. Уродинамика нижних мочевыводящих путей зависит от состояния стенки мочевого пузыря (детрузора), проксимального
отдела мочеиспускательного канала (предстательная и перепончатая части у мужчин, 2/3 проксимальной части у женщин) и сфинктера мочеиспускательного канала. Их деятельность определяется особенностями гладкой мускулатуры, ее вегетативной иннервацией и механизмами нервно-мышечной передачи [10]. Пузырно-мочеточниковый рефлюкс возникает при сочетании дисфункции мочевого пузыря и его воспаления. В норме пузырно-мочеточниковый сегмент (ПМС) способен противостоять внутрипузырному давлению жидкости до 60–80 см водн. ст. [11]. Турбулентный поток мочи при нарушении ее пассажа на уровне дистального отдела уретры создает условия для ретроградного заброса микроорганизмов из дистального отдела уретры в мочевой пузырь, что приводит к частым рецидивам хронического воспалительного процесса в нем.
Лечение дисфункций мочевого пузыря продолжает оставаться сложной и во многом еще нерешенной
задачей. Болезнь затрагивает сложнейшие механизмы взаимоотношений детрузорно-сфинктерных систем, нарушает все три функции пузыря – накопление, удержание и эвакуацию мочи. До недавнего времени даже не ставилась задача разработки патогенетически обоснованной схемы лечения дисфункций мочевого пузыря у пациенток с хроническим рецидивирующим циститом и необструктивным пиелонефритом.
Целью исследования явилось изучение функционального состояния нижних мочевыводящих путей
у пациенток с хроническим рецидивирующим циститом и необструктивным пиелонефритом для определения тактики их комплексной патогенетической терапии.
Материалы и методы. В урологической клинике Первого МГМУ им. И. М. Сеченова проведена оценка показателей функционального состояния нижних мочевыводящих путей 116 пациенток с хроническим циститом (средний возраст – 44,56±16,51 года, средняя длительность заболевания от начала первого
эпизода острого цистита – 4,3±1,4 года) и 51 пациентки с хроническим необструктивным пиелонефритом (средний возраст – 37,1±16,28 года) [12]. Было выполнено комбинированное уродинамическое исследование всех этих пациенток с профилометрией уретры для исключения нарушений уродинамики нижних мочевыводящих путей, которое могло быть пусковым механизмом и основной причиной поддержания длительно существующего воспалительного процесса.
Результаты и обсуждение. У 53 (45,68%) пациенток с хроническим циститом (средний возраст –
40,72±14,45 года) выявлена нестабильность уретры. Максимальное уретральное давление в этой группе больных – 82,46±29,26 см водн. ст. Колебания максимального уретрального давления составили 34,86±19,6 см водн. ст. Максимальная скорость мочеиспускания у них составила 16,93±6,79 мл/с, внутрипузырное давление при максимальной скорости потока мочи — 68,48±26,39 см водн. ст., детрузорное давление – 34,6±12,1 см водн. ст., вклад детрузорного давления – 55,5±18,6%.
У 10 (8,62%) пациенток с хроническим циститом (средний возраст – 45,55±13,45 года) выявлена гиперактивность детрузора. Колебания детрузорного давления составили 22,16±15,8 см водн. ст., максимальная скорость мочеиспускания – 19,9±10,09 мл/с, внутрипузырное давление.
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
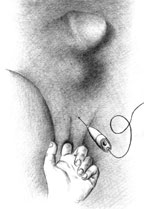 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
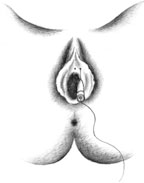 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва