Обнаружение микобактерий в мокроте что это
Лабораторные методы исследования при туберкулезе
Мокроту лучше собирать утром. Предварительно больной должен прополоскать рот, чтобы в мокроте было меньше слюны. При малом количестве мокроты ее собирают в течение суток.
При отсутствии мокроты следует вызвать ее появление раздражающими ингаляциями аэрозоля гипертонического раствора поваренной соли с содой.
Исследуют также промывные воды бронхов, получаемые после введения через трахею 10—12 мл теплого изотонического раствора хлорида натрия.
Исследование мокроты начинают с ее осмотра. У больных туберкулезом легких в мокроте могут быть прожилки или сгустки крови, кусочки обызвествленных камней бронхов — бронхолитов.
При микроскопическом исследовании окрашенных мазков мокроты у больных с деструкцией легочной ткани выявляются эластические волокна. Иногда встречаются так называемые коралловые волокна, которые образуются в результате отложения на эластических волокнах жирных кислот, а также покрытые известью эластические волокна и аморфные известковые частицы.
Для выявления в мокроте МБТ ее исследуют неоднократно, направляя в лабораторию утреннюю порцию не менее 3 дней подряд. В ряде случаев МБТ могут быть обнаружены в мокроте и при отсутствии рентгенологических изменений в легких (в этом случае нельзя исключить и язвенный туберкулез бронха). Проводить исследование мокроты необходимо до начала противотуберкулезной химиотерапии.
Выявление МБТ в патологическом материале осуществляется бактериоскопическим, бактериологическим (культуральным) и биологическим методами.
Кроме мокроты, объектами исследования для обнаружения МБТ могут быть также моча, кал, спинномозговая жидкость, экссудат из полостей, биоптаты различных тканей.
Основным методом выявления МБТ является бактериоскопический. Во многих развивающихся странах он широко применяется не только для диагностики, но и для выявления больных туберкулезом при массовых обследованиях населения.
При прямой бактериоскопии препарат окрашивают по методу Циля — Нильсена: вначале карболовым раствором фуксина, а затем после обесцвечивания 5 % раствором серной кислоты или 3 % раствором солянокислого спирта, докрашивают 0,25 % раствором метиленового синего. Окрашенные препараты микроскопируют в иммерсионной системе. МБТ окрашиваются в красный, а окружающий фон и некислотоустойчивые микроорганизмы — в синий цвет.
Информативность бактериоскопического метода выявления МБТ увеличивается на 14—30 % при применении люминесцентной микроскопии. Для окраски препарата используют флюорохромы — органические красители, флюоресцирующие при освещении ультрафиолетовыми, фиолетовыми или синими лучами. Такими красителями являются аурамин, родамин С. Препарат исследуют с помощью люминесцентного микроскопа. МБТ светятся золотисто-желтым цветом на темном фоне.
Для обнаружения бактериоскопическим методом МБТ в препарате необходимо, чтобы в 1 мл мокроты содержалось не менее 100 000 микробных тел. При меньшем числе микобактерий исследование может дать ложноотрицательный результат.
Для увеличения количества МБТ в единице исследуемого объема мокроты используют методы флотации и седиментации, особенно при отрицательных результатах прямой бактериоскопии.
Наибольшее распространение получил метод флотации, основанный на том, что после встряхивания водной суспензии с углеводородом МБТ всплывают вместе с образующейся пеной на поверхность. В качестве углеводорода используют бензин, бензол, ксилол. Образующееся на поверхности сливкообразное (флотационное) кольцо из частиц углеводорода с микобактериями служит материалом для приготовления препаратов. При использовании метода флотации число положительных результатов бактериоскопии увеличивается на 10 %.
Бактериологический (культуральный) метод выявления МБТ заключается в посеве мокроты на питательные среды. Перед посевом мокроту обрабатывают с целью подавления роста неспецифической микрофлоры. Стандартной питательной средой для выращивания МБТ служит твердая яичная среда Левенштейна — Йенсена. Существуют также полужидкие и жидкие питательные среды. Рост культуры МБТ происходит за 14—90 дней.
Для выделения культуры МБТ достаточно 20—100 микробных клеток в 1 мл мокроты. Получение чистой культуры микобактерий позволяет определить их жизнеспособность, вирулентность, а также чувствительность к лекарственным препаратам.
Нередко определяемые при бактериоскопии микобактерии не растут на питательных средах вследствие утраты способности к размножению под влиянием химиопрепаратов. По данным бактериологического исследования проводится количественная оценка бактериовыделения: скудное — до 50 колоний на среде и обильное — более 50 колоний.
Биологический метод заключается в заражении инфицированной мокротой животных (морских свинок), обладающих высокой чувствительностью к МБТ.
Перед заражением животных мокроту обрабатывают серной кислотой с целью уничтожения неспецифической микрофлоры и центрифугируют. Осадок (в изотоническом растворе хлорида натрия) вводят свинке подкожно в паховую область, внутрибрюшинно или в яичко. С целью снижения резистентности морской свинки к МБТ ей ежедневно вводят большие дозы кортизона. Примерно через месяц после заражения у свинки увеличиваются лимфатические узлы и развивается генерализованный туберкулез.
Среди методов выявления МБТ и диагностики туберкулеза биологический метод до последнего времени считался наиболее чувствительным, так как туберкулез у морских свинок может быть вызван при введении мокроты, содержащей менее 5 микробных тел в 1 мл.
В настоящее время доказана возможность потери вирулентности микобактериями туберкулеза. Такие микобактерии жизнеспособны, могут расти на питательных средах, но не вызывают заболевания экспериментальных животных. Поэтому для выявления в патологическом материале МБТ необходимо применять различные методы микробиологического исследования.
Изменение числа лейкоцитов и лейкоцитарной формулы крови происходит главным образом при острых процессах и распаде легочной ткани. Могут наблюдаться лейкоцитоз, увеличение числа палочкоядерных нейтрофилов, лимфопения, моноцитоз, эозинопения.
Для оценки состояния больного, его неспецифической и специфической реактивности, а также для определения активности туберкулезного процесса и выбора оптимальной лечебной тактики существенное значение имеет определение некоторых биохимических и иммунологических показателей.
У больных туберкулезом, выделяющих большое количество мокроты, с обильным гнойным плевральным экссудатом, амилоидозом почек может иметь место гипопротеинемия в отличие от больных с другими формами туберкулеза.
При остром туберкулезном воспалении уменьшается альбумин-глобулиновый коэффициент, увеличивается содержание в плазме фибриногена и сиаловых кислот, появляется С-реактивный белок.
Для контроля функционального состояния печени и почек в крови определяют содержание аланиновой и аспарагиновой аминотрансфераз, щелочной фосфатазы, билирубина, уровень остаточного азота, мочевины, креатинина, с сывороткой крови ставят коагуляционные пробы — тимоловую, сулемовую. С целью исключения часто сочетающегося с туберкулезом сахарного диабета в крови определяют содержание глюкозы.
Для подтверждения туберкулезной этиологии заболевания используют иммуноферментный метод, основанный на реакции антиген — антитело. При подозрении на иммунодефицит в сыворотке крови определяют содержание иммуноглобулинов. Для диагностики иммунодефицита и контроля за его течением определяют количество В- и Т-лимфоцитов.
При активном туберкулезе все иммунологические реакции положительны, причем их выраженность зависит от фазы туберкулезного процесса. У больных с благоприятным течением туберкулеза наиболее выражена реакция бласттрансформации лимфоцитов, а с прогрессирующим — реакция торможения миграции лейкоцитов в присутствии туберкулина ППД.
При вспышке процесса снижается число Т-розеткообразующих лимфоцитов и повышается число В-розеткообразующих лимфоцитов, одновременно уменьшается содержание G- и А-иммуноглобулинов.
Иммунологические тесты используются для дифференциальной диагностики туберкулеза. Например, при раке и саркоидозе в отличие от туберкулеза отмечается подавление активности Т-лимфоцитов в реакции бласттрансформации с фитогемагглютинином (ФГА), у большинства больных отмечаются отрицательные реакции бласттрансформации лимфоцитов и миграции лейкоцитов с ППД.
не дает существенной диагностической информации, но иногда выявляются серьезные осложнения основного заболевания. При туберкулезе почек в моче обнаруживают белок, лейкоциты, нередко эритроциты, а также МБТ. При осложнении легочного туберкулеза амилоидозом наблюдаются стойкая протеинурия, микрогематурия.
По выделению с суточной мочой 17-кетостероидов и 17-оксикортикостероидов судят о функциональном состоянии коры надпочечников.
«Методы исследования мокроты на туберкулез»
Мокрота является секретом, выделяющимся при воспалении трахеи, бронхов и легких. Ее появление отмечается не только при поражении дыхательных органов, но и при нарушениях сердца и сосудов. Методы исследования мокроты подразумевают макроскопическое, химическое и микроскопическое определение ее характеристик.
Что выявляет анализ
Исследование мокроты дает возможность обнаружить микроорганизмы, вызывающие патологический процесс, обозначить наличие микобактерии при туберкулезе, выявить раковые клетки, кровяные и гнойные примеси, а также определить резистентность бактерий к антибиотикам.
При каких состояниях показан анализ
Исследование мокроты на общий анализ проводится при следующих состояниях:
Подготовка к исследованию
Слизь будет лучше выделяться, если накануне перед сдачей анализа принять средство для отхаркивания или же употребить большое количество теплого питья. Перед сбором рекомендуется почистить зубы и ротовую полость, прополоскав ее теплой вскипяченной водой.
Основные правила сбора
Сбор мокроты на бактериологическое исследование желательно производить в утренние часы (она скапливается за ночь до приема пищи) в стерильный контейнер, который выдается лабораторией. Для анализа достаточно количества 5 мл. Анализ секрета производится не позднее, чем через 2 часа после его сбора. До момента отправки на исследование контейнер с содержимым должен храниться закрытым в холодильнике.
Количество мокроты при разных заболеваниях
Количество выделяемого секрета разнится в зависимости от характера патологического процесса. Обычно оно варьируется от нескольких плевков до 1 л за сутки. Малое количество выделяется при воспалении бронхов, застойных процессах легких и при начале приступа бронхиальной астмы. В конце приступа объем возрастает. Он может составлять до 0,5 л, а также выделяться в большом количестве, если имеется отек легких.
Много слизи выделяется при гнойном процессе в легких при сообщении с бронхами, при нагноении, бронхоэктазе и гангрене.
Исследование мокроты на туберкулез показывает распад тканей легких. В особенности такой процесс провоцирует каверна, которая сообщается с бронхами.
С чем связано уменьшение или увеличение выделения секрета
Увеличение количества выделяемого секрета может быть сопряжено с ухудшением состояния пациента и наблюдаться в период обострения. Увеличение может относиться и к положительной динамике развития болезни.
Уменьшение количества выделяемой слизи может свидетельствовать о регрессе воспаления или же нарушении в области дренирования полости, наполненной гноем. При этом отмечается ухудшение самочувствия больного.
Слизистый секрет выделяется при бронхитах в острой или хронической форме, бронхиальной астме, пневмонии, онкологической опухоли легкого, бронхоэктатической болезни, эхинококкозе легкого, сопровождающемся нагноением, актиномикозе.
Мокрота с примесью гноя наблюдается при абсцессе легкого, эхинококкозе и бронхоэктатической болезни.
Слизь с примесью крови или же состоящая полностью из крови присуща туберкулезу. Появление крови может свидетельствовать о наличии онкологии, бронхоэктатической болезни, нагноении легкого. Также такое явление наблюдается при синдроме средней доли, инфаркте в легком, травме, актиномикозе и сифилитическом поражении. Кровь может выделяться и при крупозном и очаговом воспалении легких, застойных процессах, сердечной астме и отечности легких.
Серозная мокрота отмечается при отечности легких.
Исследование мокроты выявляет ее различную окрашенность. Слизистые и серозные выделения не обладают цветом или же имеют беловатый оттенок.
Присоединение гноя придает секрету зеленоватый оттенок, что характеризует такие патологические процессы, как абсцесс легкого, гангрена, бронхоэктатическая болезнь, актиномикоз легкого.
Выделения с оттенком ржавчины или коричневого цвета указывают на то, что в них содержится не свежая кровь, а продукт ее распада — гематин. Такой секрет может выделяться при крупозном воспалении легких, сибирской язве, инфаркте легкого.
Зеленоватый цвет с примесью грязи или же желтый секрет свидетельствует о патологии органов дыхания в сочетании с желтухой.
В ярко-желтый цвет мокрота окрашивается при эозинофильной пневмонии.
Слизь цвета охры встречается при сидерозе легкого.
Черноватый или сероватый секрет отмечается при наличии примеси пыли от угля. При отеке легких серозная мокрота наблюдается в большом количестве. Как правило, она окрашена равномерно в розоватый цвет, что объясняется наличием эритроцитов. Такие выделения похожи на жидкий клюквенный морс.
Окрашиваться секрет может и от некоторых лекарственных препаратов. К примеру, антибиотик «Рифампицин» может придать ему красный цвет.
О характере патологического процесса в органах дыхания может свидетельствовать и запах секрета. Мокрота отдает запахом гнили при гангрене легкого или гнилостном поражении бронхов, онкологических новообразованиях, осложнившемся некрозе бронхоэктатической болезни.
Зачастую исследование выделений выявляет наличие слоев. При застойном характере мокрота с примесью гноя наблюдается при нагноении легкого и бронхоэктатической болезни.
Секрет с примесью гнили содержит в себе три слоя. Верхний слой похож на пену, средний серозный, а нижний с примесью гноя. Такой состав характеризует гангрену легкого.
Примесь пищи может отмечаться при наличии злокачественной опухоли в пищеводе при сообщении его с бронхами и трахеей. При попадании эхинококка в бронхи в мокроте могут быть обнаружены крючья или сколекс паразита. Очень редко обнаруживаются взрослые особи аскарид, которые проникают в органы дыхания у ослабленных людей.
Яйца легочной двуустки появляются при разрыве кисты, которая образуется в легких при наличии паразитов.
Гангрена и нагноение легких вызывают появление кусочков некрозов легких. При опухоли в выделениях могут присутствовать их фрагменты.
Свертки, содержащие фибрин, встречаются у пациентов с фибринозным бронхитом, туберкулезом и пневмонией.
Рисовые тельца, или линзы Коха, присущи туберкулезу.
Пробки Дитриха, включающие в себя продукты распада бактерий и ткани легких клеток жирных кислот, встречаются при гнилостном бронхите или же гангрене легкого.
Хроническая форма тонзиллита предполагает выделение из миндалин пробок, схожих с пробками Дитриха.
Исследование мокроты химическим способом предполагает определение:
Цитологический метод исследования секрета
Для дифференциальной диагностики туберкулеза и многих других поражений легких широко применяется цитологический способ, который включает два этапа: клиническое и микроскопическое исследование мокроты.
Клиническое исследование помогает определить, каким методом должен быть собран материал для получения правильного результата анализа.
Существует два основных вида материала, которых требует микроскопическое исследование мокроты: спонтанный и редуцированный. Второй вид секрета получают воздействием разнообразных раздражителей (средства для отхаркивания, ингаляции и т. д.).
Материал, полученный при игловой биопсии
Цитологическое исследование мокроты предполагает изучение макроскопического и микроскопического анализа ее клеток.
Больше всего информации для цитологического анализа несет мокрота, взятая утром на голодный желудок. До исследования она должна храниться не больше 4 часов.
Сбор мокроты для исследования бактериоскопическим методом подразумевает анализ секрета на предмет обнаружения в нем микобактерий, характерных для туберкулеза. Они похожи на тонкие, утолщенные по бокам или же посередине кривые палочки разной длины, которые располагаются как поодиночке, так и группами.
Обнаружение микобактерии туберкулеза не является доминантным признаком для диагностики и требует подтверждения бактериологическим способом. Туберкулезные микобактерии при норме в секрете не обнаруживаются.
Основой для анализа служат гнойные частицы, которые берутся из сорока шести различных областей и тщательно растираются до однородной массы двумя стеклами. Далее они сушатся на воздухе и фиксируются пламенем горелки.
Бактериологическое исследование мокроты методом Циля-Нильсена предполагает ее окрашивание в красный цвет. При этом все частицы секрета, за исключением микобактерии, приобретают синий оттенок, а микобактерии приобретают красный цвет.
При подозрении на поражение организма туберкулезом после трехкратного исследования на наличие микобактерий с отрицательным ответом прибегают к применению метода флотации (анализ Поттенджера).
Обычный способ исследования окрашенного мазка на МТБ дает положительный результат только при количестве МТБ не менее 50 000 единиц в 1 мл мокроты. По числу микобактерий судить о наличии туберкулеза нельзя.
Бактериоскопия пациентов с неспецифическими заболеваниями легких
Лабораторные исследования мокроты при наличии неспецифических заболеваний легких при бактериоскопии могут выявить следующие бактерии:
Автор: Сейтимова Молдир
Областной противотуберкулезный диспансер
Лабораторные методы выявления микобактерий туберкулеза Методы обследования на МБТ
Бактериологическая диагностика включает обработку клинического материала, микроскопическое исследование, выделение микроорганизма с применением культуральных методов, идентификацию микобактерий с использованием бактериологических и биохимических гестов, а также определение лекарственной чувствительности микобактерий.
Существует несколько групп методов, используемых для выявления МБТ в различном диагностическом материале: рутинные (микроскопия, культуральное исследование), биологические (биопроба, определение вирулентности штаммов МБТ). автоматические системы (MGIT, ВАСТЕС, МВ/ВасТ, ESP Culture System и др.), молекулярной генетические методики (PCR. I.CR, NASBA, Q-Bela и др.). Каждый из этих методов обладает определенной чувствительностью и специфичностью, что необходимо учитывать при клинической интерпретации полученных результатов.
Бактериоскопическое исследование мокроты с окраской мазка по Цилю-Нильсену для выявления кислотоустойчивых микобактерий (КУБ) является наиболее быстрым, доступным и экономически эффективным из существующих методов выявления больных туберкулезом. Оно может быть осуществлено в любой клинико- диагностической лаборатории (КДЛ) лечебно-профилактических учреждений всех уровней и ведомств. Бактериоскопия мокроты представляется чрезвычайно информативной для выяснения эпидемиологической опасности пациента для окружающих, которая коррелирует с числом микобактерий в образце. Бактериоскопическое исследование, проведенное должным образом, имеет положительную прогностическую ценность для легочного туберкулеза, более 90%. Разрешающая способность данного метода составляет 50-100 тыс. микобактерий в 1 миллилитре мокроты и существенно зависит от ряда факторов: правильности сбора мокроты, подготовленности лабораторного персонала и разрешающей способности используемых микроскопов. При микроскопии мазков, приготовленных из проб, взятых в течение трех последовательных дней, результативность метода повышается на 20-30%. Однако нет необходимости использовать более 4-5 проб мокроты.
Метод окраски по Цилю-Нильсену наиболее часто используется при бакгериоскопичсском выявлении микобактерий. Он заключается в следующем: мазки мокроты окрашивают фуксином при нагревании, затем обесцвечивают солянокислым спиртом и докрашивают метиленовым синим. В результате микобактерий окрашиваются в малиновый цвет, а фон — в синий. Это специфическое окрашивание обусловлено способностью микобактерий удерживать краситель при обработке кислотой или спиртом.
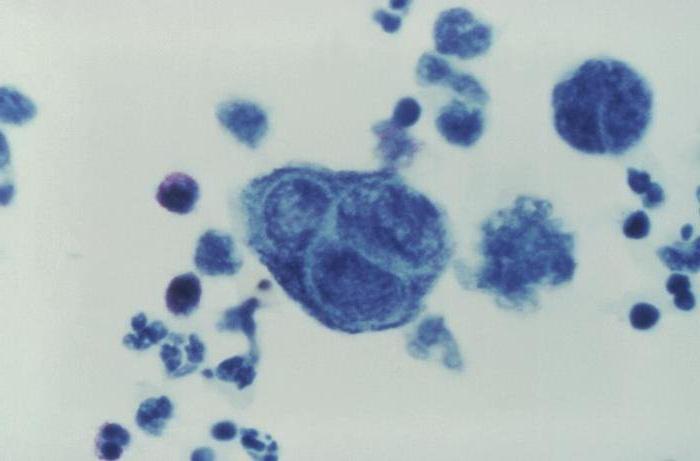
Микроскопическое исследование на микобактерию туберкулеза окрашенного мазка мокроты
Методы лабораторной диагностики туберкулеза весьма разнообразны как по характеру производимых исследований, так и по тому патологическому материалу, который подвергается исследованию. Кроме общепринятых исследований, используемых в практике при различных заболеваниях, в клинике туберкулеза применяются специальные лабораторные методы, связанные со спецификой этого заболевания. Получаемые результаты помогают клиницистам в дифференциальной диагностике процессов различной локализации, способствуют раннему выя влению туберкулеза, учитываются при выборе тех или иных методов лечения и определения его эффективности.
Несмотря на указанные недостатки, микроскопия остается одним из основных методов микробиологических исследований. Ее преимущество заключается в быстроте получения результата и относительной простоте исследования. Метод позволяет в короткие сроки обнаружить наиболее эпидемически опасных больных туберкулезом и микобактериозами, выделяющих большие количества микобактерий, и остается актуальным методом при выявлении больных туберкулезом и микобактериозами на первичных этапах обследования больных, а также при динамическом наблюдении за состоянием микобактериальной популяции в процессе лечения. Кроме того, микроскопическое подтверждение тинкториальных свойств культуры остается обязательным исследованием при ее диагностике. Человеческий туберкулез вызывают определенные бактерии, относящиеся к микобактериям. Но очень редко заболевание, схожее с туберкулезом, могут вызвать другие виды микобактерий, а также в мазке могут присутствовать неопасные микобактерии. Для более точного исследования используется бактериологический метод посева.
При подозрении на туберкулез всегда исследуется мокрота, так как легкие поражаются этим заболеванием наиболее часто. При ее отсутствии на исследование направляют промывные воды бронхов. Иногда для уточнения поражения туберкулезом других органов на исследование направляется моча, кал, отделяемое из ран и гнойников.
Микроскопия является предварительным методом исследования с целью выявления наиболее опасных форм туберкулеза («открытых»), при которых больной человек выделяет возбудителя заболевания в окружающую среду. При подозрении на туберкулез органов дыхания необходимо исследовать не менее трёх проб мокроты – это связано с особенностями выделения микобактерий из легких, а также чувствительностью методов исследования. Сбор мокроты осуществляют в течение 3-х дней подряд. Одновременно часть мокроты (или других жидкостей) направляется в бактериологическую лабораторию на посев.
Метод окраски по Ziehl-Neelsen (Цилю-Нильсену) является наиболее распространенным методом для выявления кислотоустойчивых микобактерий. Он основан на использовании нескольких специальных методических приемов:
Показания к назначению:
Туберкулез и микобактериоз. Общая информация
Туберкулез у человека вызывают микобактерии туберкулеза (МБТ): M.tuberculosis, M.bovis, M.africanum, M.microti, M.canettii, M.caprae, M.pinnipedii, M. mungi, объединяемые в группу микобактерий, называемую Mycobacterium tuberculosis complex, к которой также относится вакцинный штамм M.bovis BCG. Преобладающим этиологическим агентом является M.tuberculosis. Кроме абсолютно-патогенных для человека микобактерий, к которым кроме МБТ относится микобактерия лепры, существуют еще нетуберкулезные микобактерии (НТМБ), около 30 видов которых являются условно-патогенными для человека, прочие являются сапрофитами. Все НТМБ являются убиквитарными – т. е. повсеместно распространенными в окружающей среде.
Микобактерии (МБ) отличаются высокой устойчивостью к воздействию физикохимических факторов. До полугода они могут сохраняться на объектах окружающей среды, в пыли, на страницах книг, в почве и воде, причем высушивание увеличивает их жизнеспособность. В высушенной мокроте МБТ сохраняют жизнеспособность в течение 10–12 месяцев и погибают при нагревании до 100. С только через 45 мин, а при 70. С – через 7 часов. Низкие температуры также способствуют сохранению жизнеспособных МБ – в масле и сыре при низких температурах они живут до 1 года.
Туберкулез (ТБ) – антропозоонозное инфекционное гранулематозное заболевание. Передается в большинстве случаев аэрогенным (воздушно-капельным или воздушно-пылевым), но встречаются также алиментарный, контактный и трансплацентарный пути заражения. Следует помнить о возможности перекрестного заражения ТБ человека и животных. Микобактериоз – заболевание, вызванное другими представителями рода Mycobacterium – НТМБ, которые могут передаваться от человека к человеку, но основным источником инфицирования служат сельскохозяйственные животные.
Оба заболевания характеризуются политропностью, т. е. в организме человека и животных при развитии патологического процесса могут поражаться различные органы. Более чем в 80% случаев развивается легочная форма заболеваний, в остальных случаях – внелегочная или сочетанные формы. Внелегочный ТБ, как правило, развивается вторично, в результате распространения туберкулезной инфекции из первичного очага, локализующегося обычно в органах дыхания. При этом первичный ТБ может быть отсроченным по времени с эпизодом проявления внелегочного ТБ и разрешиться ранее, либо вследствие проведения противотуберкулезной терапии, либо самостоятельно, без ее применения.
Заболеваемость туберкулезом в Российской Федерации в настоящее время высокая: 82,4–84,0 на 100 тыс. населения. Растет и число больных с резистентными к стандартной терапии штаммами МБТ. Особую угрозу туберкулез представляет для больных с иммунодефицитными состояниями, при которых он может протекать атипично, создавая трудности для клинико-лабораторной диагностики.
Среди контингента больных ВИЧ-инфекцией в РФ постоянно увеличивается число больных с поздними стадиями ВИЧ-инфекции. Это приводит к тому, что у все большего числа больных ВИЧ-инфекцией россиян, инфицированных МБТ, на фоне иммунодефицита развивается туберкулез. При этом туберкулез – главная причина смерти умерших от причин, связанных с ВИЧ-инфекцией (63,4% в 2010 г. по данным МЗ РФ). Европейское региональное бюро ВОЗ относит Россию к числу стран с наиболее неблагоприятной ситуацией по туберкулезу, сочетанному с ВИЧинфекцией.
Наиболее частыми этиологическими причинами микобактериозов у больных ВИЧ-инфекцией является Mycobacterium avium complex, M. xenopi, M. kansasii, M. fortuitum. Клинические формы этих поражений развиваются исключительно у лиц с выраженным иммунодефицитом. Диагностика легочного и внелегочного ТБ, а также микобактериоза, зависит от настороженности врачей, в первую очередь общей лечебной сети, а также доступности специальных методов исследования. Согласно приказу № 1224н от 29 декабря 2010 г. медицинские работники любых специальностей медицинских организаций РФ должны выявлять симптомы туберкулеза. При подозрении на туберкулез органов дыхания или внелегочной локализации в медицинских организациях проводится лабораторное исследование разных видов биологического материала, преимущественно – выявление возбудителя заболевания методом микроскопии.
Для защиты от ТБ применяется вакцинация, проведение которой регулируется федеральным законодательством. Вакцина представляет собой аттенуированный штамм M.bovis – M.bovis BCG. В ряде случаев вакцинация может вызывать осложнения, т.н. БЦЖ-иты.
ТБ в мире классифицируется в соответствии с МКБ-10, которая учитывает лишь метод подтверждения диагноза и локализацию процесса, и определяется кодами А15 – А19. В России существует собственная классификация, отражающая клинико- морфологические особенности патогенеза. В ее основу положены несколько принципов: клинико-рентгенологические особенности туберкулезного процесса (в т. ч. локализация и распространенность), его течение (т. е. фазы), а также наличие бактериовыделения. В приказе Минздрава РФ от 21.03.2003 № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации» сделана попытка совмещения обеих классификаций, когда к 4 знакам шифра МКБ-10 добавлено еще 6 знаков, в которых нашли отражение уточнения отечественной классификации.
Заболевания, вызванные НТМБ, а также другими представителями порядка Actinomycetales, имеющими близкое генетическое, иммунологическое, хемотаксономическое родство с МБ, микроорганизмами родов Nocardia, Rhodococcus, Corynebacterium и др., имеют сходную с ТБ локализацию патологического процесса, а также клиническую, в ряде случаев микробиологическую, и на определенных этапах патогенеза – морфологическую картины. Такие заболевания могут протекать под маской ТБ, что затрудняет его дифференциальную диагностику. Увеличивающееся в последнее время количество случаев заболеваний, вызванных подобными возбудителями, обусловлено увеличением количества иммунокомпрометированных лиц, а также развитием бактериологических и молекулярно-биологических методов исследования. Вопросы диагностики и лечения таких больных на законодательном уровне в РФ четко не обозначены.
Показания к обследованию
Дифференциальная диагностика. Первичная форма ТБ с поражением внутригрудных лимфатических узлов: саркоидоз I стадии, лимфогранулематоз, микобактериоз, лимфолейкоз, лимфосаркома, ретикулосаркома, центральный рак легкого, застойные изменения в легких на фоне сердечной недостаточности.
Диссеминированный ТБ: саркоидоз II стадии, бактериальная пневмония, профессиональные заболевания легких – пневмокониоз (силикоз и силикатоз, металлокониоз, карбокониоз, пневмокониоз, вызванные смешанной или органической пылью), микобактериоз, канцероматоз легких, фиброзирующий альвеолит, коллагенозы, гистиоцитоз Х, гемосидероз, криптококкоз, аспергиллез, гистоплазмоз, кокцидиоидоз, бластомикоз, гранулематоз Вегенера, хроническая интерстициальная пневмония, альвеолярный протеиноз, легочный васкулит.
Очаговый, инфильтративный ТБ и казеозная пневмония: внебольничная пневмония, периферический и центральный рак легкого, эозинофильный инфильтрат, актиномикоз легкого, нокардиоз, микобактериоз, ателектаз легкого, инфаркт легкого.
Кавернозный и фиброзно-кавернозный ТБ: абсцесс легкого, рак легкого с распадом, солитарные кисты легкого, бронхоэктазы, микобактериоз, нокардиоз.
Цирротический ТБ: саркоидоз III стадии и пневмофиброзы различной этиологии.
В случае округлых образований, наблюдаемых при рентгенологическом исследовании: периферический и метастатический рак, доброкачественные опухоли, эхинококкоз, аспергиллома, ретенционные кисты легкого, ограниченный осумкованный плеврит и артериовенозная аневризма легкого.
ТБ периферических лимфоузлов: саркоидоз, токсоплазмоз, микобактериоз, бруцеллез, болезнь Кикучи (гистиоцитарный некротизирующий лимфаденит), доброкачественный лимфоретикулез, лимфогранулематоз, неходжкинская лимфома.
У больных ВИЧ-инфекцией: вторичные заболевания, протекающие с поражением легких, генерализованные вторичные инфекции, онкологические поражения.
Материал для исследования
Мокрота, трахеальный смыв, материалы, полученные при проведении бронхоскопии – промывные воды бронхов, бронхоальвеолярный лаваж, а также материалы катетер- или щеточной биопсии, промывные воды желудка, экссудаты и транссудаты, гной, отделяемое ран, аспираты и пунктаты, спинномозговая и асцитическая жидкости, цельная кровь, моча, кал, секрет простаты, эякулят, менструальная кровь, ткани, в т.ч. фиксированные или в парафиновых блоках, смывы с предметов окружающей среды, а также культуры микроорганизмов, полученные при посеве этих видов материала для идентификации вида МБ.
Лабораторная диагностика туберкулеза и микобактериоза включает визуализацию кислото- и спиртоустойчивых бактерий при использовании микроскопии, получение первичной культуры или обнаружение ДНК/РНК МБ, их дальнейшее видовое дифференцирование и определение чувствительности возбудителя заболевания к противотуберкулезным препаратам культуральным методом или МАНК.
Сравнительная характеристика методов лабораторной диагностики и особенности интерпретации их результатов. По международным стандартам диагноз ТБ должен быть подтвержден бактериологически или гистологически.
Первоначальное исследование – микроскопия препарата мокроты или других жидкостей и тканей организма, взятых максимально близко к предполагаемой локализации патологического процесса. Микроскопия препарата с окраской по Цилю-Нильсену – быстрый, дешевый, но низко чувствительный метод (с его помощью можно обнаружить 105–106 микробных тел/мл), обладающий невысокой специфичностью, выявляющий все кислото- и спиртоустойчивые микроорганизмы. Метод не позволяет дифференцировать МБТ от НТМБ и, в ряде случаев, от других микроорганизмов порядка Actinomycetales. Диагностическая чувствительность метода составляет 20–65%.
Люминесцентная микроскопия препарата с окраской флуорохромными красителями – более чувствительный метод, т. к. позволяет проводить исследование при меньших увеличениях микроскопа и, следовательно, просматривать значительно больше полей зрения, чем при обычной микроскопии с иммерсионной системой при окраске по Цилю-Нильсену, что позволяет увеличить процент положительных находок на 10–17%.
Бактериологический посев на плотные питательные среды обладает большей чувствительностью и выявляет 100–1000 микробных тел/мл. Согласно стандартам микробиологической диагностики, обязательный посев проводится на 2 питательные среды, одной из которых является яичная среда Левенштейна-Йенсена (по рекомендации ВОЗ). В результате медленного роста, когда каждое деление микобактерий, в зависимости от вида, происходит через 2–24 ч, для получения результата требуется от 7 дней для быстрорастущих и до 2–12 недель для медленнорастущих, в число которых входит и МБТ.
Посев на жидкие питательные среды с помощью автоматических анализаторов BACTEC MGIT 960 (Becton Dickinson Microbiology Systems, Sparks, MD) и VersaTREK Myco (Trek Diagnostic Systems, Westlake, OH), позволяет получить результат через 4–42 дня.
В 2010 году в документах CDC, МАНК, наряду с культуральным методом, предложено использовать для подтверждения диагноза туберкулеза. В то же время, использование методов микроскопии ограничивается и предлагается для применения только в случаях невозможности проведения посева, при получении ложноотрицательного результата посева или его контаминации (пророста). Модификация программного обеспечения «Vercrit», используемого в противотуберкулезной службе США, выстраивает следующую иерархию доказательной диагностики ТБ:
Трехкратное взятие и исследование образцов биологического материала у пациента, например мокроты, увеличивает возможность обнаружения МБТ на 2–5%. Поэтому в отечественных и зарубежных руководствах по диагностике ТБ указана необходимость трехкратного, или, по меньшей мере, двукратного исследования образцов мокроты. Сбор первого образца мокроты проводится в присутствии среднего медицинского персонала для объяснения правильной последовательности действий пациента. Второй образец больной собирает вечером того же дня, а третий утром, после чего приносит их в лабораторию. В случае госпитализации больного образцы собираются последовательно в течение 3-х дней.
Вместе с тем, обнаружение МБТ в экскретируемых организмом жидкостях не всегда возможно даже при многократном сборе и исследовании материала методом ПЦР, что связано с преимущественно тканевой локализацией возбудителя ТБ. Поэтому в сложных диагностических случаях больным показано проведение гистологической диагностики ТБ. Образец ткани из очага патологического процесса, после проведения гистологической проводки и заключения его в парафин, можно исследовать как для верификации специфического туберкулезного воспаления, так и для подтверждения этиологической причины патологического процесса. Исследования проводят с помощью окраски бактерий по Цилю-Нильсену, иммуногистохимического исследования, позволяющего отнести обнаруженные микроорганизмы к роду Mycobacterium, а также МАНК, определяющих их видовую принадлежность.
С целью дифференцирования МБ до вида, необходимого для правильного определения этиологии заболевания, анализируют морфологические характеристики выросшей культуры, проводят ее микроскопическое исследование с окраской препаратов по Цилю-Нильсену, после чего осуществляют биохимические тесты и пересев на селективные питательные среды. Такая стратегия требует много времени как для получения достаточного для анализа роста культуры, так и для осуществления используемых методик. Однако даже применение всех методов позволяет дифференцировать МБ с точностью, не превышающей 95%, что связано с индивидуальными особенностями штаммов.
Дифференцирование до вида целесообразнее осуществлять с помощью молекулярно- биологических методов: ПЦР; гибридизация с ДНК-зондами, выявляющая наиболее распространенные МБ; высокоэффективная жидкостная хроматография, сравнивающая профиль жирных кислот клеточной стенки анализируемого микроорганизма с имеющимися в базе данных; секвенирование 16S rDNA и ITS-региона МБ, результаты которого анализируются с помощью интернет-ресурса RIDOM ( http://rdna.ridom.de ). Для дифференцирования некоторых НТМБ, особенно быстрорастущих (M.fortuitum, M.abscessus, M.chelonae), обязательно ориентируются на данные антибиотикочувствительности и результаты секвенирования. Практически для всех технологий, за исключением ПЦР, в качестве материала для исследования применимы только первичные культуры МБ, выросших на плотных или жидких питательных средах
Не менее важно дифференцирование до вида внутри группы Mycobacterium tuberculosis complex. Это связано с необходимостью определения источника заболевания, определения дальнейшей тактики противотуберкулезной терапии (при индикации М.bovis или ее вакцинного штамма М.bovis BCG, которые отличаются природной резистентностью к одному из основных ПТП – пиразинамиду, этот препарат не назначается), а также для подтверждения поствакцинальных осложнений у пациента. МР № 99/219 «Диагностика поствакцинальных осложнений после введения вакцины БЦЖ» предлагают с этой целью использовать диагностический комплекс, предусматривающий последовательное применение двух методов: культурального и ИФА для обнаружения АГ полученной культуры с помощью моноклональных АТ, специфически взаимодействующих с поверхностными АГ М.bovis, но не связывающимися с АГ М.tuberculosis. Исследование включает определение морфологических особенностей штамма, его тинкториальных свойств, спирто- и кислотоустойчивости, видовой принадлежности и изучение его лекарственной чувствительности к ПТП с обращением особого внимания на чувствительность к пиразинамиду. Несмотря на то, что в МР написано, что использование диагностического комплекса при морфологической верификации диагноза позволяет в 100% случаев верифицировать диагноз «БЦЖит», очевидно, что данные методы не позволяют дифференцировать М.bovis от ее вакцинного штамма М.bovis BCG. С этой задачей успешно справляется набор реагентов, основанный на использовании метода ПЦР, который выявляет виды M.tuberculosis complex: M.tuberculosis, M.bovis и ее вакцинный штамм M.bovis BCG и др. непосредственно в разных видах биологического материала.
Для определения лекарственной чувствительности (ЛЧ) МБ к противотуберкулезным препаратам с помощью культурального метода используют первичную культуру МБ. Существует 3 основных метода непрямого определения ЛЧ МБ: метод пропорций, метод коэффициента устойчивости и метод абсолютных концентраций на плотных и жидких средах. В России и большинстве стран мира наиболее распространенным и традиционно используемым методом определения ЛЧ МБ является непрямой метод абсолютных концентраций на плотной яичной питательной среде Левенштейна–Йенсена. Остальные методы определения ЛЧ МБТ являются альтернативными. Основным недостатком традиционных культуральных методов определения ЛЧ МБТ, является их чрезвычайная длительность. Результаты исследования ЛЧ первичной культуры МБ учитываются через 3–4 недели инкубации для плотных и 4-13 дней для жидких питательных сред, поэтому необходимая коррекция химиотерапии может быть проведена не ранее, чем через 10–60 дней или 40–120 дней, в зависимости от используемых питательных сред, от момента поступления в лабораторию диагностического материала.
Определение ЛЧ с помощью молекулярно-биологических методов основано на выявлении мутаций, ассоциированных с развитием лекарственной устойчивости к ПТП. Основное преимущество таких методов заключаются в скорости получения результатов анализа – 1–2 дня, что достигается вследствие возможности использования для тестирования непосредственно клинического материала, хотя возможно использование также и первичной культуры.
Необходимо учитывать, что наборы реагентов, основанные на применении разных методов, характеризуются разными показателями чувствительности и специфичности. Гибридизационные технологии, такие как ДНК-микрочипы, могут обнаруживать только конкретные мутации, внесенные в дизайн диагностических наборов и/или дикий тип МБТ. Их диагностическая чувствительность в значительной степени зависит от спектра генетических изменений штаммов МБТ, характерных для данного географического региона, в случае наличия других мутаций исследование будет давать ложноотрицательные результаты.
Метод секвенирования является «золотым стандартом» в молекулярной диагностике, он может определять любые изменения в нуклеотидной последовательности, в т. ч. протяженные инсерции и делеции. На сегодняшний день выпускаются наборы реагентов, а также специальное программное обеспечение, автоматизирующее процесс получения результатов.
Из вышеназванных исследований тестами лабораторной диагностики in vitro являются IGRA, в настоящее время представленные наборами QFT-IT и T-SPOT. TB. Исследование основано на стимуляции мононуклеарных клеток пациента антигенами, специфичными для M.tuberculosis complex, в ответ на которую высвобождается гамма-интерферон (IFN-.). АГ представлены секреторным белком 6-kDa early-secreted antigenic target (ESAT-6), его шапероном 10-kDa culture filtrate protein (CFP-10), а также дополнительным туберкулезным протеином TB 7.7 (p4) (только в наборе QFT-IT). Эти белки отсутствуют у всех вариантов вакцинного штамма M.bovis BCG и большинства НТМБ, за исключением M.kansasii, M.marinum, M.szulgai, M.flavescens и M.gastrii. Следовательно, оба теста всегда будут давать отрицательный результат при поствакцинальной аллергии или БЦЖ-ите, и ложноположительный результат при наличии в организме НТМБ: M.kansasii, M.marinum или M.szulgai, имеющих клиническое значение.
Тесты IGRA не могут дифференцировать у человека состояние инфицированности МБТ (латентный ТБ) и активный ТБ. Их результаты должны оцениваться совместно с клиническими и рентгенологическими данными, сведениями о контактах, микробиологическими исследованиями и т. д. Особое значение приобретает использование тестов IGRA в странах, где проводится вакцинация БЦЖ. В случае положительной пробы Манту и отрицательном результате теста IGRA у пациента достоверно подтверждается состояние поствакцинальной аллергии. При конверсии результатов теста IGRA, т. е. при изменении отрицательного результата на положительный, риск последующего развития активного туберкулезного процесса не увеличивается. У иммуносупрессивных пациентов IGRA-тесты, как и проба Манту, будут отрицательными, что не может исключить у них активного туберкулезного процесса.
Наиболее удобно применять тесты IGRA у пациентов, ранее вакцинированных против ТБ, у лиц, имеющих противопоказания к проведению кожного теста, у детей, а также у тех пациентов, которым сложно попасть на повторный прием к врачу через 72 часа для определения результатов пробы Манту. В зарубежной практике тесты IGRA используют вместо или вместе с пробой Манту, во многих странах такие исследования закреплены законодательно.
IGRA-тесты являются качественными, их результаты выдаются в категориях: положительный, отрицательный и неопределенный.
Положительный результат означает текущую инфекцию МБТ, но не позволяет дифференцировать недавнее инфицирование МБТ от ранее произошедшего, а также оценить степень активности туберкулезного процесса.
Отрицательный результат чаще означает отсутствие МБТ в организме человека, но может наблюдаться и при супрессии Т-клеточного звена иммунной системы, наступившей вследствие иммунодефицитного состояния, в т. ч. и при прогрессировании туберкулеза. В этом случае следует ориентироваться на результаты прямых методов исследования, подтверждающих специфическую природу заболевания.
В редких случаях результаты тестов не могут быть интерпретированы вследствие не прохождения положительного контроля теста и оцениваются как неопределенные. В этом случае нельзя ни подтвердить, ни исключить туберкулезную инфекцию.
Следует помнить, что у части больных не удается обнаружить МБТ традиционными микробиологическими методами и даже методом ПЦР (если не проводится биопсийный забора материала). В этих случаях диагноз ТБ будет основываться на клинических данных, результатах косвенных методов диагностики и терапии ex juvantibus, а принимаемые по этому поводу решения полностью зависят от квалификации и опыта врача-фтизиатра. Вследствие этого, учитывая биологические особенности микроорганизма, а также иммунного ответа организма человека, диагностика ТБ не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Показания к применению лабораторных исследований для диагностики туберкулеза у больных ВИЧ-инфекцией и особенности интерпретации их результатов. Основной принцип диагностики туберкулеза у больных ВИЧ-инфекцией такой же, как и у пациентов с ВИЧ-негативным статусом – выявление достоверных признаков специфического воспаления (детекция возбудителя либо морфологическая верификация).
Самым важным в диагностике туберкулеза у больных ВИЧ-инфекцией является выявление возбудителя. У этой категории больных частота выявления МБТ из мокроты уменьшается по мере снижения количества CD4+лимфоцитов (ввиду снижения регистрации деструктивных форм). Однако при глубоком иммунодефиците (менее 100 клеток/мкл), вероятность обнаружения МБТ повышается (за счет огромного количества возбудителя в легочной ткани). Важно отметить, что у больных полиорганным туберкулезом не менее ценным, чем исследование мокроты, является выявление возбудителя в другом диагностическом материале. Поэтому необходим обязательный поиск МБТ в любых биологических жидкостях и биопсийном материале. Также для детекции МБТ целесообразно применять молекулярно-биологические методы, чувствительность и специфичность которых значительно превосходит традиционные микробиологические методы.
Туберкулиновая чувствительность у больных с активным туберкулезом на фоне ВИЧ-инфекции снижается по мере прогрессирования иммунодефицита, и у пациентов с количеством CD4+лимфоцитов менее 100 клеток/мкл частота регистрации положительной пробы Манту с 2 ТЕ не превышает 10%, а при количестве CD4 клеток более 500/мкл она сопоставима с группой больных без ВИЧ-инфекции (до 95%). Проведенные клинические исследования показали, что при высокой специфичности Диаскинтеста (до 100%), чувствительность этого диагностического метода также снижается по мере уменьшения количества CD4+лимфоцитов и сопоставима с чувствительностью реакции Манту.
При неинформативности туберкулинодиагностики, Диаскин- и IGRA-тестов, снижении вероятности выявления МБТ в мокроте и расширении дифференциально- диагностического ряда за счет других вторичных заболеваний в диагностике специфического процесса важную роль приобретает малоинвазивная хирургия с целью морфологической верификации туберкулезного процесса. Морфология туберкулезного воспаления тесно связана с состоянием иммунной системы больного и в значительной степени зависит от него. Гистоморфологические проявления туберкулезного воспаления при ВИЧ-инфекции утрачивают свои специфические признаки по мере ее прогрессирования. У больных с количеством СD4+лимфоцитов более 350 клеток/мкл сохраняется способность к формированию типичной гранулематозной реакции. В биоптатах пациентов с более тяжелой степенью иммуносупрессии (число СD4+лимфоцитов 200–350 в мкл) преобладает несовершенная стертая гранулематозная реакция. Это свидетельствует о смене реакции гиперчувствительности замедленного типа, типичной для туберкулеза, реакцией гиперчувствительности немедленного типа. Состояние выраженного иммунодефицита (при количестве СD4+лимфоцитов менее 200 клеток/мкл), характеризуется в большинстве случаев некротическими изменениями с выраженным экссудативным компонентом воспаления. Однако при проведении микроскопии препаратов биопсии с окраской по Циль-Нильсену обнаруживаются кислотоустойчивые бактерии в большом количестве (20-50 и более в одном поле зрения). В связи с этим у больных ВИЧинфекцией, особенно на фоне выраженной иммуносупрессии, важно проведение комплексного поэтапного изучения биопсийного материала с проведением микроскопии препаратов с окраской по Цилю-Нильсену, микроскопических исследований с применением методов иммуногистохимии (использование моноклональных АТ к M. tuberculosis) и ПЦР для выявления ДНК МБТ в нативном материале и из парафиновых гистологических блоков. Обнаружение микобактерий в кале, мокроте или бронхоальвеолярном лаваже при отсутствии клинической симптоматики может свидетельствовать только о колонизации слизистых оболочек.