Обеспечит прозрачную цепочку движения лекарств что поможет решить вопрос с фальсификатом
Российские аптеки на пути к цифровизации
Каковы преимущества быстрой цифровизации фармацевтики, и кому она нужна больше всего?
По словам В. Андосовой, главы российской ФармХаб, занимающейся разработкой и установкой цифровых технологий в фармацевтике, цифровизация отрасли даст множество преимуществ. Вот главные из них: она обеспечит прозрачную цепочку движения лекарств. Это поможет решить вопрос с фальсификатом, и в этом заинтересованы как покупатели, которые хотят быть уверенны в том, что приобретают оригинальный препарат, так и производители, которые, благодаря прозрачности отрасли и уверенности покупателей повысят лояльность к своему бренду, а значит, продажи вырастут. цифровизация поможет автоматизировать отрасль, и аптеки получат возможность прогнозировать и управлять данными по лекарственным препаратам, принимать рациональные решения о закупках и хранении.
Специалисты считают, что убыточные аптеки могут быть вполне прибыльны, а прибыльные сверхприбыльны, если систематизировать процесс работы в любой, даже небольшой аптеке, тщательно, аккуратно и на ежедневной основе работать с сотней партнеров, с каждой из условных десяти тысяч позиций ассортимента и с каждой из условных двадцати тысяч упаковок. Всем должны заниматься у них хватит на это времени, упорства и внимания. Современная система рассчитает, сколько, чего и когда надо заказать с учетом оборота, сроков хранения и предпочтений покупателя, поможет проконсультировать, даст возможность сэкономить и заработать.
Слабое звено

По мнению многих экспертов, именно ввод в действие системы мониторинга движения лекарственных препаратов (МДЛП) и сыграл основную роль в возникновении дефицита: лекарства на складах у производителя и дистрибьютора были, но в аптеки они попасть не могли. Или их не могли продать пациенту, так как не было соответствующего ответа из системы МДЛП. Это заставило многих задуматься: можно ли было предотвратить негативный сценарий?
В результате где-то увеличились сроки поставок, в других случаях лекарства оказались просто заблокированными на складах. По данным Ассоциации международных фармацевтических производителей, только у ее компаний заблокированными к концу октября оказались более 40 миллионов упаковок по 450 международным непатентованным наименованиям (МНН), среди которых были и лекарства из списка жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП). В ассоциации отмечали, что развязать «цифровые узлы» можно было только в ручном режиме после обращений в службу технической поддержки оператора системы. Последняя же оказалась перегруженной запросами из всех звеньев.
Когда система перешла из пилотного режима в промышленный, она не сумела справиться с обработкой возросших объемов данных.
Рынок держался на запасах немаркированных лекарств, выпущенных в оборот ранее, сколько мог. А потом и начались те самые перебои с лекарствами в аптечной рознице, которые фиксировали все регионы и которые стали обостряться из-за резкого роста заболеваемости COVID-19 и сезонных инфекций. На совещании с членами правительства 18 ноября президент России призвал не перекладывать вину за дефицит лекарств на граждан, отметив, что рост спроса был ожидаемым.
Исправлять ситуацию начали благодаря решению правительства, которое со 2 ноября перевело работу системы в уведомительный режим. В результате, работая по ночам и выходным и по большей части в ручном режиме, производители постепенно улучшают ситуацию с отгрузками. Для них все операции в системе МДЛП остаются обязательными до этапа ввода продукции в гражданский оборот. К этой точке нужно до семи раз направить отчеты в систему и получить положительный ответ из нее. Некоторое упрощение позволило лишь не блокировать движение товара на таможне, отмечают участники рынка.
Международная фарминдустрия с самого начала поддержала проект по мониторингу движения лекарств по всей цепи поставок от производителя до пациента. Поддерживает ее и сегодня. Как отмечает Владимир Шипков, огромные средства были инвестированы компаниями как на этапе пилотного проекта, так и при подготовке к старту, хотя новые вводные в виде «криптохвоста» и централизованной эмиссии кодов на стороне оператора все процессы сильно усложнили.
Однако регуляторы по-прежнему не слышат индустрию и профессиональное сообщество и демонстрируют в этом неоправданное упорство, считает Владимир Шипков. Эксперты отрасли отмечают ключевые вопросы, которые необходимо успеть решить до 1 февраля 2021 года:
— четко определить причины сбоев и механизмы их решения;
— установить этапность возврата к полноценной работе системы, при этом переход к следующему этапу должен базироваться на оценке работоспособности предыдущего в соответствии с критериями показателей качества работы системы, установленными оператором системы по согласованию с Минздравом России и Росздравнадзором;
— установить механизм «сброса» накопленных данных, введенных в период сбоев и уведомительного режима, с учетом массива ошибок, накопленных за это время в системе, а также отсутствия полных данных о движении лекарств по всей цепочке поставок.
Одновременно предлагается предусмотреть внесение изменений в федеральное законодательство в отношении ответственности участников, установив мораторий на штрафные санкции к ним до полной нормализации работы МДЛП. Необходим также технически и законодательно оформленный «план Б» на случай продолжения сбоев после 1 февраля или 1 июля 2021 года. Сегодня производители, по сути, тестируют систему в своей части и не должны пострадать после нового запуска системы в промышленный контур.
Реваз Юсупов, заместитель генерального директора Центра развития перспективных технологий:
— Подготовка отрасли к работе с маркированными препаратами длилась 3,5 года. Несмотря на то что работа в системе с 1 июля 2020 года является лицензионным требованием, до сих пор есть компании и медорганизации, которые так и не подключились к системе. А 17 тысяч компаний (в первую очередь оптово-розничного звена) присоединились уже после 1 июля, хотя вся отрасль к этому дню уже должна была работать в системе. Эти участники должным образом не доработали учетные системы и не протестировали процессы. Несвоевременная, спешная и часто некачественная подготовка и интеграция компаний с системой маркировки на фоне COVID-19 и ажиотажного спроса на лекарства привели к тому, что компании создали ненужную нагрузку и на свои внутренние системы, и на систему маркировки.
Перевод системы в уведомительный режим позволил устранить сложности, которые возникали у ряда участников в силу их неполной готовности к работе в новых условиях.
На данный момент маркировка не является фактором, который негативно влияет на скорость движения лекарств и их доступность. Как признают сами компании, скорость движения препаратов между дистрибьюторами и аптеками возросла, затруднений нет, партии лекарств доходят до потребителей. На сегодня 99 процентов всех документов в системе обрабатывается быстрее двух минут.
При этом важно помнить, что доля маркированных лекарств не превышает 10-15 процентов от общего числа. Поэтому сложности, которые некоторые компании могли испытывать при работе в системе, не могли стать причиной дефицита препаратов, из них более 85 процентов вообще не имеют маркировки и могут законно находиться в обороте до окончания срока годности. Сейчас уже можно констатировать, что маркировка не могла быть причиной недостатка лекарств, о котором сообщали из ряда регионов.
Противодействие незаконному обороту
Обеспечение безопасности пациентов и эффективности лекарственных препаратов «Рош» — наш главный приоритет. Контрафактные и фальсифицированные лекарственные препараты представляют значительный риск для безопасности пациентов. Вот почему мы ставим нашей целью своевременное выявление и предотвращение их незаконного распространения.
О фальсификате
Фальсифицированное лекарственное средство — это лекарственное средство, сопровождаемое ложной информацией о его составе и (или) производителе.
Часто поддельный лекарственный препарат выглядит как настоящий, это может ввести в заблуждение не только пациента, но и врача. Пациент думает, что принимает настоящее лекарство, но на самом деле он находится в опасности.
Подделка лекарственных препаратов — это незаконная деятельность, которая имеет серьезные последствия для общественного здравоохранения и безопасности пациентов.
О контрафакте
Контрафактное лекарственное средство — лекарственное средство, находящееся в обороте с нарушением гражданского законодательства.
Контрафактные лекарственные средства также представляют потенциальную опасность для пациентов. Для таких препаратов невозможно подтвердить легальность цепи поставки, а значит и соблюдение необходимых условий хранения/транспортировки, что является обязательным условием для поддержания надлежащего качества лекарственных препаратов.
Комплексный подход
Компанией «Рош» разработана комплексная система по выявлению, немедленному реагированию и информированию обо всех фактах подозрения на фальсификацию/контрафакт продукции:
Данный веб-сайт содержит информацию для пациентов и специалистов в области медицины и фармацевтики России, и может содержать информацию по продукции «Рош», по тем или иным причинам не доступную или не являющуюся официально утвержденной в вашей стране. Информация на данном сайте не должна использоваться для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Мониторинг движения лекарственных препаратов (маркировка лекарств)
Правительством Российской Федерации в числе основных направлений определена работа по модернизации процесса движения лекарственных препаратов в соответствии с лучшими международными практиками, в том числе по унификации и упрощению процедур вывода лекарств на рынок без ущерба качеству, проведению мониторинга ассортиментной политики и цен на лекарственные препараты, совершенствованию методики регистрации предельных отпускных цен производителей на жизненно необходимые лекарственные препараты, мониторингу движения лекарственных препаратов для медицинского применения от производителя до конечного потребителя с использованием средств идентификации.
Ключевые участники приоритетного проекта:
Субъекты обращения лекарственных препаратов:
Цель приоритетного проекта:
Основными ресурсами, освещающими реализацию проекта МДЛП, являются официальные сайты Минздрава России, Росздравнадзора, Национальной системы цифровой маркировки «Честный знак». Информации в соответствующих разделах много, но в сегменте вопросов, касающихся медицинских организаций, она крайне дозированная и отвечает далеко не на все вопросы. При этом важно разобраться, что находится в силах и компетенции самой медицинской организации, и к чему придется тщательно готовиться, особенно к тем аспектам процесса лекарственного обеспечения, на которые система МДЛП влияет опосредованно, без регуляторного или технического воздействия.
Система мониторинга движения лекарственных препаратов будет внедряться с 01.07.2020 одномоментно по всей стране, вовлекая огромное число субъектов обращения лекарственных препаратов. По официальным оценкам в системе будут зарегистрированы около тысячи производителей и держателей регистрационных удостоверений на лекарственные препараты, порядка 2,5 тысяч оптовых фармацевтических организаций и 350 тысяч медицинских и аптечных организаций, не говоря о том, что эта система коснется всех без исключения конечных потребителей — пациентов, а это, без преувеличения, всё население Российской Федерации.
Эксперимент по внедрению системы маркировки лекарств в соответствии с Постановлением Правительства РФ от 24.01.2017 № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» (вместе с «Положением о проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения») стартовал в начале 2017 года и закончится непосредственно перед переходом к промышленной эксплуатации в конце 2019 года. Промежуточные результаты и опыт добровольных участников эксперимента уже сегодня объективно показывают, что задачи, стоящие перед субъектами оборота лекарственных препаратов, далеко не простые и требуют серьезной подготовки, как организационной, так и финансовой.
При подготовке к внедрению системы МДЛП руководству медицинской организации необходимо самым тщательным образом подойти к оценке готовности и достаточности всех видов её ресурсов.
Человеческий ресурс
Трудоёмкость приемки товара при внедрении системы маркировки неизбежно возрастает, особенно, если мест приемки и выбытия лекарств из гражданского оборота в организации несколько. Частично решить этот вопрос можно при применении автоматизированных средств оптимизации считывания кодов с упаковок, но на рынке пока нет доступных решений, которые бы подходили для данных целей.
Места хранения
С 29.11.2019 ст. 67 Федерального закона от 12.04.2010 № «Об обращении лекарственных средств» дополняется ч. 7.1 в следующей редакции «Лекарственные препараты для медицинского применения, введенные в гражданский оборот до 1 января 2020 года, подлежат хранению, перевозке, отпуску, реализации, передаче, применению без нанесения средств идентификации до истечения срока их годности.». Это значит, что с 1 января 2020 года поток медикаментов разделится на маркированный подтвержденный, маркированный неподтвержденный и немаркированный, что потребует увеличения площадей и мест хранения препаратов, так как совместное хранение этих групп товаров может привести к нарушению требований системы мониторинга движения.
С учетом вышеописанных возможных проблем с увеличением длительности проведения закупочных процедур необходимо пересмотреть в сторону увеличения нормативы складских запасов лекарств, которые смогут обеспечить непрерывность лечебно-диагностического процесса в случае непредвиденных обстоятельств.
Финансовый ресурс
Вышеуказанный прирост численности работников требует увеличения фонда оплаты труда. Потребуются затраты на организацию новых рабочих мест, оснащенным специальным оборудованием, оптимизацию систем хранения, увеличение объемов складских запасов, а также на закупку или развитие информационных систем. Это существенные затраты для любой организации, их надо планировать и своевременно изыскивать.
Время
Временные затраты на администрирование всех этапов движения лекарственных препаратов также вырастут, этот фактор крайне важно заложить в систему управления производственными процессами.
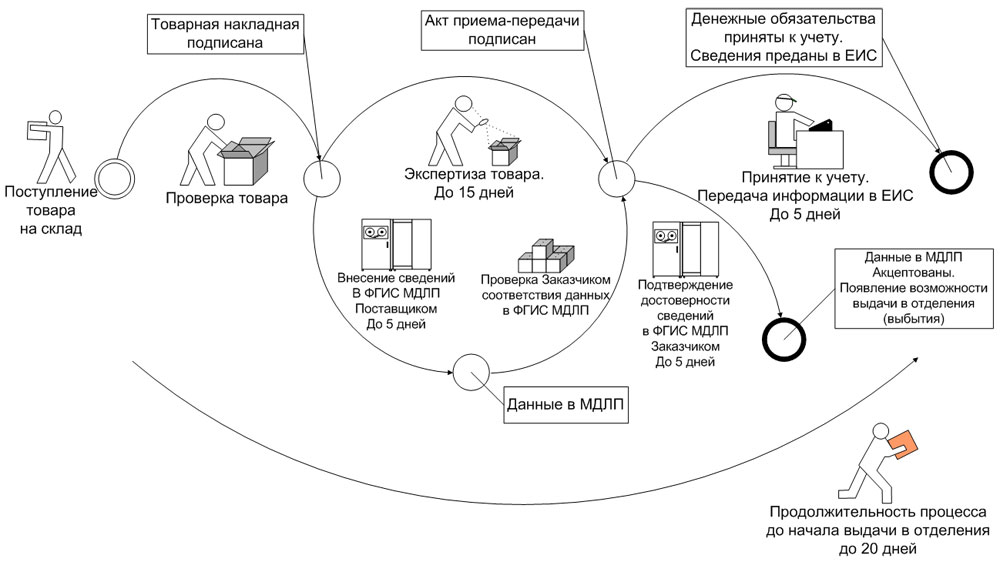
Одним из важнейших аспектов внедрения системы МДЛП для медицинского учреждения является необходимость перенастройки порядка взаимодействия с поставщиками лекарственных препаратов. В соответствии с п. 44 Положения о системе мониторинга движения лекарственных препаратов для медицинского применения, утвержденного Постановлением Правительства Российской Федерации от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» (далее — Положение) при передаче лекарственных препаратов между субъектами обращения внесение информации в ФГИС МДЛП может происходить двумя способами:
При этом решение о выборе типа порядка предоставления сведений принимается субъектами обращения лекарственных препаратов, предоставляющими данные сведения, самостоятельно. Это решение необходимо закрепить в контракте на поставку лекарственных препаратов.
Прямой порядок
В случае выбора прямого порядка предоставления сведений субъект обращения, осуществляющий передачу лекарственных препаратов другому субъекту обращения в рамках гражданско-правовых отношений (поставщик), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты отгрузки лекарственных препаратов предоставляет об этом в ФГИС МДЛП сведения, предусмотренные пунктом 2 приложения № 6 к Положению.
При этом субъект обращения, осуществляющий приемку лекарственных препаратов от другого субъекта обращения ЛП в рамках гражданско-правовых отношений (заказчик, медицинская организация), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки лекарственных препаратов и регистрации в ФГИС МДЛП сведений об отгруженных медикаментах, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о принимаемых лекарственных препаратах, предоставляя об этом сведения в ФГИС МДЛП, предусмотренных пунктом 4 приложения № 6 к Положению (рис. 1).
Рис. 1. Прямой способ внесения информации в ФГИС МДЛП
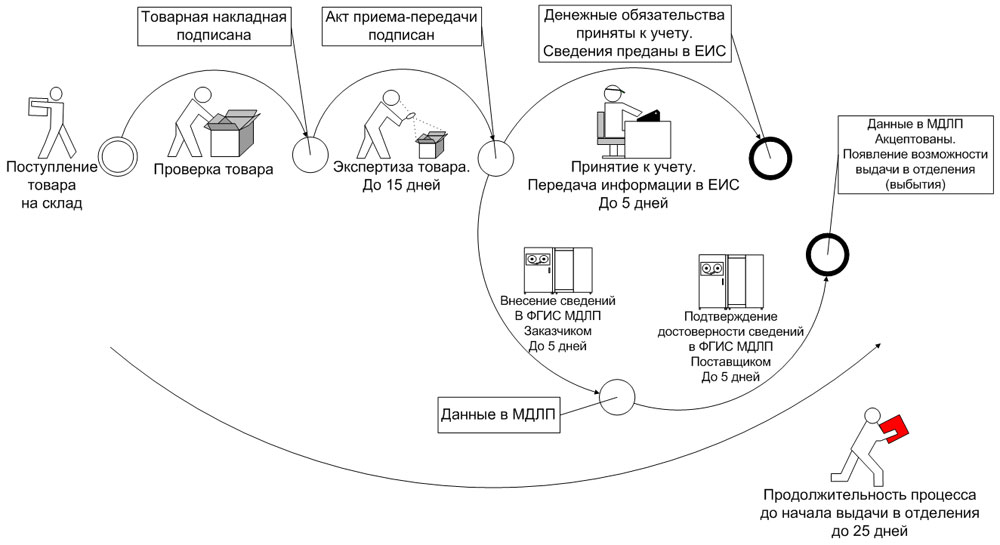
Обратный порядок
В случае выбора обратного порядка предоставления сведений субъект обращения, осуществляющий приемку медикамента от другого субъекта обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на ЛП, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки ЛП предоставляет в ФГИС МДЛП сведения о принятых ЛП, предусмотренные пунктом 3 приложения № 6 к Положению.
При этом субъект обращения, осуществивший передачу лекарства другому субъекту обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты регистрации в ФГИС МДЛП сведений о принятом товаре, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о переданных лекарственных препаратов, предоставляя об этом сведения в ФГИС МДЛП, предусмотренные пунктом 4 приложения № 6 к Положению (рис. 2).
Рис. 2. Обратный способ внесения информации в ФГИС МДЛП
В ходе подготовки к работе в новых условиях системы МДЛП важно учесть особенности медицинской организации в части её системы финансирования, организационной структуры, наличию удаленных (обособленных) подразделений, организации закупок лекарственных препаратов, в том числе участие в централизованных поставках и иные аспекты деятельности, обусловливающие многочисленные внутренние и внешние взаимосвязи, необходимые для бесперебойной работы системы лекарственного снабжения, и проводить внедрение новой системы в контексте данных качественного анализа деятельности организации.
* На заседании рабочей группы Росздравнадзора было принято решение о внесении изменений в Положение, предусматривающих сокращение сроков регистрации операций в ИС МДЛП по передаче лекарственных препаратов всеми участниками до 1 рабочего дня, в целях соблюдения приоритета интересов пациента и предоставления медицинской организации возможности выполнения требований законодательства в сфере охраны здоровья, обращения лекарственных препаратов и закупок (контрактной системы) без нарушений.
Как учитывать выявленный в аптеке фальсификат?
Автор: Стародубцева И.В., эксперт журнала
По информации Всемирной организации здравоохранения Россия находится в числе лидеров по распространению и потреблению поддельных лекарств (так называемых фальсификатов). Пальму первенства здесь держат интернет-аптеки. Но и обычные аптеки не застрахованы от обнаружения поддельных лекарственных средств, о чем свидетельствуют данные проведенных Росздравнадзором контрольных мероприятий по выявлению фальсификата.
Не рассматривая причины такого печального лидерства, остановимся на порядке бухгалтерского и налогового учета выявленного фальсификата в аптеках. Но прежде скажем несколько слов, что же все-таки им считается.
Понятие фальсификата.
Фальсифицированное медицинское изделие – это медицинское изделие, сопровождаемое ложной информацией о его характеристиках и (или) производителе (изготовителе). Недоброкачественное медицинское изделие – медицинское изделие, не соответствующее требованиям нормативной, технической и (или) эксплуатационной документации производителя (изготовителя) либо в случае ее отсутствия требованиям иной нормативной документации. А контрафактное медицинское изделие – это медицинское изделие, находящееся в обороте с нарушением гражданского законодательства (пп. 12 – 14 ст. 38 Закона № 323-ФЗ и пп. 37 – 39 ст. 4 Закона № 61-ФЗ, Постановление АС СЗО от 04.05.2018 № Ф07-3264/2018 по делу № А56-12992/2017).
Поддельные лекарства запрещены к продаже, а обнаруженный в аптеке фальсификат подлежит немедленному уничтожению (ст. 57, п. 1 ст. 59 Закона № 61-ФЗ).
Приказом Минздрава России от 31.08.2016 № 646н утверждены Правила надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения (далее – Правила), устанавливающие требования к условиям хранения и перевозки лекарственных препаратов, а также минимизации риска проникновения фальсифицированных, недоброкачественных, контрафактных лекарственных препаратов в гражданский оборот. Указанные правила распространяются на производителей лекарственных препаратов, организации оптовой торговли лекарственными препаратами, аптечные организации, индивидуальных предпринимателей, имеющих лицензию на фармацевтическую деятельность.
Ответственность за торговлю фальсификатом.
Административная ответственность за производство, продажу или ввоз на территорию РФ фальсифицированных лекарств, медицинских изделий предусмотрена ст. 6.33 КоАП РФ.
Штрафуемые лица
Наказание
Штраф в размере от 100 тыс. до 600 тыс. руб.
Штраф в размере от 100 тыс. до 600 тыс. руб. или приостановление деятельности на срок до 90 суток
Штраф в размере от 1 млн до 5 млн руб. или приостановление деятельности на срок до 90 суток
Поскольку продажа недоброкачественного лекарственного препарата не только создает угрозу жизни и здоровью человека, но и может повлечь ухудшение самочувствия граждан после приема лекарственного средства, суды, как правило, не усматривают оснований для замены административного наказания в виде штрафа на предупреждение (Определение ВС РФ от 16.11.2018 № 305-АД18-18299, Решение Арбитражного суда Архангельской области от 21.06.2018 по делу № А05-2733/2018, Постановление Калининградского областного суда от 22.11.2016 по делу № 4А-509/2016).
Документальное оформление изъятия и уничтожения фальсификата.
Как следует из ст. 59 Закона № 61-ФЗ, недоброкачественные, фальсифицированные и контрафактные лекарственные средства подлежат изъятию из гражданского оборота и уничтожению в связи с их потенциальной опасностью и несоответствием требованиям законодательства в сфере обращения лекарственных средств. Основаниями для уничтожения лекарственных средств являются решение владельца лекарственных средств, решение соответствующего уполномоченного федерального органа исполнительной власти или решение суда.
Порядок уничтожения изъятых фальсифицированных, недоброкачественных и контрафактных медицинских изделий устанавливается Правительством РФ, а расходы, связанные с их уничтожением, возмещаются их владельцем.
Итак, фармацевт, сверив данные о препарате на официальном сайте Росздравнадзора либо с информационными письмами Росздравнадзора, обнаружил в аптеке фальсифицированные лекарственные препараты. Алгоритм действий будет следующим.
Во-первых, нужно составить акт об обнаружении фальсификата. Законодательно соответствующая форма не установлена, но с опорой на требования об обязательных реквизитах первичного документа акт должен содержать (п. 2 ст. 9 Закона № 402-ФЗ):
дату составления документа;
наименование аптечной организации, составившей документ;
содержание факта хозяйственной жизни;
величину натурального и (или) денежного измерения факта хозяйственной жизни с указанием единиц измерения;
наименование должности лиц, совершивших сделку, операцию и ответственных за ее оформление, либо наименование должности лиц, ответственных за оформление свершившегося события;
подписи данных лиц с указанием их фамилий и инициалов либо иных реквизитов, необходимых для идентификации этих лиц.
Примерный образец акта представлен ниже.
Общество с ограниченной ответственностью «Аптека «Витаминка»
об обнаружении поддельных лекарственных средств
Комиссия в составе заведующей аптекой (А. М. Ивановой), фармацевта (М. С. Петровой), бухгалтера (М. К. Сидоровой) составила настоящий акт о том, что ей были выявлены следующие фальсифицированные лекарственные средства:
Реквизиты письма Роскомнадзора, согласно которому лекарственное средство считается фальсифицированным
Отличительные признаки
фальсификата
Покупная стоимость, руб.
Сведения о поставке препарата
Реквизиты
документа
поставщика
Толперизон-OBL серии 120517
120 упаковок таблеток
От 07.12.2017 № 01И-3042/17
Отличается по высоте таблеток и растворяется дольше оригинала
УПД № 241/8 от 20.12.2018
Итого по акту 120 упаковок таблеток общей покупной стоимостью 500 (пятьсот) рублей.
Приведенные в акте фальсифицированные лекарственные средства изъяты из аптечного оборота, помещены на карантин и подлежат уничтожению.
Во-вторых, необходимо поместить фальсификат в отдельную карантинную зону вместе с копией составленного акта, заверенного печатью и подписью заведующего аптекой.
В-третьих, фальсификат необходимо уничтожить. Уничтожением фальсификатов занимаются специализированные организации, имеющие лицензию на сбор, использование, обезвреживание, транспортировку и размещение отходов I – IV классов опасности, на специально оборудованных площадках, полигонах и в специально оборудованных помещениях с соблюдением требований по охране окружающей среды в соответствии с законодательством РФ (п. 8 Правил).
Специализированная организация составляет акт на уничтожение фальсификата, в котором должны содержаться:
дата и место уничтожения лекарственных средств;
Ф. И. О. лиц, принимавших участие в уничтожении лекарственных средств, их места работы и должности;
обоснование уничтожения лекарственных средств;
сведения об уничтоженных лекарственных средствах (наименование, лекарственная форма, дозировка, единицы измерения, серия) и их количестве, а также о таре или упаковке;
наименование производителя лекарственных средств;
сведения о владельце лекарственных средств;
способ уничтожения лекарственных средств.
Акт об уничтожении лекарственных средств составляется в день уничтожения фальсификата. Количество экземпляров этого акта определяется по числу сторон, принимавших участие в уничтожении указанных лекарственных средств. Акт подписывается всеми лицами, принимавшими участие в уничтожении указанных лекарственных средств, и заверяется печатью организации, осуществляющей уничтожение лекарственных средств (п. 11 и 12 Правил).
Таким образом, в аптеке должны иметься акт об обнаружении фальсификата и акт о его уничтожении.
Бухгалтерский учет списания и уничтожения фальсификата.
Стоимость выявленного фальсификата списывается со счета 41 «Товары» в дебет счета 94 «Недостачи и потери от порчи ценностей» (пп. «б» п. 29 Методических указаний по бухгалтерскому учету материально-производственных запасов, Инструкция по применению Плана счетов бухгалтерского учета финансово-хозяйственной деятельности организаций).
В бухгалтерском учете такие операции отражаются следующими записями:
Содержание операции
Дебет
Кредит
Отражено внутреннее перемещение лекарственных средств (помещение лекарственного средства в карантинную зону на основании акта об обнаружении поддельных лекарственных средств)
41 «Товары» субконто «Карантинная зона»
41 «Товары» субконто «Торговый зал»
Учтена стоимость работ специализированной компании по уничтожению лекарственных средств*
Учтена стоимость НДС в части работ по уничтожению лекарственных средств
Отражен НДС в составе прочих расходов**
Списана стоимость лекарственных средств на основании акта об уничтожении фальсификата
41 «Товары» субконто «Карантинная зона»
Отражен финансовый результат (убыток) от списания уничтоженных лекарственных средств
* Стоимость услуг специализированной организации по уничтожению фальсификата признается в составе прочих расходов на основании акта приемки-сдачи оказанных услуг (п. 11 и 18 ПБУ 10/99).
** См. раздел «Порядок учета НДС при списании и уничтожении фальсификата».
Поскольку в данной ситуации виновные лица не установлены, убытки от недостачи товаров списываются на финансовые результаты компании (п. 11 ПБУ 10/99 «Расходы организации», Инструкция по применению Плана счетов).
Налоговый учет списания и уничтожения фальсификата.
Порядок налогового учета списания и уничтожения фальсификата зависит от применяемой аптекой системы налогообложения.
Аптека применяет специальные налоговые режимы
В том случае, если аптека применяет «вмененку», операции изъятия из оборота с последующим уничтожением никак не скажутся на едином налоге на вмененный доход, поскольку расчет ЕНВД производится с учетом площади торгового зала, базовой доходности и корректирующих коэффициентов (п. 1 ст. 346.29 НК РФ).
В части «доходной» «упрощенки» аптека также не учтет данные операции в налоговой базе.
А если аптека применяет УСНО с объектом налогообложения «доходы, уменьшенные на величину расходов», возможность учета тех или иных затрат определяется перечнем расходов, предусмотренным п. 1 ст. 346.16 НК РФ. Затраты на уничтожение фальсификата в приведенном закрытом перечне расходов отсутствуют.
Аптека применяет ОСНО
Как уже было отмечено, нормы действующих актов законодательства устанавливают обязанность уничтожения обнаруженных аптекой фальсифицированных лекарственных средств (п. 6 ст. 47 Закона № 61-ФЗ). А потому расходы в виде стоимости самого фальсификата, а также расходы, связанные с уничтожением таких лекарственных средств, могут быть учтены для целей налогообложения прибыли при условии документального подтверждения подобных расходов (п. 1 ст. 252, пп. 49 п. 1 ст. 264 НК РФ, письма Минфина России от 04.05.2012 № 03-03-06/1/227, от 08.07.2008 № 03-03-06/1/397, УФНС по г. Москве от 25.11.2009 № 16-15/123920).
Такими подтверждающими документами могут быть решения владельца недоброкачественных лекарственных средств об их изъятии, уничтожении, договор с организацией, осуществляющей уничтожение лекарственных средств с копией лицензии организации, осуществляющей уничтожение лекарственных средств на право ведения такой деятельности, акт об уничтожении лекарственных средств (постановления АС МО от 04.04.2017 № Ф05-3541/2017 по делу № А40-81669/2016, от 28.05.2014 № Ф05-4671/14 по делу № А40-115533/13).
Аптека совмещает ОСНО и спецрежим в виде ЕНВД
Аптека может совмещать традиционную систему налогообложения (например, в отношении оптовой продажи лекарственных препаратов) со спецрежимом в виде ЕНВД (розничные продажи физическим лицам).
В этом случае порядок учета расходов на списание и уничтожение фальсификата зависит от его предназначения. Если такие препараты отпускаются только в розницу (в отношении которой аптека уплачивает ЕНВД), их стоимость не учитывается при определении налоговой базы.
Если выявленный фальсификат отпускается только в рамках ОСНО, порядок налогового учета аналогичен порядку, изложенному выше.
Если выявленный фальсификат предназначался как для розницы, так и для опта, расходы на уничтожение фальсификата и стоимость самого фальсификата должны быть распределены между этими видами деятельности. В такой ситуации действует порядок, предусмотренный п. 9 ст. 274 НК РФ: расходы распределяются пропорционально доле доходов от деятельности, относящейся к спецрежиму в виде ЕНВД, в общем доходе по всем видам деятельности. Та часть расходов, которая относится к ОСНО, учитывается при наличии документального подтверждения списания и уничтожения фальсификата, а оставшаяся часть расходов, относящаяся к деятельности, облагаемой ЕНВД, не признается в налоговом учете.
Порядок учета НДС при списании и уничтожении фальсификата.
Операции по изъятию поддельных лекарственных средств не являются реализацией в смысле п. 1 ст. 39 НК РФ и, соответственно, НДС не облагаются. При этом возникает вопрос о необходимости восстановления сумм «входного» НДС, ранее принятого к вычету (пп. 1 п. 2 ст. 171, п. 1 ст. 172 НК РФ).
Напомним: случаи, когда налогоплательщик должен восстановить сумму принятого ранее к вычету НДС, четко указаны в НК РФ (п. 3 ст. 170 и ст. 171.1 НК РФ, Решение ВАС РФ от 19.05.2011 № 3943/11). Высшие судьи напомнили об исчерпывающем перечне ситуаций, в которых нужно восстанавливать НДС; в нем списание товаров в связи с изъятием из оборота не значится.
Многочисленные разъяснения Минфина предписывают восстанавливать ранее принятый к вычету НДС со стоимости товаров при их списании из-за порчи, морального устаревания, аварии, пожара или кражи (см., например, письма от 09.07.2018 № 03-03-06/1/47374, от 21.01.2016 № 03-03-06/1/1997, от 05.07.2011 № 03-03-06/1/397, от 04.07.2011 № 03-03-06/1/387). Исключение сделано для случаев уничтожения недоброкачественной продукции в соответствии с требованиями законодательства. В этом случае восстанавливать НДС не нужно, если необходимость уничтожения продукции по указанным причинам документально подтверждена (Письмо Минфина России от 23.08.2013 № 03-07-11/34617).
Так, рассматривая операцию по изъятию сотрудниками полиции контрафактной алкогольной продукции, налоговая инспекция посчитала необходимым восстановить НДС, ранее принятый к вычету. Поскольку изъятая алкогольная продукция с признаками подделки федеральных специальных марок не используется в деятельности, облагаемой НДС, применение вычетов НДС по данной алкогольной продукции необоснованно.
Но суд признал недействительным решение налоговиков. Как отметили арбитры, алкогольная продукция приобреталась компанией для последующей реализации, и на тот момент у компании отсутствовали основания полагать, что данная продукция является контрафактной и не может использоваться в деятельности, облагаемой НДС. Поэтому ранее принятый к вычету НДС со стоимости продукции при последующем ее признании контрафактной не восстанавливается (Постановление АС СЗО от 12.07.2018 № Ф07-6773/2018 по делу № А13-9057/2017).
Аналогичным образом складывается ситуация при изъятии из аптечного оборота фальсификата, который аптеки обязаны передать специализированной организации на уничтожение в силу закона. По этой же причине предъявленный специализированной организацией «входной» НДС со стоимости услуг по уничтожению фальсификата может быть принят к вычету при наличии соответствующих первичных документов (пп. 1 п. 2 ст. 171, п. 1 ст. 172, п. 2 ст.169 НК РФ).
Однако отметим, что, учитывая наличие арбитражной практики по аналогичной ситуации, правомерность такого порядка учета НДС, скорее всего, придется отстаивать в суде.