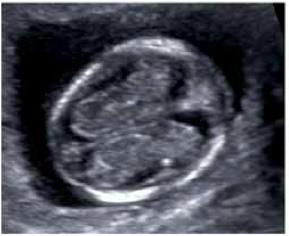
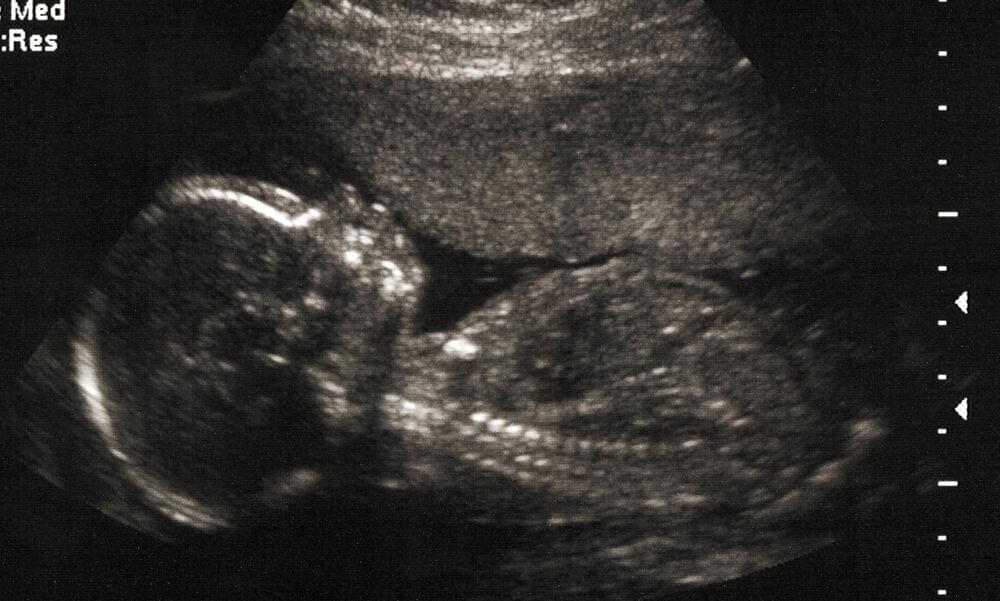
Оага при беременности что
Роль негативных факторов антенатального и интранатального периодов в формировании дезадаптации новорожденных из группы высокого риска
Изучена роль неблагоприятных материнских факторов в нарушении постнатальной адаптации новорожденных из группы высокого риска. Выявлено негативное влияние факторов анте- и интранатального периодов, в большинстве случаев сочетанных, способствовавших формиро
Meaning of adverse maternal factors in disorder of post-natal adaptation of newborn children from high-risk group was studied. Negative effect of factors of ante-natal and intra-natal periods, combined in most cases, contributing to newborns’ deconditioning, was revealed.
На этапе внутриутробного развития происходит сложный процесс формирования будущего ребенка, в связи с чем проблемы женского здоровья в различные сроки гестации, а также состояние развивающегося плода и новорожденного занимают одно из ведущих мест в современном здравоохранении [1, 2]. Наиболее частой причиной инвалидизации детского населения являются разнообразные поражения перинатального периода [3–6]. При нарушении функционирования различных систем материнского организма, ответственных за развитие адаптационных изменений в течение беременности, многочисленные физиологические приспособительные процессы становятся несовершенны [7, 8]. Это способствует формированию акушерской патологии (невынашивание, гестозы, анемия и др.), обострению хронических и/или манифестации латентных заболеваний (патология сердечно-сосудистой, мочевыводящей систем, сахарный диабет, нарушение функции надпочечников, щитовидной железы и др.). Риск перинатальной патологии возрастает при формировании осложнений беременности и родов [9–11].
Преждевременные роды остаются одной из важнейших проблем акушерства и неонатологии, так как недоношенные дети определяют уровень перинатальной заболеваемости и смертности среди новорожденных [12, 13]. Современные перинатальные технологии позволяют выхаживать недоношенных детей с очень низкой и экстремально низкой массой тела при рождении, но недоношенность рассматривается не только как маркер неблагополучного внутриутробного созревания, но и последующего постнатального развития ребенка. Снижение неонатальной смертности происходит также вследствие совершенствования акушерских оперативных технологий. Расширение показаний к проведению операции кесарева сечения (КС) позволило снизить летальность новорожденных от внутричерепной родовой травмы, синдрома респираторных расстройств [14, 15]. Однако применяемые современные методики не могут полностью нивелировать последствия воздействия патологических факторов анте- и интранатального периодов на детей из группы высокого риска (недоношенные; рожденные оперативным путем; дети, перенесшие гипоксию-ишемию и т. д.) [16–18]. В связи с этим тенденции к детальному обследованию беременных и выявлению факторов риска имеют важнейшее значение для профилактики осложнений беременности, родов и перинатальной патологии. Целью нашего исследования была оценка значимости факторов риска анте- и интранатального периодов в развитии нарушений ранней адаптации у новорожденных из группы высокого риска по развитию патологии перинатального периода.
Материалы и методы исследования
Проведено комплексное клинико-инструментальное исследование состояния здоровья 690 новорожденных группы риска в периоде ранней адаптации, распределенных в следующие группы. Основная группа: 290 детей, рожденных путем КС и перенесших церебральную гипоксию-ишемию (ЦИ). Выделены две подгруппы: первая — доношенные новорожденные со сроком гестации 38–41 неделя (39,3 ± 0,21) и массой при рождении 2750–4550 г (3358,7 ± 41,75); вторая — недоношенные 30–37 недель (35,8 ± 0,41) и массой при рождении 860–3560 г (2169,1 ± 46,11). В группу сравнения 1 включено 150 доношенных детей после КС без клинических признаков ЦИ в периоде ранней адаптации, рожденных в сроке беременности 38–40 недель (39,1 ± 0,17), с массой при рождении 2388–4450 г (3398,6 ± 144,72). Группа сравнения 2: 250 новорожденных от естественных родов с перенесенной ЦИ и подразделением на две подгруппы: первая — доношенные со сроком гестации 38–41 неделя (39,7 ± 0,23) и массой при рождении 2330–4790 г (3371,6 ± 144,36); вторая — недоношенные, рожденные в 30–37 недель (35,1 ± 0,33) с массой 700–3210 г (2136,7 ± 54,19). Критерии исключения из исследования: дети с врожденными аномалиями развития, инфекционными процессами, гемолитической и геморрагической болезнью, синдромальной формой патологии. Контрольная группа — 57 новорожденных от физиологичных беременности и родов при сроке 39–40 недель (39,5 ± 0,16), с массой при рождении 3000–4110 г (3427,3 ± 160,52), оценкой по Апгар не менее 8/8 баллов. Для изучения зависимости нарушения процессов ранней адаптации новорожденных группы повышенного риска от характера и сочетанного воздействия патологических факторов анте- и интранатального периодов проводился анализ стационарных карт матерей в исследуемых группах с оценкой акушерско-гинекологического анамнеза, соматического статуса, изучался спектр показаний к проведению родоразрешения путем КС.
Статистическая обработка полученных данных проводилась с помощью пакета прикладных программ Statistica. Количественные показатели анализировались по критерию Стьюдента с расчетом средней арифметической (М), стандартной ошибки среднего (± m) и соответствующему уровню достоверности; для сравнения качественных переменных использован критерий χ². Корреляционный анализ проводился с использованием коэффициента ранговой корреляции Спирмена.
Результаты и обсуждение
В ходе проведенного исследования состояния детей в основной группе и группе сравнения 2 зарегистрированы клинические признаки церебральной ишемии различной степени выраженности (рис. 1); у большинства формировалось нарушение процессов ранней адаптации с значительным преобладанием у новорожденных, перенесших ЦИ (χ² = 57,92, р = 0,000) (рис. 2). У всех матерей исследуемых групп был выявлен отягощенный акушерско-гинекологический анамнез (ОАГА) (табл. 1). Женщин с первой беременностью было меньше по сравнению с женщинами, имевшими первые роды (p > 0,05). При этом количество медабортов у матерей, чьи дети перенесли ЦИ (95 (33%) в основной группе, 80 (32%) в группе сравнения 2), значительно превышало аналогичный показатель в контроле (10 (18%) (χ² = 4,53, р = 0,033 и χ² = 4,01, р = 0,045)). Особенно часто самопроизвольные выкидыши, медаборты (χ² = 8,15, р = 0,004) регистрировались у женщин с преждевременными родами. По данным литературы [6, 10, 19] изменения, связанные с искусственным прерыванием, особенно первой беременности, являются наиболее частой причиной привычных выкидышей, осложнений в родах и послеродовом периоде (возникновение аномалий родовой деятельности, кровотечений, послеродовых заболеваний и др.). При искусственном аборте, воспалительных процессах происходит резкое раздражение и/или повреждение нервных окончаний, возникает патологическая импульсация в область солнечного сплетения и вегетативных центров гипоталамуса, лимбическую систему и кору головного мозга. На деятельность гипоталамо-гипофизарной системы влияет внезапное, насильственное прекращение эндокринной функции желтого тела беременности и хориона. При повторных абортах изменения в гипоталамо-гипофизарной системе могут приобрести стабильный характер, что тормозит формирование механизмов адаптации при вновь возникшей беременности, нарушается доминанта беременности. Эти условия предрасполагают не только к выкидышу, но также к развитию токсикозов в первой и второй половине беременности [20].
К факторам риска развития осложненной беременности относят воспалительные заболевания внутренних половых органов, в том числе возникшие после родов и абортов [10, 12, 19]. Следствием перенесенного воспалительного процесса могут быть морфологические и функциональные изменения в маточных трубах, нарушающие транспорт и имплантацию оплодотворенной яйцеклетки. Изменения в самом эндометрии тормозят его трансформацию, необходимую для нормальной имплантации и последующего развития зародыша, провоцируя риск выкидыша, неразвивающейся беременности. Имплантация в нижнем отделе матки формирует угрозу предлежания плаценты, преждевременной ее отслойки с высоким риском развития кровотечений и вторичным нарушением гемодинамики в системе мать–плацента–плод, что, несомненно, значительно ухудшает состояние плода и новорожденного [19, 20]. В нашем исследовании у матерей, чьи дети перенесли ЦИ, значительно чаще выявлялись хронические и/или острые воспалительные заболевания женской половой сферы (у 61 (21%) и 57 (23%) в основной группе и группе сравнения 2 по отношению к 5 (9%) случаям в контроле, χ² = 3,89, р = 0,049 и χ² = 4,83, р = 0,02 соответственно). Частота патологии, связанной с невынашиванием беременности (внематочная беременность, неразвивающаяся беременность), в исследуемых группах была сопоставимой (2–9%, p > 0,05). Обращала на себя внимание достаточно высокая представленность повторных операций КС в соответствующих группах сравнения (11–32%). Кесарево сечение, а также другие операции на матке предрасполагают к формированию ее несостоятельности в дальнейшем (дистрофические процессы, фиброз, угроза спонтанного разрыва не только в родах, но и во время беременности и др.) [14, 19, 20]. Таким образом, женщин, перенесших оперативные вмешательства на матке, можно отнести к высокой группе риска по развитию и повторяемости акушерской патологии.
На формирование осложненного течения беременности, в частности развитие гестозов, особенно второй ее половины, гипохромной анемии и других осложнений оказывает выраженное влияние характер экстрагенитальной патологии. Многочисленные научные исследования [6, 10, 12] указывают на отрицательное влияние на плод и, как следствие, на новорожденного заболеваний сердечно-сосудистой, эндокринной, выделительной (почки, мочевыводящие пути), гепатобилиарной и других систем, возникающих до беременности и/или проявляющихся в течение гестационного процесса. К числу основных повреждающих факторов, определяющих возникновение патологии плода при заболеваниях беременной, относится гипоксия, которая способствует ухудшению метаболических процессов и выведению продуктов обмена плода, интоксикации и формированию других патогенных влияний. В нашем исследовании выявляемость экстрагенитальной патологии у беременных женщин составляла 56–78%, сочетанная патология зарегистрирована в 19–37% случаев (р > 0,05) с относительным преобладанием заболеваемости у женщин, родоразрешенных оперативным путем. В структуре выявленной патологии, без статистически значимых различий в группах, доминировала патология мочевыделительной системы (в основной группе 28%, в группах сравнения по 22%), достигая 32% у женщин с преждевременными родами; вегетососудистая дистония (23–25%); заболевания сердечно-сосудистой системы с преобладанием артериальной гипертензии (15% в основной группе, 9–11% в группах сравнения); заболевания желудочно-кишечного тракта, чаще выявлялся гепатит (11% в основной группе, в группах сравнения по 5%); ожирение, метаболический синдром (в основной группе 14%, в группах сравнения 6–8%); миопия высокой степени в 6–15% случаев. Острое респираторное вирусное заболевание женщины исследуемых групп перенесли в 7–12% случаев.
Отягощенный акушерско-гинекологический анамнез и соматическое неблагополучие женщин способствовали развитию различных осложнений беременности, особенно в основной группе, что имело в большинстве случаев значительные отличия от женщин контрольной группы (табл. 2). Частота формирования гестоза (в 52–58% случаях) и анемии (у 37–42% женщин) различной степени выраженности значительно отличала женщин групп сравнения от контрольной группы (р ≤ 0,05). Угроза прерывания беременности возникала у 28% женщин основной группы, а в группах сравнения в 21–23% случаев, достигая уровня статистической значимости с контролем только в основной группе. На фоне выявленных нарушений течения беременности более половины (54%) женщин основной группы имели хроническую маточно-плацентарную и плодово-плацентарную недостаточность, а в группах сравнения данная патология формировалась у 26–30% беременных. Плацентарная недостаточность, характеризующаяся нарушениями структуры и функций плаценты, ухудшает условия питания, газообмена и выведения продуктов обмена веществ из организма плода, в результате чего возникает гипоксия, задержка развития плода, склонность к асфиксии при рождении, родовым травмам и заболеваниям в периоде новорожденности [3, 6, 9, 15, 16].
Совокупность патологических факторов (ОАГА, тяжесть экстрагенитальной патологии и осложненное течение беременности) формировало у ряда беременных показания к родоразрешению путем кесарева сечения (рис. 3). Наиболее часто оперативные роды проводились при повторном КС (18–32%), дородовом излитии околоплодных вод и развитии слабости родовой деятельности (9–12%), начавшейся асфиксии плода (6–17%), преэклампсии тяжелой степени (6–14%), тяжелой соматической патологии женщин (13%). При этом сочетанные показания преобладали у женщин основной группы (у 119 (41%) против 49 (27%), χ² = 6,68, р = 0,010), особенно при недоношенной беременности (у 94 (55%) женщин; χ² = 23,18, р = 0,000). Следует отметить, что в группах сравнения по ряду показаний к проведению КС выявлены различия, не достигавшие статистического уровня значимости (рис. 3). При оценке значимости выявленных факторов риска в формировании нарушений постнатальной адаптации новорожденных, в том числе формировании церебральной ишемии, была установлена корреляция с рядом факторов антенатального периода (медабортами (r = 734, р = 0,000); воспалительными заболеваниями женской половой сферы (r = 855, р = 0,000); возрастом первородящей (rs = 0,674, р = 0,001); хронической фетоплацентарной недостаточностью (ХФПН), особенно у детей, рожденных путем КС (rs = 0,974, р = 0,000); угрозой прерывания беременности (rs = 0,812, р = 0,000) в основной группе); в интранатальном периоде при родоразрешении путем КС с ухудшением состояния женщин по экстрагенитальной патологии и преэклампсией тяжелой степени (rs = 0,718 и rs = 0,762, р = 0,001), с хронической гипоксией и/или острой асфиксией плода (rs = 0,823, р = 0,000), с начавшимся кровотечением (rs = 0,689, р = 0,001), задержкой развития плода (rs = 0,636, р = 0,002). Таким образом, при анализе анте- и интранатального периодов развития детей из группы высокого риска выявлено патологическое влияние множественных материнских факторов, в большинстве случаев сочетанных, которые играли важную роль в формировании дезадаптации новорожденных.
Выводы
Нарушение ранней постнатальной адаптации новорожденных из группы высокого риска связано с патологическим влиянием различных факторов анте- и интранатального периодов развития плода. Наибольшую значимость приобретает сочетанное влияние отягощенного акушерско-гинекологического анамнеза (медаборты, невынашиваемость беременности, воспалительные заболевания женской половой сферы, повторные операции кесарева сечения); осложненное течение беременности с развитием гестозов, анемии, угрозы преждевременных родов, нарушением маточно-плацентарного и плодово-плацентарного кровотока; соматические заболевания матерей. Тяжесть состояния беременных женщин способствует, прежде всего, нарушению родовой деятельности, возникновению угрожающих состояний плода (острой гипоксии/асфиксии) и т. д., приводящих к невозможности родоразрешения естественным путем, формированию показаний для проведения операции кесарева сечения. Изучение причин и оценка значимости факторов риска в развитии перинатальной патологии создает возможность своевременной коррекции материнских факторов, организации эффективной медицинской помощи новорожденным высокого риска, способствуя повышению качества жизни детей в последующие возрастные периоды, что носит важный медико-социальный характер.
Литература
* ГБУЗ РМ МРКПЦ, Саранск
** ФГБОУ ВПО МГУ им. Н. П. Огарева, Саранск
Пренатальная (дородовая) диагностика врожденной патологии плода
Рождение здорового ребенка – естественное желание каждой беременной женщины. Но, к сожалению, надежды на счастливое материнство не всегда оправдываются. Около 5% новорожденных имеют различные врожденные заболевания. Скрининг в 1 и во 2 триместрах беременности позволяет определить, насколько велик риск врожденной патологии у будущего ребенка.
В настоящее время существуют достаточно эффективные методы пренатальной (дородовой) диагностики многих заболеваний плода, которые можно выявить с 11 недели беременности. Своевременное проведение скрининговых обследований дает возможность определить большой спектр патологии плода и увидеть ультразвуковые признаки хромосомных аномалий.
Что такое ранний пренатальный скрининг и когда он проводится
Скрининг (от англ. «просеивание») – это совокупность исследований, позволяющих определить группы беременных, у которых существует риск рождения ребенка с хромосомными аномалиями и врожденными пороками. Но ранний скрининг – это только начальный, предварительный этап обследования, после которого женщинам, с выявленным риском врожденных аномалий, рекомендуется более детальное диагностическое обследование, которое точно подтвердит или исключит наличие патологии.
Что включает в себя ранний пренатальный скрининг
В комплексное обследование входят:
Полученные данные: анамнез, УЗИ и биохимические маркеры помещают в специально разработанную программу Astraia, которая рассчитывает риск рождения ребенка с врожденными аномалиями. Комбинация данных исследований увеличивает эффективность выявления плодов с синдромом Дауна и другими хромосомными заболеваниями.
Что такое программа Astraia
Astraia – это профессиональная программа, вычисляющая вероятность хромосомных аномалий у плода. Программа была разработана Фондом Медицины Плода (Fetal Medicine Foundation – FMF) в Лондоне и успешно апробирована на огромном клиническом материале во многих странах мира. Она постоянно совершенствуется под руководством ведущего специалиста в области пренатальной диагностики профессора Кипроса Николаидеса, в соответствии с последними мировыми достижениями в области медицины плода.
Специалист, проводящий ранний пренатальный скрининг, должен иметь международный сертификат FMF, дающий право на выполнение данной диагностики и работу с программой Astraia. Сертификат подтверждается ежегодно после статистического аудита проделанной за год работы и сдачи сертификационного экзамена. Таким образом обеспечивается высокая диагностическая точность полученных рисков.
Проведение раннего пренатального скрининга с помощью данной программы регламентировано приказом Министерства Здравоохранения РФ от 1 ноября 2012 г. № 572н «Об утверждении порядка оказания медицинской помощи по профилю «акушерство-гинекология» (за исключением использования вспомогательных репродуктивных технологий)».
Ранний пренатальный скрининг позволяет вычислить следующие риски:
Что оценивается при УЗИ в 1 триместре
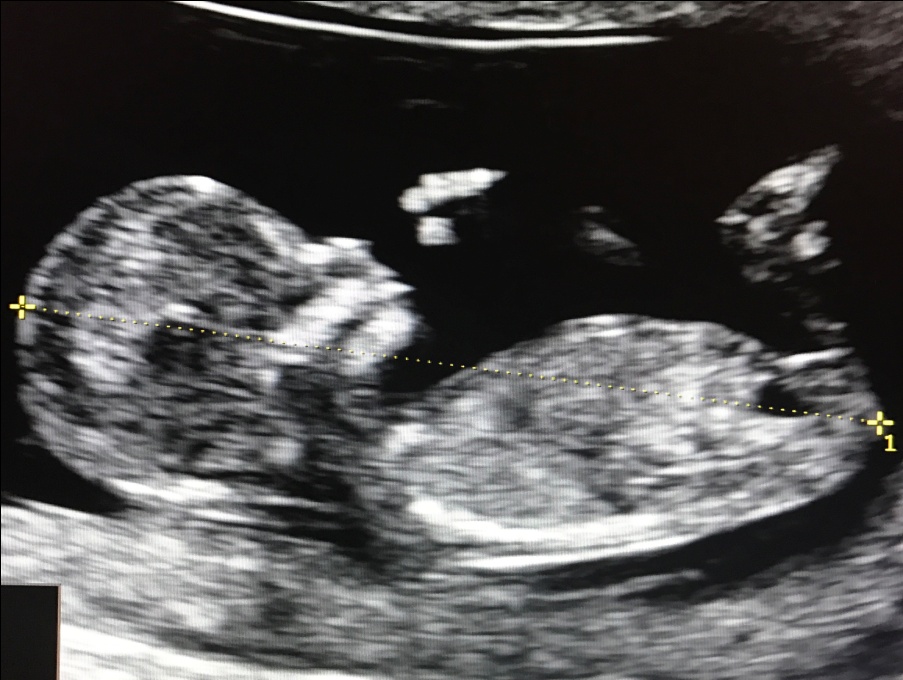
1. Копчико-теменной размер (КТР) плода
Правильное измерение КТР плода
2. Маркеры хромосомной патологии:
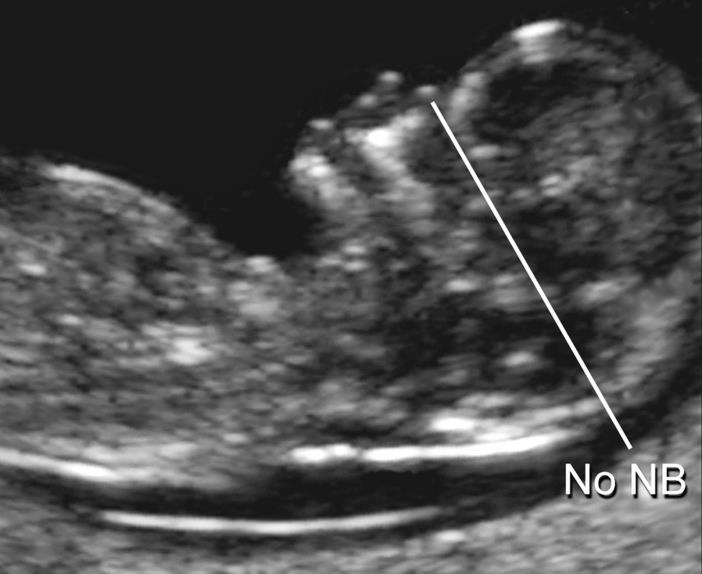
— толщина воротникового пространства (ТВП) – является основным признаком хромосомной патологии у плода. Патологической величиной считается увеличение ТВП больше 95-й процентили для каждого срока гестации. Каждое увеличение ТВП повышает риск существования хромосомной аномалии у плода.
ТВП в норме ТВР при патологии
— носовая кость. У плодов с синдромом Дауна носовая кость может отсутствовать, либо быть уменьшенной (гипоплазированной). Очень редко такое может встречаться и у совершенно здоровых детей. Точный диагноз устанавливается только при помощи генетического анализа.
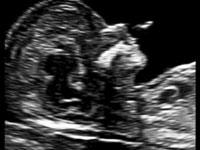
Нормальная носовая кость Отсутствие носовой кости
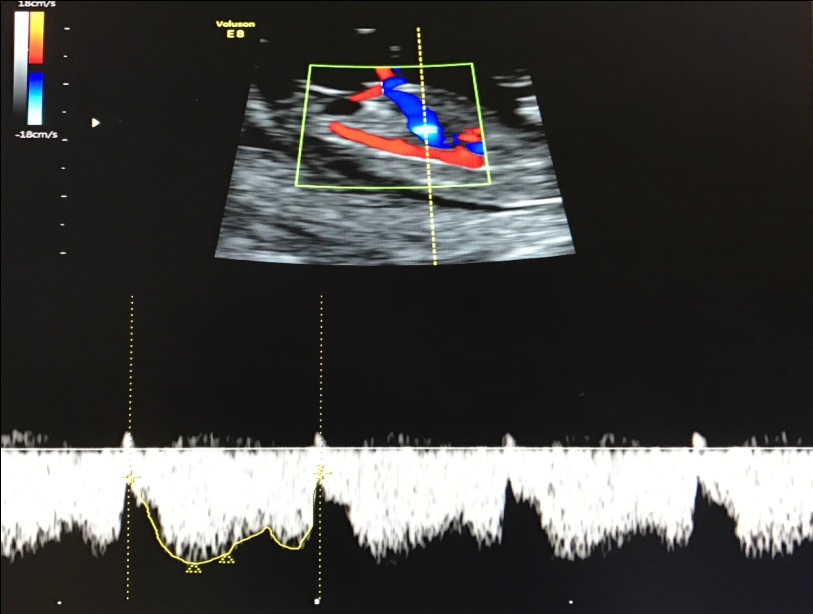
— кровоток в венозном протоке – это маленький сосуд в печени плода. При обратном (ретроградном) токе крови в данном сосуде можно предположить, что у плода хромосомный синдром, либо врожденный порок сердца.
Нормальный кровоток в венозном протоке
Но важно правильно получить этот кровоток и дать ему оценку. Для этого требуются определенные навыки и квалификация врача, которые подтверждаются ежегодной сертификацией FMF.
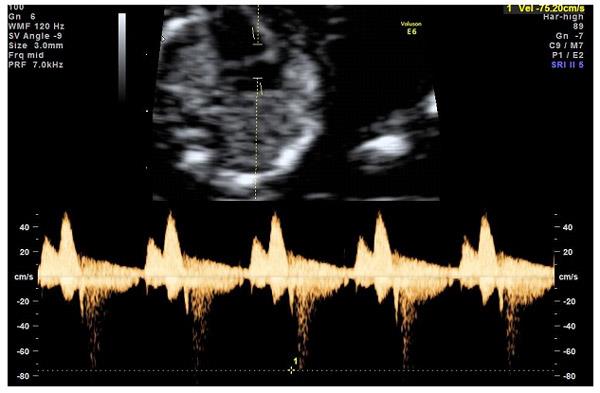
— кровоток через трикуспидальный клапан в сердце плода. Здесь ретроградный (обратный) кровоток тоже указывает на хромосомную патологию, либо может проявляться при врожденных пороках сердца.
3. Анатомические структуры плода и исключение крупных врожденных пороков
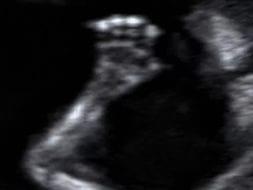
Ручка плода Мозг плода в виде “бабочки” в норме
4. Длина шейки матки
5. Стенки матки и придатков (яичников)
6. Кровоток в маточных артериях
УЗИ может проводиться как трансабдоминально, так и трансвагинально.
Что делать при высоком риске хромосомной патологии у плода
Если комплекс раннего пренатального обследования указывает на высокий риск врожденной патологии у плода, Вам будет рекомендована консультация генетика с последующей инвазивной диагностикой (биопсия ворсин хориона на сроке до 14 недель или амниоцентез, проводимый после 16 недель) и генетическим анализом. Именно генетический анализ точно определяет хромосомные заболевания и врожденные патологии у плода.
Что представляет собой скрининг во втором триместре беременности
Согласно приказу № 572н от 1.11.2012 г., второй скрининг состоит из ультразвукового исследования плода на сроке 18-21 неделя беременности. В этом возрасте кровь на биохимические маркеры уже не сдается. Плод имеет массу около 300-500 грамм и длину 20-25 см, и УЗИ позволяет детально проанализировать все анатомические структуры плода и выявить большинство пороков развития. Тогда же оценивается количество околоплодных вод, расположение и структура плаценты, длина шейки матки и др.
После проведения УЗИ на данных сроках беременности большинство вопросов пренатальной диагностики считаются закрытыми.
Надеемся, что эта информация поможет Вам лучше понять важность и необходимость скрининга в первом и втором триместрах беременности. В нашей клинике у Вас есть уникальная возможность пройти качественное обследование и получить максимально объективные данные о состоянии Вашего плода.
Перинатальные и отдаленные исходы у детей с синдромом задержки роста плода
В. Е. Радзинский, А. А. Оразмурадов, Е. А. Девятова
Кафедра акушерства и гинекологии с курсом перинатологии Российского Университета Дружбы Народов
ул. Миклухо – Маклая, 8, Медицинский факультет, 117198, Москва, Россия
Т. В. Златовратская, Н. М. Старцева
ГБУЗ «Городская клиническая больница № 29 им. Н.Э. Баумана» ДЗМ
Госпитальная площадь, д. 2, 111020 Москва, Россия
Актуальность: в статье представлен широкий обзор литературы по проблеме хронической плацентарной недостаточности (ПН), и освещены взгляды, сложившихся на рубеже XX–XXI веков. ПН остается одной из наиболее актуальных проблем современного акушерства и перинатологии, так как перинатальная заболеваемость и смертность в большой мере определяются степенью тяжести ПН, а малый вес при рождении – фактор риска повышенной заболеваемости на протяжении всей последующей жизни ребенка и формирует перинатальную заболеваемость и смертность.
Перинатальные поражения центральной нервной системы приводят к возникновению неврологических осложнений различной степени тяжести, что существенно ухудшает качество жизни таких детей.
При изучении отдаленных исходов у детей с синдромом задержки роста плода (ЗРП) в анамнезе обращает на себя внимание не только большой удельный вес неврологических осложнений, но и высокая частота болезней органов дыхания и болезней крови.
Хроническая ПН остаётся ключевой проблемой акушерства, неонатологии, патологии анте- и перинатального периодов, поскольку функциональная недостаточность плаценты приводит к угрозе прерывания беременности, гипоксии, отставанию роста и развития плода, либо к его гибели ( Савельева Г. М., 1991; Бунин А. Т., 1993; Башмакова Н. В. и др., 1996; Макаров И. О., 1998; Радзинский В. Е., Милованов А. П. и др., 2004). Плацентарная недостаточность – это клинический синдром, отражающий патологическое состояние материнской (маточно – плацентарной) и плодной (плацентарно – плодной) частей плаценты, приводящее к замедлению развития и роста плода (Савельева Г. М. и др., 1991). Милованов А. П., (1999) предложил определение ПН: это клинико – морфологический симптомокомплекс, возникающий как результат сочетанной реакции плода и плаценты на различные нарушения состояния материнского организма. Клинически обоснована терминология и классификация ПН предложенная Радзинским В. Е. (1983, 2001): это поликаузальный синдром, возникающий как результат сочетанной реакции плода и плаценты на различные изменения в материнском организме, характеризующийся нарушением молекулярных, клеточных, тканевых и органных адаптационно – гомеостатических реакций фетоплацентарной системы и реализующийся в компенсированной, субкомпенсированной и декомпенсированной формах. Частота плацентарной недостаточности составляет 17 – 26%, не имеет тенденции к снижению и обусловливает до 47% перинатальных потерь (Колгушкина Т. Н., 2004). По данным Барашнева Ю. И. и др. (1997), частота ее колеблется от 3 – 4 % до 45 %, перинатальная заболеваемость достигает 700 %о, а смертность 24,2 – 177,4%о. По данным других исследователей, ПН составляет более 20% в структуре причин перинатальной смертности (Мурашко Л.Е., Бадоева Ф.С., Асымбекова Г.У., Павлович С.В., 1997).
К основным звеньям многогранного патогенеза ПН относят нарушения маточно – плацентарного и плодово – плацентарного кровотока, метаболизма, синтетической функции и состояния клеточных мембран плаценты, изменения иммунного статуса плода. Патология маточно – плацентарного кровообращения в свою очередь характеризуется тремя важнейшими моментами: нарушением притока крови в межворсинчатое пространство, затруднением оттока из него и локальными изменениями реологических и коагуляционных свойств крови.
Функциональная недостаточность плаценты оказывает прямое отрицательное воздействие на развитие плода и новорожденного, что проявляется характерной клинической симптоматикой, в частности синдромом ЗРП, который занимает важное место в структуре перинатальной смертности и оказывает отрицательное влияние на последующее развитие ребенка. (Борзова Н. Ю., Гагаева Ю. В. и др., 2004). Синдром ЗРП – одно из наиболее часто встречающихся состояний новорожденного (Афанасьева Н. В., Игнатко И. В., 2003). В акушерской практике, по данным Медведева Н. В., Юдиной Е. В. (1998), данная патология встречается в 5 – 31 % случаев.
Учитывая важность своевременной профилактики и диагностики ПН, необходима адекватная оценка степени риска ее развития. По данным Сидельниковой В. М. (2002), хроническая ПН наблюдается у каждой третьей женщины из группы высокого перинатального риска. Легко оцениваемым фактором риска является возраст матери до 18 и старше 35 лет. По данным Стрижакова А. Н. (2003), у 26 – 30 % беременных в возрасте до 20 лет выявляются признаки ПН, что создает угрозу развития ЗРП у данной группы беременных. При наличии экстрагенитальной патологии риск развития ПН составляет 24 – 45%. Важная роль в формировании ПН отведена заболеваниям сердечно – сосудистой и эндокринной систем, а болезни почек составляют до 9,5% среди факторов риска ее развития. Среди эндокринных заболеваний особого внимания заслуживает сахарный диабет. Популяционная частота сахарного диабета у беременных составляет 0,2 – 3,0%, однако среди беременных с ПН он встречается в 2 – 3 раза чаще. При этом частота гипотрофии плода составляет 35,5%, а отставание в росте плода, по данным ряда исследователей, отмечается уже в начале II триместра гестации.
В последние годы все больше внимания уделяется изучению внутриутробного инфицирования как этиологического фактора развития ПН. Так, при хронических неспецифических заболеваниях легких отмечается увеличение процента рождения детей с низкими весо – ростовыми показателями. При этом у 30,8% детей выявляются признаки внутриутробной инфекции. У беременных с ПН на фоне генитальных инфекций в 1,6 раза чаще наблюдается ЗРП, при этом в 2 раза чаще возникает ее симметричная форма.
Среди осложнений беременности, наиболее часто приводящих к развитию ПН, первое место занимает гестоз. При наличии ПН на фоне гестоза, частота ЗРП составляет 22,7 – 44%. Частота клинических проявлений ПН прямо пропорциональна тяжести гестоза и составляет при легкой, среднетяжелой и тяжелой степени 16, 22 и 62% для ЗРП соответственно (Федорова М. В. и др., 1997).
Существенную роль в патогенезе плацентарной недостаточности играет неполноценное питание беременных, прежде всего недостаток белков, жиров, витаминов. При отсутствии рациональной диеты частота ЗРП может достигать 16,2%.
Из данных акушерского анамнеза статистически достоверную связь с развитием плацентарной недостаточности имеют перенесенные ранее самопроизвольные аборты, антенатальная гибель плода и рождение детей с низкой массой тела.
Ранняя диагностика ПН и профилактическое лечение беременных групп высокого риска по развитию синдрома ЗРП позволяет предупредить декомпенсированные формы маточно – плацентарной дисфункции и прогнозировать благополучный исход беременности с высокой степенью вероятности (Афанасьева Н. В., Стрижаков А. П., 2004).
Выявление синдрома ЗРП и определение его формы является основной задачей эхографии при диагностике хронической ПН. ЗРП диагностируется при выявлении параметров фетометрии ниже 10 – го перцентиля или более чем на 2 стандартных отклонения ниже среднего значения для данного гестационного возраста. Некоторые исследователи допускают прогнозирование развития ЗРП по отклонению фетометрических показателей ниже 25 – го перцентиля (Федорова и др., 2001). Однако в этом случае вероятность подтверждения прогноза составляет только 70%.
При ультразвуковой (УЗИ) диагностике ЗРП, говоря о I степени тяжести, наблюдается отставание фетометрических параметров до 2 недель (34,2%), при II степени – в пределах 2 – 4 недель (56,6%), при III степени – более 4 недель (9,2%) от должных значений для данного гестационного срока. Клинически принято выделять симметричную, ассиметричную и смешанную формы данного синдрома. Ассиметричная форма встречается чаще симметричной, но развивается обычно позднее (в 30 – 34 недели гестации). Смешанная форма синдрома ЗРП характеризуется непропорциональным отставанием всех фетометрических показателей при наиболее выраженном отставании размеров живота и считается наиболее неблагоприятной. При обнаружении несоответствия одного или нескольких показателей показано произведение расширенной фетометрии. В то же время отставание фетометрических параметров не всегда позволяет уверенно диагностировать ЗРП. До настоящего времени остаются недостаточно разработанными вопросы тактики ведения беременных с симметричным отставанием размеров плода от срока гестации при отсутствии остальных проявлений ПН, поскольку имеются данные о том, что в этих случаях (генетически детерминированная малая масса, плод «small for date») перинатальные исходы не отличаются от таковых в популяции.
Экстрагенитальные заболевания матери в сочетании с акушерской патологией, реализуясь посредством различных патогенетических механизмов, приводят к единому результату – прогрессирующей ЗРП (Радзинский В. Е., Милованов А. П. и др.,2004). Многолетние наблюдения за развитием детей, родившихся у пациенток с диагностированной ПН, позволили сделать вывод, что акушерская патология обусловливает значительное увеличение перинатальной заболеваемости и является субстратом для возникновения многочисленных патологических изменений в организме ребенка, которые в течение первых лет жизни становятся основной причиной нарушения его физического, умственного развития и повышенной заболеваемости.
По данным Л. О. Бадаляна и др. (1983), более 60% всех заболеваний центральной нервной системы детского возраста связано с перинатальной гипоксией плода. Многие авторы (Paneth N., Stark R., 1983; Seidman D.S., Paz G., 1991 и др.) отмечают, что более половины энцефалопатий обусловлено не острой гипоксией при родах, а длительной, хронической гипоксией плода и новорожденного, нередко связанной с внутриутробной инфекцией. Дети, перенесшие острую гипоксию в родах, чаще имеют совершенно нормальное развитие в дальнейшем (Самсыгина Г.А. и др., 1995).
По данным А. Н. Стрижова и др. (1995), при декомпенсированной форме ПН перинатальная смертность достигает 50%, а заболеваемость новорожденных 100%. ЗРП формирует перинатальную заболеваемость и смертность, а также является фактором риска повышения заболеваемости на протяжении предстоящей жизни. Кроме того, у детей, родившихся маловесными, сокращается средняя продолжительность предстоящей жизни, в сравнении с детьми, не имевшими дефицита веса при рождении (Lithell., 1999). Частота ЗРП по данным многих авторов колеблется от 3% до 22% у доношенных, от 18 до 24% у недоношенных, и не имеет тенденции к снижению (Белоусова В. Б., 1988, Ахмадеева Н. Э. и др., 1989; Радзинский В. Е. и др., 1990).
В структуре перинатальной смертности 23% – 25% занимает ЗРП и связанные с этой патологией осложнения. У 32,5% детей, родившихся с гипотрофией, в возрасте одного года сохраняются отклонения в физическом развитии.
Перинатальные поражения центральной нервной системы занимают одно из важнейших мест в структуре перинатальной заболеваемости по частоте и значимости и составляют 60 – 80% всех заболеваний нервной системы детского возраста ( Студеникин М. Я., Халлман Н., 1984; Яцык Г. В., 1989; Бадалян Л. О., 1989, Барашнев Ю. И., 1993). Перинатальные повреждения головного мозга характеризуются многофакторным генезом, но гипоксия является центральным патогенетическим фактором, приводящим к различным структурным и функциональным повреждениям и порокам развития центральной нервной системы. Характер церебральных изменений зависит от гестационного возраста в период развития патологии, времени действия гипоксии и её интенсивности (Студеникин М.Я. и др., 1993).
Серьёзные неврологические осложнения: такие как детский церебральный паралич, ретинопатиия недоношенных, глухота, грубая задержка темпов психомоторного развития, приводят к неполноценному развитию и снижению качества жизни у таких детей. Неврологические осложнения наиболее распространены у недоношенных детей. Частота неврологических нарушений легкой степени у этих детей составляет 10% – 45 %, тяжелой степени 7% – 9 % (Савельева Г. М., Федорова М. В., Клименко П. А., Сичинава Л. Г., 1991).
Снижение уровня смертности в последние годы сопровождается повышением процента инвалидизации (Cano A., Fons F., Brines J., 2001). Ведущее место среди причин детской инвалидности занимают болезни нервной системы, врождённая и наследственная патология, состояния перинатального периода (Емельянова А. С. 1999).
При снижении летальности новорожденных с массой тела при рождении 1500 г и менее до 49—57%, число выживших детей достигает 43—51%. Однако из выживших детей здоровыми оказываются не более 10—25%. Причем количество детей с тяжелыми психоневрологическими расстройствами может достигать 12—19% (Michelsson K., Lindahl E., Parre M.,1984; Lloyd B. W., 1984; Vohr B.R., Coll C., 1985).
Риск развития психоневрологических расстройств разной степени тяжести у новорожденных с очень низкой массой тела при рождении в 3 раза выше, чем у детей с нормальной массой тела при рождении. Для новорожденных с экстремально низкой массой тела (ЭНМТ) при рождении 1000 г и менее перинатальная смертность может достигать 64—85%, а число выживших детей — не более 15—36%. У выживших детей тяжелые инвалидизирующие расстройства могут превышать 28%, а менее грубые психоневрологические нарушения до 44%. Причем, из выживших детей здоровые составляют не более 8—15% ( HirataT., Epcar J.R., Walsh A.,1983; Fleischman A.R.,1986). При сравнении перинатальных исходов в группах новорожденных с ЭНМТ, 1001 – 1500, 1501 – 2000 и 2001 – 2500 гр. Шалина Р. И. и др., 1999, пришли к заключению, что абдоминальное родоразрешение не позволяет полностью избежать развития мозговых дисфункций, но тем не менее способствует уменьшению числа детей с умеренно выраженными и тяжелыми нарушениями центральной нервной системы.
Изучение отдаленного катамнеза у детей группы высокого инфекционного риска от матерей с внутриутробным инфицированием также представляет большой интерес, поскольку имеются сведения, что у таких детей отмечаются симптомы поражения центральной нервной системы: отставание в психомоторном развитии, прогрессирующие нарушения зрения и слуха (Веденеева Г. Н. и др., 1997; Тареева Т.Г. и др., 1999; Hess D.,1993; Couvreus J. Et al., 1996).
По данным Волгиной С. Я. (2000), в структуре заболеваемости недоношенных детей с ЗРП, в различные периоды жизни выявлялись свои особенности. Доминирующее положение занимают болезни органов дыхания. У детей раннего возраста второе и третье места занимали болезни нервной системы и крови. К 7 годам жизни у значительного количества детей, родившихся с признаками ЗРП, сохраняются изменения неврологического статуса. Развитие этой патологии соотносится со степенью отставания фетометрических показателей и выраженностью признаков внутриутробного страдания плода.
Вывод: состояние здоровья маловесных детей в перинатальном и отдаленном периоде не позволяет приуменьшить значимость проблемы плацентарной недостаточности в настоящее время, а лишь еще раз указывает на необходимость ее детального изучения, своевременной профилактики и лечения.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
.gif)
_575.gif)
.gif)