Нутритивная недостаточность что это такое
Нутритивная недостаточность что это такое
Резюме. В статье представлен обзор литературы по проблеме диагностики и коррекции нутритивной недостаточности у больных раком желудка. Недостаточность питания у больных раком желудка приводит к ухудшению качества жизни пациентов, увеличению числа послеоперационных осложнений, увеличению послеоперационной летальности. Проанализирована безопасность и эффективность влияния энтеральной нутритивной поддержки на течение послеоперационного периода у больных раком желудка. Оценка нутритивного статуса больных раком желудка на всех этапах лечения пациента и своевременная коррекция риска развития недостаточности питания, активная персонализированная нутритивная поддержка пациентов с диагностированной нутритивной недостаточностью – обязательный элемент современного лечения рака желудка.
Ключевые слова: рак желудка, нутритивный статус, нутритивная недостаточность, нутритивная поддержка, индекс массы тела (ИМТ), послеоперационные осложнения.
Рак желудка (РЖ) является актуальной проблемой онкологии. На сегодняшний день в мире регистрируются высокие показатели заболеваемости и смертности от данного заболевания [1]. Количество впервые выявленных случаев РЖ в 2018 году по данным ВОЗ составило более 1 миллиона, без существенной динамики по сравнению с данными 2012 года. В структуре общей онкологической заболеваемости занимает устойчивое 5 место. Более половины впервые диагностированных случаев заболевания зарегистрировано в странах Азии (75,4%). В структуре смертности от онкологических заболеваний РЖ занимает 3 место. Несмотря на успехи современной медицины, внедрение высокоинформативных методов диагностики, таргетной терапии, ежегодно в мире от данной опухоли продолжают погибать около 800000 человек. Стандартизированные по возрасту показатели заболеваемости у мужчин в 2 раза выше, чем у женщин [1]. В России в 2017 году выявлено около 35000 новых случаев заболеваемости РЖ, при этом у большинства пациентов заболевание было диагностировано в стадии местного и отдаленного распространения (III стадия – 23,8%, IV стадия – 39,9%) [2]. В Красноярском крае в 2017 году диагноз РЖ был впервые установлен 725 пациентам. Летальность на первом году заболевания с момента установления диагноза составила 44,2% [2].
Согласно практическим рекомендациям RUSSCO по лекарственному лечению РЖ, выбор тактики лечения определяется степенью распространенности опухолевого процесса и функциональным состоянием пациента. Основным методом радикального лечения РЖ является хирургическое вмешательство, дополняемое в большинстве случаев системной противоопухолевой терапией [3, 4].
Нутритивная недостаточность у больных раком желудка не всегда позволяет провести лечение в полном объеме [5, 6].
Европейским обществом по клиническому питанию (European Society for Clinical Nutrition and Metabolism, ESPEN, 2015) нутритивной недостаточностью называется состояние, при котором в результате недостаточного поступления в организм или усвоения в нем питательных веществ отмечаются изменения в компонентном составе организма, в частности, снижение тощей массы тела, приводящие к нарушению физических и психических функций организма, ухудшающие клинический исход заболевания. По результатам исследования ECOG в 2003 г., включавшего 3047 онкологических больных, выявлено, что частота нутритивной недостаточности при опухолевом поражении органов желудочно-кишечного тракта (ЖКТ) колеблется от 70 до 83%. Наиболее часто нутритивная недостаточность встречается при раке желудка и пищевода (75-80%) [5].
Для улучшения результатов лечения рака желудка, снижения частоты развития послеоперационных осложнений, профилактики рецидивов заболевания, повышения качества жизни пациентов важную роль играет поддерживающая терапия, в частности, снижение риска развития недостаточности питания, адекватная и своевременная нутритивная поддержка 9.
Отсутствие персонифицированного подхода к коррекции нутритивного статуса у больных раком желудка остается одной из важных нерешенных проблем мирового сообщества на сегодняшний день [9, 11].
Оценка нутритивного статуса
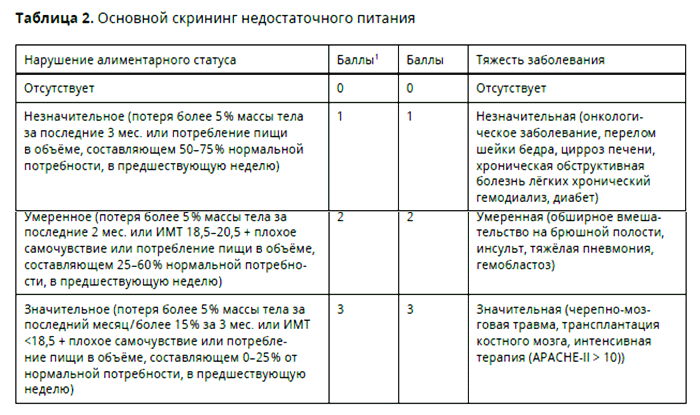
Для определения недостаточности питания необходимо оценивать нутритивный статус пациента [9, 12-14]. Оценка нутритивного статуса базируется на определении антропометрических, лабораторных и морфофункциональных критериев [15]. Для определения риска развития нутритивной недостаточности используются различные скрининговые шкалы [16]. Для больных раком желудка, которым планируется оперативное лечение, Европейским обществом клинического питания и метаболизма (ESPEN) рекомендован скрининг нутритивного статуса по шкале «Оценка нутритивного риска» (Nutritional Risk Screening) NRS 2002. Данная шкала состоит из двух блоков – предварительного скрининга и финальной оценки недостаточности питания 18.
Баллы из левой и правой колонок суммируются. У пациентов в возрасте ≥70 лет к полученной сумме прибавляется 1 балл. При итоговом количестве баллов ≥3 имеется риск недостаточности питания, необходимо проведение нутритивной поддержки. Если количество баллов 5% массы тела за последние 2 мес. или ИМТ 18,5-20,5 в сочетании с плохим самочувствием или потребление пищи в объеме 25-60% от нормальной потребности за последние 7 дней).
В 2018 г. ESPEN и ASPEN (Американской ассоциацией парентерального и энтерального питания) также были предложены критерии оценки недостаточности питания GLIM (Global Leadership Initiative on Malnutrition).
Лабораторные методы оценки нутритивного статуса позволяют определить степень нутритивной недостаточности: легкую, среднюю, тяжелую.
Таблица 3. Оценка степени нутритивной недостаточности [20].
Цели нутритивной поддержки в предоперационном периоде
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Нутритивная недостаточность — это подострый или хронический недостаток питательных субстратов, который приводит к нарушениям функционирования систем и органов (нарушениям когнитивной сферы, ослаблению иммунного ответа, нарушению работы мышц, в т. ч. дыхательных), что влияет на качество жизни и выживаемость пациентов после перенесенного хирургического вмешательства. По данным литературы, до 61% больных в хирургических отделениях имеют нутритивную недостаточность уже при поступлении в стационар. Нутритивная недостаточность у пациентов хирургического профиля обусловлена снижением аппетита, дисфагией, нарушениями переваривания и всасывания питательных веществ при заболеваниях желудочно-кишечного тракта, а также социально-экономическими причинами. Нутритивная недостаточность у пациентов хирургического профиля является одним из факторов, определяющих тяжесть заболевания. В ряде исследований показано, что нутритивная недостаточность является фактором риска осложнений и неблагоприятного исхода в послеоперационном периоде. В данной статье обсуждаются вопросы диагностики нутритивной недостаточности. Авторами обоснована необходимость включения оценки нутритивного статуса пациента в план предоперационного обследования. Также авторы рассматривают современные способы коррекции нутритивной недостаточности на этапе предоперационной подготовки, обсуждают сроки проведения нутритивной поддержки.
Ключевые слова: нутритивная недостаточность, нутритивная поддержка, нутритивный статус, предоперационная подготовка, ERAS-протокол, сипинг, энтеральное питание, нутриционный риск.
Для цитирования: Арыкан Н.Г., Шестопалов А.Е., Митичкин А.Е. и др. Цели нутритивной поддержки в предоперационном периоде. РМЖ. 2019;7:22-25.
Nutritional support goals in the preoperative period
1 City Clinical Hospital named after F.I. Inozemtsev, Moscow
2 Russian Medical Academy of Continuing Professional Education, Moscow
Nutritional deficiency is a subacute or chronic lack of nutrient substrates that leads to functioning disorders of systems and organs (cognitive impairment; immune response weakening; impaired muscle function, including respiratory), which affects the patient’s life quality and survival after surgery. According to the literature data, up to 61% of patients in surgical departments have nutritional deficiency already upon admission to the hospital. Nutritional deficiency in surgical patients is due to decreased appetite, dysphagia, disorders of digestion and nutrient absorption in gastrointestinal tract diseases, as well as due to socio-economic reasons. Nutritional deficiency in surgical patients is one of the factors determining the disease severity. A number of studies have shown that nutritional deficiency is a risk factor for complications and adverse outcomes in the postoperative period. This article discusses the diagnosis of nutritional deficiency. The authors substantiate the need to include the patient nutritional condition assessment in the preoperative examination plan. The authors also consider modern methods of nutritional deficiency correction at the stage of preoperative preparation and discuss the nutritional support time frame.
Keywords: nutritional deficiency, nutritional support, nutritional condition, preoperative preparation, ERAS protocol, sip feeding, enteral nutrition, nutritional risk.
For citation: Arykan N.G., Shestopalov A.E., Mitichkin A.E. et al. Nutritional support goals in the preoperative period. RMJ. 2019;7:22–25.
В статье обсуждаются вопросы диагностики нутритивной недостаточности. Рассмотрены способы коррекции нутритивной недостаточности на этапе предоперационной подготовки, обсуждают сроки проведения нутритивной поддержки.
Введение
Нутритивная недостаточность — это подострый или хронический недостаток питательных субстратов, который приводит к нарушениям функционирования систем и органов (нарушениям когнитивной сферы, ослаблению иммунного ответа, нарушению работы мышц), что влияет на качество жизни и выживаемость после перенесенного хирургического вмешательства [1, 2]. Другим, схожим определением является следующее: нутритивная недостаточность — состояние питания, при котором дефицит энергии, белка и других питательных веществ может оказывать влияние на состав организма, функционирование его систем и органов и на исход лечения [3]. Согласно литературным данным, до 61% пациентов хирургических отделений в той или иной степени имеют нутритивную недостаточность уже при поступлении в хирургический стационар [4–6]. В абдоминальной хирургии распространенность нутритивной недостаточности в предоперационном периоде составляет 46,5–72% (из них в 46% случаев — это тяжелая степень нутритивной недостаточности) [7–9].
Нутритивная недостаточность у пациентов хирургического профиля обусловлена снижением аппетита, которое может быть вызвано как симптомами заболевания (тошнота, рвота, боль), так и побочными эффектами лекарственных препаратов (опиоидные анальгетики). Кроме того, причинами нутритивной недостаточности могут быть дисфагия, нарушения переваривания и всасывания питательных веществ при заболеваниях ЖКТ. Не стоит забывать о социально-экономических причинах нутритивной недостаточности [10].
Нутритивная недостаточность является одним из важнейших факторов, определяющих тяжесть хирургического заболевания [11, 12]. Хотя в ряде исследований показано, что нутритивная недостаточность является фактором риска развития осложнений и неблагоприятного исхода в послеоперационном периоде [13–16], на практике важность оценки нутритивного статуса больного часто недооценивают и не включают в план предоперационного обследования пациента диагностику нутритивной недостаточности [11].
Диагностика нутритивной недостаточности
Европейская ассоциация клинического питания и метаболизма (The European Society for Clinical Nutrition and Metabolism, ESPEN) выделяет 2 главных диагностических критерия нутритивной недостаточности [17]:
индекс массы тела (ИМТ) менее 18,5 кг/м 2 ;
потеря массы тела более 10% или более 5% в течение 3 мес. и снижение ИМТ или безжировой массы тела.
Следует учитывать, что ИМТ 2 у пожилых больных указывает на недостаточность питания [18].
При подозрении на нутритивную недостаточность необходимо провести обследование в предоперационном периоде, включающее скрининг риска и степени нутритивной недостаточности. Существуют различные шкалы и индексы, которые могут использоваться как стартовый компонент обследования пациента [19–21]. Наибольшей чувствительностью и специфичностью обладает предложенная ESPEN Оценка нутриционного риска — 2002 (Nutritional Risk Screening — 2002, NRS-2002). Значение показателя NRS-2002 ≥3 указывает на то, что у пациента есть нутритивная недостаточность или риск ее развития, поэтому таким пациентам необходимо проводить нутритивную поддержку.
Для пациентов старшей возрастной группы может быть использована Краткая шкала оценки питания (Mini Nutritional Assessment, MNA) [22]. Результативным может быть использование прогностического питательного индекса (ППИ) [23, 24]. Достоверно доказано, что определение ППИ и его интерпретация оказывают прямое влияние на предотвращение возможных осложнений в ходе хирургического лечения [25]. ППИ является достоверным при потере массы тела более 6% и рассчитывается по следующей формуле:
где АЛБ — концентрация альбумина плазмы крови, мг/100 мл;
ТКС — толщина кожной складки, мм;
ТФР — концентрация трансферрина плазмы крови, мг/100 мл;
КП — внутрикожные пробы с антигенами, оцениваемые по диаметру эритемы (0 — анергия, 1 — менее 5 мм, 2 — 5 мм и более), баллы;
ППИ менее 40% — невысокая вероятность развития осложнений; от 40 до 49% — значительная вероятность развития осложнений; более 50% — высокая вероятность осложнений, связанных с расстройством питания.
Среди функциональных тестов в диагностике нутритивной недостаточности выделяют следующие [18].
Ручная динамометрия. Определяет силу руки на сжатие, результат коррелирует с нутритивным статусом. Исследование выполняется у постели больного и позволяет выявить ранние изменения в мышечной силе во время голодания и в начале нутритивной поддержки.
Электрическая мышечная стимуляция. Определяется путем стимуляции m. adductor policis (отражается в графических кривых).
Респираторные пробы. Изменения пикового давления и объема форсированного выдоха за 1 с (ОФВ1) при нутритивной недостаточности отражают силу дыхательных мышц.
В комплексной диагностике нутритивной недостаточности невозможно обойтись только функциональными методами и шкалами, важное значение имеют и лабораторные параметры [18, 26].
Сывороточный альбумин. В 1987 г. Leite et al. [27] предположили, что уровень альбумина плазмы, в совокупности с особенностями оперативного вмешательства, может оказывать влияние на течение послеоперационного периода у больных, которым было проведено оперативное вмешательство на органах ЖКТ. Поскольку динамика снижения уровня альбумина может быть длительной (в связи с его периодом полужизни), этот параметр сложно назвать единственным маркером нутритивной недостаточности [19], однако установлено, что уровень сывороточного альбумина менее 35 г/л связан со значительным повышением частоты послеоперационных осложнений [12].
К другим лабораторным показателям, по которым можно судить о нутритивной недостаточности, относят короткоживущие белки плазмы крови: трансферрин, транстиретин и ретинолсвязывающий белок, периоды полужизни которых равны 7 дням, 2 дням и 12 ч соответственно. С учетом того, что внесосудистый пул трансферрина весьма незначителен, а период его полужизни по сравнению с периодом полужизни альбумина существенно меньше, снижение концентрации трансферрина в сыворотке позволяет раньше выявить изменения белкового статуса. Эффективность применения этого показателя для оценки висцерального пула белка может быть ограничена при наличии железодефицитной анемии, которая вызывает компенсаторное увеличение концентрации трансферрина в сыворотке крови даже в условиях белкового дефицита. По уровню содержания сывороточного трансферрина можно диагностировать не только степень белкового истощения, но и выявить группы больных повышенного риска, к которым следует относить лиц с содержанием трансферрина в сыворотке крови менее 1,75 г/л [28]. Короткий период полужизни, незначительность пула во внесосудистом пространстве и быстрый синтез в печени делают транстиретин и ретинолсвязывающий белок маркерами диагностики нутритивной недостаточности [29].
Креатинин. Экскреция креатинина с мочой отражает дефицит мышечного белка. Дефицит 5–15% сопровождает питательную недостаточность легкой степени, 15–30% — средней степени, более 30% — тяжелой степени.
Азотистый баланс исследуют для оценки направленности белкового обмена. Метод объективно применим в послеоперационном периоде, т. к. предполагает сбор в течение суток проб мочи с последующим лабораторным определением азота мочевины.
Нутритивная недостаточность как фактор риска развития хирургических осложнений
Нутритивная недостаточность приводит к слабости дыхательных мышц, снижению функциональной способности легких, повышению частоты осложнений (в т. ч. инфекционных) со стороны органов дыхания. Пациентам с нутритивной недостаточностью в послеоперационном периоде часто необходимо проведение интенсивной респираторной терапии [13, 30]. Показано, что ухудшение нутритивного статуса приводит к систолической дисфункции желудочков [31]. При нутритивной недостаточности уменьшается минутный объем кровообращения. Тяжелая белково-энергетическая недостаточность может приводить к атрофии и интерстициальному отеку миокарда [32].
У пациентов с нутритивной недостаточностью проявляется неадекватный ответ на изменение температуры окружающей среды, развивается вторичный иммунодефицит. По данным иммунограммы отмечаются уменьшение пула CD4+ Т-лимфоцитов и изменение лейкоцитарно-Т-лимфоцитарного индекса [13, 33].
В результате тяжелых расстройств метаболического фона эффективность лечебных мероприятий в послеоперационном периоде значительно снижается, что увеличивает риск развития септических и инфекционных осложнений, длительность госпитализации и показатели летальности [12, 22, 28, 34].
По данным A.M. Ryan et al. (2007), у пациентов, перенесших тотальную гастрэктомию по поводу рака желудка, потеря массы тела более чем на 10% была связана со статистически значимо более высокой частотой послеоперационных осложнений и статистически значимо более высокой летальностью по сравнению с данными показателями у пациентов, у которых потеря массы тела была менее 10% (p=0,036 и p=0,027) [35].
По данным Y. Yu et al. (2013), J. Chen et al. (2015), пероральная углеводная нагрузка в предоперационном периоде снижала число случаев инсулинорезистентности в послеоперационном периоде [40, 41]. На сегодняшний день суточное предоперационное голодание не является необходимостью, что подтверждает и протокол ускоренного восстановления (Enhanced Recovery After Surgery, ERAS). Исключение из этого правила составляют пациенты, у которых диагностирована задержка эвакуации желудочного содержимого. При отсутствии рисков аспирации и регургитации прием жидкости можно прекратить за 2–3 ч перед анестезиологическим пособием [12, 42, 43]. Протокол ERAS рекомендует за сутки до операции для подготовки выбирать сочетание либо больничной диеты и выбранной нутритивной поддержки, либо 800 мл 12,5% углеводного напитка и выбранной нутритивной поддержки. В день операции за 2–3 ч принимают 400 мл 12,5% углеводного напитка [12].
Дискутабельным остается вопрос, когда начинать предоперационную нутритивную поддержку Существуют различные схемы и мнения. К примеру, L. Gianotti et al. (2002) при обследовании 305 плановых пациентов онкохирургического профиля с дефицитом массы тела более 10% выявили, что длительность предоперационной нутритивной поддержки должна составлять 5 сут. Именно эти сроки имеют связь со снижением послеоперационных инфекционных осложнений [44]. U. Giger et al. (2007) показали эффективность предоперационного применения энтеральных смесей в течение 2 или 5 сут до операции [45]. По данным О.А. Обуховой и др. (2010), эти сроки должны составлять как минимум 7–10 сут [46].
Выбор программы нутритивной поддержки у больных в абдоминальной хирургии, определение ее длительности и состава строятся на предпочтениях клинициста и потребностях пациента. Несомненным является то, что предоперационную нутритивную недостаточность необходимо корректировать, что позволит улучшить результаты лечения пациентов в послеоперационном периоде. Качественный состав смесей может быть разнообразным, однако иммуномодулирующее питание может служить эффективной составляющей предоперационной нутритивной поддержки. U. Giger et al. [45], Y. Zheng et al. [28] показали, что применение иммуномодулирующего питания в периоперационном (в том числе в предоперационном) периоде позволило уменьшить частоту развития системной воспалительной реакции, послеоперационных инфекционных осложнений и сократить длительность пребывания в стационаре пациентов, которым проводили операции на ЖКТ.
Заключение
В абдоминальной хирургии распространенность нутритивной недостаточности в предоперационном периоде достигает 72%. С учетом неблагоприятного влияния нутритивной недостаточности на течение периоперационного периода представляется необходимым включение оценки нутритивного статуса пациента в план предоперационного обследования и проведение, при необходимости, коррекции нутритивного статуса до выполнения хирургического вмешательства. Суточное голодание в предоперационном периоде не является необходимостью, что подтверждает протокол ERAS. Исключением из этого правила являются пациенты, у которых диагностирована задержка эвакуации желудочного содержимого. Программу предоперационной нутритивной поддержки (выбор смеси, пероральный прием или зондовое введение, длительность) для каждого пациента следует подбирать индивидуально, с учетом основного и сопутствующих заболеваний.
Только для зарегистрированных пользователей
Нутритивная поддержка онкологических пациентов
На любом этапе комплексного лечения онкологических заболеваний – от диагностики заболевания до этапа реабилитации – необходимо уделять должное внимание тому, чем и как питается пациент. Питание – это важный показатель качества жизни пациента.
Что такое нутритивная недостаточность?
Каковы ее причины?
Как определить нутритивную недостаточность самостоятельно?
Кому нужна нутритивная поддержка?
Что нужно знать о нутритивной поддержке?
Ответы на эти и другие вопросы в статье Надежды Александровны Бриш, врача-онколога отделения краткосрочной химиотерапии НМИЦ онкологии им. Н.Н. Петрова.
Значимость питания в жизни пациента
Питание важно для здорового функционирования организма человека. И в особенности для онкологических пациентов.
На любом этапе комплексного лечения онкологических заболеваний – от диагностики заболевания до этапа реабилитации – необходимо уделять должное внимание тому, чем и как питается пациент. Питание – это важный показатель качества жизни пациента.
Качество жизни пациента – это интегральная характеристика. Она включает в себя его физическое, психологическое и социальное функционирование.
Цель врача не просто вылечить человека, но и сохранить социальную адаптацию и психологическое благополучие, чтобы пациент мог себя максимально комфортно чувствовать в период лечения и после него.
Нутритивная недостаточность и риск ее возникновения
Важно, чтобы пациент и врач понимали, о чем они говорят друг другу. Поэтому ознакомимся с некоторыми терминами.
Нутритивный статус – комплекс клинических, антропометрических и лабораторных показателей, характеризующих количественное соотношение мышечной и жировой массы человека.
Также важным понятием является нутритивная или питательная недостаточность. Это состояние, которое обусловлено несоответствием между поступлением питательных веществ в организм и их расходом, что приводит к снижению массы тела и изменению компонентного состава организма.
Риск развития нутритивной недостаточности у онкологических пациентов высок. Он зависит от локализации опухоли и стадии процесса.
Причины нутритивной недостаточности
1. Снижение потребления пищи.
Оно может быть связано как с проявлениями самого заболевания (затруднения при проглатывании пищи, тошнота, рвота), так и с осознанным ограничением потребления пищи пациентом.
2. Нарушение усвоения питательных веществ.
Часто это связано с органическими и структурными изменениями органов ЖКТ.
3. Потеря питательных веществ.
Это может происходить на фоне рвоты или диареи в связи с основным заболеванием или в результате лечения.
4. Нарушения метаболизма (обмена веществ).
Нарушение метаболизма на фоне онкологического заболевания может быть связано с недостатком определенных питательных веществ, например, витаминов. Они участвуют во многих биологических реакциях организма. Если происходит нарушение всасывания или поступления витаминов в организм, нарушается обмен веществ в целом.
5. Психологический стресс.
Во-первых, на фоне стресса может снижаться аппетит, и, как следствие, снижаться количество потребляемой пищи. Замыкается порочный круг. Во-вторых, в организме могут запускаться механизмы, которые ускоряют распад питательных веществ.
Медицинский скрининг нутритивной недостаточности
Специалистам в контроле динамики и состояния нутритивного статуса пациента помогают следующие методы:
1. Контроль массы тела.
Контроль массы тела – задача не только врача, но и самого пациента. Необходимо следить за своим весом, питанием и обращать внимание на происходящие изменения.
2. Клинический и биохимический анализы крови.
По данным анализа крови (например, по уровню белка, альбумина в крови, по количеству лимфоцитов) врачи могут отслеживать и фиксировать наличие и динамику нутритивной недостаточности у пациента.
3. Биоимпедансметрия.
Это один из инструментальных методов в арсенале врачей. Он основан на изучении количественного соотношения мышечной и жировой массы тела, оценке их соотношения в динамике. В его основе лежат физические законы различной электропроводимости тканей организма.
4. Компьютерная томография.
Используется также для оценки количества мышечной и жировой массы тела. Она выполняется каждому пациенту на этапе постановки диагноза и при дальнейшем лечении.
Скрининг нутритивной недостаточности: самостоятельный тест
Пациент может самостоятельно осуществить скрининг нутритивной недостаточности.
Для этого нужно ответить на три простых вопроса:
Если за 3 вопроса в сумме набралось более 2х баллов, то пациенту необходимо проведение нутриционной поддержки.
Необходимо своевременно выявлять пациентов из группы риска нарушения питательного статуса. Это позволяет защитить их от прогрессирующей потери массы тела и развития связанных с этим осложнений.
Скрининг и мониторинг недостаточности питания должны проводиться на протяжении всего лечения, что важно для оценки динамики нутритивного статуса онкологических пациентов.
Профилактика саркопении
Саркопения – понятие, которое тесно связано с нарушением питательного статуса.
Саркопения – изменение скелетной мускулатуры, приводящее к постепенной потере мышечной массы тела и снижению функции мышц. Обычно такое состояние обусловлено возвратными изменениями метаболических процессов, нарушением питания и усиленным мышечным катаболизмом (расщеплением питательных веществ).
Помочь в профилактике саркопениии могут следующие методы:
Если говорить о конкретных показателях, то можно обратить внимание на следующие элементы и придерживаться указанных значений:
Синдром анорексии-кахексии
Следующее важное понятие – синдром анорексии-кахексии. Это многофакторный синдром, характеризующийся потерей массы тела, анорексией (в том числе снижением или отсутствием аппетита) и различными метаболическими нарушениями (усиленный распад питательных веществ, распад белков в мышцах, синдром хронического воспаления).
Выделяют 3 степени этого синдрома: прекахексия, кахексия и рефрактерная кахексия.
Синдром анорексии-кахексии тесно связан с общим самочувствием пациента. При нарастании явлений синдрома анорексии-кахексии ухудшается общее самочувствие пациента, что влечет за собой невозможность продолжения специализированного противоопухолевого лечения.
В широком смысле кахексия не равняется потере массы тела. Потеря массы тела – это только часть, одно из звеньев, которое приводит к ее развитию.
Раковая кахексия — это:
Нутритивная поддержка как вид сопроводительной терапии
Нутритивная поддержка – это лечебное питание, цель которого обеспечить организм всеми необходимыми питательными веществами с помощью питательных смесей. Это оптимизирует процессы метаболизма, а также увеличивает резервы организма.
Цели и задачи нутритивной поддержки:
Методы нутритивной поддержки:
Сипинговое питание
Энтеральное питание (сипинг) — питание, физиологичное для организма. Применяется обычно в дополнение к обычному рациону пациента. Это пероральный прием питательной смеси через трубочку маленькими глотками.
Следует соблюдать простые правила относительно сипинга: пить необходимо строго через трубочку (чтобы глоток был небольшим) и пить медленно (примерно в течение 30 минут). При этом предпочтительно использовать специализированные смеси, содержащие максимальное количество питательных веществ в минимальном объеме.
Особое внимание следует обращать на количество в смеси белка – строительного материала для восстановления организма, повышения его сопротивляемости. При развитии нутритивной недостаточности в первую очередь усиливается распад именно белков, нарушается их синтез в организме.
Смеси для сипинга имеют различные вкусовые особенности, и часто пациенты могут индивидуально выбирать тот вкус, который им нравится.
Зондовое питание
Еще один из методов нутритивной поддержки – зондовое питание. Оно представляет собой энтеральное питание. Такое питание осуществляется посредством постановки зонда в желудок или тонкий кишечник.
При невозможности постановки зонда необходимо формирование гастро- или энтеростомы, при которых питание поступает непосредственно в соответствующий орган.
Данный подход применим в трех случаях: когда пациенты не могут, не хотят или не должны получать питание перорально (через рот).
Парентеральное питание
Парентеральное питание предполагает использование смесей, которые специально разработаны для их введения в периферические или центральные вены.
Показания к применению такого метода:
Кому нужна нутритивная поддержка?
К принципам нутритивной поддержки принято относить следующие:
Важно, чтобы этапы оценки нутритивного статуса пациента, разработка плана питательной поддержки пациента совпадали с диагностикой и лечением основного заболевания. Тем самым можно добиться увеличения эффективности обоих методов.
Абсолютными показаниями к назначению активной нутритивной поддержки являются:
Начало и продолжительность нутритивной поддежки
Период, когда назначается нутритивная поддержка:
Продолжительность проведения нутритивной поддержки:
Критерии продолжительности нутритивной поддержки или показатели того, что она может быть завершена:
Лишний вес и нутритивная поддержка
Очень важным вопросом является оценка того, нуждаются ли пациенты с повышенной массой тела в нутритивной поддержке.
Нормальная или повышенная масса тела не означает того, что у пациента не имеется признаков саркопении (снижения объема мышечной массы).
При нарастающей потере массы тела в первую очередь уменьшается не жировая ткань, а теряется именно мышечная ткань. Это ведет к потере белка и развитию различных осложнений. Данный процесс не зависит от исходной массы тела человека.
Кроме того, во многих исследованиях доказано, что наличие саркопенического ожирения (сочетание уменьшения мышечной массы тела с повышенной жировой массой) также неблагоприятно сказывается на прогнозе заболевания, т.к. ухудшает переносимость противоопухолевого лечения.
Развитие опухоли и нутритивная поддержка
Еще один часто задаваемый вопрос от пациентов: влияет ли проведение нутритивной поддержки на рост и распространение опухоли?
В настоящее время данных, подтвержденных какими-либо научными исследованиями, которые говорили бы о воздействии нутритивного («искусственного») питания на рост опухоли у пациентов, нет.
Нормальные неизмененные клетки организма (точно также, как и злокачественные) нуждаются в питательных веществах, чтобы лучше функционировать, чтобы иметь возможность сопротивляться активному противоопухолевому лечению.
Жесткое ограничение в питательных веществах и каких-либо продуктах не только не поможет в лечении, но и может нанести вред.
Рекомендации нутритивной поддержки от russco
Рекомендации по проведению нутритивной поддержки являются неотъемлемой частью многих руководств по лечению различных заболеваний, в том числе и онкологических.
Так, в руководстве российского общества клинической онкологии RUSSCO даны четкие указания по поводу проведения нутритивной поддержки:
Что нужно знать о нутритивной поддержке?
Подходит ли спортивное питание для пациентов?
Некоторые пациенты интересуются возможностью использования питания для спортсменов, поскольку оно содержит много питательных веществ.
Спортивное питание рассчитано на спортсменов, которые получают повышенную физическую нагрузку. В таком питании очень высоки дозы всех питательных веществ, не только витаминов. Это питание создано из расчета на то, что человек будет испытывать большую физическую нагрузку.
Пациенты, как правило, в период лечения в спортивный зал не ходят, поэтому все-таки лучше обратиться к медицинскому питанию. Оно более сбалансировано и рассчитано на потребности именно пациентов, которые на данный момент получают лечение.
Рекомендации по лечебному питанию должен давать онколог. Также есть и другие специалисты – диетологи и нутрициологи, которые могут помочь с подбором питания. Кроме того, можно также проконсультироваться с гастроэнтерологом, который учтет имеющиеся гастроэнтерологические проблемы, связанные с нарушением питания.
Лечебное голодание и лечение опухоли
Бытует мнение, что при онкологических заболеваниях полезно лечебное голодание, чтобы не «кормить» опухоль.
Специалисты с этим категорически не согласны. Опухоль, которая имеется в организме, получает только часть питательных веществ, которые поступают в организм. При голодании организму не хватает сил, строительного материала для быстрого и успешного восстановления после химиотерапии, лучевой терапии или хирургического лечения. Поэтому ограничений в рационе быть не должно.
Конечно, этот вопрос должен решаться индивидуально: многие пациенты имеют сопутствующую патологию. В этом случае врач должен подобрать определенную диету. Но целенаправленно ограничивать себя в употреблении белка, рыбы, молочных и других продуктов и не стоит. Весь организм, кроме злокачественной опухоли, настроен на борьбу с заболеванием и нуждается в питательных веществах.
В организме ежесекундно образуются опухолевые клетки – клетки, над которыми организм теряет контроль – у кого-то они эффективно уничтожаются, у кого-то активно делятся. Наивно думать, что ограничение употребления белка приведет к гибели опухоли. При голодании организм запускает альтернативный синтез и начинает «брать» белок из здоровых тканей. В таком случае в теле человека происходят необратимые процессы, что приводит к ограничению использования современных методов противоопухолевого лечения.
Можно ли оценить недостаточность питания только по индексу массы тела?
Недостаточность питания также оценивается по ИМТ. Индекс массы тела – это соотношение веса к росту в квадрате. Но у онкологических больных ИМТ не является однозначным показателем для оценки нутритивного статуса.
Для оценки состояния нутритивного гомеостаза у пациента нужно оценивать все в комплексе: и клинические данные, и жалобы пациента на потерю массы тела, и показатели клинического и биохимического анализов крови, а также рассчитывать соотношение мышечной и жировой массы тела по компьютерной томографии и биоимпедансметрии.
Следует обращать большое внимание на стабильность массы тела. О любом снижении массы тела пациент должен сообщить лечащему врачу. Очень важно учитывать за какой период и сколько килограммов было потеряно.
Когда нет необходимости в нутритивной поддержке?
Нутритивная поддержка нужна не всем пациентам.
Питание должно быть полноценным и в процессе лечения, и в период реабилитации, и на протяжении всей жизни. Рацион должен стать гармоничным.
Витаминные комплексы и нутритивную поддержку (лечебное, специальное питание) должен назначать только лечащий врач. Существует целая линейка такого питания, и специалист выбирает именно то, что необходимо для поддержки и лечения конкретному пациенту.
Роль обычных продуктов питания при лечении онкологических заболеваний
Не существует каких-либо общих рекомендаций по рациону онкологических пациентов.
На основании исследований, в том числе зарубежных, врачи приходят к выводу, что «ненужных» продуктов как таковых не существует. Например, нет обоснованных запретов относительно употребления сахара.
Что касается белка, то он должен присутствовать в рационе – как растительный, так и животный. Некоторое отклонение в вегетарианство на фоне достаточно тяжелого и сложного лечения врачами не очень приветствуется, так как этим резко ограничивается разнообразие рациона пациентов.
В лечении онкологического заболевания важна стабильность. В том числе и в питании. Не стоит резко переходить на другой тип питания (например, вегетарианство, если вы всегда если мясо), или садиться на любую другую диету. Это ‒ стресс для организма.